

Preview text:
lOMoARcPSD| 27790909
ÔN TÀP LÝ THUYÀT HÓA HĀU C¡ CUàI KỲ
1. Phân biệt phản ứng tách loại E1 và E2
2. Phân biệt phản ứng thÁ S 1 2 N và SN
Phản ứng thÁ ái nhân ¢n phân tÿ S 1 2 N
Phản ứng thÁ ái nhân lưỡng phân tÿ SN
Giai oạn chÁm có sự tham gia của hai tiểu phân ² lưỡng phân tÿ
Giai oạn chÁm có sự tham gia của một tiểu
VÁn tác phản ứng v=[R-X][y-] phân ² ¢n phân tÿ
Các d¿n xuất C bÁc 1 chỉ cho S 2 VÁn tác phản ứng v=k[R N -X]
Sản phẩm nghịch ảo cấu
Các d¿n xuất C bÁc 3 chỉ cho S
hình so với chất nền ban ầu 1 N
Sản phẩm có thể là hỗn hợp racemic
3. Nêu quy tắc tách Zeisev, quy tắc tách Hofmann. Trong nhāng trường hợp nào thì sản
phẩm tạo thành theo quy tắc tách Hofmann chiÁm ưu thÁ? Cho ví dụ?
a. Quy tắc tách Zeisev: Hβ ở C bÁc cao nhất s¿ ưu tiên tách cùng nhóm X và
tạo nái ôi có nhiều nhóm alkyl nhất
b. Quy tắc tách Hofmann: X tách cùng với Hβ ở C bÁc thấp h¢n Tách Hofmann chiÁm ưu thÁ nÁu:
- Gác R của R-X chứa nhiều nhóm thÁ kích thước lớn
- Tác nhân base có kích thước lớn lOMoARcPSD| 27790909
- Nhóm thÁ X mang iện tích dư¢ng có kích thước lớn (N+R3, S+R2, SO2R,…)
4. Nêu quy tắc cộng Markovnikov, cho ví dụ. Nhāng trường hợp nào cộng trái
Markovnikov (Kharasch), cho ví dụ?
Quy tắc Markovnikov: Phản ứng cộng tác nhân không ái xứng (HX,
HOH,...) vào hợp chất có liên kÁt bội bất ái xứng s¿ ưu tiên xảy ra theo
hướng tạo thành carbocation trung gian bền h¢n.
Nhāng trường hợp cộng trái Markovnikov (Kharasch):
- Cộng H-Br theo quy tắc Kharasch (trái Markovnikov): có mặt oxy hoặc các hợp chất peroxide
- Phản ứng hydrobo hóa – cộng hợp B2H6
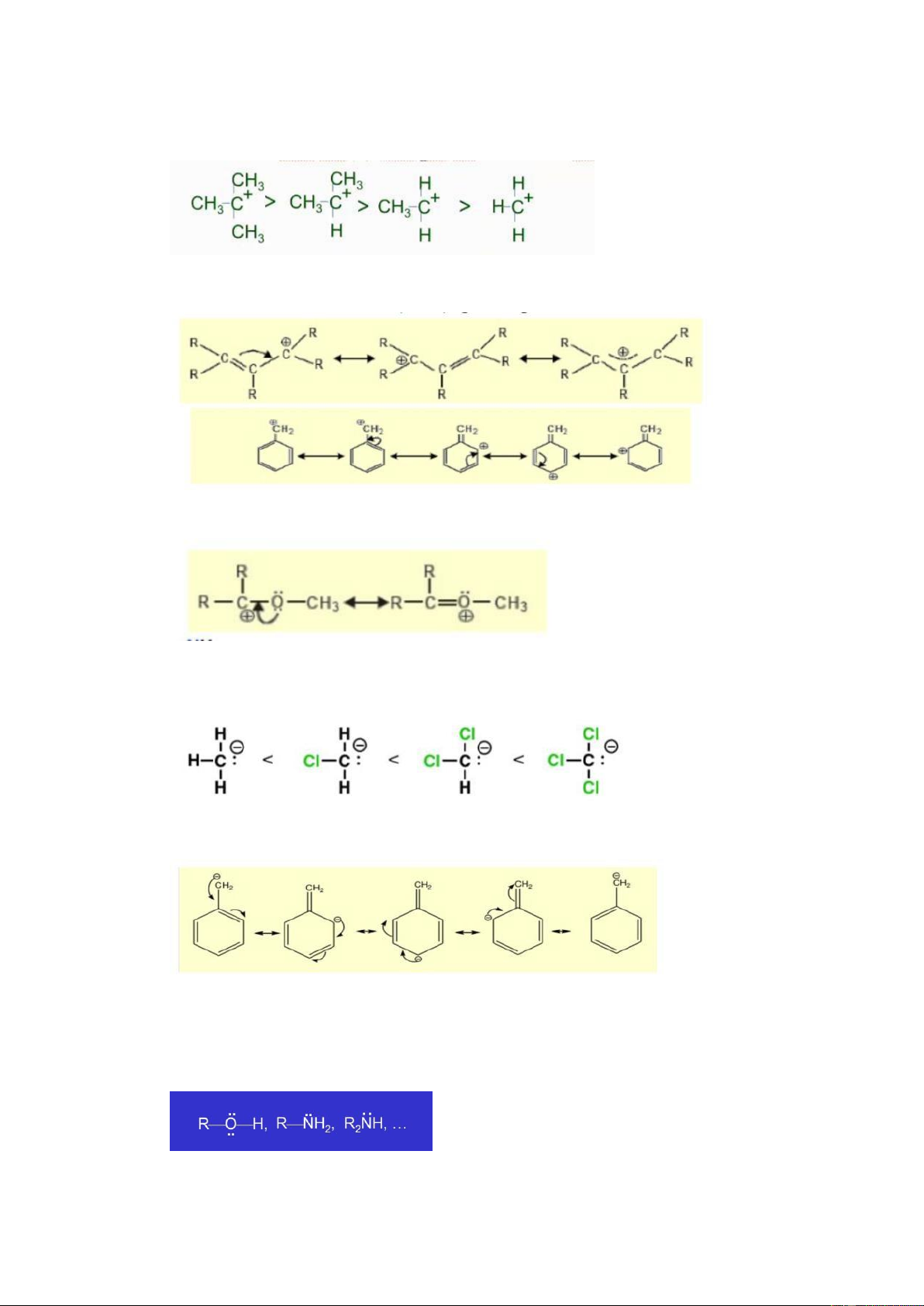
5. Khái niệm gác tự do, carbocation, carbanion. Độ ổn ịnh ( ộ bền) của gác tự do,
carbocation, carbanion? a. Gốc tự do:
- Là nguyên tÿ hay nhóm nguyên tÿ chứa e ộc thân
- Độ ổn ịnh của gác C: 3o>2o>1o>methyl
- Độ ổn ịnh cộng hưởng: khi iện tÿ tự do ở vị trí cách 1 so với liên kÁt π lOMoARcPSD| 27790909
b. Carbocation: ion dư¢ng mà iện tích (+) tÁp trung ở nguyên tÿ C
- Độ ổn ịnh: iện tích (+) càng ược giải tßa ² carbocation càng bền
- Độ ổn ịnh cộng hưởng: ộ bền carbocation tăng khi iện tích (+) ở vị trí cách 1 với nái ôi
- Dị tá (N,O, halogen) gắn trực tiÁp với (+) làm tăng ộ bền:
c. Carbanion: ion âm mà iện tích (-) tÁp trung ở nguyên tÿ C
- Điện tích âm càng ược giải tßa thì ion âm càng bền
- Các nhóm thÁ hút iện tÿ làm tăng ộ bền của carbanion: -NO2, -COOH, -X,…
- C¢ cấu cộng hưởng làm tăng ộ bền của carbanion
6. Chất ái nhân, chất ái iện tÿ?
a. Chất ái nhân (nucleophile): Là nhāng tác nhân cho cặp e cho phân tÿ khác: -
Nhāng chất trung hòa có chứa các cặp e tự do
- Các ion âm: RO-, HO-, CN-, RS- lOMoARcPSD| 27790909
b. Chất ái iện tÿ (Electrophile):
✓ Là nhāng tác nhân có orbital tráng, có thể nhÁn cặp e từ phần tÿ khác
- Các ion có iện tích dư¢ng
- Các hợp chất có vß e chưa hoàn chỉnh:
Axit Lewis: BF3, AlCl3, TiCl4, SnCl4
- Các phân tÿ trung hòa có thể phân cực hóa:
Carbonyl, halogen, acetylene...
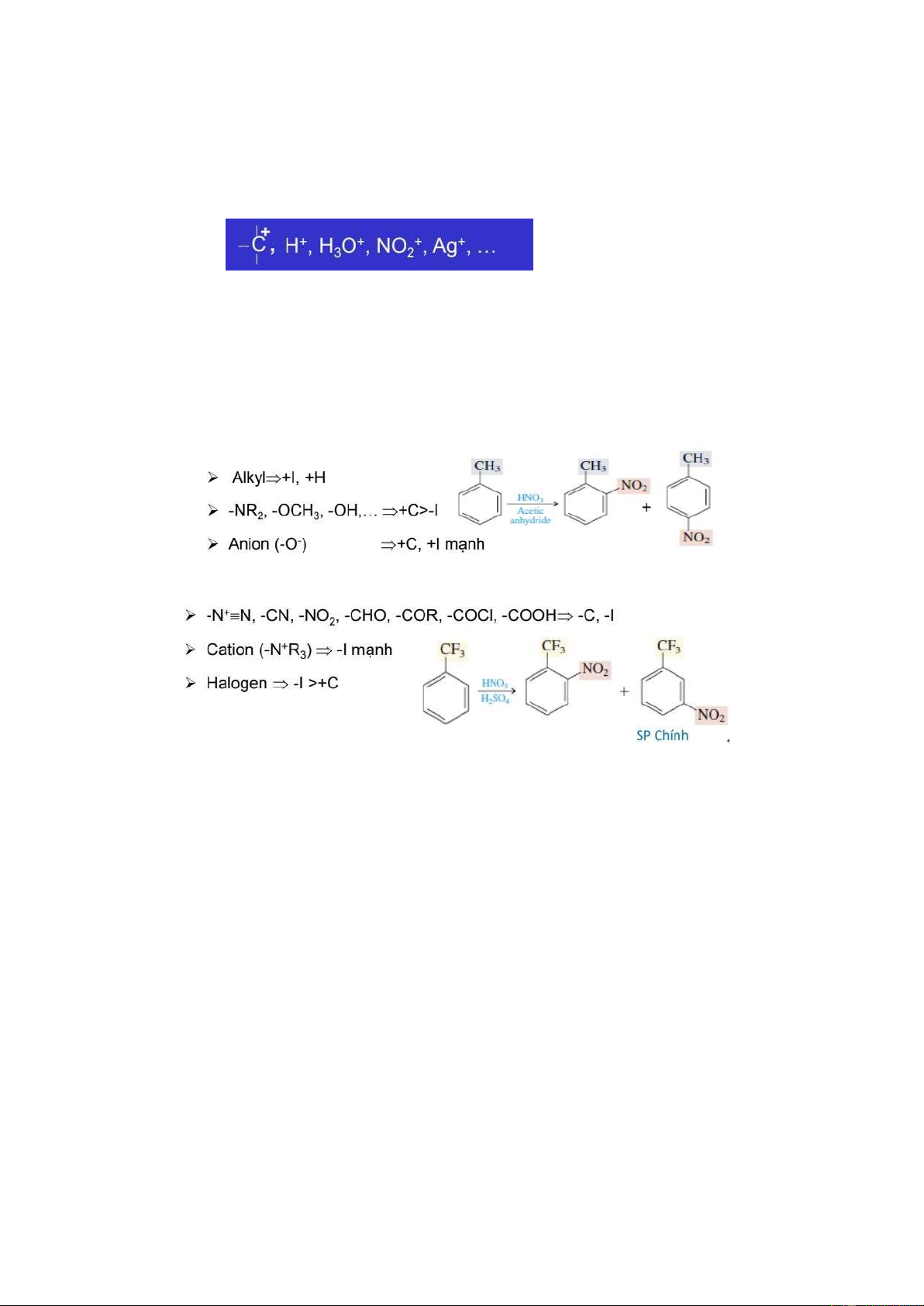
7. Quy tắc thÁ ái iện tÿ vào nhân th¢m trường hợp có sẵn 1 nhóm thÁ, 2 nhóm thÁ?
a. Khi vòng benzen có 1 nhóm thÁ:
- Các nhóm thÁ ẩy e (+C, +I, +H) (loại I) ² SE ± ² sp chính ortho, para
- Các nhóm thÁ hút e (-C, -I) (loại II) ² SE³² sp chính meta
8. Quy tắc gọi tên theo danh pháp IUPAC và tính chất vÁt lý (Độ hòa tan, nhiệt ộ sôi)
của alkane, alkene, alkyne, hydrocarbon th¢m, d¿n xuất halogen, ancol, phenol,
aldehyde, ketone, carboxylic acid, amine.




