

Preview text:
MÔ HÌNH SỰ ĐẨY GIỮA CÁC CẶP ELECTRON VỎ HÓA TRỊ
THUYẾT VSEPR (Valence Shell Electron Pair Repulsion)
1. Những luận điểm chính Xét phân tử AXnEm A: Nguyên tử trung tâm. X: Phối tử.
E: Đôi electron không liên kết.
n: Số phối tử (cũng là số đôi electron tạo thành liên kết )
m: Số đôi electron không liên kết.
n + m = q: Tổng số đôi electron vỏ hóa trị bao quanh A.
a. Cấu dạng các liên kết của nguyên tử (hay ion) trung tâm đa hóa trị chỉ phụ thuộc
vào tổng số đôi electron vỏ hóa trị q = n + m bao quanh nó.
b. Các đôi electron vỏ hóa trị được phân bố cách nhau tới mức xa nhất có thể được để
có lực đẩy nhỏ nhất giữa chúng.
c. Đôi electron không liên kết (klk) chiếm khoảng không gian lớn hơn so với một đôi
electron tham gia vào liên kết đơn. Sức đẩy giữa các cặp electron vỏ hóa trị giảm theo thứ tự sau:
Đôi klk – đôi klk (E – E) > đôi klk – đôi lk (E – X) > đôi lk – đôi lk (X – X)
Sức đẩy 90o >> sức đẩy 120o
(Đôi electron klk chỉ chịu tác dụng hút chủ yếu của một hạt nhân, do vậy dễ chiếm
một không gian lớn hơn so với một đôi electron liên kết bị hút mạnh hơn tới hai hạt nhân)
d. Liên kết bội thì xem như liên kết đơn. Khoảng không gian chiếm bởi liên kết bội
lớn hơn khoảng không gian chiếm bởi liên kết đơn
e. Không gian của một đôi electron liên kết giảm khi độ âm điện của phối tử tăng sẽ
dẫn đến góc hóa trị hợp bởi những liên kết của nguyên tử trung tâm với những phối
tử càng âm điện càng có giá trị nhỏ.
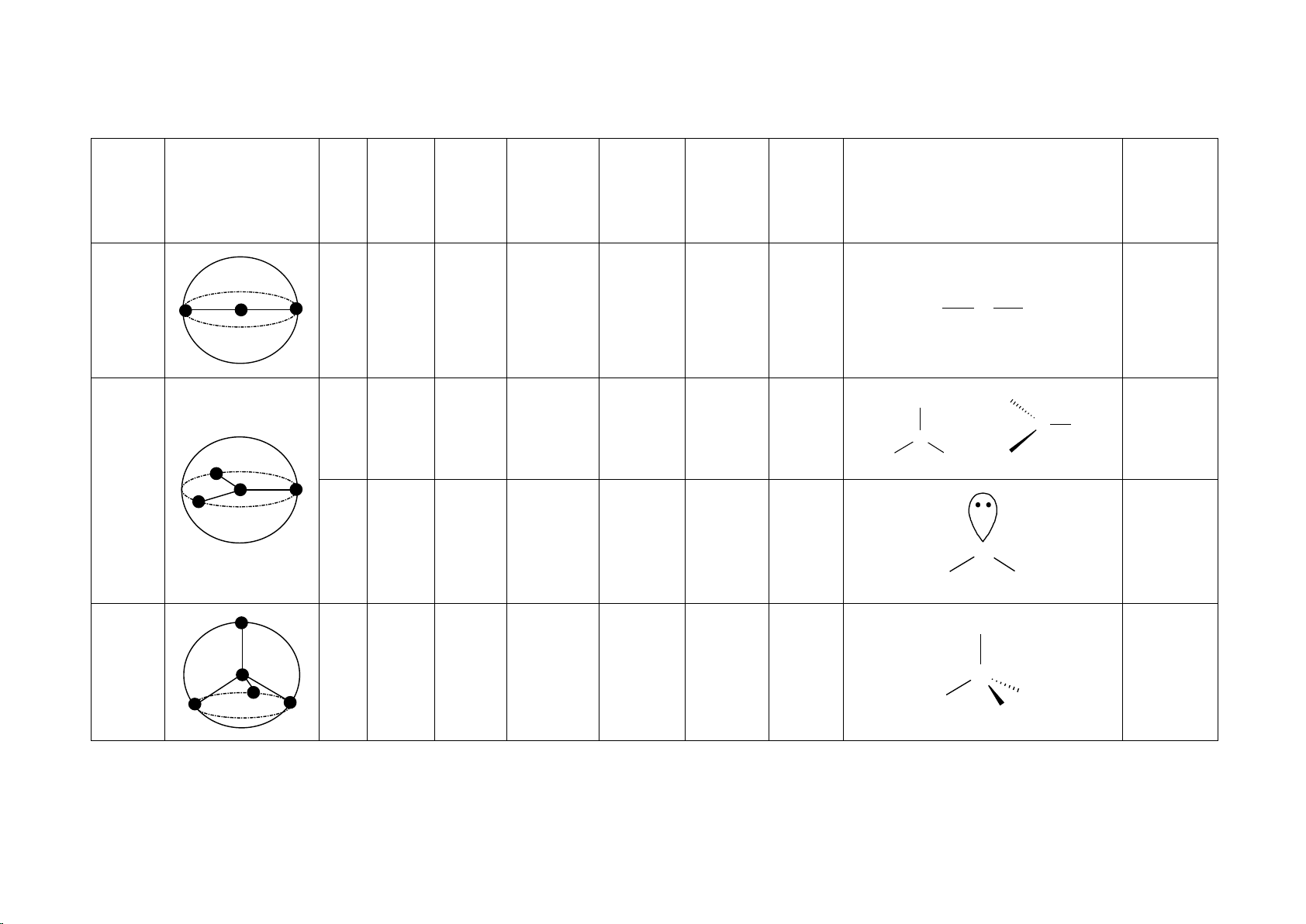
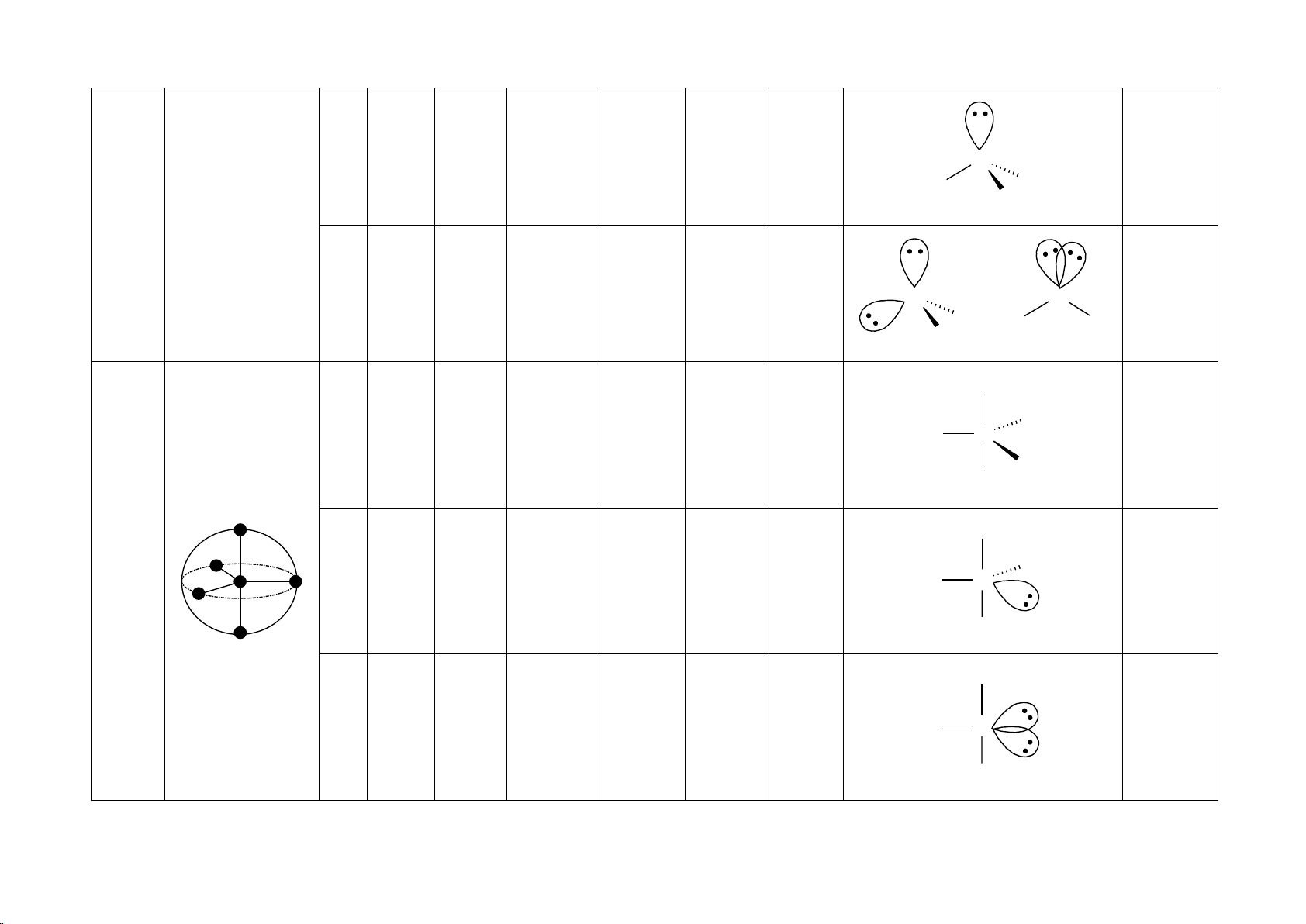
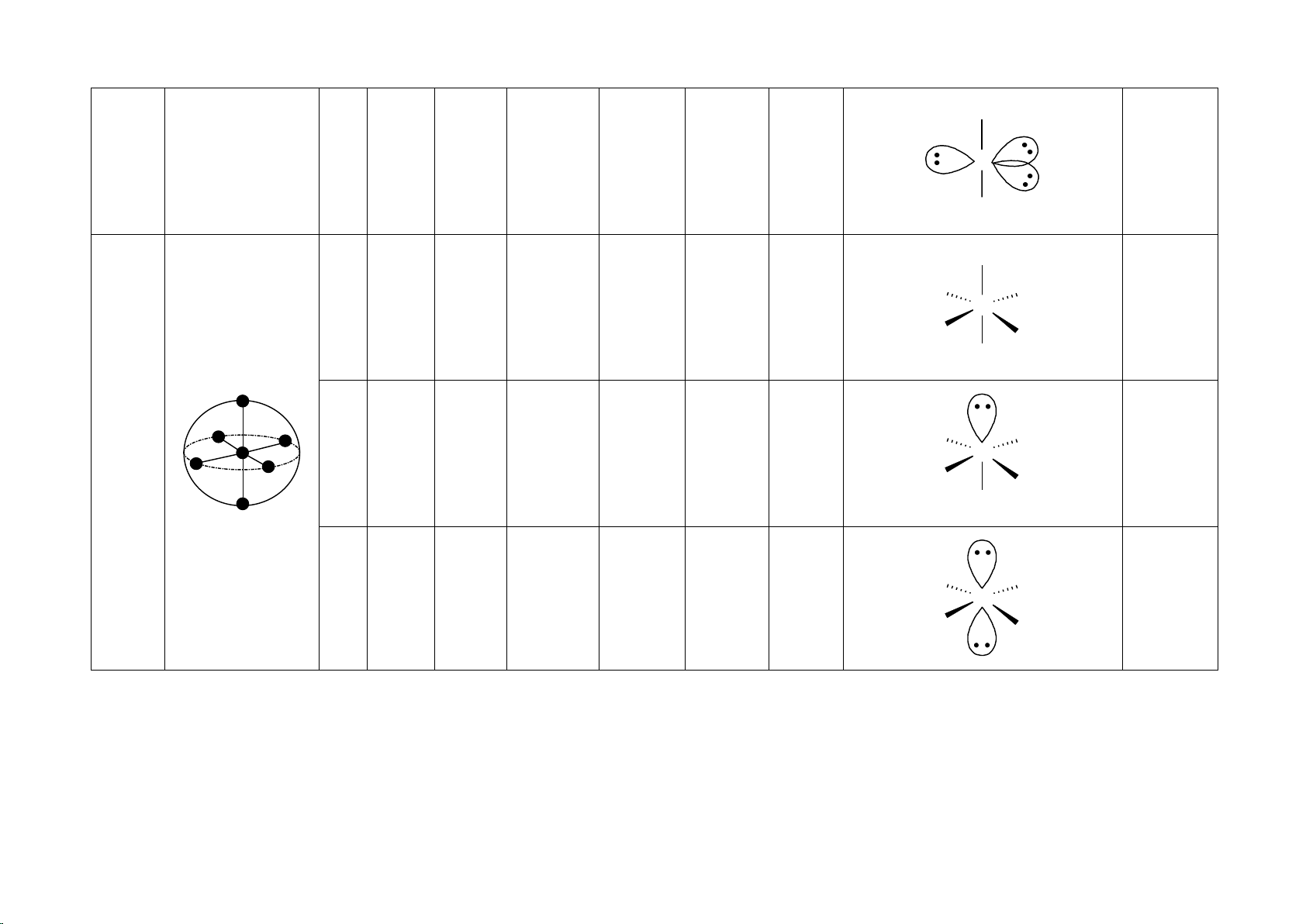
2. Hình dạng một số loại phân tử 1
HÌNH DẠNG MỘT SỐ PHÂN TỬ Số đôi Số Số đôi electron Hình dạng không
Hình dạng Góc liên Tính phân trong vỏ liên electron AX Lai hóa Cấu tạo Ví dụ gian nEm phân tử kết cực kết tự do hóa trị BeH2 Đường Không 2 2 0 AX HgCl 2 thẳng 180o sp X A X 2 phân cực X X BF3 Tam giác 3 0 AX = A X 3 phẳng 120o Không sp2 phân cực A AlCl3 X X X 3 SnCl2 2 1 AX2E Chữ V < 120o Phân cực sp2 A X X X CH4 + 4 4 0 AX NH 4 Tứ diện 109,5o Không 4 phân cực sp3 A X X X 2 NH3 Tháp tam 3 1 AX H 3E < 109,5o Phân cực sp3 3O+ giác A X X X H2O 2 2 AX SCl 2E2 Chữ V < 109,5o Phân cực sp3 A = A 2 X X X X X PCl5 Lưỡng tháp 120o Không X 5 0 AX5 sp3d X A tam giác phân cực 90o X X X SF4 Hình bập < 120o X 5 4 1 AX4E Phân cực sp3d X A bênh < 90o X X ClF3 HClO 3 2 AX 2 3E2 Chữ T 90o Phân cực sp3d X A X 3 X XeF2 Đường Không 2 3 AX2E3 thẳng 180o sp3d A phân cực X X SF6 Không X X 6 0 AX6 Bát diện 90o phân cực sp3d2 A X X X IF5 X X BF 6 5 1 AX 5 5E Tháp vuông < 90o Phân cực sp3d2 A X X X XeF4 Vuông Không X X 4 2 AX4E2 phẳng 90o sp3d2 A phân cực X X 4
3. Hình dạng một số phân tử chứa liên kết bội
Cơ sở vẫn là số đôi electron. Người ta quy ước tính số đôi electron trong loại phân tử này như sau:
– Mỗi đôi electron liên kết tạo 1 liên kết đơn hay 1 đôi electron riêng (không liên kết)
vẫn tính là 1 đôi electron như trên.
– Hai đôi electron tạo 1 liên kết đôi (=) tính là 1 “đôi” electron.
– Ba đôi electron tạo 1 liên kết ba () tính là 1 “đôi” electron.
Số đôi electron trên tính cho từng nguyên tử trung tâm. Sau đó quy về một
trong số các công thức phân tử đã xét, từ đó suy ra hình dạng của phân tử. Ví dụ: C2H4 H o 122 H o 116 C C H H
4. Ảnh hưởng của độ âm điện đến góc liên kết
Độ âm điện của nguyên tử trung tâm A và phối tử X đều có ảnh hưởng đến độ
lớn của góc liên kết, tức là ảnh hưởng đến hình dạng phân tử.
Nguyên tử trung tâm A có độ âm điện lớn sẽ kéo mây của đôi electron liên kết
về phía nó nhiều hơn, kết quả làm tăng độ lớn của góc liên kết. Nếu phối tử X có độ
âm điện lớn thì sẽ gây tác dụng ngược lại. Ví dụ: Phân tử dạng AX2E2 Phân tử dạng AX3E H2O 104o NH3 107o PCl3 102o OF2 103o NF3 102o PF3 98o H2S 92o PH3 93o SCl2 100o PI3 102o SF2 98o PBr3 98o BÀI TẬP
Bài 1: Trong phân tử H O, độ dài liên kết O–H bằng 0,96.10–10 2 m và HOH = 104,5o.
Hãy tính khoảng cách giữa 2 nguyên tử H. 1,52.10–10 m
Bài 2: Trong phân tử NH , độ dài liên kết N–H bằng 100 pm (1 pm = 10–12 3 m) và
HNH = 107o. Hãy tính khoảng cách giữa 2 nguyên tử H. 160,77 pm
Bài 3: Dự đoán dạng hình học của một số phân tử và ion sau: a. BeCl2, CO2, CS2, HCN, C2H2 b. BF – 2– 3, CH2O, NO3 , CO3 c. CH + 2– 3– 4, NH4 , SO4 , PO4 d. NH3, PH3, H3O+, PF3 e. H2O, SO2, SCl2, OF2 5




