
















Preview text:
lOMoAR cPSD| 45148588 DUNG DỊCH MỤC TIÊU BÀI HỌC
- Trình bày được khái niệm, phân loại dung dịch để giải thích được các loại dung
dịch có trong cơ thể sống
- Trình bày được tính acid base của dung dịch và giải thích vai trò của hiện tượng
thẩm thấu và dung dịch đệm đối với cơ thể sống 1. CÁC LOẠI DUNG DỊCH
1.1. Khái niệm dung dịch
Nếu trong một chất nào đó người ta phân bố những hạt rất nhỏ của một hay nhiều
chất khác, ta được một hệ phân tán. Chất thứ nhất gọi là môi trường phân tán, chất thứ
hai gọi là chất phân tán.
Dung dịch là một hệ phân tán gồm môi trường phân tán và chất phân tán phải đồng nhất
Môi trường phân tán là chất quyết định dạng tồn tại của hệ. Trong trường hợp các
chất ở cùng một dạng tồn tại, chất nào có lượng nhỏ hơn sẽ đóng vai trò chất phân tán,
chất nào có lượng lớn hơn sẽ đóng vai trò môi trường phân tán.
Môi trường phân tán là chất lỏng, thường được gọi là dung môi. Dung môi có thể
là dung môi vô cơ (H2O), dung môi hữu cơ (rượu), dung môi phân cực (acid axetic),
dung môi không phân cực (n- Hexan).
1.2. Phân loại dung dịch 1.2.1.Phân loại theo trạng thái của môi trường phân tán
Môi trường phân tán tồn tại dưới ba trạng thái: rắn, lỏng và khí. Như đã quy định
ở trên, môi trường phân tán quyết định dạng tồn tại của dung dịch. Do đó dung dịch phân
loại theo cách này có ba loại : dung dịch khí (khí dung, thuốc xịt), dung dịch lỏng (dung
dịch natri clorid 0,9%...), dung dịch rắn (thuốc ở dạng viên nén,dạng nang hay bột…)
Do khả năng khuyếch tán nhanh nên dung dịch tồn tại dạng khí cho hiệu quả chữa
bệnh nhanh hơn so với dạng lỏng, dạng lỏng nhanh hơn so với dạng rắn. Tuy nhiên nhược
điểm của thuốc dạng khí khó điều chế, khó bảo quản, dụng cụ chứa có cấu tạo phức tạp
chỉ phù hợp với việc điều trị bệnh tức thời, vận chuyển khó khăn.
1.2.2. Phân loại theo kích thước chất tan
Trong trường hợp môi trường phân tán là chất lỏng, tùy theo kích thước của các
tiểu phân phân tán mà dung dịch chia làm 3 loại:
+ Dung dịch thực (dung dịch) : kích thước các tiểu phân phân tán nhỏ hơn 1nm
(cỡ nguyên tử, phân tử hay ion). Chất tan không nhìn thấy được qua kính hiển vi điện tử,
đi qua màng siêu lọc và màng thẩm tích, khuyech tán nhanh. Ví dụ về dung dịch thực:
Dung dịch NaCl, rượu 370. Đây là hệ phân tán đồng thể
+ Dung dịch keo: kích thước tiểu phân phân tán từ 1nm – 100nm. Chất tan không
nhìn thấy được qua kính hiển vi thường, nhìn được qua kính siêu hiển vi, hiển vi điện tử,
đi qua giấy lọc thường, không qua được màng thẩm tích, khuyếch tán rất chậm.
Đây là hệ phân tán vi dị thể.
Ví dụ: dung dịch hồ tinh bột, lòng trắng trứng, hơi nước trong không khí + Dung
dịch thô (hệ thô): kích thước các tiểu phân phân tán lớn hơn 100nm. Chất tan nhìn thấy
được trong các loại kính hiển vi, không qua giấy lọc thường, không qua được màng thẩm
tích, không khuyếch tán. Nếu chất phân tán ở trạng thái rắn gọi là huyền phù: nước phù
sa; nếu chất phân tán ở trạng thái lỏng thì gọi là nhũ tương. Đây là hệ phân tán dị thể.
Có nhiều loại thành phần cơ thể tồn tại ở nhiều dạng khác nhau hoặc là hỗn hợp
nhiều dạng dung dịch: Ví dụ : Sữa động vật là một dung dịch phức tạp gồm 87 – 89 % 3 lOMoAR cPSD| 45148588
nước (dung môi); 2,7 – 4,5 % lipit ở dạng nhũ tương; 2,7 – 3,8% casein ở dạng dung
dịch keo; 4,5 – 4,7 % lactose cùng với các muối khoáng và các vitamin ở dạng dung dịch
thật. Máu người gồm hồng cầu, tiểu cầu và bạch cầu là những tế bào máu, chiếm 40 –
46% thể tích máu tạo thành hệ phân tán thô trong huyết tương. Huyết tương chiếm 54 –
60% thể tích máu vừa là dung dịch keo (chứa các đại phân tử như albumin; protein; phức
hợp lipid – protein) vừa là dung dịch thật (chứa các chất hòa tan là những phân tử nhỏ oxi, glucose...)
Thuốc dưới dạng dung dịch thật hay dùng các dung môi là: nước, cồn hay dầu.
Ưu điểm của dạng thuốc này là thuốc ngấm nhanh, tác dụng nhanh hơn các dạng thuốc
rắn và không gây kích ứng khi tiếp xúc với niêm mạc vì các phân tử chất tan khuyêch
tán được qua màng tế bào vào dịch nội bào thể hiện tác dụng chữa bệnh. Hơn nữa, dược
chất được hoà tan trong dung môi nên có thể bào chế ở dạng thuốc giọt, rất tiện dùng cho
người già và trẻ nhỏ khi dùng qua đường uống. Nhược điểm của dạng thuốc này là thường
kém bền vững, nên không thể bảo quản lâu dài. Việc chia liều kém chính xác hơn dạng
thuốc rắn. Vận chuyển gặp nhiều khó khăn do dung dịch thuốc được đóng gói cồng kềnh và dễ vỡ.
Một số loại thuốc dạng dung dịch thật hay sử dụng như dung dịch natri clorid
0,9%; dung dịch glucose nồng độ khác nhau dùng để tiêm truyền… Thuốc dạng uống có
một số loại Siro (thuốc là dạng thuốc lỏng, sánh và có chứa tỷ lệ đường cao (56 64%),
được điều chế bằng cách hòa tan dược chất, dung dịch dược chất trong đường siro đơn
hoặc hòa tan đường trong dung dich dược chất, dùng để uống); Elixir là dạng thuốc lỏng,
chứa một hay nhiều dược chất, thường chứa một tỉ lệ lớn ethanol và saccharose hoặc
polyalcol (như glycerin) cùng một số chất phụ thích hợp (như chất bảo quản chống nấm
mốc..).Ví dụ như: elixir paracetamol, elixir phenobarbitan,… Dung dịch cồn thuốc là
dạng thuốc dùng trong hoặc dùng ngoài, gồm một hay nhiều dược chất hòa tan hoàn toàn
trong ethanol dùng bôi ngoài da…
Hỗn dịch là dạng thuốc lỏng để uống, tiêm hay dùng ngoài có chứa dược chất rắn
không hòa tan ở dạng hạt rất nhỏ (đường kinh ≥ 0,1μm) (dung dịch thô) được phân tán
đồng đều trong chất lỏng là môi trường phân tán. Môi trường phân tán thường gặp: nước,
nước thơm, dung dịch dược chất...Ưu điểm của thuốc ở dạng hỗn dịch là hạn chế được
nhược điểm của một số dược chất khi hoà tan kém bền vững hoặc có mùi vị khó uống và
gây kích ứng niêm mạc đường tiêu hoá. Đối với thuốc dạng hỗn dịch cần lắc kỹ trước
khi sử dụng. Thuốc tiêm dạng hỗn dịch dùng để tiêm dưới da (hỗn dịch trong môi trường
nước), tiêm bắp (hỗn dịch trong môi trường nước hoặc dầu); tiêm tĩnh mạch (hỗn dịch
nano có đường kính nhỏ hơn 500nm).
Nhũ tương là dạng thuốc lỏng chứa các tiểu phân lỏng phân tán trong một chất
lỏng khác không đồng tan. Có thể dùng để uống, tiêm hay dùng ngoài. Nhũ tương dạng
lỏng dùng để uống gọi là nhũ dịch.Ưu điểm: Che giấu mùi vị khó chịu của thuốc, giảm
tác dụng gây kích ứng niêm mạc đường tiêu hoá của dược chất. Nhũ tương dùng đường
tiêm không gây tắc mạch như các thuốc tiêm dạng dầu. Nhũ tương dùng để tiêm bắp,
tiêm tĩnh mạch hay làm dịch truyền. Cần lắc kỹ trước khi sử dụng.
Quy luật tương tác của các hạt phân tán với môi trường phân tán và của các hạt
tương tác với nhau đã quyết định tới sự khuyêch tán, sự hấp thu và có tác dụng ngắn –
dài hay nhanh – chậm của một dạng thuốc.
Các dạng thuốc phun mù, thuốc xịt dưới dạng khí dung có tác dụng điều trị nhanh
và hiệu quả tại chỗ là do cấu trúc của các thuốc này là hệ keo. 4 lOMoAR cPSD| 45148588
Trong nhóm thuốc tác dụng kéo dài thường là những hệ phân tán dị thể gồm
những hạt tiểu phân hoạt chất phân tán trong các tá dược cao phân tử, nhằm giải phóng
từ từ dược chất. Hệ phân tán này đã góp phần quan trọng trong việc kéo dài hiệu quả điều trị của thuốc.
1.2.3. Phân loại theo lượng chất tan
Khi cho chất tan rắn vào một dung môi sẽ xảy ra hai quá trình: quá trình tách các
hạt chất tan từ bề mặt tiếp xúc giữa chất tan và dung môi, gọi là quá trình hòa tan, có tốc
độ hòa tan vht (số hạt chất tan chuyển vào dung môi trong một đơn vị thời gian). Các hạt
chất tan đã ở trong dung môi có thể gặp lại bề mặt chất tan rồi bị giữ lại trong cấu trúc
chung, đó gọi là quá trình kết tinh, có tốc độ vkt (số hạt chất tan trở lại cấu trúc chung
trong một đơn vị thời gian). Ban đầu tốc độ hòa tan lớn hơn tốc độ kết tinh. Nhưng khi
dung môi đã có nhiều hạt chất tan (nồng độ chất tan trong dung dịch lớn) thì tốc độ kết
tinh lớn dần, tốc độ hòa tan nhỏ dần
Dựa vào lượng chất tan có trong dung dịch, người ta chia dung dịch làm ba loại:
+ Nếu vht> vkt, dung dịch chứa lượng chất tan nhỏ hơn lượng chất tan tối đa có
thể hòa tan ở nhiệt độ nhất định gọi là dung dịch chưa bão hòa. Dung dịch chưa bão hòa
có khả năng hòa tan thêm chất tan.
+ Nếu vht= vkt, trong một đơn vị thời gian, có bao nhiêu hạt chất tan chuyển vào
dung dịch thì cũng có chừng ấy hạt từ dung dịch trở về cấu trúc ban đầu của chất tan.
Quá trình hòa tan đạt trạng thái cân bằng. Dung dịch chứa lượng chất tan bằng lượng
chất tan tối đa có thể hòa tan ở nhiệt độ nhất định gọi là dung dịch bão hòa. Dung dịch
bão hòa không thể khả năng hòa tan thêm chất tan và có nồng độ không đổi.
+ Nếu vht < vkt, Dung dịch chứa lượng chất tan lớn hơn lượng chất tan tối đa có
thể hòa tan ở nhiệt độ nhất định gọi là dung dịch quá bão hòa. Loại dung dịch này được
tạo thành khi làm nguội chậm và yên tĩnh một dung dịch bão hòa ở nhiệt độ cao. Dung
dịch quá bão hòa không có khả năng hòa tan thêm chất tan, là dung dịch kém bền vững,
dễ tách lượng chất tan ra tạo dung dịch bão hòa.(quá bão hòa để 1 thời gian sẽ chuyển về bão hòa)
1.3. Vai trò của các dung dịch đối với cơ thể sống
Trong cơ thể sống tồn tại nhiều loại dung dịch khác nhau. Có thể liệt kê ra một số
vai trò chủ yếu của các dung dịch trong cơ thể sống là: vận chuyển chất từ nơi này đến
nơi khác của cơ thể (từ ngoài màng tế bào vào trong màng tế bào, vận chuyển từ cơ quan
này đến cơ quan khác trong cơ thể); là môi trường để thực hiện các phản ứng sinh hóa
(các phản ứng chuyển hóa trong cơ thể); bao bọc và bảo vệ các tế bào, các tổ chức sống
(dịch tế bào); là yếu tố không thể thiếu trong quá trình trao đổi vật chất qua màng; là yếu
tố dẫn điện trong quá trình lan truyền xung điện sinh vật; điều hòa thân nhiệt của cơ thể sống
1.4. Cách biểu thị nồng độ
Nồng độ là cách biểu thị thành phần định lượng của một dung dịch. Nó biểu thị
lượng chất tan (g, mol) có trong một khối lượng xác định (một thể tích xác định) của dung dịch hoặc dung môi
Lượng chất tan càng lớn thì nồng độ càng lớn và ngược lại. Loại nồng độ Kí hiệu Định nghĩa
Phần trăm theo khối lượng
%(KL/KL) Số g chất tan có trong 100 g dung (KL) dịch 5 lOMoAR cPSD| 45148588
Phần trăm theo thể tích (V) %(V/V)
Số ml chât tan trong 100ml dung dịch
Phần trăm theo khối lượng – % (KL/V)
Số g (mg) chất tan có trong 100ml thể tích dung dịch Mol M, mol/l
Số mol chất tan có trong 1 L dung dịch Molan M
Số mol chất tan có trong 1000 g dung môi Phần mol X hoặc Ni
Tỷ số giữa số mol một chất có trong
dung dịch và tổng số mol các chất có trong dung dịch
Loại nồng độ dung dịch hay sử dụng trong y học là nồng độ phần trăm theo khối
lượng – thể tích % (KL/V)
Ví dụ: Thuốc nhỏ mắt natri clorid NaCl 0,9% có nghĩa là có 0,9 g NaCl trong 100 ml dung dịch
Dung dịch glucose 30%, (G 30) nghĩa là 30 gam glucose có trong 100ml dung dịch
Thuốc tiêm phenobarbital 10% nghĩa là 10g phenobarbital trong 100 ml dung dịch (hay 200mg/2ml) 1.5. Độ tan S
Độ tan của một chất trong một dung môi là nồng độ dung dịch bão hòa bền vững
của chất đó ở nhiệt độ và áp suất nhất định.
Như vậy có bao nhiêu cách biểu diễn nồng độ dung dịch thì có bấy nhiêu cách
biểu diễn độ tan. Hay sử dụng độ tan của một chất tan ở nhiệt độ xác định là số gam chất
tan tối đa tan được trong 100 gam dung môi.
Độ tan của một chất phụ thuộc vào: bản chất chất tan, bản chất dung môi và nhiệt độ khi hòa tan. Phân loại khả năng tan: Ở 200C:
+ Chất có độ tan lớn hơn 1g: chất dễ tan
+ Chất có độ tan từ 0,001 – 1 gam: chất ít tan
+ Chất có độ tan nhỏ hơn 0,001 gam: chất không tan
3. HIỆN TƯỢNG THẨM THẤU
3.1. Khái niệm
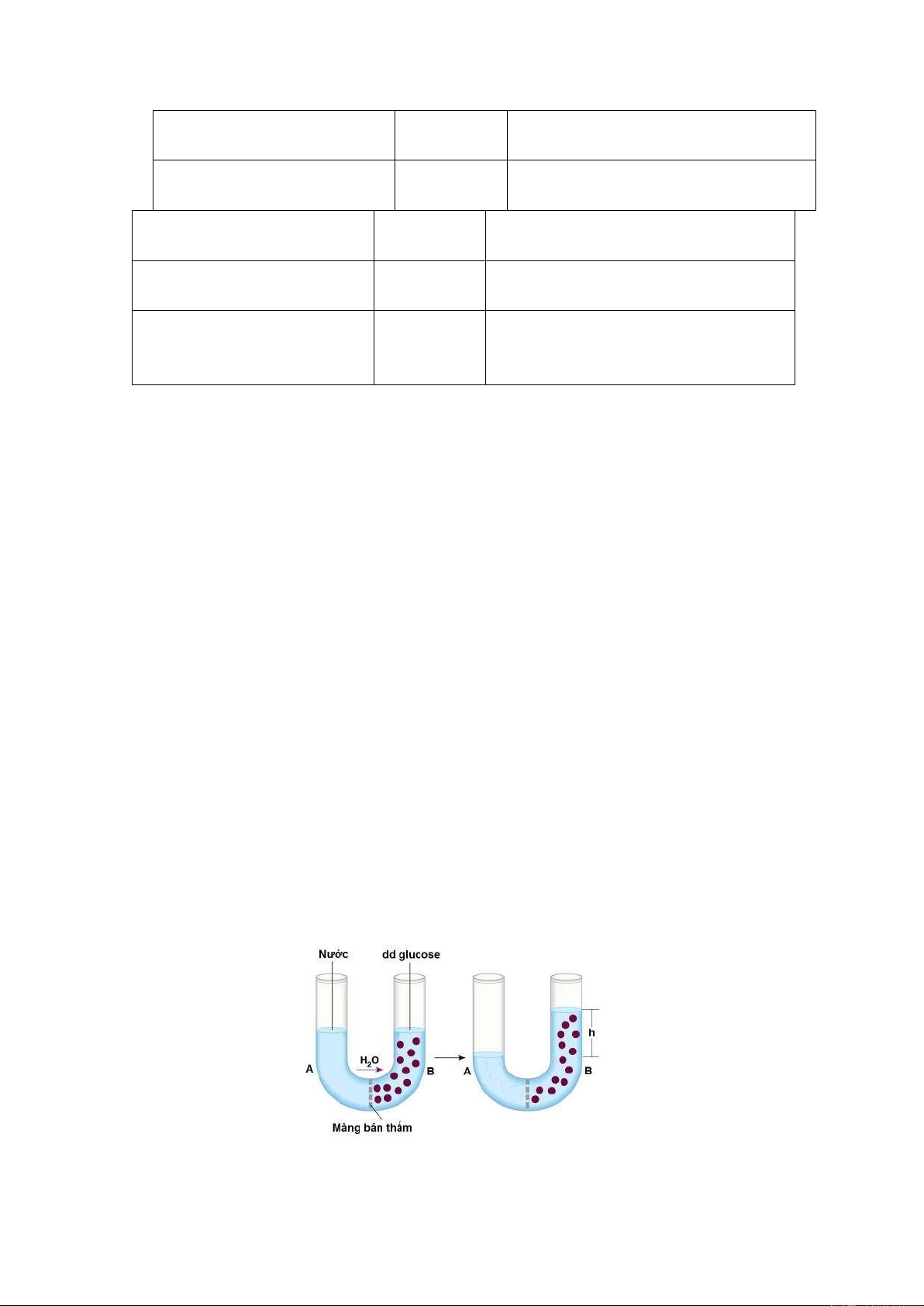
Có một ống thủy tinh hình chữ U ở giữa được đặt một màng bán thấm (màng chỉ
cho dung môi đi qua mà không cho các phân tử chất tan đi qua). Nhánh A đựng nước,
nhánh B đựng dung dịch glucose.
+ Ban đầu mực nước ở hai nhánh bằng nhau. 6 lOMoAR cPSD| 45148588
+ Một thời gian sau, thấy mực chất lỏng ở nhánh A giảm đi và nhánh B dâng lên và
dâng lên đến độ cao h nào đó thì dừng lại.
+ Hiện tượng này gọi là hiện tượng thẩm thấu của dung dịch.
Hiện tượng thẩm thấu xuất hiện khi: Dung dịch tiếp xúc với dung môi nguyên
chất qua màng bán thấm hoặc hai dung dịch có nồng độ khác nhau tiếp xúc với nhau qua màng bán thấm.
Hiện tượng thẩm thấu không thể hiện ở các dung môi riêng biệt.
3.2. Giải thích hiện tượng thẩm thấu
Do tính chất của màng bán thấm chỉ cho các phân tử nước đi qua, nên các phân
tử nước có thể đi từ nhánh A sang nhánh B và ngược lại.
Lúc đầu lượng nước ở nhánh A lớn hơn ở nhánh B, nên các phân tử nước đi từ
nhánh A sang nhánh B lớn hơn các phân tử nước đi từ nhánh B sang nhánh A. Kết quả
này làm tăng thể tích dung dịch trong nhánh B.
Cột dung dịch trong nhánh B tăng lên làm tăng áp suất thủy tĩnh trong nhánh B
tác dụng lên màng bán thấm, làm tăng tốc độ các phân tử nước từ nhánh B ra nhánh A,
làm giảm tốc độ các phân tử nước từ nhánh A sang nhánh B. Đến một lúc nào đó, tốc độ
các phân tử nước di chuyển qua màng bán thấm bằng nhau, thì thể tích dung dịch trong
nhánh B không tăng thêm nữa. Ta nói hiện tượng thẩm thấu đã dừng lại. Sự chuyển các
phân tử dung môi vào dung dịch gọi là sự thẩm thấu.
Hiện tượng thẩm thấu là hiện tượng di chuyển của dung môi từ nơi có nồng độ
chất tan thấp đến nơi có nồng độ chất tan cao qua màng bán thấm
3.3. Định luật VanHoff
Áp suất thẩm thấu: Áp suất thẩm thấu là áp suất cần thiết đặt lên dung dịch ngăn
cách với dung môi bằng màng bán thấm để làm ngừng sự thẩm thấu.
Áp suất thẩm thấu của dung dịch càng lớn khi nó tiếp xúc với dung dịch có nồng
độ càng thấp hơn nó. Như vậy, áp suất thẩm thấu sẽ là lớn nhất khi nó tiếp xúc với dung môi nguyên chất.
Định luật Van Hôp: П = C.R.T hay П.V = n.R.T
П: Áp suất thẩm thấu (atm)
C: nồng độ của dung dịch (mol/l) T: Nhiệt
độ dung dịch (K) V: Thể tích dung dịch (l) n: Số mol chất tan trong
dung dịch R: Hằng số khí 0,082 l.atm/mol.K
Áp suất thẩm thấu của dung dịch tỷ lệ với nồng độ mol chất tan và nhiệt độ tuyệt đối của dung dịch.
Định luật này áp dụng cho những dung dịch loãng, vì chỉ khi đó khoảng cách
giữa các chất tan mới đủ lớn để lực tương tác giữa chúng là không đáng kể.
Nếu hai dung dịch có áp suất thẩm thấu bằng nhau gọi là dung dịch đẳng trương so với nhau.
Nếu hai dung dịch có áp suất thẩm thấu khác nhau, thì dung dịch nào có áp suất
thẩm thấu lớn hơn gọi là dung dịch ưu trương và ngược lại gọi là dung dịch nhược trương so với nhau.
Áp suất thẩm thấu của các dung dịch điện li thường lớn hơn các giá trị tính toán
theo định luật nói trên. Và các dung dịch này đều dẫn được điện.
Để áp dụng công thức tính П cho các dung dịch điện li ta phải bổ xung thêm hệ
số bổ chính i (hệ số VanHop, hệ số đẳng trương). Khi đó các công thức tính П có dạng: П = i.C.R.T 7 lOMoAR cPSD| 45148588
Giá trị i đo được bằng thực nghiệm. Nó cho biết các giá trị áp suất thẩm thấu đo
được bằng thực nghiệm lớn hơn bao nhiêu lần so với lý thuyết.
Để giải thích hiện tượng trên, Arenius đưa ra thuyết điện li:
- Những chất ở trạng thái nóng chảy hay hòa tan có khả năng dẫn điện được gọilà chất điện li.
- Khi hòa tan vào nước, các chất điện li thành các phần tử mang điện dương
vàcác phần tử mang điện âm.
Nguyên nhân gây ra tính sai lệch của định luật Vanhop và tính dẫn điện của các
dung dịch acid, base, muối là sự điện li thành các ion của các phân tử của chúng khi hòa tan vào nước.
Để đánh giá mức độ phân li của một chất, người ta đưa ra khái niệm độ điện li
α, chính là tỷ số giữa số phân tử đã phân li ra ion và tổng số phân tử chất đem hòa tan. Ta có 0 ≤ α ≤ 1
+ Nếu α = 0, chất tan không phân li thành ion, chất này gọi là chất không điện
li, dung dịch thu được khi hòa tan chất không điện li gọi là dung dịch chất không điện
li (dung dịch lỏng phân tử) và dung dịch này không có khả năng dẫn điện.
+ α < 3%: chất điện li yếu
+ 3% < α < 30%: chất điện ly trung bình
+ α > 30% : chất điện li mạnh
Độ điện li α phụ thuộc vào bản chất dung môi, bản chất chất điện li, nhiệt độ và nồng độ dung dịch.
Mối quan hệ giữa độ điện li α và hệ số bổ chính i:
i chính là tỷ số giữa tiểu phân có trong dung dịch và tổng số phân tử hòa tan:
Giả sử có N phân tử chất A có độ điện li α, mỗi phân tử A phân li ra n ion, thì tổng
số phân tử chưa phân li và số ion trong dung dịch là: N(1-α) +n.N.α
N(1−α)+n.N .α i−1 Ta có i = N
= 1 + α(n – 1) hay α = n−1
Như vậy dung dịch đường và dung dịch muối có cùng nồng độ thì áp suất thẩm thấu
của dung dịch muối cao hơn dung dịch đường
3.4. Vai trò hiện tượng thẩm thấu
Có ý nghĩa lớn đối với quá trình hoạt động sống:
+ Đa số các màng tế bào đều có tính bán thấm. Nhờ hiện tưọng thẩm thấu mà
nước có thể qua màng tế bào, điều hòa nồng độ chất tan và gây ra một sức căng làm cho
cơ thể sinh vật chắc và có tính đàn hồi. Khi tế bào chết, màng tế bào mất tính bán thấm.
+ Đối với cơ thể con người chỉ cần một thay đổi nhỏ về áp suất thẩm thấu cũng
gây ảnh hưởng nghiêm trọng đến quá trình trao đổi chất của cơ thể. Khi cần tiêm truyền
các dung dịch vào máu, cần phải tiêm truyền dung dịch đẳng trương so với máu (dung
dịch glucose 5% hoặc dung dịch NaCl 0,9%). Nếu tiêm truyền vào máu những dung dịch
ưu trương hoặc nhược trương sẽ gây hiện tượng teo hoặc trương vỡ hồng cầu. Thuốc nhỏ
mắt, rửa mắt phải đẳng trương với dịch mắt để không làm biến đổi các thể tích các tế bào
giác mạc (nước muối sinh lý là dung dịch NaCl 0,9%). Trường hợp tiêm các dung dịch
nhược trương như dung dịch natri clorid 0,45 % chỉ được tiêm bắp, tiêm dưới da, tiêm
tĩnh mạch với lượng nhỏ. Khi tiêm hoặc truyền dung dịch ưu trương chỉ tiêm tĩnh mạch
như với tốc độ chậm để thuốc có thể được pha loãng nhanh, tránh gây ra sự thay đổi đột
ngột của áp suất thẩm thấu (gây đau, gây tổn thương vị trí tiêm) 8 lOMoAR cPSD| 45148588
Nước chiếm khoảng 60% - 80% trọng lượng cơ thể. Nước đóng vai trò quan trọng
trong việc chuyển hóa các chất dinh dưỡng vào máu và truyền đi tới các bộ phận khác
trong cơ thể. Nước di chuyển tự do ở nơi có nồng độ chất hoà tan thấp sang nơi có nồng
độ chất hoà tan cao hơn để bảo đảm cân bằng áp lực thẩm thấu. Nước cũng giống như
chất đạm, vitamin là những chất cần thiết cho sự sinh tồn của cơ thể, là vật chất để duy
trì hoạt động cơ bản nhất của sự sống. Chỉ cần mất 10% số lượng nước là cơ thể đã đối
đầu với nhiều nguy hiểm đến tính mạng.
Đồng hành với nước trong cơ thể là các chất điện giải hay còn gọi là các chất
khoáng. Chất điện giải là những chất phân ly thành các ion khi hòa tan trong nước. Chất
điện giải đóng vai trò quan trọng trong việc duy trì sự hằng định của áp suất thẩm thấu.
Các ion kali, magie, photphat là những thành phần quan trọng của dịch lỏng trong tế bào.
Còn các ion natri, clo là thành phần không thể thiếu được của huyết tương. Chính vì vậy,
tình trạng mất nước và chất điện giải có thể gây ra những hậu quả nghiêm trọng tới sức
khỏe. Rối loạn nước và điện giải xảy ra khi xuất hiện yếu tố nào đó làm phá vỡ sự cân
bằng của nước và các chất điện giải gây nên những thay đổi có tính bất lợi cho cơ thể.
Mất nước và chất điện giải, cơ thể sẽ trong tình trạng suy kiệt, nặng hơn người bệnh có
thể tử vong. Một số bệnh lý gây rối loạn nước và điện giải như tiêu chảy, tiểu dầm, mồ
hôi trộm, có thể dẫn đến tử vong, đặc biệt là ở trẻ em. Khi cơ thể bị tiêu chảy, ốm sốt,
nôn dẫn đến mất nước ở trẻ em thì thường bù nước và các chất điện giải bằng dung dịch
oresol. Oresol là hỗn hợp các muối natri, kali và đường glucose được đựng trong gói.
Oresol được pha đúng, uống đúng sẽ bù lại lượng nước đã mất giúp trẻ phục hồi. Nếu
Oresol được pha đặc hơn so với khuyến cáo thì khi trẻ uống không khác gì uống một cốc
nước muối. Uống Oresol với nồng độ quá đặc như thế sẽ khiến hàm lượng muối trong
máu tăng lên, gây tình trạng ưu trương (quá nhiều muối trong máu), áp lực thẩm thấu
trong máu cao hơn bình thường (bình thường, hai bên màng tế bào cân bằng nhau). Do
nồng độ muối quá cao nên áp lực thẩm thấu trong máu cao hơn bình thường, “hút” nước
từ tế bào ra ngoài, khiến tế bào bị mất nước nên bị “teo” lại. Lúc này, trẻ có biểu hiện da
nhăn, khô, mắt trũng... Nguy hiểm nhất là khi tế bào não bị “teo”, gây tổn thương não
khiến trẻ bị co giật, sốt cao, vật vã, kích thích nặng hơn nữa thì hôn mê... Nếu không
được cấp cứu kịp thời, trẻ rất dễ bị tử vong. Chính vì vậy khi uống thuốc hay tiêm thuốc
để bù nước và chất điện giải cho cơ thể phải uống và tiêm đúng dung dịch đẳng trường với cơ thể.
Người ta cũng tạo ra môi trường có áp suất thẩm thấu rất lớn để bảo quản các
dược chất được lâu dài (siro), vì trong môi trường này các tế bào, vi khuẩn bào tử nấm
bị hút kiệt nước và chết. Thuốc lợi tiểu do thẩm thấu có cơ chế làm tăng áp suất thẩm
thấu ở ống thận để thu hút nhiều nước về thận rồi bài xuất qua nước tiểu.
Trong đời sống hàng ngày ta cũng gặp nhiều hiện tượng liên quan đến áp suất
thẩm thấu. Nhờ có áp suất thẩm thấu tăng dần từng bậc từ rễ cây lên ngọn mà nước và
dinh dưỡng có thể thấm qua màng có thể lên cao hàng chục mét. Cá nước mặn thích nghi
với áp suất thẩm thấu lớn của nước biển nên không thể sống được trong nước ngọt có áp
suất thẩm thấu thấp. Ướp muối lên thực phẩm để bảo quản thực phẩm.
4. PH CỦA CÁC LOẠI DUNG DỊCH ACID, BASE VÀ MUỐI
4.1. Khái niệm acid – base.
Theo Arenius: acid là những chất khi phân ly tạo ra ion H+, base là những chất khi phân ly tạo ra ion OH- 9 lOMoAR cPSD| 45148588
Ưu điểm của thuyết Arenius: Thuyết Arenius đã hệ thống hóa các acid – base và giải
thích được tính chất chung của acid – base.
Hạn chế của thuyết Arenius: Chỉ xét được trong dung dịch nước, chỉ giới hạn
trong một số chất có chứa ion H+ và OH-. Không giải thích được tính acid, base của nhiều chất.
Thuyết Bronsted và Lauri: Để khắc phục hạn chế của thuyết Arenius, Bronsted
và Lauri đưa ra thuyết Proton:
Acid là những chất có khả năng cho proton trong quá trình tương tác
Base là những chất có khả năng nhận proton trong quá trình tương tác. Khi một acid cho
proton thì chuyển thành base tương ứng và ngược lại, một cặp acid – base tương ứng như
vậy gọi là cặp acid - base liên hợp. Acid ⇋ base + H+
Đối với một cặp acid – base liên hợp, khi dạng acid càng dễ cho proton (tính
acid càng mạnh) thì dạng base càng khó nhận proton (tính base càng yếu) và ngược lại.
Mối liên hệ giữa hằng số Ka và Kb của một cặp acid – base liên hợp HA/A- trong dung dịch: HA ↔ H+ + A- A- + H2O ↔ HA + OHKa= Kb =
Ta có Ka. Kb = [H+] [OH-] = KN = 10-14 do pKa = - lgKa và pKb = - lgKb Nên: pKa + pKb = 14
Acid càng mạnh (pKa càng nhỏ) thì base liên hợp với nó càng yếu.
Trong cơ thể, pH ở các bộ phận có giá trị khác nhau và thay đổi theo thời gian.
Cơ thể con người chiếm 70% trọng lượng là dịch lỏng chứa Hydro, một người
nặng 50kg thì chứa 35kg dịch acid và kiềm. Vì thế vai trò của kiềm và acid vô cùng quan
trọng. Nguyên tố tạo kiềm di chuyển trong máu, còn nguyên tố tạo acid di chuyển lên não.
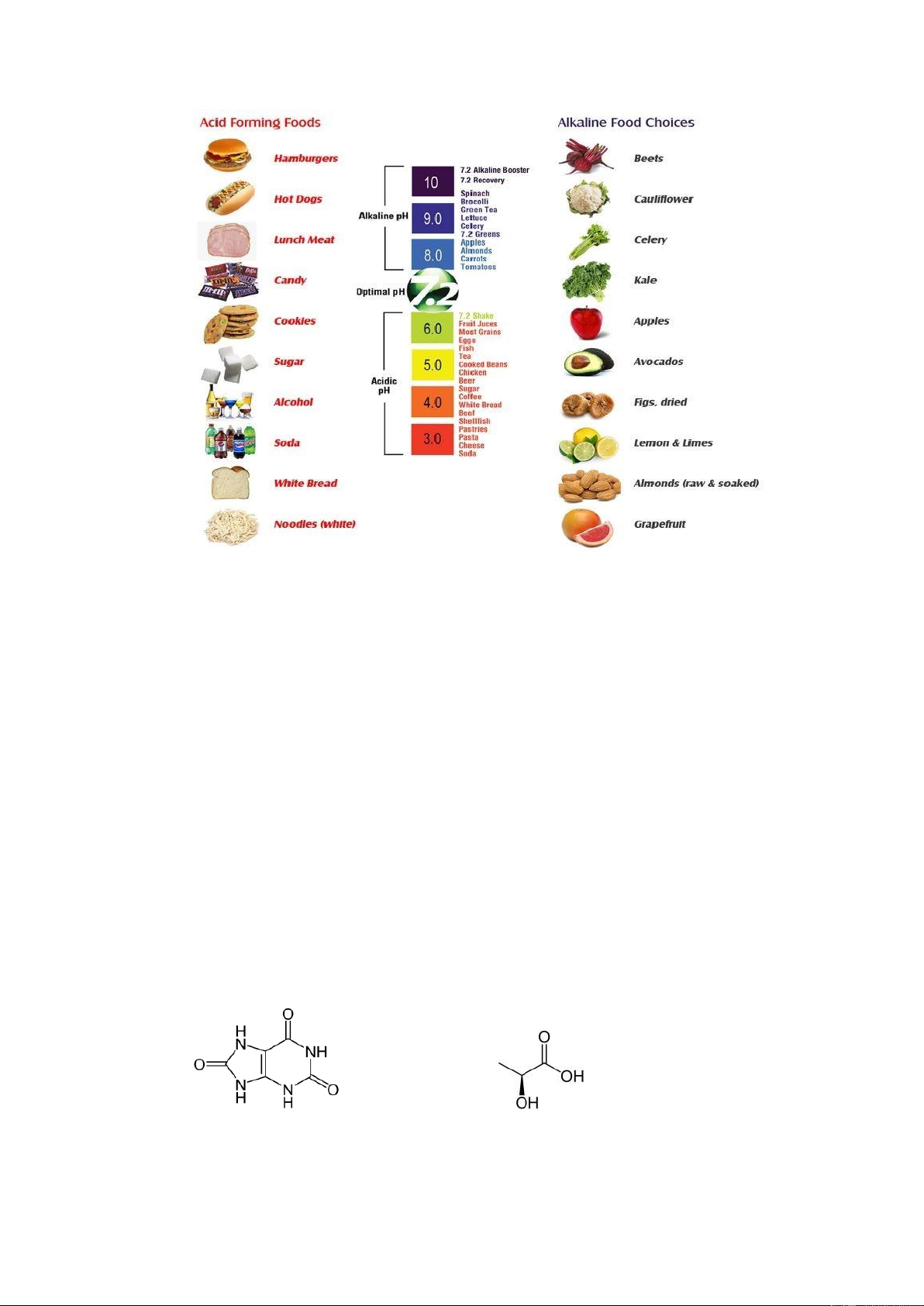
Các loại thực phẩm có chứa acid – base:
NOTE; chỉ số PH chỉ từ 1 đến 14 vì các chất sẽ có nồng độ là 0,1 đến 10^- 14( nước) 10 lOMoAR cPSD| 45148588
Ăn uống dư acid sẽ làm suy yếu hệ thần kinh, gây bệnh về thận, dạ dày và ung
thư. Còn nếu thừa kiềm trong máu sẽ gây kích thích mạnh trong hệ thần kinh dẫn đến
cảm giác bức rứt, khó chịu dẫn đến gây ra co rút đột ngột của cơ bắp. Một chế độ ăn
được gọi là lý tưởng khi thực phẩm tạo kiềm 60- 80% trong thực đơn, còn lại 20-40% là
thực phẩm tạo acid. Dù vậy chúng ta cũng cần một số thực phẩm tạo acid để có được
những chất dinh dưỡng thiết yếu.
Một số loại acid tồn tại trong cơ thể:
Acid uric là một hợp chất dị vòng của cácbon, nitơ, ôxi, và hyđrô với công thức
C5H4N4O3. Nó tạo thành các ion và muối được gọi là urat và acid urat như amoni acid
urate. Acid uric được tạo thành trong cơ thể do quá trình thoái giáng các nhân purin, sau
đó chúng được hòa tan trong máu và đưa đến thận và thải ra ngoài qua nước tiểu. Acid
uric tăng có thể do quá trình tăng cung cấp, tăng tạo hoặc giảm thải trừ acid uric qua thận
hoặc cả hai quá trình này. Khi nồng độ acid uric tăng cao kéo dài trong máu có thể dẫn
đến một dạng viêm khớp được biết đến với tên bệnh gout. Các hạt lắng đọng trong và
xung quanh các khớp dẫn đến hậu quả viêm, sưng và đau khớp, lắng đọng dưới da tạo
nên các hạt tophi, có thể tạo sỏi thận và suy thận. Hàm lượng acid Uric trong máu bình
thường ở nam trưởng thành là 210-420 µmol/l, ở nữ trưởng thành là 150-350 µmol/l. Khi
nồng độ acid uric cao hơn mức bình thường cảnh báo cơ thể đang tạo ra nhiều acid uric
hoặc chức năng thận bị suy giảm có nguy cơ mắc bệnh gout. pKa = 5,8 Acid Uric Acid lactic
Acid lactic: Hầu hết lượng acid lactic được tạo thành từ mô cơ và hồng cầu. Khi
nồng độ oxy trong cơ thể ở mức bình thường, cacbonhidrat phân giải thành nước và 11 lOMoAR cPSD| 45148588
carbon dioxide. Khi nồng độ oxy thấp, cacbonhidrat được phá vỡ tạo năng lượng và sản
sinh ra acid lactic. Nồng độ acid lactic cao lên khi luyện tập gắng sức hoặc các bệnh lý
khác – chẳng hạn như suy tim, nhiễm trùng nặng (nhiễm trùng huyết) hoặc sốc – giảm
lưu lượng máu và oxy toàn cơ thể. Nồng độ acid lactic cũng có thể tăng cao khi gan bị
tổn thương hoặc mắc bệnh nghiêm trọng, bởi vì gan bình thường có vai trò thoái giáng
acid lactic. Nồng độ acid lactic rất cao có thể gây tình trạng nghiêm trọng, đôi khi đe doạ
tính mạng còn được gọi là nhiễm toan lactic. Các triệu chứng của nhiễm toan lactic bao
gồm thở nhanh, vã mồ hôi nhiều, da lạnh ẩm, hơi thở có mùi mồ hôi, đau bụng, buồn
nôn hoặc nôn, lú lẫn và hôn mê. Nhiễm toan lactic cũng có thể gặp ở người dùng
metformin (Glucophage) để điều trị tiểu đường khi có kèm suy tim, suy thận hoặc nhiễm
trùng nặng. Kiểm tra hàm lượng acid lactic trong cơ thể làm xét nghiệm acid lactic. Xét
nghiệm acid lactic thường được thực hiện từ mẫu máu tĩnh mạch cánh tay nhưng cũng
có thể lấy từ máu động mạch.Acid lactic có thể được đo trong các dịch cơ thể khác ngoài
máu, chẳng hạn như dịch não tuỷ. Nồng độ acid lactic trong các dịch cơ thể thường tăng
khi có nhiễm trùng. Bác sĩ cũng có thể đo lượng acid lactic trong dịch não tuỷ để xác
định xem nhiễm trùng não là do vi khuẩn hay virus.
4.2. Sự thủy phân của muối
Một số muối khi hòa tan vào trong nước được dung dịch có pH khác 7. Ta nói những
muối này bị thủy phân.
Hiện tượng các ion của muối kết hợp với nước tạo ra acid yếu hoặc base yếu gọi là hiện tượng thủy phân.
+ Muối tạo bởi acid yếu và base mạnh: anion gốc acid bị thủy phân cho môi trường base
CH3COONa tạo bởi base mạnh là NaOH và acid yếu là CH3COOH
CH3COONa → Na+ + CH3COOCH3COO- + H2O ↔ CH3COOH + OH-
Môi trường có chứa ion OH-, là môi trường base
+ Muối tạo bởi acid mạnh và base yếu: cation kim loại sẽ bị thủy phân cho môi trường acid.
FeCl2 tạo bởi acid mạnh HCl và base yếu Fe(OH)2 FeCl2 → Fe2+ + 2Cl-
Fe2+ + H2O ↔ Fe(OH)+ + H+ Fe(OH)+ + H2O ↔ Fe(OH)2 + H+ Môi
trường có chứa ion H+, là môi trường acid.
+ Muối tạo bởi acid yếu và base yếu: cả cation và anion đều bị thủy phân, tùy vào
tương quan mạnh yếu giữa acid và base mà dung dịch có môi trường acid hay base
(NH4)2CO3 tạo bởi base yếu NH4OH và acid yếu H2CO3 (NH + 2- 4)2CO3 → 2NH4 + CO3 NH + 4 + H2O ↔ NH3 + H3O+ CO 2- - - 3 + H2O ↔ HCO3 + OHHCO3 + H2O ↔ CO2 + H3O+
+ Muối tạo bởi acid mạnh và base mạnh, khi hòa tan vào nước chúng không bị thủy
phân nên dung dịch thu được có pH bằng pH của nước.
4.3. pH của một số dung dịch acid, base, muối * Dung dịch acid
+ Acid mạnh: Xét dung dịch acid mạnh HA có nồng độ Ca. Trong dung dịch ta có các quá trình sau: 12 lOMoAR cPSD| 45148588 HA ↔ H+ + A- HOH ↔ H+ + OH-
Do tính trung hòa về điện trong dung dịch nên ta có: KN
[H+] = [A-] + [OH-] = Ca + [H+]
[H+]2 – Ca [H+] – KN = 0 Giải phương trình ta có: Ca KN [H+] = 2
(Vì nồng độ [H+] > 0)
+ Nếu dung dịch acid mạnh không quá loãng thì [H] » [OH-], ta có thể bỏ qua
nồng độ [OH-] trong biểu thức tính. Khi đó nồng độ [H+] = [A-] = Ca pH = - lg [H+] = - lgCa
+ Nếu dung dịch acid rất loãng, không thể bỏ qua nồng độ [OH-] trong biểu thức tính.
- Acid yếu: người ta chỉ tính gần đúng các giá trị pH của các dung dịch. Giả thiết
acid không quá yếu, dung dịch không quá loãng thì bỏ qua sự điện li của nước, vì acid
yếu, độ điện li nhỏ nên coi Ca = [HA] lúc cân bằng. HA ↔ H+ + A- có Ka =
[H+]2 = Ka.Ca hay [H+] = √KaCa hay 1 √K C 2 pH = - lg[H+] = - lg a a = (pKa – lgCa)
* Dung dịch base
- Base mạnh: Xét dung dịch base mạnh BOH, nồng độ Cb. Trong dung dịch ta có các quá trình sau: BOH = B+ + OH- HOH ↔ H+ + OH- KN = + ] ] + Cb+ [ H
Ta có: [OH-] = [B+] + [H+] hay [ H hay [H+]2 + Cb[H+] – KN = 0 KN [H+] = 2
+ Nếu dung dịch không quá loãng, thì [H+] « [OH-], ta có thể bỏ qua nồng độ [H+] trong biểu thức tính. = 13 lOMoAR cPSD| 45148588
Khi đó [OH-] ≈ [B+] = Cb hay [KHN Cb
KCNb = 10C−b14 + ] hay [H+] =
Ta có pH = - lg[H+] = 14 + lgCb
+ Nếu dung dịch quá loãng, không thể bỏ qua nồng độ [H+] trong biểu thức tính.
- Base yếu: tính pH gần đúng của các dung dịch base yếu với giả thiết base không
quá yếu, dung dịch không quá loãng, thì bỏ qua sự điện li của nước. [B−][OH−] ]
Xét ví dụ base yếu BOH có : BOH ↔ B+ + OH- có Kb = [ BOH
Lúc cân bằng có: [B-] = [OH-] và [BOH]cb = [BOH] ban đầu = Cb KN 2 ] ) 2 ( + 1 [OH−] [ H Kb = Cb = Cb
Từ đó suy ra pH = 14 - 2 ( pKb−lg Cb)
Đối với các acid yếu và base yếu đa bậc, vì sự điện li của nấc thứ nhất là chủ yếu,
nên trong công thức tính gần đúng lấy pK bằng pK1. Dung dịch muối
Các dung dịch muối có pH ≠7, thì đó là dung dịch chứa các muối bị thủy phân,
thực chất đó là acid yếu hoặc base yếu. vì vậy áp dụng công thức tính pH đối với acid yếu hoặc base yếu.
Muối tạo bởi acid yếu và base mạnh sẽ tạo ra môi trường có tính base yếu: 1 ( )
pH = 14 - 2 pKb−lg Cm . Muối tạo bởi base
yếu và acid mạnh => môi trường acid yếu: pH = (pKa – lgCm)
Đối với cặp acid – base liên hợp ta luôn có:
Ka. Kb = 10-14 pKa + pKb = 14.
Ví dụ: Xét muối tạo bởi acid yếu và base yếu: CH3COONH4 CH + 3COONH4 = CH3COO- + NH4 CH +
3COO- + NH4 + H2O ↔ CH3COOH + NH4OH Ta có: ] [H+ [CH3COO−] [ NH4+] [OH−] 14 lOMoAR cPSD| 45148588
Ka= [CH3COOH ] và Kb = [ NH4OH ] Ka
[H+ ] [CH3COO−] . [ NH4OH ] Nên Kb = [CH3COOH ] [ NH4+][OH−] Lúc cân bằng ta có : [NH +
4OH] = [CH3COOH] và [NH4 ] = [CH3COO-] Ka ] ]
Ta có Kb = [OH− = [ H+ 1 Nên [H+] =
b hay pH = 7+ 2( pKa−pKb)
Như vậy, pH của dung dịch không phụ thuộc vào nồng độ của dung dịch mà chỉ phụ
thuộc vào hằng số điện li của acid – base. 5. DUNG DỊCH ĐỆM
5.1. Định nghĩa và phân loại dung dịch đệm
Dung dịch đệm (hệ đệm) là dung dịch có pH thay đổi không đáng kể khi ta thêm
lượng nhỏ acid mạnh hoặc base mạnh, hay pha loãng dung dịch. Có hai loại dung dịch đệm:
+ Hệ đệm acid: gồm một acid yếu và muối của nó với base mạnh
+ Hệ đệm base: gồm một base yếu và muối của nó với acid mạnh
Như vậy thành phần của
dung dịch đệm gồm một acid và một
base liên hợp với acid đó và luôn acid ↔ base + H+ tồn
tại cân bằng 5.2. pH của dung dịch đệm
- Dung dịch đệm acid:
Giả sử có dung dịch đệm gồm một acid yếu HA (Ca) và muối của nó với base
mạnh BA (Cm), ta có phương trình điện li: HA ↔ H+ + A- và BA = B+ + AĐể tính
gần đúng pH, ta bỏ qua sự điện li của nước và sự thủy phân của muối. Lúc các quá trình đạt cân bằng ta có:
[HA]cb ≈ [HA]đ = Ca và [A-]cb = [BA]đ = Cm
[H+ ] [ A− ] [ H+ ]Cm Ca ơ = [ HA ] C Ta có Ka = a [H+] = Ka. Cm Ca Ca Ca pK pH = -lgK C C a - lg
a. Cm hay pH = - lg[H+] = - lg Ka m = m (Ph của hệ đệm acid)
- Dung dịch đệm base: Giả sử dung dịch đệm gồm một base yếu BOH (Cb) và
muối của nó với acid mạnh BA (Cm). Trong dung dịch ta có các phương trình: 15 lOMoAR cPSD| 45148588
BOH ↔ B+ + OH- và BA = B+ + A-
Để tính gần đúng pH bỏ qua sự thủy phân của muối và sự điện li của nước.
Lúc đạt cân bằng ta có: [BOH]cb ≈ [BOH]đ = Cb và [B+] ≈ [BA] = Cm Cm[ OH− ] 10−14 Cm 10−14 Cm Kb = [ BOH ] = Cb
= [ H+ ] Cb hay [H+] = Kb Cb Cb pH = 14 – pKb + lgC hay
m (PH của hệ đệm base)
5.3. Cơ chế đệm - Hệ đệm acid:
Ví dụ: Dung dịch đệm axetat: CH3COONa / CH3COOH
Phương trình điện li: CH3COONa = CH3COO- + Na+ và CH3COOH ↔ CH3COO- + H+
+ Khi thêm một lượng nhỏ dung dịch acid mạnh, tức thêm H+ vào dung dịch đệm,
khi đó H+ sẽ kết hợp với ion CH3COO- có trong dung dịch tạo ta CH3COOH là acid điện
li yếu, do đó nồng độ ion H+ thêm vào ở trạng thái tự do tăng lên không đáng kể.
+ Thêm một lượng nhỏ base mạnh, tức thêm OH- vào dung dịch đệm. Khi đó ion
OH- sẽ kết hợp với ion H+ do CH3COOH phân li ra, lượng H+ tự do bị giảm sẽ được bù
lại do CH3COOH có nhiều trong dung dịch phân li ra. Vì vậy lượng H+ bị giảm đi không
đáng kể nên pH của dung dịch không thay đổi.
- Hệ đệm base: cơ chế tương tự như hệ đệm acid.
Ví dụ: Khi pha loãng dung dịch đệm, pH của dung dịch cũng ít bị thay đổi, vì
vậy theo công thức tính pH của dung dịch đệm thì khi pha loãng, tỷ lệ Ca/Cm hoặc Cb/Cm
không thay đổi, nên pH của dung dịch cũng ít thay đổi.
Tuy nhiên không thể pha loãng dung dịch đệm với bất kì tỷ lệ nào, vì khi pha
loãng thì công thức tính pH của dung dịch đệm không còn áp dụng được nữa, do khi xây
dựng công thức tính pH của dung dịch ta bỏ qua sự điện li của nước và sự thủy phân của
muối. Mặt khác khi pha loãng làm tăng độ điện li của acid, base yếu, tăng độ thủy phân
của muối, nên dung dịch đệm mất tác dụng.
Giải thích cơ chế đệm tổng quát: Trong dung dịch đệm tồn tại cân bằng: Acid ↔ Base + H+
Khi thêm acid mạnh, ion H+ do acid mạnh phân li ra sẽ kết hợp với base tạo ra
acid yếu liên hợp, lượng H+ tăng lên không đáng kể, và do đó pH thay đổi không đáng kể.
Khi thêm base mạnh: ion OH- do base mạnh phân li ra sẽ kết hợp với ion H+(do
acid phân li ra), tạo ra nước là chất điện li kém, lượng H+ bị hao hụt được bù lại nhờ cân
bằng chuyển dịch về bên phải, làm cho pH của dung dịch đệm thay đổi không đáng kể.
5.4. Vai trò dung dịch đệm
- Nhiều ứng dụng trong công nghiệp như trong hóa học, cơ thể sinh vật. 16 lOMoAR cPSD| 45148588
+ Trong hóa học: dùng dung dịch đệm để tạo ra môi trường có pH ổn định dùng để
tiến hành trong các phản ứng cần môi trường pH không thay đổi.
+ Các cơ thể sinh vật chỉ tồn tại trong khoảng pH xác định. Đối với các dịch trong
cơ chế, nếu pH chỉ cần thay đổi đi ± 0,2 đơn vị thì đã gây ra những rối loạn trong hoạt động sống.
Acid và độ kiềm đều quan trọng đối với cơ thể. Trong khi dạ dày đòi hỏi mức
acid cao để tiêu hóa thực phẩm thì hệ thống miễn dịch lại vào kiềm là chủ yếu. Hai yếu
tố này luôn cùng tồn tại với sự cân bằng - cân bằng độ pH. Nhưng nếu cơ thể bị đẩy vào
trạng thái có nồng độ acid cao (thừa acid) thì có thể gây ra các hiệu ứng nguy hiểm.
Sự cân bằng độ pH của cơ thể con người có một tầm quan trọng to lớn cho sức
khỏe, nhưng ít người biết về nó và quan tâm đến sự cân bằng này. Độ pH đánh giá cơ
thể của chúng ta đang ở mức nào, trong môi trường kiềm (giàu oxy) hoặc môi trường
acid (thiếu oxy). Khi cơ thể thừa acid gây ra các bệnh như sau:
Thừa cân và không giảm cân được: Khi cân bằng tính kiềm trong cơ thể không
được duy trì, sẽ có những chất thải chứa acid dư thừa được hình thành. Đại tràng, thận,
hệ bạch huyết và da – các bộ phận có chức năng đào thải các chất độc ra khỏi cơ thể –
bây giờ cũng không thể loại bỏ các chất thải này bởi vì chúng đang quá tải khi xử lý các
chất độc hại từ acid dư thừa. Từ đó, cơ thể phải đối phó với lượng acid dư thừa này bằng
cách đẩy chúng vào trong các mô mỡ, nơi mà acid có thể bám vào các tế bào mỡ. Điều
đó là lý do không thể giảm cân khi cơ thể của bạn có quá nhiều acid.
Yếu xương: Xương trở nên yếu đi khi cơ thể rút lượng canxi dự trữ của xương để
trung hòa acid cho cơ thể . Khi cơ thể thừa acid, các khoáng chất quan trọng cho các cơ
quan và mô tế bào hoạt động, đặc biệt là canxi bị tàn phá. Lâu dần điều này dẫn đến cấu trúc xương giòn, yếu.
Vấn đề răng miệng: Tương tự như xương, lượng canxi trong răng bị giảm đi khi
cơ thể thừa acid. Sức khỏe răng miệng sẽ đi xuống, tạo điều kiện cho vi khuẩn miệng
phát triển, dẫn đến sâu răng và một số vấn đề khác.
Thường xuyên mệt mỏi: môi trường lý tưởng cho các vi sinh vật phát triển đó là
môi trường acid. Các vi khuẩn, nấm, virut… xâm chiếm vào các cơ quan của tiêu hóa,
làm cho chúng ta thêm mệt mỏi, chán ăn. Điều này dẫn đến hệ miễn dịch và làm cạn kiệt
cơ thể, khiến cơ thể mệt mỏi thường xuyên.
Mất ngủ: Không đủ canxi trong cơ thể dẫn đến mất ngủ . Đây là một triệu chứng
điển hình khác khi cơ thể hấp thụ canxi có trong xương và sử dụng nó để trung hòa acid trong cơ thể.
Tích tụ chất nhầy: Sự sản xuất chất nhầy là cơ chế bảo vệ tự nhiên của cơ thể
chống lại sự tích tụ acid trong việc cố gắng để đẩy nó ra khỏi cơ thể thông qua đường
mũi. Nó cũng có thể do sự tích tụ acid trong chính đường mũi. Sự tích tụ dịch nhầy
thường xuyên và sự tiếp xúc liên tục của phổi với dịch nhầy cuối cùng là dẫn đến ho, thở
khò khè, các vấn đề về xoang, các vấn đề về hô hấp và đau ngực.
Các vấn đề về da: Hàm lượng acid cũng có thể gây ra các rối loạn về da và khiến
da trở nên xấu đi. Mụn trứng cá và ban da xuất hiện thường xuyên vì cơ thể đang cố gắng
loại bỏ độc tố qua da.
Vì vậy, cơ thể sinh vật cần có những hệ đệm để điều chỉnh pH vì thức ăn hay
nước uống đưa vào cơ thể sẽ làm thay đổi pH rất nhiều.
Trong máu người có 3 hệ đệm quan trọng giúp duy trì pH của máu người là hệ đệm cacbonat H - - 2-
2CO3/(Na+)HCO3 ; (Na+)H2PO4 /(Na+)2HPO4 và các protein trong huyết 17 lOMoAR cPSD| 45148588
tương; hemoglobin/oxyhemoglobin. Trong huyết tương có 4 hệ đệm: Na2CO3/NaHCO3;
NaH2PO4/Na2HPO4; H- Protein/Na-Protein; acid hữu cơ và muối natri của nó. Trong hồng
cầu có 5 hệ đệm: Na2CO3/KHCO3; KH2PO4/K2HPO4; HHbO2/KHbO2; HHb/KHb; ; acid
hữu cơ và muối kali của nó trong đó hệ đệm cacbonat là quan trọng nhất vì có pH gần
bằng pH của máu người.
Trong máu người có pH ≈ 7,36. Giá trị này xấp xỉ hệ đệm cacbonat trong máu người.
pH của hệ đệm cacbonat trong máu người được tính: [ NaHCO3]
pH = pK H2CO3 + lg [ H2CO3] [ NaHCO ] Ở 37 C: pK H CO CO 2
3 =6,1. Tỷ lệ: [ H2 3 = 1 nên pH = 6,1 + lg= 7,34 TỰ LƯỢNG GIÁ
1. Phát biểu định nghĩa, thành phần và phân loại dung dịch đệm, cho ví dụ?
2. Nêu định nghĩa và phân loại dung dịch, cho ví dụ?
3. Trình bày hiện tượng thẩm thấu. Viết và giải thích các đại lượng của biểu thứcVanhop?
4. Giải thích cơ chế hệ đệm acid – base, cho ví dụ?
5. Trình bày mối liên hệ giữa hằng số acid và hằng số base của một cặp acid – baseliên hợp?
6. Người ta điều chế 1 dung dịch đệm bằng cách hòa tan 0,02 mol acid propionicvà
0,015 mol natri propionat trong nước để được 1 lít dung dịch đệm A. a) Tính pH của dung dịch đệm A
b) Tính pH của dung dịch đệm thu được khi thêm vào 1 lít dung dịch A
0,005mol HCl; 0,01 mol NaOH. Cho Ka = 1,34.10-5
7. Độ điện li của ZnSO4 trong dung dịch ZnSO4 0,1M bằng 20%. Tính áp suất thẩm
thấu của dung dịch này ở 200C?
8. a) Tính pH của dung dịch sau khi trộn 50 ml dung dịch CH3COOH 0,01M với
450 ml dung dịch NaOH 0,1M. Biết Ka = 1,76.10-5
b) Tính pH của muối NH4Cl 0,1M biết hằng số base của NH3 là Kb =1,76.10-5
9. a) Tính pH của dung dịch sau khi trộn 100 ml dung dịch NH3 0,05M với 400 ml
dung dịch HCl 0,01M. Biết Kb = 1,76.10-5.
b) Tính pH của muối CH3COONa 0,2M biết hằng số acid của CH3COOH là Ka = 1,76.10-5
10. Tính pH của muối CH3COONH4 0,5M biết hằng số acid của acid axetic là Ka =
1,76.10-5 và hằng số base của amoniac là Kb = 1,76.10-5.
11. Các hệ đệm nào có trong hồng cầu: 1) H2CO3/KHCO3 2) KH 3) HHbO 2PO4/K2HPO4 2/KHbO2
4) CH3COOH/ CH3COONa 5)HHb/KHb 6) NH3/ NH4Cl A: 3,4,5,6 B: 2,3,4,5 C:1,3,4,5 D: 1,2,3,5 18 lOMoAR cPSD| 45148588
12. Thuốc chữa đau dạ dày có thành phần NaHCO3. Tác dụng của NaHCO3 dùng để chữa đau dạ dày là:
A: Thủy phân cho môi trường kiềm nhẹ để làm dịch tiêm truyền tĩnh mạch để trung hòa acid
B: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở huyết tương C:
Thủy phân cho môi trường kiềm nhẹ để trung hòa acid sinh ra quá nhiều trong dạ dày
D: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở dạ dày
13. Cho các loại dung dịch sau: 1) Dung dịch glucose 5% 2) Dung dịch natri clorid 0,9% 3) Dung dịch glucose 10% 4)
Dung dịch natri clorid 1,2% Các dung dịch đẳng trương là? A : 1,2 B : 3,4 C : 1,3 D : 2,4
14. Pepsin là một enzym phân giải protein có mặt trong ống tiêu hóa. Một mẫu 0,500g
pepsin đã tinh chế trong 30,0ml dung dịch nước có áp suất thẩm thấu là 8,92
mmHg ở 27,00C. Khối lượng phân tử của pepsin là: A: 35.000 B: 36.000 C: 34.500 D: 36.500
15.Cocain dùng để gây tê niêm mạc mắt, miệng, niệu đạo là một base yếu có công
thức là C17H21NO4 có hằng số base là Kb = 2,6.10-6. pH của dung dịch này ở nồng
độ 0,0025M có giá trị gần nhất là: A: 9,34 B: 8,67 C: 8,94 D: 9,91
16.Trong cơ thể luôn tồn tại dung dịch đệm. Dung dịch đệm được định nghĩa là dung
dịch có pH thay đổi không đáng kể khi
(1) Thêm một lượng nhỏ acid mạnh
(2) Thêm một lượng nhỏ base mạnh
(3) pha loãng có giới hạn dung dịch
(4) Thêm một lượng rất lớn dung môi
Hãy khoanh vào đáp án đúng khi định nghĩa về dung dịch đệm. A: (1),(2),(4) B: (2),(3),(4) C: (1),(2),(3) D: (1),(3),(4)
17.Thuốc chữa đau dạ dày có thành phần chính là NaHCO3.
Hãy chọn đáp án đúng giải thích tác dụng của NaHCO3 dùng để chữa đau dạ dày.
A: Thủy phân cho môi trường kiềm nhẹ để làm dịch tiêm truyền tĩnh mạch để trung hòa acid
B: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở huyết tương C:
Thủy phân cho môi trường kiềm nhẹ để trung hòa acid sinh ra quá nhiều trong dạ dày
D: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở dạ dày 18.Cho các yếu tố sau : (1) Bản chất chất khí (2) Bản chất dung môi (3) Áp suất chất khí
(4) Sự có mặt của chất khí khác (5) Nhiệt độ chất khí
Tổ hợp các yếu tố mà độ tan của chất khí phụ thuộc là gì?: A: (1),(2),(3),(4)
B: (1),(2),(3),(5) C: (2),(3),(4),(5) D: (1),(3),(4),(5) 19 lOMoAR cPSD| 45148588 19.Cho các phát biểu sau:
(1) Muối tạo bởi acid mạnh và base yếu cho môi trường base
(2) Muối tạo bởi base mạnh và acid yếu cho môi trường acid
(3) Muối tạo bởi acid mạnh và base yếu cho môi trường acid(4) Muối tạo bởi acid
yếu và base yếu luôn cho môi trường trung tính Phát biểu nào là đúng ? A: (1) B: (2) C: (3) D: (4)
20.Ancol etylic hòa tan vô hạn trong nước.
Giải thích đúng về khả năng hòa tan trong nước của ancol etylic là gì?
A: Giữa ancol etylic và nước có liên kết hidro
B: Giữa các phân tử ancol etylic có liên kết hidro
C: Giữa các phân tử nước có liên kết hidro
D: Ancol etylic và nước trong phân tử đều có nhóm OH
21.Cho các đặc điểm của chất tan :
(1) Đi qua được mọi loại màng lọc khác nhau
(2) Nhìn thấy được qua kính hiển vi điện tử
(3) Khuyêch tán nhanh từ nơi này đến nơi khác
(4) Phát hiện bằng các phản ứng hóa học
Các đặc điểm nào là của chất tan trong dung dịch thật ?: A: (1),(2),(3) B: (1),(3),(4) C:(1),(2),(4) D :(2),(3),(4)
22.Tác dụng của phèn chua có công thức K2SO4.Al2(SO4)3.24H2O dùng làm trong nước
Phát biểu nào giải thích đúng về tác dụng của phèn chua :
A: Trong nước, Al2(SO4)3 bị thủy phân tạo thành hợp chất Al(OH)3 kết tủa bông
có tác dụng liên kết với các hạt cát thành hạt lớn hơn lắng xuống đáy
B: Khi hòa tan vào trong nước, Al2(SO4)3 kết hợp với K2SO4 tạo phức tinh thể
kéo các hạt cát thành hạt lớn hơn lắng xuống dưới đáy.
C: Hỗn hợp muối Al2(SO4)3 và K2SO4 trong nước kết hợp với nhau tạo thành muối
kép có tác dụng kéo các hạt cát thành hạt lớn hơn lắng xuống dưới đáy.
D: Trong nước, K2SO4, Al2(SO4)3 bị thủy phân tạo thành hợp chất KOH, Al(OH)3
kết tủa bông có tác dụng liên kết với các hạt cát thành hạt lớn hơn lắng xuống đáy.
23.Cho các hiện tượng sau:
(1) Dung dịch đường 20% tiếp xúc với dung dịch muối ăn 0,9% qua màng bán thấm
(2) Dung dịch muối ăn 0,9% trong màng tế bào và 1% ngoài màng tế bào
(3) Hai dung dịch đường G5 và G30 ở hai cốc riêng biệt (4) Dung dịch glucose
5% tiếp xúc với nước qua màng bán thấm Số trường hợp xảy ra hiện tượng thẩm thấu : A: 1 B: 2 C: 3 D: 4
24. Ka (CH3COOH) = 1,75.10-5; Ka (HNO2) = 4,0.10-4. Nếu hai acid có nồng độ mol
bằng nhau và ở cùng nhiệt độ, khi quá trình điện li ở trạng thái cân bằng, cho các đánh giá dưới đây:
(1) [H+] của CH3COOH lớn hơn [H+] của HNO2
(2) [H+] của CH3COOH nhỏ hơn [H+] của HNO2
(3) pH của CH3COOH nhỏ hơn pH của HNO2 (4) Nồng độ ion acetat lớn hơn
nồng độ ion nitrit Đánh giá nào là đúng? A: (1) B: (2) C: (3) D: (4) 20 lOMoAR cPSD| 45148588
25.Có bốn dung dịch: natri clorua; ancol etylic, acid acetic , kali sunfat đều có nồng độ 0,1mol/l.
Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào?
A: NaCl < C2H5OH < CH3COOH < K2SO4
B: C2H5OH < CH3COOH < NaCl < K2SO4
C: C2H5OH < CH3COOH < K2SO4 < NaCl
D: CH3COOH < NaCl < C2H5OH < K2SO4
26.Trong các phản ứng dưới đây:
(1) HCl + H2O → H3O+ + Cl(2)
Ca(HCO3)2 → CaCO3 + H2O + CO2 (3) NH + 3 + H2O ↔ NH4 + OH(4) CuSO4 + 5H2O → CuSO4.5H2O
Phản ứng nào nước đóng vai trò là một acid theo Brosted: A: (1) B: (2) C: (3) D: (4)
27.Dung dịch NaCl 0,15M (có độ điện li α = 100%) tương đương với nồng độ 0,9% là dung dịch rửa mắt.
Áp suất thẩm thấu của dịch mắt người ở 370C là bao nhiêu? A: 7,626 atm B: 3,813atm C: 6,578atm D: 4,567atm 21 lOMoAR cPSD| 45148588 22




