



Preview text:
Dạng bài tập: Năng lượng liên kết hạt nhân En và năng lượng ion hóa In
I, Mô hình một electron – nguyên tử H và ion tương tự nó: 2 Z CT: E = 13 − ,6
(eV ) , n là số lượng tử chính, Z là điện tích hạt nhân. n 2 n
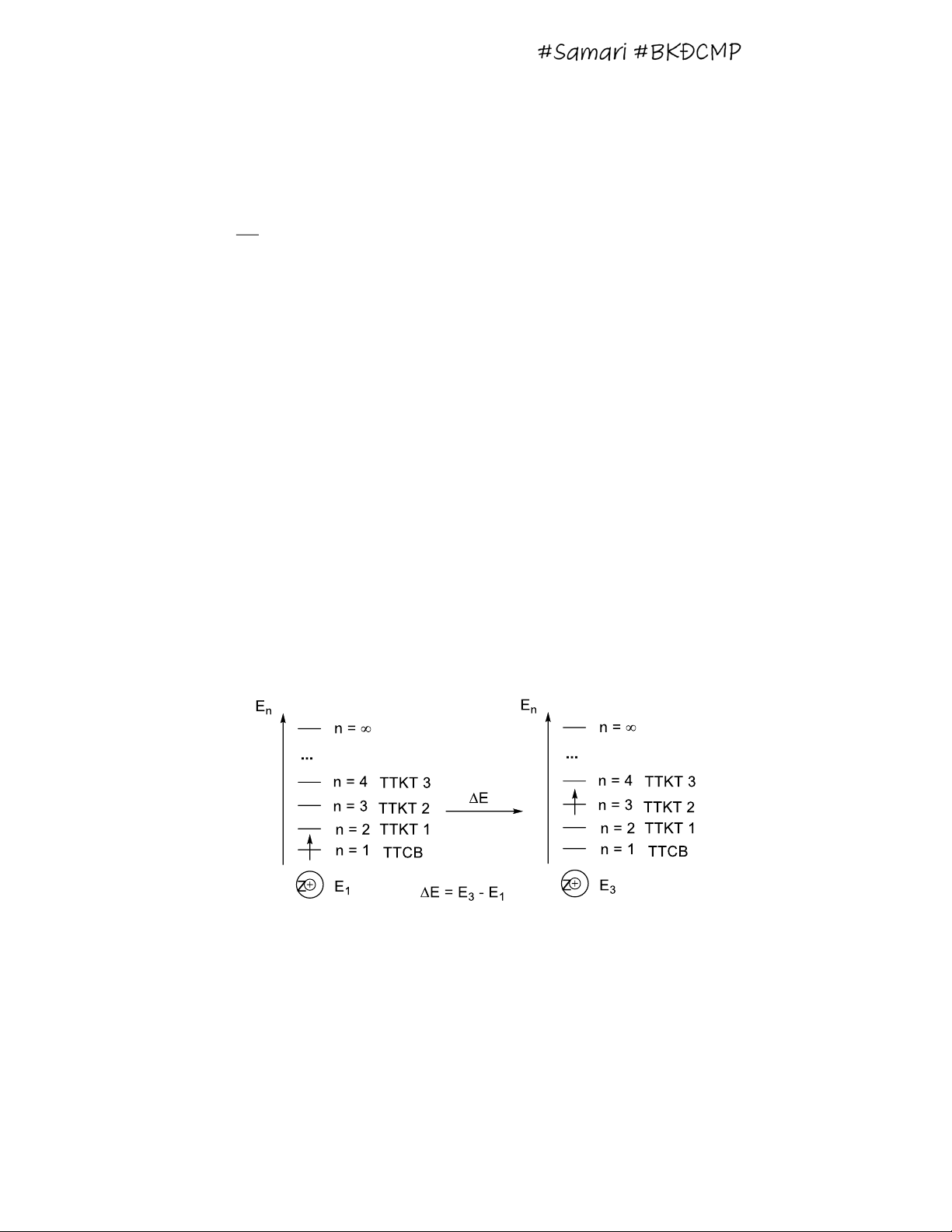
En mang giá trị âm, đặc trưng cho sự hút electron của hạt nhân, càng âm (càng nhỏ) càng hút electron mạnh.
- Electron nằm ở lớp n = 1 (lớp K) gần hạt nhân nhất, có giá trị En âm nhất, bị hút
electron mạnh nhất, bền nhất gọi là trạng thái cơ bản.
- Electron nhận được một năng lượng ∆E nhảy lên lớp electron cao hơn n = 2, 3, …
gọi là trạng thái kích thích thứ nhất, hai, ba … Khi đó ∆E = En – E1
Tổng quát: electron từ lớp electron n1 nhảy lên n2 thì cần năng lượng ∆E = En2 – En1
- Khi electron từ TTCB bị tách ra xa khỏi hạt nhân hay n = ∞ với E∞ = 0, ứng với
quá trình ion hóa và nó ứng với năng lượng ion hóa. I1 = E∞ - E1 = -E1. VD: Bài tập luyện tập:
Bài 1: Tính năng lượng ion hoá của nguyên tử H; ion He+ và ion Li2+ ở trạng thái cơ bản
và giải thích sự biến thiên năng lượng ion hoá theo dãy H, He+, Li2+. Bài 2:
a. Năng lượng ion hóa của nguyên tử hidro là 13,6 eV. Nếu nguyên tử hidro ở trạng thái
cơ bản nhận một năng lượng bằng 99% năng lượng ion hóa thì electron của nó sẽ chuyển
lên mức năng lượng ứng với giá trị số lượng tử n bằng bao nhiêu?
b. Tính bước sóng phát ra khi electron ở trạng thái kích thích này trở về trạng thái cơ bản. Bài 3:
Tính năng lượng của electron trong nguyên tử khi hidro đang ở trạng thái cơ bản và trạng
thái kích thích khi electron ở lớp M. Nguyên tử H ở trạng thái nào bền hơn? Bài 4:
a, Ion Li2+ đang ở trạng thái cân bằng nó cần năng lượng là bao nhiêu (J) để chuyển lên
trạng thái kích thích thứ 4, lớp P. Năng lượng ion hóa I1 của Li2+ là bao nhiêu?
b, Nếu ion Li2+ đang ở trạng thái kích thích thứ 5 thì nó giải phóng ra năng lượng bao
nhiêu (J) khi chuyển về trạng thái kích thích thứ nhất ?
II. Dạng bài tập: mô hình nhiều electron – En, In theo quy tắc Slayter
Áp dụng quy tắc Slayter xác định năng lượng liên kết hạt nhân En
- Bước 1: Viết cấu hình electron của nguyên tử hoặc ion và phân thành các nhóm:
(1s)(2s 2p)(3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p)
- Bước 2: Xác định electron đang xét, loại bỏ các electron nằm ở lớp electron cao
hơn electron đang quan tâm.
- Bước 3: Áp dụng quy tắc Slater tính hằng số chắn theo 2 trường hợp sau:
Giả sử electron nằm ở lớp electron n
• Đối với electron nằm ở phân lớp s,p:
▪ Bị chắn bởi các electron trong cùng 1 nhóm là 0,35, ngoại trừ 1s thì chắn 0,35.
▪ Bị chắn bởi electron nằm ở lớp electron (n-1) là 0,85
▪ Bị chắn bởi electron nằm ở lớp electron (n-2) hoặc nhỏ hơn là 1.
• Đối với electron nằm ở phân lớp d, f:
▪ Bị chắn bởi các electron trong cùng một phân lớp là 0,35
▪ Bị chắn bởi các electron nằm ở nhóm thấp hơn là 1.
- Bước 4: Xác định n*, Z* suy ra En.
VD: Tính năng lượng En của nguyên tử R có Z = 23:
Viết cấu hình electron : (1s2 )(2s22p6)( 3s23p6 )(4s2 )(3d3)
Trong cấu hình electron chia thành các nhóm sau: - 2 electron 1s - 8 electron 2s2p - 8 electron 3s3p - 2 electron 4s - 3 electron 3d
Lần lượt đi tính năng lượng En cho các electron theo quy tắc Slater:
- Electron 1s chỉ bị chắn bởi electron còn lại trong 1s với hằng số chắn là 0,3: 2 (23 − 0, 3.1) E = 13 − ,6 (eV ) 1s 2 1
- Electron 2s2p bị chắn bởi 7 electron còn lại (0,35) và 2 electron lớp n = 1 (0,85): 2 (23 − 0, 35.7 − 0,85.2) E = 13 − ,6 (eV ) 2s 2 p 2 2
- Electron 3s3p bị chắn bởi 7 electron còn lại (0,35), 8electron 2s2p (0,85) và 2 electron 1s (1): 2
(23 − 0, 35.7 − 0,85.8 − 2.1) E = 13 − ,6 (eV ) 3s3 p 2 3
- Electron 3d bị chắn 2 electron 3d còn lại (0,35) và 16 electron bên trong (1s2s2p3s3p) (1): 2 (23 − 0, 35.2 −16.1) E = 13 − ,6 (eV ) 3d 2 3
- Electron 4s bị 1 e4s còn lại chắn (0,35), 9 electron lớp trong chắn (0,85 – 3s3p3d)
và 8 electron bên trong chắn (1 – 1s2s2p): 2
(23 − 0,35.1− 0,85.9 −1.8) E = 1 − 3,6 (eV ) 4s 2 3, 7
- Năng lượng hạt nhân R: E = 2.E + 8E +8E + 3E + 2E R 1s 2s2 p 3s3 p 3d 4s Bài tập luyện tập.
Bài 1: Dựa vào phương pháp Slater, hãy tính năng lượng của một electron ở lớp ngoài cùng của P.
Bài 2: Dựa vào phương pháp Slater hãy tính năng lượng tổng của các electron trong
nguyên tử Li và ion Li+, từ đó tính năng lượng ion hóa thứ nhất của Li.
Bài 3: Nguyên tố có Z = 19 có thể viết cấu hình electron:
1s22s22p63s23p63d1 (1) hay 1s22s22p63s23p64s1 (2)
Dựa vào việc tính Z’ và từ đó tính Ee(3d1) và Ee(4s1) theo qui tắc Slater, hãy chứng
minh cấu hình (2) hợp lý.
Bài 4: Sử dụng phương pháp tính năng lượng của Slayter hãy so sánh năng lượng của hai
cấu hình electron nguyên tử sau Z = 25: a, 1s22s22p63s23p63d7 b, 1s22s22p63s23p64s23d5
Từ đó rút ra cấu hình nào phù hợp ở trạng thái cơ bản.
Bài 5: Sử dụng quy tắc của Slater tính năng lượng của ion Fe2+ (Z = 26) cho 2 cấu hình
electron sau và rút ra kết luận cấu hình nào phù hợp. a, 1s22s22p63s23p63d6 b, 1s22s22p63s23p64s23d4
Bài 6: Dựa vào công thức tính NL AO của Slayter. Tính năng lượng ion hóa thứ nhất và
thứ hai của nguyên tử Mg (Z = 12).
Bài 7: Dựa vào quy tắc Slayter cho biết:
a, Cấu hình nào phù hợp với nguyên tử Co Z =27 ở trạng thái cơ bản (1) 1s22s22p63s23p64s23d7 (2) 1s22s22p63s23p63d9
b, Cấu hình nào là cấu hình của ion Co2+ (3) 1s22s22p63s23p64s23d5 (3) 1s22s22p63s23p63d7
c, Từ a, b tính năng lượng ion hóa thứ nhất, năng lượng ion hóa thứ 2 và năng lượng để
tách 2 electron từ nguyên tử Co.
Bài tập về giải thích dự đoán , so sánh năng lượng ion hóa:
Cấu hình đạt trạng thái bền khi có cấu hình bão hòa của khí hiếm, hoặc bán bão hòa. Thế
nên khi mất electron để tạo cấu hình này thì sẽ lợi về mặt năng lượng do đó năng lượng
ion hóa nhỏ (tiêu tốn ít hơn). Tương tự với quá trình nhận electron (ái lực electron).
BT: Viết cấu hình electron của các nguyên tử có Z = 9, 11, 16. Từ đó hãy cho biết:
a. Nguyên tố nào trong các nguyên tố trên có năng lượng ion hoá I1 lớn nhất, nguyên tố
nào có năng lượng ion hoá I1 nhỏ nhất.
b. Cation và anion nào dễ được tạo thành nhất từ mỗi nguyên tử.




