










Preview text:
lOMoAR cPSD| 40342981 Machine Translated by Google lOMoAR cPSD| 40342981 Machine Translated by Google 1476 lOMoAR cPSD| 40342981 Machine Translated by Google
ydrocacbon, thường bị n ứt t rên n ền t han c hì ở n hiệt độ trên
2000 C. Quá trình n ày d ẫn đ ến k ết q uả l à c ác t inh thể có trục
c của c húng c hủ yếu v uông g óc v ới c hất n ền
(độ lan truyền khảm = 40–50 ) và mật độ lớn hơn 2 ,2 g/cm3. Để cải thiện sự
liên kết tinh thể, quá trình kết tinh lại ứng suất được sử dụng. Điều này bao
gồm quá trình ép nóng với áp suất một trục 300–500 kg/cm2 ở 2800–3000 C và
tạo ra các mẫu dày hơn 10 mm dọc theo trục c và mật độ 2,266 g/cm3, hơn
99,95% so với lý thuyết Tỉ trọng. Quá trình ủ sau đó của vật liệu đó ở nhiệt độ
3400–3500 C dưới t ác dụng tải nhẹ sẽ tạo ra than chì nhiệt phân có tính định
hướng cao (HOPG) với độ lan truyền khảm là 0,02 C và kích thước crys-tallite cỡ
1 µm ở cả a và c hướng d ẫn [18].
Cần l ưu ý r ằng t han chì n hiệt phân c ó s ẵn trước n ăm 1960 không c ó t ính định h
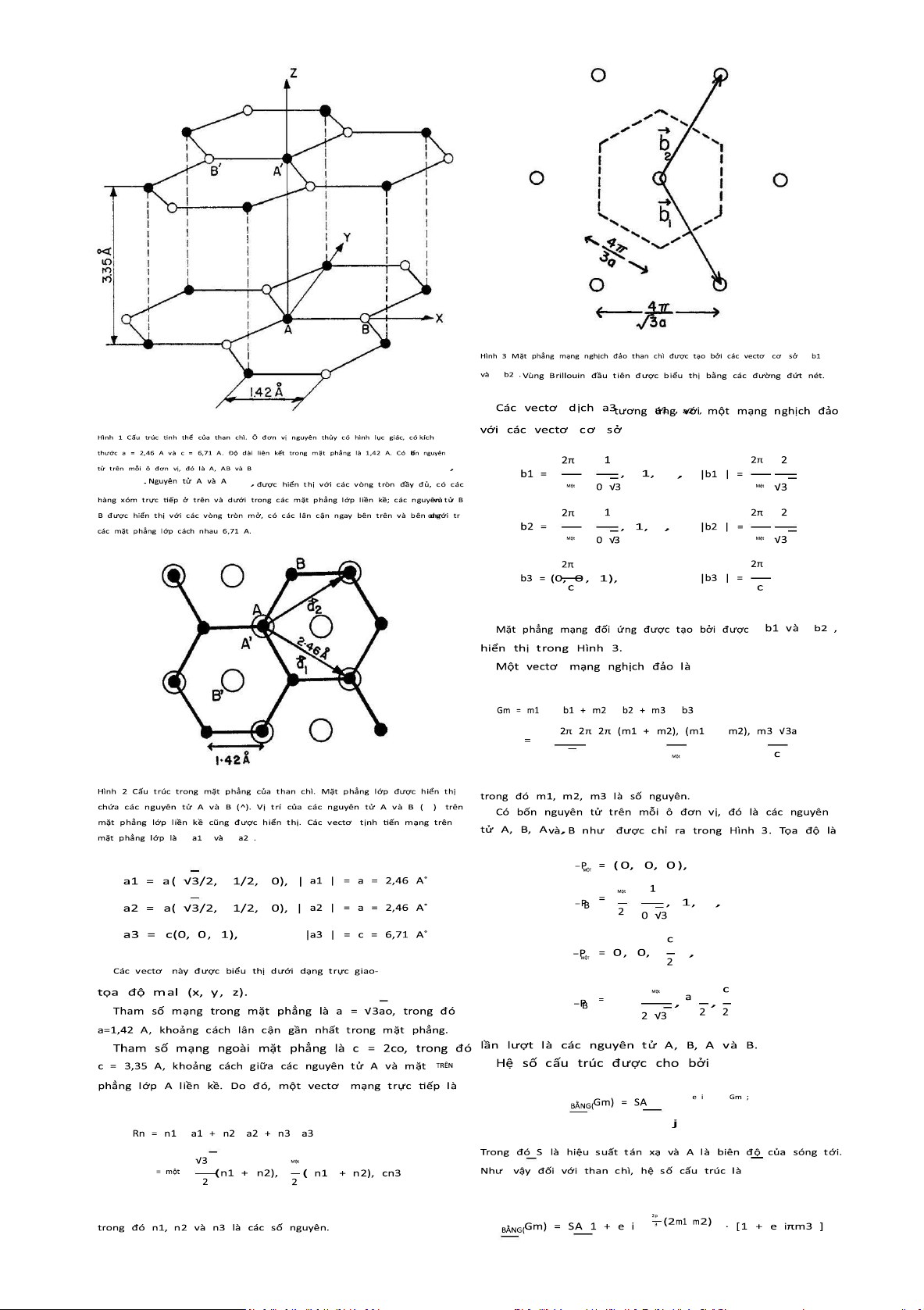
Hình 4 Vùng B rillouin t hông thường c ủa than c hì. C ác bề m ặt Fermi của e lectron và lỗ trống nằm ở vùng l ân cận của c ác cạnh
ướng cao, d o đó c ác k ết quả t hử n ghiệm trên các v ật l iệu đó c ần đ ược xử l ý thận t H KH và H KH rọng. .
Do đ ó, N hư(Gm) = 0 f orm3 = số n guyên l ẻ và không có phản xạ B ragg cho m 3 =
s ố n guyên l ẻ, p hù h ợp v ới hệ quả của trục vít 6 3 d ọc t heo m ặt p hẳng. K ết quả 3. Liên kết
l à v ùng Brillouin a3 dithứ n hất đ ược hình t hành b ởi c ác m ặt p hẳng kz = ±2π và
Một nguyên tử cacbon cô lập có cấu hình electron là 1s22s22p2. Các electron
sáu mặt p hẳng đ i q ua c ác cđoạn n ét đ ứt n hư t rong Hình 3. Do đó, vùng B
1s2 thuộc lõi ion và bốn electron còn lại là electron hóa trị.
rillouin thứ n hất l à m ột l ăng t rụ l ục giác có chiều cao b ằng
Trong than chì, các electron 2s, 2px và 2py tạo thành ba quỹ đạo lai hóa sp2
4cp . T uy n hiên n ó t hường được v ẽ v ới c hiều cao
hướng cách nhau 120 trên một mặt 2 t rangc , BẰNG
phẳng lớp. Sự chồng chéo của các quỹ đạo này dẫn đến sự hình thành liên kết
được h iển thị t rong Hình 4 , trong đó c ác mặt p hẳng k z = ±πc không đ úng sự t hật
σ giữa các nguyên tử carbon trên mặt phẳng lớp. Mặt khác, electron 2pz tạo
Ranh g iới vùng B rillouin.
thành quỹ đạo đối xứng π. Sự định vị này giúp ổn định liên kết carbon trong
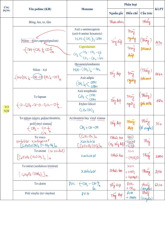
Ngoài c ấu t rúc l ục g iác đ ược mô t ả ở trên, còn có một dạng t han c hì í t g ặp
mặt phẳng sao cho độ bền liên kết cao hơn liên kết cộng hóa trị C–C đơn lẻ.
h ơn trong đ ó c ác l ớp carbon được xếp chồng l ên n hau theo t rình t ự A BC, d ẫn đ
Ngoài ra, quá trình định vị dẫn đến các electron π liên kết lỏng lẻo có độ linh
ến cấu trúc hình thoi [ 10, 1 1]. K hoảng cách c ác l ớp c arbon v à các tham số trục
động cao, do đó các electron π đóng vai trò chủ đạo trong các tính chất điện
a g iống n hau ở c ả c ấu t rúc l ục g iác và hình thoi. Trong c ấu t rúc h ình t hoi, t âm c
tử của than chì. Các lớp carbon liên kết theo hướng c bởi lực van der Waals
ủa hình l ục giác carbon trong l ớp A nằm n gay b ên d ưới m ột g óc của hình lục
yếu. Kết quả là, than chì có tính dị hướng, c ó các tính chất vật lý khác nhau
giác trong lớp B , l ớp n ày l ại n ằm n gay b ên dưới m ột góc không tương đ ương
đối với các hướng tinh thể trong mặt phẳng và trục c.
của h ình l ục giác t rong l ớp C.
Cấu trúc v ùng năng lượng electron c ủa t han chì h ình thoi đã được tính toán [ 12, 13]. Sự
phân tán v ới t hành phần vectơ s óng song song với t rục c g ây ra sự c hồng chéo d ải 0,02 4.
Cấu t rúc vùng năng lượng đ iện tử Trong than c hì, mỗi nguyên t ử c acbon có b
eV. D o đó, t heo McClure, t rên ~ 1 50 K, c ác tính chất c ủa than chì h ình thoi trong mặt
ốn electron h óa trị v à có b ốn nguyên tử trên một ô đ ơn v ị. Do đó, c ó 16 d ải năng lượng
phẳng v uông góc v ới t rục c g ần n hư giống với c ác t ính chất của than chì h ai c hiều. Ở nhiệt
( không tính spin), trong đ ó 1 2 dải l à dải σ và 4 d ải là dải π . Sáu d ải σ đ ang liên kết và s áu
đ ộ thấp, đ ặc t ính này giống n hư cấu trúc dải h ai chiều “ bị n hòe”. Quá trình m ài t ạo ra p ha
dải ở m ức n ăng lượng cao hơn l à phản l iên kết. Hai nhóm s áu dải σ này c ách nhau 5 eV. Các hình thoi [14–16].
dải π nằm g iữa hai nhóm d ải σ n ày. Tương t ự, hai d ải π l iên kết và h ai dải phản l iên kết. Tuy
nhiên, tất c ả các d ải đều được g hép nối và b ốn dải π được g hép nối chặt chẽ. Vì t han chì có
1 6 e lectron trên mỗi ô đơn v ị nên c hỉ có 8 dải năng lượng đ ược lấp đầy. D o đó m ức Fermi
Hầu h ết c ác n ghiên c ứu c ơ bản v ề t han c hì đều được thực hiện t rên t
nằm ở g iữa bốn d ải π. C ác dải π p hía trên, t ạo thành c ác d ải hóa trị c ao nhất, chồng lên n
han c hì đơn t inh t hể t ự n hiên h oặc than chì nhiệt p hân. L oại t hứ n hất x uất
hau dọc theo các c ạnh vùng Brillouin H KH và HKH, l àm cho than c hì trở thành m ột bán k im
h iện dưới d ạng các mảnh có đường k ính 1 h oặc 2 m m, n ằm t rong đ á c
loại. N ăng lượng chồng l ấp dải là k hoảng 0,03 eV.
anxit. Để tách các mảnh t han c hì r a k hỏi đ á, n gười ta t hường s ử dụng các
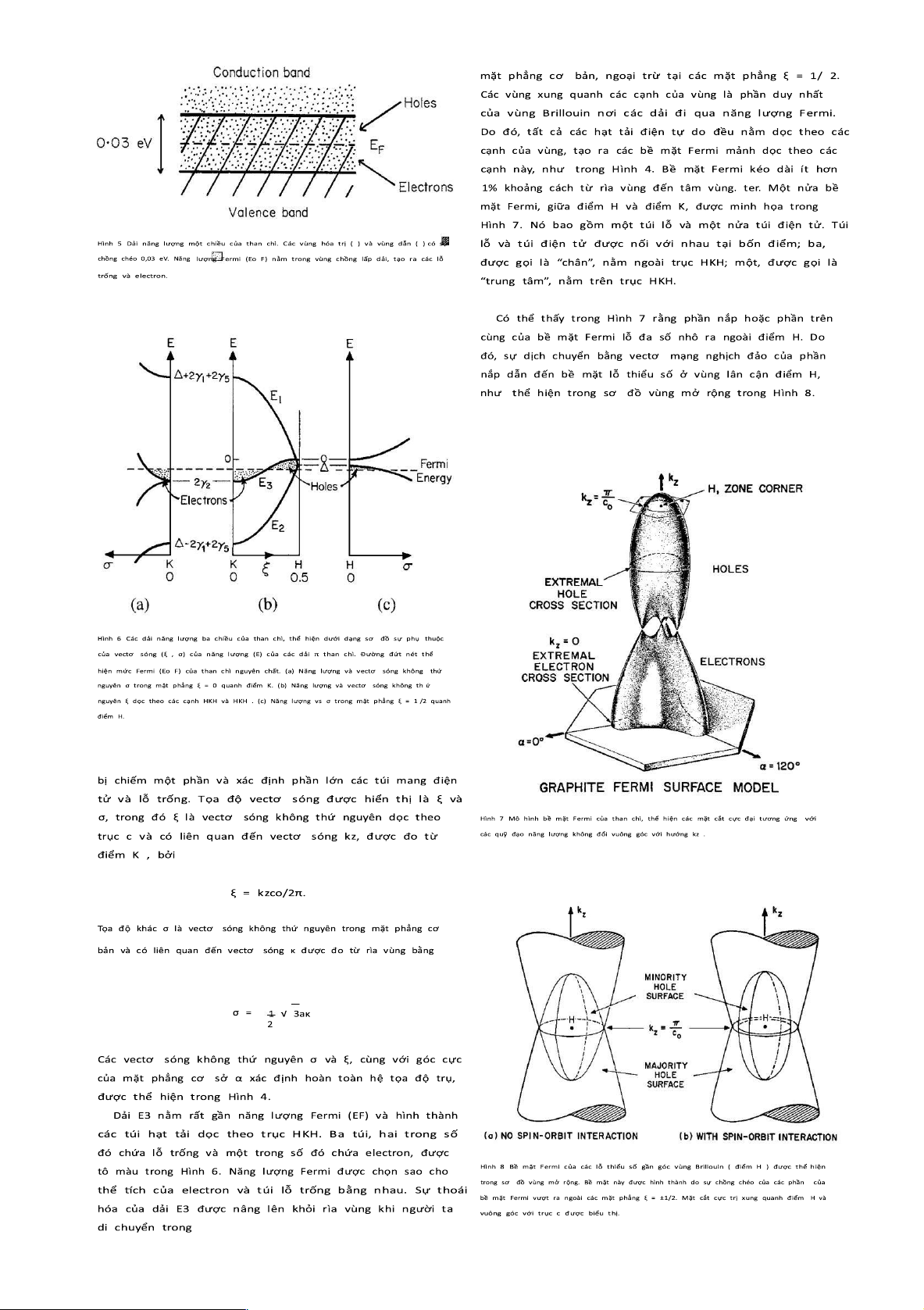
Các d ải năng lượng có t hể được m inh họa theo một c hiều như trong Hình 5.
phương pháp h óa h ọc, t rong đó đ á đ ược n gâm trong axit sôi ( HCl v à H F)
[17]. M ặt k hác, t han c hì n hiệt phân là chất tổng hợp. T uy n hiên, t ính c hất c
ủa n ó t ương tự như than chì đ ơn t inh t hể v à kích t hước l ớn c ủa n ó là một
lợi thế trong nhiều t hí n ghiệm. số đo.
Trong ba chiều, các dải năng lượng được h iển thị trong
Than c hì n hiệt p hân ( PG) là đ a t inh t hể, có kết cấu sợi sao c ho t rục c c ủa
Hình 6. Dọc theo trục HKH và HKH, bốn dải π được dán nhãn E1, E2 và E3,
t ất c ả c ác tinh t hể t hẳng hàng nhưng trục a l à n gẫu n hiên. N ó đ ược hình t
trong đó dải E3 bị suy biến gấp đôi dọc theo các cạnh của vùng. Dải E1 trống .
hành b ằng quá trình nhiệt p hân, t rong đ ó k hí c acbon, chẳng h ạn như h
Dải E2 gần đầy và xác định túi lỗ nhỏ gần góc vùng. ban nhạc E3 lOMoAR cPSD| 40342981 Machine Translated by Google 1478 lOMoAR cPSD| 40342981 Machine Translated by Google
điểm t rong m ặt phẳng ξ = 1 /2, như đ ược minh h ọa t rong Hình 6 c.
BẢNG I Thông số d ải năng lượng đ iện t ử của t han c hì Giá trị tham số ( eV) Nguồn gốc v ật l ý
5. Mô hình d ải năng lượng
Slonczewski v à W eiss [19] đ ã phát t riển một d ải n ăng lượng mô h ình mô tả c0 3.12
Sự c hồng c héo của c ác nguyên tử l ân c ận
mối q uan hệ phân t án năng l ượng điện tử cho v ùng vùng Brillouin x ung q
trong m ột mặt phẳng một lớp uanh c1 0,377
Sự chồng chéo của các quỹ đạo liên quan đến
Các nguyên t ử A và A nằm ở p hía trên
Trục H KH. S ự phụ t huộc năng lượng d ọc theo hướng kz (HKH) đ ược x ác
khác trong c ác mặt phẳng l ớp liền kề
định bằng sự khai triển F ourier t rong ξ . Vì liên k ết giữa các l ớp yếu nên c c2 0,0206
Tương tác g iữa các n guyên t ử t rong
huỗi Fourier nên hội t ụ nhanh chóng v à chỉ c ần một vài s ố hạng được g iữ
các lớp g ần n hất v à t ừ khớp n ối giữa c ác d ải π v
lại. T rong mặt phẳng cơ b ản, l ý thuyết n hiễu loạn k · p được s ử dụng đ ể mở r à σ .
ộng H amiltonian theo k ,Một vectơ s óng trong m ặt phẳng k x ky được đ o từ c3 0,29
Ghép n ối h ai d ải E 3 b ằng một
vùng cạnh, l ấy hàm sóng b ậc 0 như c ác hàm tại cạnh t hẳng đứng H KH của
phần tử m a trận đ ộng lượng
vùng B rillouin. B ởi vì kích t hước nhỏ của b ề mặt Fermi trong kx và ky h c4 0,120
Khớp n ối c ác d ải E 3 v ới c ác d ải E 1 v à E2
ướng, khai t riển k · p sẽ hội tụ n hanh chóng. Tính đối x ứng đ ược sử d ụng
bởi phần t ử ma t rận động l ượng
để x ác định s ố lượng t ối t hiểu của các t ham số độc l ập. c5 0,025
Tương t ác g iữa l ớp g ần t hứ h ai
máy bay. G iới thiệu ở E 1 v à E 2 ở bậc hai c ủa
Khối l ượng hiệu dụng Hamiltonian c ủa m ô h ình dải Slonczewski-
k hai t riển F ourier phù hợp v ới E 3
Weiss-McClure (SW-McC) t hường được s ử d ụng viết l à [19, 0,009
Sự k hác b iệt về năng lượng tiềm năng tại 20]:
Vị t rí mạng tinh thể A và B . E1 0 H13 H 13 H = 0 E2 H23 H 23
6. Mức n ăng lượng t ừ tính
Với từ t rường dọc t heo trục c, c ác quỹ đạo n ăng lượng k hông đổi v uông H 13 H23 E3 H 33
góc với H KH trục của v ùng than c hì Brillouin. tương ứ ng đến cực trị tại mặt H13 H23 H
cắt ngang b ề mặt Fermi tại các đ iểm khác n hau dọc theo t rục HKH, c ó ba l oại 33 E3
quỹ đạo, n hư trong H ình 9a–c. các quỹ đạo t hể hiện trong h ình 9a t ương Ở đâu
ứng v ới cực trị tiết d iện trên b ề mặt electron đ a số ở Điểm K (kz = 0). C
ác quỹ đạo t hể hiện trong h ình 9b tương ứ ng với các m ặt cắt cực t rị trên 1 P E1 = + γ1 + c52 ,
phần l ớn và b ề mặt lỗ thiểu s ố tại điểm H (kz = ). c0 Quỹ đạo b ên ngoài n 2
ằm trên bề m ặt lỗ đa số và quỹ đạo b ên trong nằm t rên bề mặt l ỗ thiểu 1 số. c ác E2 = γ1 + c52 ,
các quỹ đạo như t rong Hình 9 c, được gọi là quỹ đạo chân và q uỹ đạo trung tâm, 2
tương ứ ng với các m ặt cắt cực trị t rên phần l ớn bề mặt e lectron 1
hoặc l ỗ đa số nơi e lectron và E3 = c22 , 2
bề m ặt l ỗ t iếp xúc. C ó bốn s ự t iếp xúc n hư vậy; b a, đ ược gọi là “ chân”, nằm n goài H13 = γo(1 ν)seia/21/2 , trục H KH v à
H23 = γ (1 + ν)seia/21/2 , H33 = γ
phần c òn lại, được g ọi là “trung t âm”, n ằm trên HKH trục.
Có hai cách t iếp cận đ ể tính mức n ăng lượng t ừ: 3seia,
(i) g iải khối l ượng hiệu d ụng = 2 cos(πξ ),
Hamiltonian t rong s ự có mặt của t ừ trường [ 27–
29], ( ii) s ử d ụng đ iều k iện l ượng tử hóa Bohr-Sommerfeld [30]. T rong cách t iếp Và
c ận đ ầu t iên, γ3 được x ử lý theo lý t huyết n hiễu l oạn, mặc d ù γ 3 thực sự quá
lớn để sử dụng của l ý t huyết nhiễu l oạn. T rong p hép tính g ần đúng γ3 = 0 , ν = γ4/γo.
Hamiltonian k hối l ượng hiệu d ụng được đ ơn giản h óa nhiều. Lời g iải của
b ài t oán g iá t rị riêng t ừ n ày d ẫn đến một b ộ b ốn thang L andau, trong đ
Khi b ảy tham s ố băng t ần (, γ 0, γ1, γ2, γ 3, γ4, γ5) được xác
ó các mức được dán nhãn bằng chỉ số N. Sự phụ thuộc ξ của những c hiếc t
định, các dải n ăng lượng g ần v ùng
hang này được m inh h ọa t rong đường v iền mức Landau sơ đ ồ đ ược đưa ra t rong h ình
cạnh và bề m ặt Fermi được x ác định h oàn toàn. Trong B ảng I l à các giá t
10 [24]. C ách tiếp cận thứ hai là bán cổ đ iển, nhưng đ ưa ra một c ách thẳng t
rị của các t ham số băng t ần, được chọn [ 21] để phù h ợp với điểm K hắn
[22, 23] và p hổ phản xạ t ừ điểm H [24] về đ a số và thiểu s ố de Haas-
mức độ đ a s ố (kết q uả từ c ác quỹ đ ạo giống n hư các q uỹ đ ạo đ ược h iển t hị van Alphen kỳ [25, 2 6].
trong H ình 9a và b ) và các cấp đ ộ đặc biệt ( do quỹ đ ạo chân v à trung
Các giá t rị riêng c ủa Hamiltonian H đưa r a mối quan hệ p hân tán năng
tâm n hư trong h ình 9c). Các mức năng l ượng t ừ tính tại điểm K là hàm s
l ượng. Dọc t heo rìa k hu vực HKH, hai t rong số bốn n ghiệm có t ính suy
ố của từ trường đ ược biểu d iễn trong Hình 1 1. P hần l ớn c ác mức L andau của e
biến k ép và tương ứ ng với E 3. Hai nghiệm c òn lại k hông suy b iến và t
lectron bị c ắt ở ε e-sp trong k hi lỗ t rống mức độ bị cắt ở εh-sp. Đối với n ăng
ương ứng v ới E1 và E2 t rong Hình 6 . Tại điểm H ( ξ = 1/2), E1 v à E2 suy lượng g iữa εh-sp
biến và sự t hoái hóa k ép của các c ấp độ này v à của
Mức E3 được d uy trì khi n gười ta d i chuyển r a khỏi H lOMoAR cPSD| 40342981 Machine Translated by Google mứ c 1480 lOMoAR cPSD| 40342981 Machine Translated by Google lOMoAR cPSD| 40342981 Machine Translated by Google
điều kiện chân không h oặc sau khi g ia nhiệt. K hi hợp c hất đã đ ến đến trạng t hái cân b
ằng với á p suất r iêng phần b ằng 0 của bên ngoài xen kẽ, n ó được g ọi là h ợp chất c ặn [ 48].
Vì t han chì n guyên chất là một b án k im loại n ên b ằng p hương p háp i on hóa liên k ết với intercalate,
đã đ ược q uan sát [33]. D òng này c ó thể l iên quan đến liên kết t ứ diện t
các liên k ết π của t han c hì c ó t hể nhận electron t ừ h oặc mất electron v ào v ùng g ian
rong c ấu trúc kim cương, v ì kim cương có đ ỉnh R aman ở 1322 c m 1.
giữa, d o đ ó làm dịch c huyển vị trí c ủa năng lượng F ermi từ đó trong than c hì nguyên c
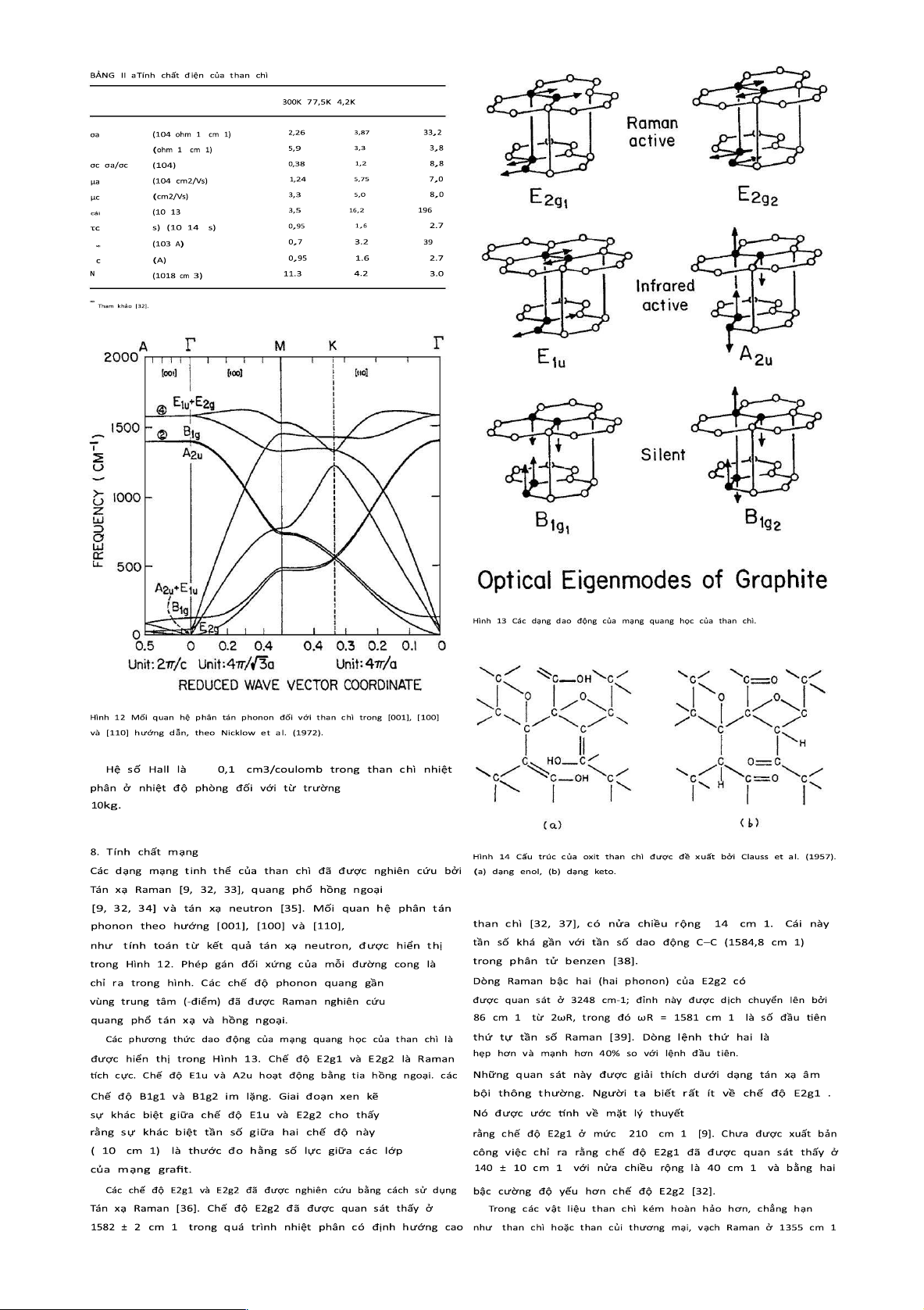
Các mode E 1u và A 2u đã đ ược n ghiên c ứu bằng phương p háp quang p hổ phản
hất. Nói cách k hác, các n guyên tử xen k ẽ có thể đóng v ai trò l à chất cho h oặc chất n
x ạ h ồng ngoại. V ới điện trường E c, c hế độ E 1u đã đ ược q uan sát tại p hòng nhiệt
hận đ ể pha tạp than chì. Ả nh hưởng đến tính chất đ iện tử c ủa than chì t ạo ra l oại hợp
đ ộ ở 1588 ± 5 c m 1 trong than c hì đơn tinh t hể
chất x en k ẽ n ày hấp dẫn.
[32], v ới nửa chiều r ộng 15 cm 1. Với E c,
Chế độ E1u cũng đ ã được quan sát t hấy ở nhiệt độ phòng trong t han chì
nhiệt p hân có định hướng c ao ở 1588 cm 1 [39]. V ới E//c, c hế độ A 2u đã đ ược q
9.3. Các hợp chất xen kẽ cộng hóa trị
uan sát tại nhiệt đ ộ phòng ở m ức 8 68 ± 1 cm 1 ở m ôi t rường có định h ướng cao
Các hợp c hất xen kẽ c ộng h óa trị n hận được í t h ơn chú ý hơn s o v ới i on. Số l
than chì nhiệt p hân [39]. M ột mặt đ ược đánh b óng cơ học được s ử d ụng để đ o v ới
ượng c ác hợp c hất xen k ẽ c ộng hóa trị đ ã b iết cũng nhỏ h ơn n hiều— chỉ c ó
E//c. C ác khoản phí h iệu quả vĩ m ô cho chế độ E 1u và A 2u
oxit t han chì ( axit than c hì) và t han c hì florua (carbon m onofluroide và t
đã đ ược tính t oán lần lượt l à 0 ,41 e v à 0 ,11 e [ 39]. etracarbon m ono-florua).
9. H ợp chất x en kẽ t han chì
9.3.1. Ôxít than chì (axit than chì) 9.1. Hợp chất than chì
Ôxit t han chì là m ột hợp c hất chưa đ ược hiểu r õ. c ác quan s át cả c hế độ k éo dài
Than c hì phản ứng v ới nhiều chất h óa học để t ạo thành hợp chất. C ác hợp chất
CO ( gợi ý sự h iện d iện của d ạng keto) v à k éo dài OH chế độ ( gợi ý s ự h iện diện c
than c hì có t hể được p hân loại t hành ba n hóm, đ ó là c ác h ợp chất bề m ặt, các h
ủa d ạng enol) gợi ý rằng o xit than c hì bao gồm e nol, k eto và nhóm epoxy p hân
ợp chất thay t hế và các hợp chất x en kẽ.
tán t rong mạng t han chì. C ái n ày cấu trúc dẫn đến một c ông thức t hực nghiệm l ý
Các hợp chất b ề m ặt của than c hì [40] được h ình thành bằng phản ứ ng với các
t ưởng h óa c ủa C8O2(OH)2.
nguyên t ử b ề m ặt than chì. S ự h ấp phụ xảy ra t rên các b ề mặt p hẳng vuông g óc với
Ôxít than c hì là c hất cách đ iện, có đ ộ d ẫn đ iện 1 03– 107 .cm [ 49], tùy t
trục c c ũng như trên c ác nguyên t ử r ìa của c ác m ặt p hẳng c acbon. Do l iên kết hóa t rị
huộc vào hàm l ượng o xy-gen. lOMoAR cPSD| 40342981
tự d o của c ác nguyên tử ở cạnh, các nguyên tử ở rìa có x u hướng hoạt đ ộng m ạnh h Machine Translated by Google
ơn. S ự oxy h óa phản ứ ng là m ột ví d ụ v ề phản ứ ng bề m ặt.
Các hợp chất t hay thế c ủa than chì [40] c hứa thay thế b ằng loài ngoại l ai.
9.3.2. Carbon m onoflorua (graphit monoflorua)
Các hợp chất x en kẽ c ủa than c hì [41–45] là c ác hợp chất xen kẽ t rong đ ó c ác
Than chì-flo có t hành phần gần đúng l à
loài n goại lai được b ao gồm trong c ác vị t rí xen kẽ g iữa các hành t inh của tinh thể
CF [ 50] được h ình t hành b ằng phản ứ ng trực t iếp của than c hì với flo
than c hì sao cho cấu trúc l ớp của mạng than c hì (Hình 1) đ ược g iữ lại. N hững hợp
ở nhiệt độ hoặc á p suất c ao hoặc thông qua sự p hóng điện phát s
chất n ày là những h ợp chất n ổi tiếng n hất trong s ố tất cả c ác hợp chất c ủa than chì.
áng flu-orine (plasma) [ 51, 52].
Sự hiện d iện của liên k ết C–F trong cacbon monoflorua đã
được c hứng minh bằng q uang phổ truyền hồng n goại. Sự c ó mặt
9.2. Phân loại than chì hợp chất
của nhóm C F có l ẽ là d o xen kẽ
đối v ới l ượng f lo dư t hừa, như được đ ề xuất bởi p hương p háp cân b ằng hóa h ọc của C
Trong t han chì, các n guyên tử cacbon t rong một l ớp liên kết c hặt chẽ với n hau được liên k ết bởi c
F1,12±0,03. Flourine N MR k hông cho t hấy b ằng c hứng nào v ề các loài f
ác liên k ết σ đ iện t ử và c ác nguyên t ử cacbon ở các lớp l iền kề b ị l iên kết yếu b ởi lo di động [ 45].
điện tử liên k ết π. K ết quả là c hất x en kẽ ( hoặc xen kẽ) chiếm g iữ và d o đ ó mở r ộng k
Những quan sát khác n hau này cho thấy m ột cấu trúc bao gồm
hoảng cách giữa c ác mặt phẳng của t inh thể than c hì mà k hông làm g ián đoạn các lớp
các lớp nhăn n heo của các khối t ứ diện đ ược p hối hợp nguyên tử c
cacbon. Q uá trình x en kẽ t rong than c hì có b ản chất hóa học cũng n hư vật lý. L oại
arbon lai h óa sp3 , m ỗi n guyên tử liên k ết cộng h óa trị
tương tác hoặc liên k ết giữa các n guyên tử c arbon và sự x en kẽ p hụ thuộc v ào sự x en
ba nguyên t ử cacbon k hác và m ột nguyên tử f lo.
kẽ c ụ t hể. Theo t ính chất liên kết, c ác hợp chất xen k ẽ của t han chì có t hể được p hân
Nhiễu xạ t ia X cho thấy khoảng c ách giữa c ác lớp là 5,80˚ đến 6,6
thành h ai loại các n hóm.
A [51, 53 – 55]. Theo m ô hình n ày, có là h ai cấu trúc có t hể. Một
Nhóm t hứ nhất, t rong đó l iên k ết là c ộng hóa trị (hoặc đồng p hân cực), b ao
bao gồm các lớp các vòng cyclohexane liên k ết ngang ở dạng
gồm oxit t han chì, carbon monoflu-oride và t etracarbon monofluoride. K iểu l iên kết
ghế; l ớp còn lại bao gồm các lớp thuyền cy-clohexane liên kết
này được ư a chuộng bởi sự c ó m ặt của liên kết đ ôi
với cis-trans. Nhiễu xạ tia X không thể phân b iệt giữa h ai khả
liên k ết trong c ác mặt phẳng c acbon. C ác m ặt p hẳng l ớp c ó dạng l ượn sóng d o s ự thay đ ổi c ủa c acbon
năng. Chi tiết 19F nghiên cứu khoảnh k hắc thứ hai [53, 5 6] về
liên k ết từ d ạng lượng giác ( sp2) sang d ạng tứ d iện ( sp3) . Các hợp chất n ày không d ẫn điện, thiếu t NMR của flo
ính chất b án kim loại của t han chì.
đã c ung cấp bằng c hứng cho một cấu trúc bao gồm các
Nhóm thứ hai, t rong đ ó liên k ết đ ược t hực hiện m ột p hần ion (hoặc c ực), b ao gồm các muối t han
lớp vòng cyclohexan l iên kết cis-trans trong thuyền cấu tạo.
chì ( ví d ụ, t han chì nitrat, b isulfat than c hì), hợp c hất kim l oại t han chì-kiềm, hợp chất than c hì-halogen,
Carbon monoflorua l à chất c ách điện.
t han chì-kim l oại hợp chất c lorua, v.v. T uy nhiên, c ần n hấn m ạnh rằng m ức đ ộ ion trong c ác hợp chất n
ày nhóm c ó thể r ất thấp. Hơn n ữa, nhiều i nterca-late c ủa n hóm này vẫn giữ được b ản sắc phân t ử c ủa
c húng t rong mạng t han chì, do đ ó b ản chất c ủa l iên kết i on phức t ạp hơn thế trong n hiều t rường hợp
9.3.3. Tetracacbon m onoflorua
h oàn t oàn chất r ắn ion, t rong đó c ó s ự tham g ia c ủa các i on đơn g iản. Mặc d ù nhiều h ợp chất c ủa nhóm
Tetracarbon monofluoride, với thành phần g ần đúng của C4F, được h
này liên q uan đến m ột mức độ i on hóa nhỏ m à chúng t hực s ự k hông nên
ình thành do phản ứ ng của than chì với
được g ọi là “ ion”, chúng đ ược gọi l à hợp c hất xen k ẽ i on để t huận t iện cho việc p hân loại. T RONG
F2 và H F ở nhiệt độ d ưới 80 C [43, 5 1, 57].
sự h iện diện c ủa lớp xen kẽ b ên n goài d ư t hừa, c ác h ợp c hất này có c ấu trúc lớp x en kẽ c ó trật t
Cấu trúc của tetracarbon monofluoride k hác nhau từ c arbon ự t ốt. Trong n ày
monofluoride t rong đó carbon các mặt phẳng không bị nhăn, như t
trạng t hái, c húng được g ọi là h ợp c hất d ạng lớp. T uy n hiên khi t rạng thái c ân bằng với s ự xen k ẽ bên n
hể hiện qua nhiễu xạ tia X
goài dư t hừa l à bị l oại bỏ, các hợp c hất có x u h ướng g iải hấp t hụ c hất xen k ẽ [46, 47]. M ặc dù p hần
[43]. Sự khác b iệt này có l ẽ là d o lớn hơn số l iên k ết cộng h óa t rị
lớn nội dung x en k ẽ b ị m ất d ưới trong đ iều kiện như v ậy, một p hần được giữ l ại ngay c ả trong
định h ướng C –F t rong cacbon monofluoride h ơn trong tetracarbon 1482
monofluoride. các các h ình lục g iác carbon t hực tế v ẫn giống như ở d ạng nguyên chất
thuận tiện nhất l à pin điện b ên ngoài. Ví dụ, than chì bisulphate được h ình
than c hì, nhưng các mặt phẳng than c hì có sự x ếp chồng AA, ˚ với khoảng c ách giữa c ác
thành từ c ực dương khi lưu huỳnh đậm đặc axit đ ược đ iện phân g iữa than c hì
lớp là 5,29 đ ến 5,50 A [43, 5 1]. Các nguyên tử f lo được sắp xếp thành hai lớp, m ột
và bạch k im cực âm [61, 6 2]. Phần l ớn các hợp chất xen kẽ c ó thể được hình t
lớp ở trên và m ột ở dưới m ỗi lớp cacbon.
hành một cách tự n hiên.
Độ d ẫn điện của tetracarbon monofluo-ride nhỏ hơn k hoảng
100 lần so với than c hì nguyên chất 9.4.1. T han chì-halogen
[58]. Tuy nhiên giá trị này cao hơn s o với carbon monoflorua.
Mặc d ù nhiều t ính chất c ủa halogen t hể hiện xu h ướng liên tục k hi người ta x em xét các n guyên t ố
9.4. Hợp c hất xen kẽ ion
F, Cl, Br v à I thuộc nhóm V II của bảng tuần h oàn, khả năng p hản ứng của các
halogen này đối với than chì không thể hiện một xu h ướng như vậy. C hỉ có flo
Phần l ớn các hợp chất xen kẽ t han chì thuộc loại t rong đó liên kết giữa
và b rom phản ứ ng dễ d àng với than c hì; iốt và c lo thì không. T uy nhiên iốt
intercalate và c arbon có m ột mức độ ion hoặc tính chất c ực. Các hợp chất n ày
monoclorua (ICl) iốt bromua ( IBr) và m ột số interhalogens khác c ó thể xen kẽ v
tồn tại ở các giai đoạn c ô đặc được đánh d ấu bằng sự k hác biệt t rong trình tự ào than c hì.
sắp xếp tuần h oàn của các lớp cacbon v à các lớp xen kẽ.
Một số lý t huyết đã đ ược đề x uất để g iải thích hành vi k hác nhau c ủa các
các lớp. Số l ượng lớp cacbon g iữa hai lớp xen kẽ x ác định
halogen đối với than chì. Vì c ác halogen có độ â m điện n ên chúng dự kiến s ẽ nhận
“giai đoạn” của hợp chất. BẰNG nồng độ c ủa intercalate tăng l ên, giai đ oạn giảm
electron t ừ than c hì. Các kết quả thí nghiệm [63] g ợi ý một mức độ điện t ử nhất đ
đi. Các giai đ oạn có t hể được xác định b ằng nhiễu xạ tia X và bằng c ác đường đ
ịnh chuyển từ t han chì sang x en kẽ halogen. c ao ái lực điện tử v à độ phân cực c ao
ẳng nhiệt xen kẽ [ 59], mặc dù
đối với các c alate sẽ tạo điều kiện t huận lợi cho s ự tương tác như v ậy. Tham khảo 6
các giai đoạn có t hể được phân biệt rõ r àng hơn t rong một
4 gợi ý rằng, mặc dù c lo và flo có e lectron cao ái lực, đ ộ phân c ực của chúng thấp.
số h ợp chất so v ới các hợp chất k hác. Kết quả thực nghiệm c hỉ ra thực tế l à liên k ết trong các hợp
Ngược lại là đúng đ ối với iốt. Mặt khác, bromine dường như thể hiện cả h ai tính chất
chất này có m ột số ion nhân vật [58].
n ày ở mức độ vừa đủ.
Các hợp chất n ày có thể được h ình t hành tự phát tương t ác của chất xen kẽ v ới than chì hoặc
Flo phản ứng với than c hì nhưng chỉ tạo thành các hợp chất xen kẽ với liên k ết
b ằng điện p hân. Các xen kẽ t ạo thành các hợp chất xen kẽ t ự phát b ao gồm Br2, cộng hóa trị, d o đó IBr, I Cl, K, R b, Cs,
Tính c hất vật lý c ủa than chì-flo hoàn t oàn khác s o với các than chì-halogen khác.
HNO3, FeCl3, S bF5, v.v. C húng có t hể được điều chế bằng cách cho than c hì phản ứng lại với chất xen
Than c hì-brom [65, 6 6] được s ử dụng r ộng rãi nhất nghiên c ứu tất cả các than
kẽ trong c hất lỏng hoặc hơi hình thành trong nhiều giờ hoặc n hiều ngày, ở nhiệt độ mà á p suất h ơi
c hì-halogen. Than c hì-brôm Các hợp c hất dạng l ớp tồn t ại ở í t n hất bốn g iai đoạn
của lớp xen kẽ đ ủ để v ượt q ua ngưỡng t iềm năng x en kẽ [60]. Một số i n-tercalate có thể được h òa tan ( giai đ oạn
trong dung môi hữu cơ v à hợp chất s au đó có t hể được điều c hế bằng cách n gâm than c hì trong dung
2–5), được x ác định bằng n hiễu xạ tia X và c ác phép
dịch c hứa xen kẽ. các xen kẽ tạo thành các hợp chất x en kẽ điện p hân bao gồm NH3, H2F2, H3PO4, H
đo đ ẳng nhiệt xen kẽ [ 59]. 2SO4, HNO3, v.v..
Khi x ác đ ịnh các đường đ ẳng n hiệt, t rọng l ượng đã b iết c ủa than c hì tiếp xúc với
Các hợp chất này có t hể được t ạo ra để p hản ứng với than c hì bằng các chất o xy hóa hoặc chất k
một loạt á p suất h ơi nước b rom từ 0 đến áp s uất hơi b ão hòa và
hử phụ trợ không chúng tham gia vào sự k ết hợp trong hợp chất thu được. T ác nhân p hụ trợ này lOMoAR cPSD| 40342981 Machine Translated by Google 1484 lOMoAR cPSD| 40342981 Machine Translated by Google
Than c hì bisulfate bao gồm các lớp than chì với HSO ion và
p hân tử H 2SO4 giữa các lớp.
4 H ợp chất l amellar than chì b isulfate giai đ oạn 1 màu x anh lam c ó t hể đ ược đ iều chế b ằng tương t ác h óa h ọc trực t iếp (b)
giảm t ỷ lệ d ị hướng của điệnđiện t rở
than chì với hỗn hợp axit s unfuric đậm đặc và m ột tác nhân oxy hóa (axit suất,
nitric, oxit c rom, thuốc tím, a moni persulfat, man-gan dioxit, chì dioxit, asen p (c)
tăng hệ s ố nhiệt độ d ươngđiện trở
entoxit, iốt axit, axit t uần hoàn h oặc muối m angan) hoặc bằng đ iện phân
suất ở cả trục a và c [61, 89–92]. (d)
đổi dấu của nhiệt điện trongcả trục a
Ưu điểm c ủa phương pháp đ iện hóa chuẩn bị m ẫu là số lượng anion xen kẽ và c ,
có thể đ ược đánh g iá bằng cách á p dụng đ ịnh luật Faraday. Đ iều này cho phép x ác định n t (e)
giảm h ệ số H all âm v ớităng nồng độ x rong công t hức hóa học en kẽ,
CnHSO4 · xH2SO4. Bằng cách đ o sự h ấp thụ trọng lượng, giá t rị của x có t hể đạt (f)
sự bất thường v ề độ dẫn điện t
đ ược n ếu biết n . S ự xuất h iện của các giai đoạn l àm phát sinh c ác bước t rong đường c
rongkhoảng nhiệt độ 7 7–360 K.
ong của thế điện c ực so với dòng điện h oặc thời g ian. Cùng với kết quả nhiễu
xạ t ia X, các bước n ày chỉ ra rằng n = 24 ở giai đ oạn 1 và n = 48 ở giai đ
Điện t rở s uất ở c ả t rục a v à c đ ều g iảm khi xen kẽ nhưng l ại giảm ở t rục c
oạn 2 [62, 88]. c ác giá trị của x là 2,5 [93] ở cả giai đ oạn 1 và 2 .
Khi t hêm m ột lượng n hỏ nước vào axit sunfuric, hợp c hất màu xanh s ẽ b ị phân h ủy t
được thể hiện rõ r àng hơn. T rong khi đó điện t rở suất trên trục c
giảm l iên tục khi hàm lượng kiềm t ăng kim loại, sự g iảm giới h ạn theo heo t ừng b ước.
hướng của trục a dường như đ ạt được ở giai đoạn 4 [79].
tạo thành hỗn hợp các hợp chất d ạng tấm ở giai đ oạn cao hơn [87] không có m
Ảnh hưởng c ủa sự xen kẽ kim loại k iềm lên từ t rường tính c hất mạng c ủa
àu xanh lam (ví dụ, than c hì nguyên chất l à
than chì được tóm tắt dưới đ ây:
bạc). Sự p hân hủy cũng x ảy ra bằng c ách phơi b ày hợp chất màu xanh v ào
không khí [94]. Màu xanh đ ã mất ngay s au khi tiếp xúc với không khí, m ặc dù
(a) thay đổi độ n hạy từ tính t ừ âm s ang dương,
nhiễu xạ t ia X vẫn c ho t hấy sự hiện diện của m ột lượng n ào đ ó của c hất đ ầu tiên
hợp chất d ạng lớp [95]. Sự p hân hủy ở không khí là d o sự h ấp thụ nước.
(b) những thay đổi về g -shift và độ r ộng đường truyền c ủacộng h ưởng s pin electron,
9.4.4. H ợp chất t han c hì-halua
(c) Dịch chuyển h iệp sĩ của từ t rường hạt nhân C s133 cộng hưởng.
Than c hì tạo thành các hợp chất x en kẽ với khối l ượng lớn số halogenua. C
ác halogen tham gia gồm có F, C l, Br và I . Hầu hết các halogenua được n
ghiên cứu là c lorua, mặc dù florua đ ang nhận đ ược sự c hú ý. Các halogenua
Có rất nhiều hợp chất b ậc ba liên q uan đến các kim loại kiềm v à các
đóng v ai trò l à chất nhận đ iện tử trong t han chì.
loại khác ( ví dụ oxy, b en-zene và halogenua) [80–84].
Than c hì-ferric c lorua là l oại h alogenua k im l oại t han chì đ ược nghiên cứu t ốt nhất một p hần vì n ó là l
oại h alogenua l âu đ ời n hất v à m ột p hần vì tính c hất từ t ính thú vị c ủa nó.
9.4.3. Hợp c hất a xit-Graphite
Các hợp chất l amellar than c hì-sắt clorua ở giai đ oạn
Than chì phản ứ ng với một lượng lớn axit để t ạo thành các hợp chất x
1 (69 t rọng lượng%), g iai đ oạn 2 (53 t rọng lượng%), giai đoạn 3 ( 42 trọng l ượng%), giai đoạn 4
en kẽ đã đ ược đề c ập đến là “muối axit c ủa than chì”. Họ đ ã nhận đ
(35 trọng l ượng%), giai đ oạn 5 ( 30 t rọng lượng%) v à giai đ oạn 6 ( 28 t rọng lượng%) c ó đã thu được [ 96–98].
ược nhiều quan t âm vì tính d ẫn điện cao của chúng.
Than c hì-ferric clorua đ ã được đ iều chế bằng c ách nung than c hì bằng
Các axit x en kẽ bao gồm axit n itric (HNO3), axit s unfuric
FeCl3 khan [ 96]. Sau đó làm nguội sản phẩm, FeCl3 dư s ẽ được loại b ỏ b
(H2SO4), a xit perchloric ( HClO4), selenic axit ( H2SeO4), v.v. [85, 8 6]. Các axit n ày
ằng cách hoặc rửa bằng a xit clohydric hoặc thăng hoa.
hoạt động n hư chất nhận đ iện tử t rong tinh thể than c hì bằng cách h ình
Bằng cách t hay đổi nhiệt độ p hản ứng, c ao hơn 180 C, có t hể đạt được các
thành các gốc axit t ích điện â m (NO
3 , HSO 4 , v.v.). Tuy nhiên, c hỉ
giai đ oạn khác n hau. Than chì mẫu thường đ ược duy trì ở nhiệt độ c ao
một phần nhỏ các phân tử a xit trải q ua quá trình ion hóa này. P hần còn lại
hơn hơn FeCl3 để giảm t hiểu sự ngưng tụ c ủa FeCl3 lOMoAR cPSD| 40342981
vẫn là phân t ử axit trong tinh t hể grafit. Graphite-HNO3 ( còn được g ọi là như
than chì nitrat) và t han chì-H2SO4 (còn được g ọi là như bisulfate than c hì) Machine Translated by Google
được nghiên c ứu rộng rãi nhất các hợp chất t huộc loại này.
Than chì n itrat c ó thể đ ược đ iều chế b ằng phương pháp h óa h ọc t rực t iếp
tương tác của than c hì với axit nitric [ 87] hoặc đ iện phân [88]. Phương p háp
vật mẫu. T han chì-sắt clorua l à loại p . M ột p hương pháp í t p hổ
biến hơn l iên quan đ ến xen k ẽ đ iện hóa [ 99].
hóa học liên quan đ ến nitrat hóa ở pha lỏng h oặc hơi. T rong quá trình nitrat
hóa ở pha lỏng, than c hì đ ược n gâm trong a xit n itric ( HNO3) c ó các chất khác nhau
cường đ ộ axit. Các h ợp chất ở giai đoạn 1 có thể thu đ ược bằng c ách sử dụng h ỗn hợp
Pentaflorua than c hì-antimony đã n hận đ ược s ự c hú ý d o tính dẫn đ iện
50% axit nitric b ốc khói (sg 1,52) tính t heo khối l ượng với 50% nitơ pentoxit
t rong mặt p hẳng c ao [ 100]. Hợp c hất ở g iai đ oạn 1 c ó m àu xanh đ en. T ất
( N2O5) được điều chế trực t iếp bằng cách c hưng c ất từ axit n itric và photpho
cả c ác h ợp c hất ở giai đ oạn c ao h ơn đều c ó m àu đen [101].
pentoxit (P2O5). Các hợp chất ở giai đ oạn 1 là
màu x anh d a trời. Tất c ả các g iai đ oạn cao h ơn có t hể thu được mà k hông cần đến n itro-gen p entoxide.
10. Than c hì t ẩy t ế b ào chết C ác hợp c hất x en k ẽ t han chì c ó x u h ướng
C ác hợp c hất ở giai đ oạn 2 có thể thu được bằng c ách sử d ụng a xit nitric b ốc khói.
bong t róc khi đ un n óng [ 4]. Quá t rình t ẩy da c hết b ao g ồm s ự g iãn nở l
Trong quá trình n itrat h óa ở pha h ơi, than chì t iếp xúc v ới hơi axit nitric c ó áp
ớn ( lên t ới v ài trăm lần) d ọc t heo t rục c. Đ ó l à d o x u h ướng xen kẽ t
s uất riêng phần k hác nhau. Hơn
rong t han c hì b ay hơi, do đ ó h ình t hành các t úi k hí c ó t hể nổ h oặc k
mẫu đạt yêu cầu có t hể thu được bằng p ha hơi nitrat hóa hơn là n itrat hóa ở
hông n ổ. S ự giãn nở c ủa các t úi k hí đ ược thực h iện nhờ s ự c ắt c ủa c ác l
pha lỏng v ì quá trình nitrat h óa ở pha lỏng diễn r a rất nhanh ở các cạnh của
ớp than c hì đối v ới nhau. N ếu c ác t úi k hông vỡ v à n hiệt đ ộ k hông quá c
ao t hì quá t rình t ẩy d a chết c ó t hể p hục h ồi sau k hi l àm m át t iếp theo.
mẫu có c ác cạnh phồng lên do s ự xen kẽ
Tuy n hiên, đ un n óng quá m ức s ẽ g ây r a t ình trạng t ẩy d a c hết không
trước khi các phân tử c ó thời g ian thâm n hập vào bên trong của các lớp. thể p hục hồi.
Phương p háp điện hóa b ao g ồm việc s ử d ụng than c hì làm điện cực tham c hiếu và axit n itric bốc khói
như c hất đ iện p hân [ 88].
Quá t rình t ẩy da c hết đ ược tiến h ành p hổ biến n hất t rên t han chì x en k ẽ ở d ạng v
Khả n ăng hấp p hụ c ủa s ợi t han h oạt tính tương đương v ới than hoạt tính, n hưng h ình d ạng s ợi
ảy, vì v ảy t han c hì c ó các l ớp t han c hì t hẳng hàng t rong mặt p hẳng c ủa v ảy và s ự g iãn
c ủa sợi than hoạt tính cho phép chất hấp p hụ đ ến v ị t rí h ấp phụ n hanh hơn, do đó đẩy nhanh
n ở d ọc t heo trục c k hông b ị cản t rở b ởi p hép đo p há v ỡ đ ịa l ý. Sau k hi t ẩy d a c hết
quá trình h ấp p hụ v à giải h ấp. L ượng hấp phụ tăng theo mức độ kích hoạt. không t hể
phục h ồi, v ảy d ọc t heo trục c d ài h ơn nhiều s o v ới hướng t rong mặt p hẳng, v ì v ậy n ó
được g ọi là s âu. Đ ộ x ốp l ớn của t han c hì được tẩy t ế bào c hết r ất h ấp d ẫn đối v ới c ác
Sự x en k ẽ c ó t hể x ảy r a trong s ợi than chì, tức là sợi carbon có độ kết t inh c ao. S ự x en
ứ ng d ụng y s inh [ 102].
kẽ c ó t hể được sử dụng để sửa đổi các sợi nhằm t ăng h iệu q uả che c hắn n hiễu đ iện từ [3,
5] hoặc để tăng công suất n hiệt đ iện khi s ử d ụng h ỗn h ợp sợi làm cặp nhiệt điện [103].
Mặc d ù c ó p hản ứ ng hóa h ọc g iữa c ác nguyên tử cacbon không kết tinh (chẳng hạn n hư sợi c
Việc n én m ột t ập h ợp giun m à k hông c ó c hất kết d ính s ẽ t ạo r a s ự liên k ết c ơ học
acbon k hông kết tinh và than đá) và các chất xen k ẽ k hác n hau, nhưng c ác p hản ứ ng không
g iữa c ác g iun. Do đ ó, m ột t ấm d ẻo (gọi l à t han c hì dẻo) được hình t hành [ 5]. N hững
tạo ra hợp chất xen kẽ than c hì.
con s âu đ ược s ử d ụng đ ể chế t ạo than c hì d ẻo t ốt n hất là n hững l oại đ ược tạo r a b
ằng cách t ẩy d a chết l iên q uan đến v iệc l àm v ỡ c ác túi k hí.
Tấm c ó t ính đ àn h ồi v à có t hể đ ược cắt b ằng k éo.
Nó t hường đ ược sử d ụng làm v ật l iệu đ ệm cho m ôi t rường k hắc nghiệt, vì t han c hì k
12. B ảo v ệ chống o xy h óa X u h ướng cacbon b ị o xy h óa v à trở t hành h ơi là vấn đề hạn chế
việc sử dụng cacbon ở n hiệt đ ộ c ao. C acbon cấu trúc bao gồm sợi cacbon, vật liệu tổng h ợp c
há t rơ về m ặt hóa h ọc v à c ó k hả n ăng chịu nhiệt đ ộ c ao. N ó cũng c ó t hể đ ược sử d
acbon-cacbon và t han c hì. Chúng được s ử dụng trong ngành hàng k hông v ũ t rụ và c ác ứ ng d
ụng l àm vật l iệu đ ệm đ ể c he chắn n hiễu điện t ừ ( EMI), v ì t ính dẫn đ iện v à d iện t ích bề
ụng c ông nghiệp khác nhau. Người ta chú ý n hiều đ ến v iệc phát t riển c ác phương pháp bảo
m ặt đ ặc biệt c ao ( thường là 1 0–15 m 2/g) c ủa n ó tăng c ường s ự p hản x ạ c ủa điện t ừ t
vệ oxy hóa vật l iệu cacbon [ 104–107].
ần s ố c ao (lên đ ến G Hz). b ức x ạ mạng [ 5]. lOMoAR cPSD| 40342981 Machine Translated by Google
11. S ợi carbon S ợi c arbon là l oại sợi c ó t hành p hần chứa í t n hất 9 2% t rọng lượng c arbon.
Phương p háp c hống oxy hóa chủ yếu của cacbon l iên quan
Chúng c ó t hể ngắn h oặc l iên t ục; cấu t rúc c ủa c húng c ó thể l à t inh thể, v ô đ ịnh hình h
đến việc s ử dụng l ớp phủ, c hẳng hạn như SiC [108– 129], s ilicon
oặc m ột p hần tinh t hể. D ạng t inh thể c ó c ấu t rúc tinh t hể c ủa t han c hì. Mô đ un c ao c
oxycarbua [130], T iC [131], TiN [132],
ủa s ợi carbon b ắt n guồn t ừ t hực tế l à c ác lớp c arbon, m ặc d ù k hông nhất t hiết p hải
TiO2 [ 133, 134], S i3N4 [135, 1 36], B4C [ 137, 138],
phẳng, n hưng c ó xu h ướng song s ong v ới t rục sợi.
SiO2 [ 139], ZrSiO4 [140, 1 41], ZrO2 [ 142], Si-Hf-Cr
[143], Al2O3 [ 144–146], Al2O3-SiO2 [ 147, 148], S iC/C
Định hướng ưa t hích về m ặt t inh t hể n ày được g ọi l à k ết c ấu s ợi. Kết q uả l à s ợi
[149–154], BN [155–157], S i-B [ 158, 159], m ullit
carbon c ó m ô đ un s ong song v ới t rục s ợi cao h ơn so với m ô đ un v uông g óc với t rục s
[160–162], L aB6 [ 163], MoSi2 [164], Y 2SiO5 [165– 168] v à
ợi. T ương tự, đ ộ d ẫn đ iện và n hiệt cao hơn d ọc theo t rục s ợi v à h ệ số g iãn n ở n hiệt t
thủy t inh [ 169–171]. Những l ớp phủ gốm này được chủ yếu
hấp hơn dọc theo t rục sợi.
được á p dụng b ằng c ách lắng đ ọng h ơi hóa học (CVD) h oặc
nhiệt p hân p olyme tiền g ốm [172, 173].
Mức đ ộ liên k ết c ủa c ác l ớp carbon s ong s ong v ới trục s ợi c àng lớn, t ức l à kết c ấu
Một phương pháp k hác đ ể bảo vệ o xy hóa cacbon liên q
s ợi c àng c hắc thì t inh t hể t rục c càng l ớn
uan đến việc x ử lý b ề mặt bằng d ung dịch n ước p hản ứng
[174], c hẳng hạn như axit p hotphoric [ 175, 176], c ác hợp chất
kích t hước ( Lc), mật đ ộ, h àm l ượng carbon và mô đun kéo của sợi, độ d ẫn đ iện v à đ ộ dẫn n hiệt s ong s
p hotphat o xi-florua [ 177], POCl3 [178] v à axit b oric [179]. T iếp
ong với trục sợi; hệ số giãn nở nhiệt v à đ ộ b ền c ắt bên t rong c ủa sợi càng nhỏ. Trong sợi cacbon có thể c
theo l à ngâm t rong d ung d ịch bằng c ách s ấy khô và đôi khi
ó các v ùng t han c hì c ó kích t hước Lc vuông góc với các lớp và có kích t hước L a s ong s ong v ới các lớp.
làm nóng. Phương p háp n ày
Cũng có thể có những vùng kết t inh t rong đó c ác l ớp c acbon, mặc dù phát triển tốt và song song v ới n
nên được p hân b iệt với sự h ình thành c ủa gốm phủ bằng c ách
hau, n hưng k hông x ếp chồng lên nhau theo bất kỳ trình tự cụ t hể n ào; cacbon ở n hững v ùng n ày được
n húng vào sol-gel [180]. K ỹ thuật g iải pháp đơn giản h ơn so
gọi là cacbon phản lực. Tuy nhiên, m ột l oại c arbon khác c ó thể tồn tại trong sợi carbon là carbon v ô đ ịnh
với CVD, m ặc dù nó t hường cung cấp khả năng c hống o xy hóa
hình, t rong đ ó c ác lớp carbon dù phát triển tốt nhưng t hậm c hí k hông s ong song v ới nhau.
ở nhiệt đ ộ thấp h ơn hơn so với phương p háp phủ gốm [174]. 13. Than h oạt tính
Tỷ l ệ than c hì t rong s ợi c arbon có thể dao động từ 0 đến 100%. Khi t ỷ l ệ c ao, s ợi đ ược g ọi là s ợi
Than hoạt tính d ùng để c hỉ một loại v ật liệu cacbon c ó
than chì và được gọi là sợi than chì.
độ xốp bề mặt dẫn đ ến một d iện tích b ề mặt cụ t
Tuy n hiên, s ợi t han chì l à đ a t inh thể, trong khi sợi than chì là một t inh t hể đ ơn với l ớp c acbon cuộn lại hể
như một cuộn giấy. Do bản c hất đ ơn tinh t hể c ủa chúng, s ợi than chì hầu như k hông có khuyết t ật v à có
thường v ượt q uá 1000 m2/g. Các lỗ c hân lông t hường˚ micropores
đ ộ b ền đ ặc b iệt cao. Tuy nhiên, năng suất sản xuất than c hì q uá t hấp nên k hông c ó g iá trị thương m ại.
( kích thước d ưới 2 0 A), mặc dù mesopores ( kích ˚ thước t rên 2 0 A)
có n hiều trong t han hoạt t ính đ ã được đ iều
chế phù hợp [181, 1 82]. Đã k ích hoạt cacbon được s ử dụng đ ể
Sợi carbon c ó s ẵn t rên t hị trường được chia thành ba loại, đó là s ợi đ a n ăng (GP), h iệu s uất c ao (HP)
hấp phụ các phân t ử và i on nhằm mục đ ích xử l ý nước, l ọc
và sợi carbon hoạt tính (ACF). L oại có m ục đ ích c hung đ ược đặc trưng b ởi cấu trúc vô định hình v à đ ẳng
không khí, k hí đốt tách, thu hồi dung m ôi, k hử mùi và các vấn
hướng, đ ộ b ền k éo t hấp, mô đun kéo thấp và chi phí thấp. L oại h iệu suất c ao đ ược đặc trưng bởi cường
đề liên q uan các ứng dụng liên q uan đ ến kỹ thuật m ôi trường
độ và mô đun tương đ ối c ao. Trong s ố c ác s ợi carbon hiệu suất cao, mô đun cao hơn có l iên quan đ ến t ỷ [183, 1 84].
l ệ t han chì cao hơn và tính dị hướng cao hơn. S ợi t han h oạt t ính được đặc trưng bởi sự hiện diện của
một số l ượng l ớn c ác v i l ỗ mở, h oạt đ ộng như các vị trí hấp phụ. 1486
Than h oạt tính t hường đ ược t ạo ra bằng c ách đun nóng tiền c hất cacbon ( ví
17. W.P. EATHERLY, thông tin liên l ạc riêng tư, 1 975.
dụ: hắc ín và polyacrylonitrile) h oặc một vật liệu c acbon trong môi trường p hản ứ
18. A . W . M OORE, n gười Hà L an. T ạp c hí N atuurkde ( Hà L an) 3 2(7) (1966) 2 21. 19.
ng. Quá trình n ày, được g ọi là hoạt h óa, l à một phản ứ ng (chẳng hạn như C +
N hư vậy. t rong “ Hóa h ọc v à V ật l ý c ủa C arbon,” d o P L W alker b iên t ập,
Jr. ( Dekker, N ew Y ork, 1 973) C hương 1 1, t r. 6 9.
CO2 2CO) làm biến đ ổi một số vật liệu t hành hơi, d o đó tạo ra các lỗ x ốp trên
20. J . C. S LONCZEWSKI v à P . R . W EISS , Vật lý. Mục lục 109
bề m ặt. Kích h oạt tương đ ối khó khăn n ếu vật liệu cacbon đ ã bị được đ ồ họa (1958) 2 72.
hóa trước k hi kích hoạt. Q uá trình t iền xử l ý liên q uan đ ến ozon nhằm m ục đích
21. J . W . M C C LURE, n hư trên. 1 08 ( 1957) 6 12.
t ăng n ồng độ o xy bề mặt, từ đó t ạo điều kiện c ho hoạt h óa [185].
22. M . S G.. D RESSELHAUS v à J. E .DESSELHAUS ,
FISCHER, n hư trên. B 15 ( 1977) 3 180.
23. P D RESSELHAUS v à. R. S CHROEDER, M. S A . JAVAN, . 14. Kết luận
trong “Vật l ý c ủa bán k im l oại v à khoảng c ách h ẹp
Than chì là m ột vật liệu kỹ t huật giàu vật lý và hóa học, n goài việc h ữu ích
Chất b án d ẫn” d o C arter v à B ate b iên t ập ( Pergamon P ress, New Y ork, 1 971) t r. 1 39.
trong dạng k hối, dạng s ợi, k ích h oạt và t ẩy tế bào chết. T uy nhiên, bảo vệ oxy
24. B . L. H EFLINGER, luận á n M S, K hoa Kỹ thuật Đ iện, Viện Công nghệ M assachusetts, C ambridge, MA,
hóa là c ần thiết cho nhiệt đ ộ cao ứng dụng. Hoa K ỳ, 1 971.
25. W. W. Đ Ồ CHƠI, M. S , Phys. Linh m ục . DRESELHAUS v à Tài liệu t ham khảo
G. DRESSELHAUS 2 6. I. L . TÂY B15 (1977). 1.
M. INAGAKI, Nihon E nerugi G akkaishi/Tạp c hí N hật B ản
BAN NHA, t rong “ Hóa học v à Vật l ý của C acbon,” do biên t ập v iên Walker v à T hrower ( 1973) T
Viện Năng lượng 77(9) ( 1998) 8 57. ập. 8 , C hương 1 . 2.
M.S .DRESSELHAUS và G. D RESSELHAUS ,trong P roc. t hứ 7 27.
J . W . MC C LURE, t rong “Vật lý của bán kim loại và t hu hẹp
Hội nghị chuyên đ ề q uốc t ế v ề c ác h ợp c hất x en k ẽ, p hân t ử Tinh thể & T inh t
Gap S emiconductors,” d o C arter v à B ate b iên t ập ( Pergaman P ress, New Y ork, 1 971) t r. 1 27.
hể l ỏng P hần K hoa h ọc & C ông n ghệ A — 28.
I dem., P hys. R ev. 1 19 ( 1960) 6 06.
Tinh thể phân t ử & T inh t hể l ỏng ( 1994) T ập. 2 44, t r. 1 . 29.
M . I NOUE, J . P hys. S óc. N hật B ản 1 7 ( 1962) 8 08. 3. G. HARRIS , J. LENNHOFF , J. NASSIF , 30.
P . R. S CHROEDER, T iến sĩ. l uận văn, Khoa V ật lý, Viện C ông n ghệ M assachusetts, C ambridge, M A, H oa K
M. VINCIGUERRA , P. R OSE, D. JAWORSKI và ỳ, 1969.
J. GAIER, ở Proc. 1 999 Kỹ thuật S AMPE q uốc tế l ần thứ 3 1 31.
G .F . DRESSELHAUS , Vật lý. Mục s ư B10 ( 1974) 3 602.
Hội t hảo, V ật l iệu v à q uy t rình t iên t iến c huẩn b ị c ho c ái m ới Thiên n iên k ỷ ( 1999) T ập. 3 1, t r. 1 22. 4.
D. D. L. CHUNG, J. Mater. Khoa học. 22(12) (1987) 4190. 32.
I . L . T ÂY BAN N HA, A . R . U BBELOHDE và D. A . Y OUNG, 5.
Phil. C huyển. R oy. S óc. ( Luân Đ ôn) A 262 ( 1967) 1 128.
Như v í dụ, J. Mater. A nh. Hoàn h ảo. 9 (2) ( 2000). 33.
L . J. B RILLSON, T iến s ĩ. l uận án, Khoa Vật lý, Đại học Pennsylvania, P hiladelphia, P A, 6.
J .D.BernAL , P roc . R oy. S óc. A 106 ( 1924) 7 49. Hoa Kỳ, 1972. 7. R. W . G . WYCKOFF
, “ Cấu t rúc t inh t hể,” T ập. 1 ( Liênkhoa h ọc, N ew Y ork, 1 963). 34.
F TUINSTRA v à J . L . K OENIG, J . C hem. V ật l ý. 5 3 ( 1970). 1126. 8.
W . R ULAND, “ Hóa h ọc v à V ật l ý c ủa C arbon,” d o b iên t ập v iên 35.
R . A . F RIEDEL v à G . L . C ARLSON, J . P hys. C 7 5 ( 1971) 1149.
Walker v à T hrower ( 1968) C hương 4 . 9.
L . J. B rillson, E . B urstein, A. A. M ARADUDIN. 36.
R . NICKLOW, N . W AKABAYASHI và H . G . SMITH,
và T . S TARK, “ Vật l ý c ủa b án k im l oại v à k hoảng c ách t hu h ẹp Chất b án d ẫn,” d o C arter v à B ate b iên t ập
Vật l ý. L inh m ục B 5 ( 1972) 4 951. ( Pergamon P ress, 37.
J . J. S ONG, D. D . L . CHUNG, P . C. EKLUND v à NewYork, 1 971) t r. 1 87.
M. S . DESSELHAUS , Ủy b an t rạng t hái r ắn. 2 0 ( 1976) 1111.
10. H. L IPSON v à A. R . STOKES
,Proc. R oy. S óc. A 227 ( 1942) 330. 38.
G . H ERZBERG, “ Phổ p hân t ử v à c ấu t rúc p hân t ử”(Van N ostrand, N ew Y ork, 1 950).
11. H . J AGODZINSKI, T inh t hể A cta. 2 ( 1949) 2 98. 39.
R . J . N EMANICH v à S . A. S OLIN, Ủy b an trạng t hái rắn. 2 3(7) (1977) 4 17.
12. R . R . H AERING, C an. J . V ật l ý. 3 6 ( 1958) 3 52. 40.
G . R. H ENNIG, trong “Proc. của H ội nghị C arbon l ần t hứ 2 . (Pergaman
Press, O xford, 1 956) t r. 1 03.
13. J . W . M C C LURE, C arbon 7 ( 1969) 4 25. 41.
H . L . R ILEY, N hiên l iệu 2 4 ( 1945) 8 ; N hư v ậy, n hư trên. 2 4 ( 1945) 2 4.
14. G . E . B ACON, A cta C rystal. 3 ( 1950) 2 0. 42.
G . R . H ENNIG, t rong “ Progr. I norg. Chem.,” d o FA C otton b iên tập(Wiley I nterscience, N
15. H . P BOEHM và U . H OFMANN, Z. A norg. b ạn. Tổng quan. C hem..
ew Y ork, 1 959) C hương 1 , t r. 1 25. 278 ( 1955) 5 8.
16. N hư đã nêu, như trên. 278 ( 1955) 299. 1488