




Preview text:
Sản xuất Protease thực vật và công nghệ sinh học mới Ứng dụng: Đánh giá cập nhật
Franco David Troncoso,[a, c] Daniel Alberto Sánchez,*[a, c] và María Luján Ferreira[b, c]
Một đánh giá cập nhật về các protease thực vật mới nổi có tiềm năng ứng dụng công nghệ sinh học được trình bày. Protease thực vật
cho thấy hiệu suất tương đương hoặc thậm chí cao hơn protease động vật hoặc vi sinh vật trong việc ổn định sản phẩm phụ thông qua
quá trình thủy phân, ví dụ như váng sữa phô mai, lông chim, collagen, vật liệu sừng, gelatin, protein cá và protein đậu nành.Các peptide
sinh học hoạt tính có thể thu được dưới dạng sản phẩm có giá trị gia tăng cao, cho thấy nhiều tác dụng có lợi đối với sức khỏe con
người. Protease thực vật cũng có thể được sử dụng để xử lý nước thải. Việc sản xuất protease thực vật mới được khuyến khích vì những
ưu điểm sau: chi phí phân lập thấp bằng cách sử dụng quy trình đơn giản, độ ổn định vượt trội trong nhiều điều kiện hoạt động (nhiệt độ,
pH, độ mặn và dung môi hữu cơ), ái lực đáng kể với nhiều loại của chất nền và khả năng cố định. Protease thực vật có tiềm năng ứng
dụng to lớn trong việc bình ổn hóa chất thải công nghiệp và chuyển đổi nó thành các sản phẩm có giá trị gia tăng cao thông qua các quy trình chi phí thấp 1. Giới thiệu
Protease (còn gọi là proteinase, hoặc enzyme phân giải protein) là enzyme có khả năng thủy phân các liên kết peptide trong
protein. Trong môi trường sinh học, protease rất cần thiết cho quá trình chuyển hóa tế bào bình thường, bao gồm cả quá trình của ty thể.[1]
Pro-tease cũng đóng một vai trò quan trọng trong các quá trình sinh hóa khác nhau, kiểm soát kích thước, cấu trúc và thành
phần của các protein quan trọng.[2]
Từ góc độ kinh tế, việc nghiên cứu các protease mới đang không ngừng tăng trưởng vì chúng chiếm 60% tổng số enzyme
được thương mại hóa trên thế giới. Thị trường enzyme protease tổng thể ước tính trên 3 tỷ đô la Mỹ, cho thấy tốc độ tăng
trưởng kép hàng năm (CAGR) là 6,1% vào năm 2024.[3]
Ngày nay, các ứng dụng công nghiệp của protease bao gồm nhiều ngành công nghiệp, chẳng hạn như công nghiệp da và chất
tẩy rửa, sản xuất dược phẩm công nghệ thực phẩm.[4]
Và các protease có thể được phân loại theo các tiêu chí sau:
(i) Phản ứng có xúc tác; theo loại này, các protease được bao gồm trong hydrolase (nhóm 3) và phân nhóm 4 (hydrolase của
liên kết peptide). Phân lớp 3.4 cũng có thể được chia thành exo- hoặc endopeptidase. Những chất đầu tiên thủy phân các liên
kết peptid bên ngoài (đầu amino hoặc đầu carboxyl), trong khi đó, các endopeptidase thủy phân các liên kết peptide bên trong protein.[5]
(ii) Bản chất của địa điểm đang hoạt động; Theo tiêu chí này, các protease được phân loại thành bảy loại: cystein endpeptidase
(còn được gọi là thiol protease), serine endpeptidase, aspartic endpeptidase (đầu tiên được gọi là axit protease), endopeptidase
glutamic, metallicoendopepti-dase, threonine endpeptidase và peptidase chưa rõ cơ chế tác dụng. Chúng được nhóm lại nếu
phức hợp cộng hóa trị giữa enzyme và cơ chất được tạo ra trong cơ chế enzyme (cysteine, threonine và serine endpeptidase)
hoặc không (aspartic, glutamic và metallicoendopeptidase). Sự hình thành phức hợp enzyme-cơ chất cộng hóa trị có thể được
hiểu khi xem nucleophile là một axit amin trong serine, threonine và cysteine protease, trong khi đó, ở các peptidase khác,
nucleophile được kích hoạt bởi các phân tử nước.[6]
(iii) Các mối quan hệ tiến hóa dựa trên cấu trúc; trong đó các protein có trình tự tương đồng đầy đủ (trình tự axit amin) được
bao gồm trong cùng một họ, trong khi một họ được tích hợp bởi các họ có protein tổ tiên chung. Cơ sở dữ liệu MEROPS
(http://merops.sanger.ac.uk/index. htm ) chứa 244 họ và 55 họ. Tên dòng họ được thiết kế dựa trên các chữ cái S, C, T, A, G,
M, U, phù hợp với cơ chế xúc tác cụ thể. Một số họ chứa các họ với cơ chế khác nhau, được thiết kế bằng chữ “P”.[7]
Protease được tìm thấy từ sinh vật nhân sơ đến các sinh vật phức tạp (thực vật và động vật). Loại protease cũng như các đặc tính
chức năng của nó phụ thuộc trực tiếp vào chức năng cụ thể của nó và điều kiện sinh vật của vật chủ.[6]
Protease tham gia vào sinh lý học của thực vật trong toàn bộ vòng đời của chúng (ức chế quang hợp clo-oplast, cơ chế bảo vệ,
hình thành quang hình và sự nảy mầm của hạt, v.v.). Loại protease phổ biến nhất ở thực vật là cysteine (CP), tiếp theo là
protease serine (SP) và protease aspartic (AP).
Trong protease cystein, nucleophile là nhóm sulfhydryl của gốc cystein và chất cho proton là gốc histidine (một đặc điểm chung
với protease serine). Chúng hoạt động trong khoảng nhiệt độ và độ pH rộng. Nhóm thiol của enzyme phải ở dạng khử để có hoạt tính xúc tác.
Vì vậy, protease cystein đòi hỏi môi trường khử khá tốt để hoạt động. Hầu hết các protease cystein có trọng lượng phân tử từ 25
đến 30 kDa và có độ pH tối ưu từ 5 đến 8. Theo cơ sở dữ liệu MEROPS, CP được chia thành 10 nhóm: CA, CD, CE, CF, CH,
CL, CM, CN , CO và C và cho đến nay, CP thực vật được mô tả là thuộc năm nhóm này (CA, CD, CF, CO và CE). Cấu trúc của
các protease này cho thấy ,một chuỗi xoắn α và giống như thùng β được tách ra khỏi vị trí hoạt động (Cys-25 và His-159), nằm
ở mỗi vị trí. bên của một rãnh và được bảo tồn tốt ở tất cả các thành viên trong gia đình.
CP thực vật đóng vai trò quan trọng trong việc huy động protein và bảo vệ chống lại các tác nhân sinh học và phi sinh học.
CP thực vật bị ức chế bởi Iodoacetamide (IAA) và p-chloromercury ben-zoate (PCMB).[8]
SP thực vật có dư lượng Ser là nucleophile. Cơ chế xúc tác liên quan đến một chất cho proton ngoài serine mang nucleophile.
Trong 4 họ, chất cho proton là gốc histidin; với dư lượng thứ ba hiện diện: aspartate ở 3 nhóm và một histidine khác ở nhóm
thứ tư. Ở 2 cái còn lại nhóm, chất cho proton là dư lượng lysine và dư lượng xúc tác thứ ba là không cần thiết. Trong một
trong số đó, có một bộ đôi xúc tác Ser/His. Ba nhóm (SA, SB và SC) chia sẻ bộ ba xúc tác gồm serine (S) aspartate (D) và
histidine (H) theo các thứ tự khác nhau (ví dụ: HDS (SA), DHS (SB) và SDH (SC )).
SP thực vật tham gia vào nhiều quá trình sinh lý, chẳng hạn như phát sinh bào tử vi mô, tấn công mầm bệnh và chuyên môn
hóa các mô. Chúng có trọng lượng phân tử từ 20 đến 120 kDa (hầu hết chúng nằm trong khoảng 60–80 kDa). Điều kiện tối ưu
cho hoạt tính cao nhất của chúng là môi trường kiềm (pH: 7-11) và nhiệt độ lên tới 50°C. Một số trường hợp ngoại lệ là Ara12
từ A. thaliana, RSIP từ ngô và C1 từ đậu nành, cho thấy độ pH tối ưu trong khoảng 3,5 đến 6,5.[9]
Hơn nữa, diisopropyl-fluorophosphate và phenylmeth-ylsulfonyl fluoride là chất ức chế peptidase serine.
Protease aspartic thực vật được tìm thấy trong hạt, hoa và lá, khác với protease cysteine và serine,
nucleophile là một phân tử nước hoạt hóa chứ không phải chuỗi bên nucleophilic của axit amin. Theo cơ sở dữ liệu MEROPS,
các AP được nhóm thành AA (họ A1, A3, A11 và A12) và nhóm AD (họ A22), hầu hết chúng đều thuộc họ A1. Cấu trúc bậc
một của AP chứa chuỗi tín hiệu ở đầu amino để truyền vị trí, một phân đoạn chịu trách nhiệm cho việc gấp và ổn định chính xác
cũng như một phần chèn dành riêng cho thực vật (PSI, còn được gọi là miền hoán đổi). PSI chứa khoảng 100 axit amin, chịu
trách nhiệm vận chuyển enzyme vào không bào. Về cấu trúc thứ hai, AP chủ yếu chứa các tấm β có cấu trúc hai cánh.[10]
Hầu hết các AP đều có hai gốc aspartic chịu trách nhiệm cho hoạt động của enzyme, bị ức chế bởi pepstatin A. Vị trí hoạt
động được hình thành bởi hai gốc Asp chịu trách nhiệm hoạt hóa nước. AP thể hiện tính đặc hiệu cao đối với sự phân cắt ở các
liên kết peptide giữa các gốc axit amin kỵ nước. Phần lớn AP hoạt động trong điều kiện axit, có độ pH tối ưu là 4–6,5 và nhiệt
độ lên tới 55°C. AP có phạm vi trọng lượng phân tử từ 35–65 kDa. Khối lượng enzyme phụ thuộc vào việc đoạn PSI có được
loại bỏ bằng quá trình phân giải protein trước khi kích hoạt (dị thể) hay không (monomeric). Phần lớn AP thực vật là chất dị thể
có khối lượng từ 35 đến 51 kDa.
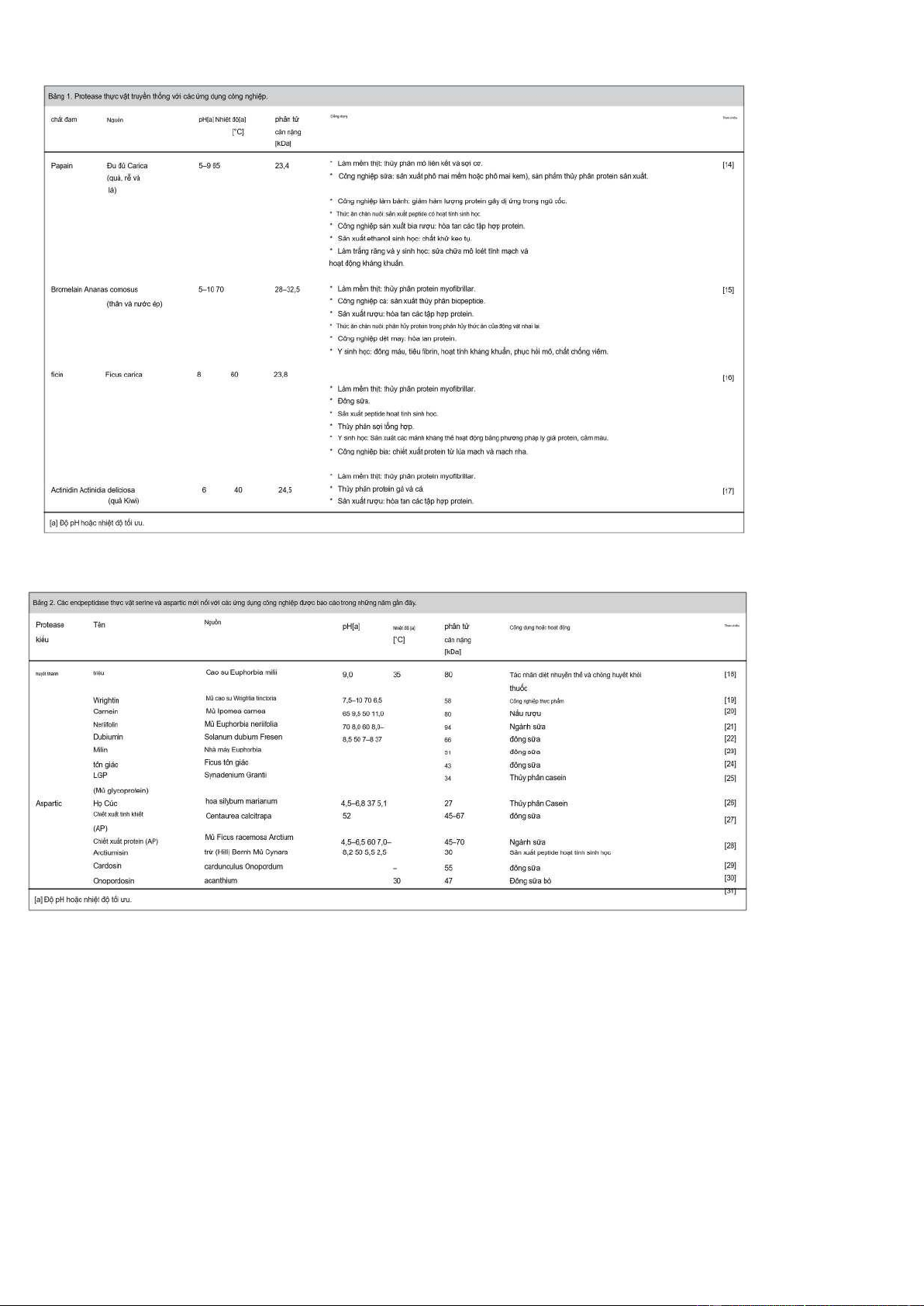
Protease thực vật đã được sử dụng theo truyền thống trong nhiều thập kỷ; làm nổi bật papain, bromelain, ficin và Actinidin (xem Bảng 1).
Trong những thập kỷ gần đây, các loài thực vật mới đã nổi lên như một nguồn protease thô có giá trị với tiềm năng thương mại cạnh tranh.
Bảng 2 cho thấy các endpeptidase serine và aspartic mới nổi được phân lập từ thực vật với các ứng dụng công nghiệp được báo
cáo trong những năm gần đây. Protease có nguồn gốc từ thực vật đang được chú ý nhờ hoạt tính phân giải protein cao và ái lực
với các cơ chất cụ thể, độ ổn định vượt trội trong nhiều điều kiện hoạt động (pH: 4–10 và nhiệt độ lên tới 60°C), và chi phí thấp
khi sản xuất nguồn nguyên liệu thô
Công trình này cung cấp thông tin cập nhật và đánh giá quan trọng về kỹ thuật sản xuất, quy trình phân lập và cố định
protease thực vật. Các ứng dụng mới nổi của protease thực vật sẽ được thảo luận chi tiết, bao gồm việc ổn định giá trị sản phẩm
và chất thải từ ngành công nghiệp thực phẩm (ví dụ: lông chim,..)
-cá, sữa, gluten, đậu nành), thủy phân các chất sừng,hóa học hữu cơ, xử lý nước, sản xuất biopeptide,và công dụng chữa bệnh.
Những ứng dụng này có thể cung cấp những tính năng mới.các lựa chọn thay thế cho việc sử dụng protease thực vật để tăng
cường tính khả thi của ngành công nghiệp thực phẩm và y sinh. 1.1. Cơ chế xúc tác
Như đã đề cập trước đây, protease thực vật phong phú nhất là protease cystein, tiếp theo là protease serine và sau đó protease
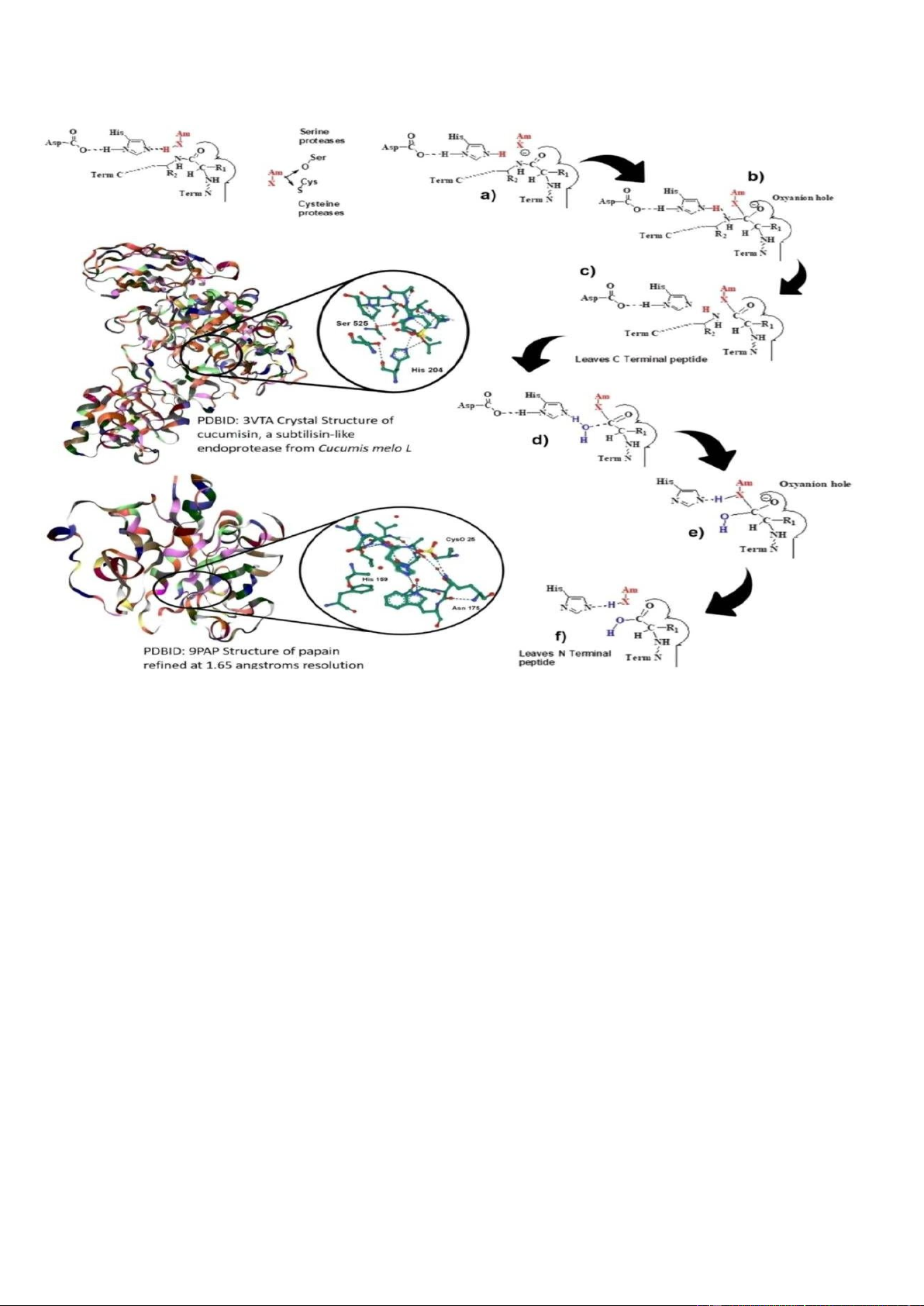
aspartic. Cơ chế xúc tác cho các chất chính này protease thực vật được mô tả dưới đây. Hình 1 cho thấy cơ chế của protein được
xúc tác bởi serine/cysteine protease phản ứng thủy phân. Cơ chế tác dụng của serine protease có liên quan đến bộ ba xúc tác
trong đó Asp có tính axit cần thiết để ổn định His tích điện dương, giúp tăng cường tính độc hại của oxy serine. Trong trường
hợp cysteine protease, Asp là không cần thiết và vị trí xúc tác là cặp Cys-His.[11] Cuộc tấn công ái nhân xảy ra bởi X (O hoặc
S) phân cực âm (Hình 1a), tạo ra một trung gian tứ diện trong đó X tích điện âm liên kết với lỗ oxyanion (Hình 1 b). Sự proton
hóa của NH- phá vỡ liên kết bằng cách giải phóng sản phẩm 1 (peptide đầu C (Hình 1c)) và hình thành chất trung gian acyl, bị
tấn công bởi nước xúc tác (Hình 1d). Chất trung gian thứ hai được hình thành (Hình 1e). Cuối cùng, sản phẩm 2 được giải
phóng (peptide đầu N) và vị trí hoạt động được tái tạo (Hình 1f).
phân tử có trạng thái chuyển tiếp đầu tiên và hình thành trung gian tứ diện. 2. Sự proton hóa nitơ. 3. Phân tách liên kết cắt và
giải phóng các sản phẩm có peptide đầu C và N mới.[11] Hình 1 bao gồm số liệu PDB của papain
(https://www.rcsb.org/structure/9pap) và cucumisin (https://www.rcsb.org/ 3d-view/ngl/3vta).[12,13]
Hình 1. Cơ chế thủy phân protein được xúc tác bởi protease serine/cysteine thực vật.
Downloaded by Nguy?n H?p (myhop23082001@gmail.com)





