



Preview text:
Chương 8 NGUYÊN TỬ
8.1. Nguyên tử Hiđro
8.2. Nguyên tử kim loại kiềm (biểu thức năng lượng, các dãy vạch quang phổ)
8.3. Mômen động lượng quỹ đạo và mômen từ quỹ đạo của electron. Hiệu ứng Zeeman
8.4. Spin của electron
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong nguyên tử Hiđro (r, , )
Xét chuyển động của electron trong z
nguyên tử Hiđro. Hàm sóng 𝝍 của electron e
là nghiệm của phương trình Schrodinger r - 0 2me y
(E U (r)) 0 + 2 x Với e2
U 4 r0 2 2 m e e (E ) 0 (*) 2 4 r 0
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong nguyên tử Hiđro
Giải phương trình Schrodinger ta có:
* Hàm sóng 𝝍 của electron trong nguyên tử Hiđro:
(r,,) R (r)Y (,) nlm nl lm
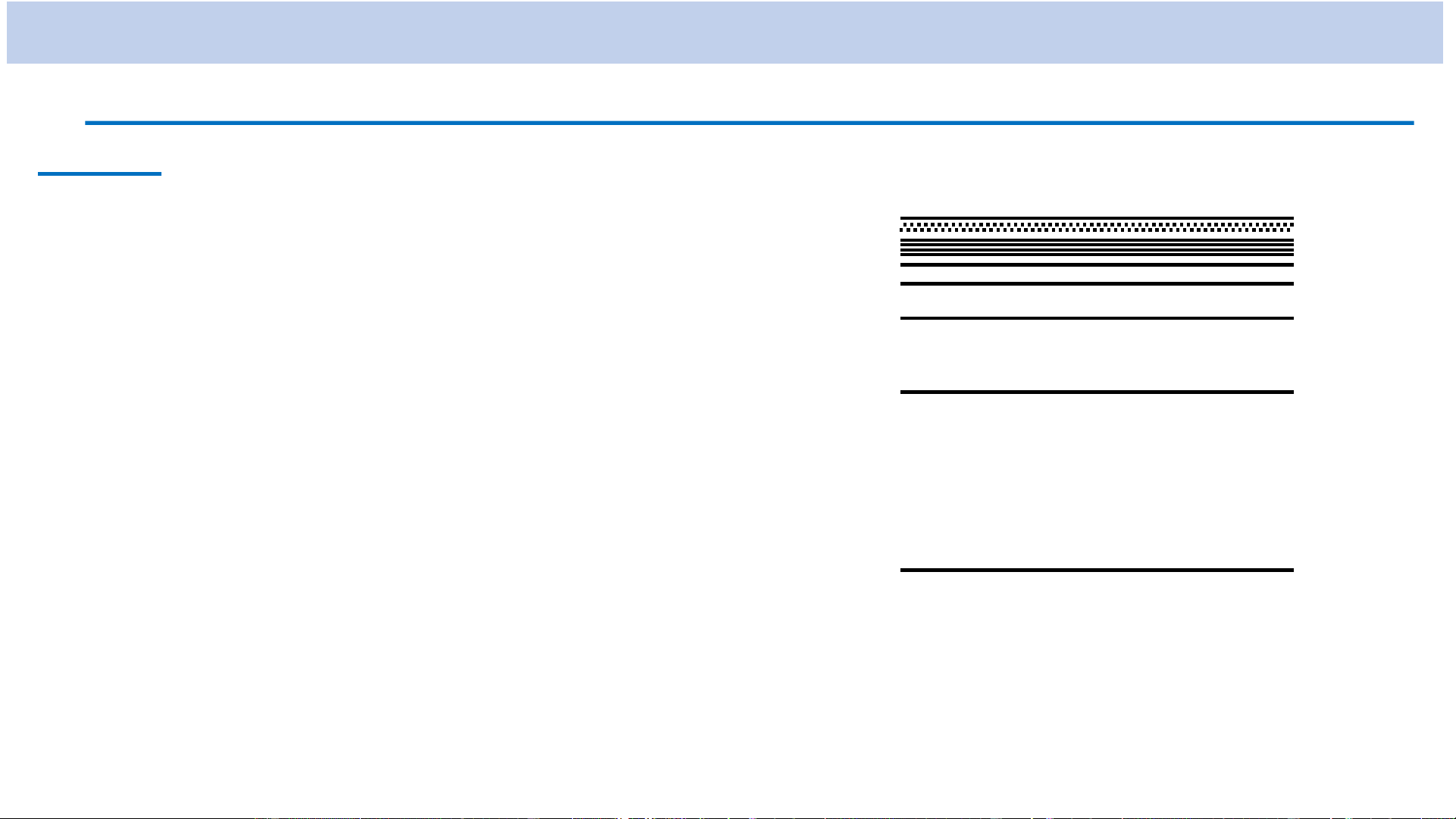
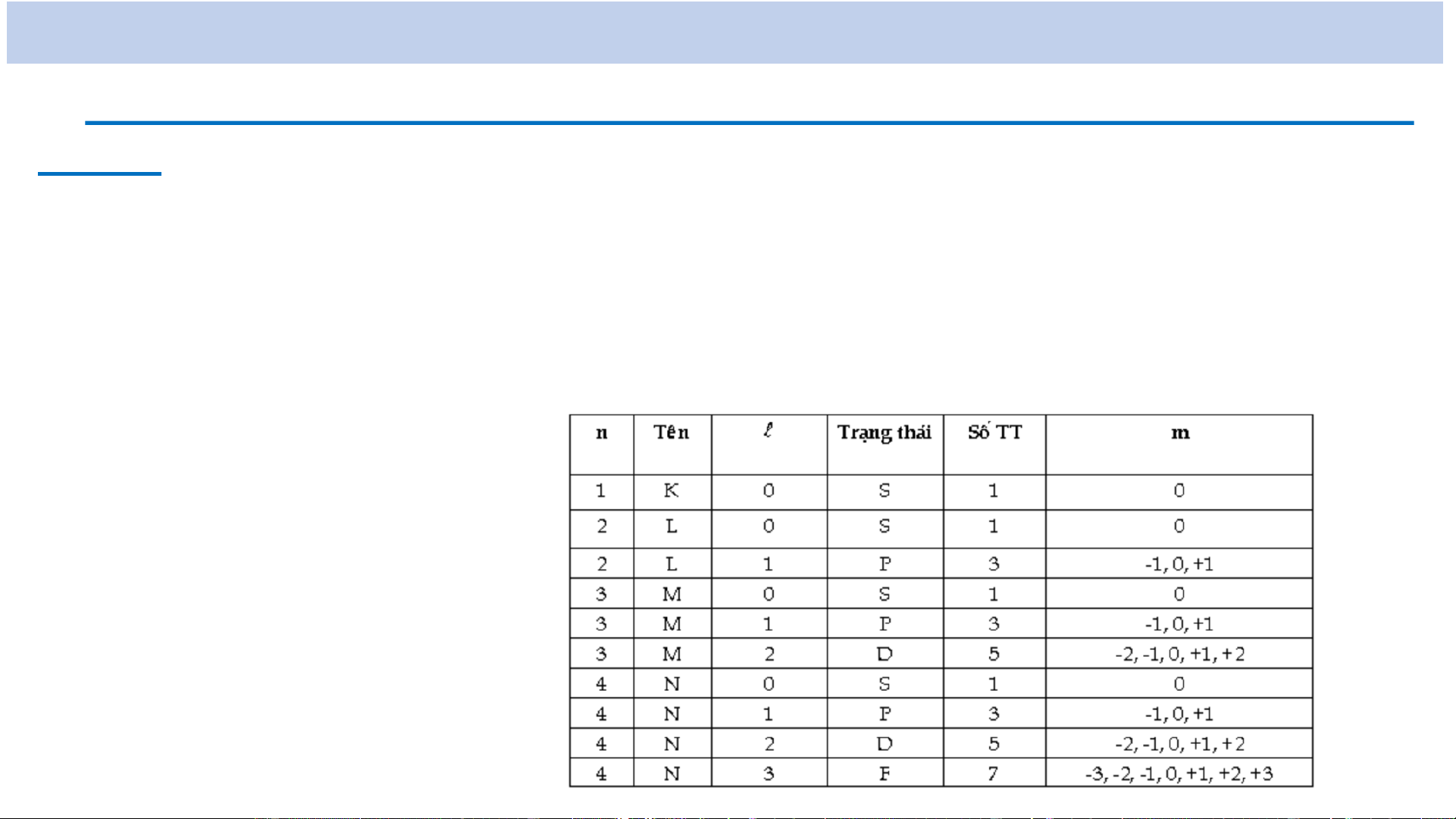
Trong đó n = 1, 2, 3, ...: số lượng tử chính
𝒍 = 0, 1, 2, ..., n-1: số lượng tử quỹ đạo m , 0 , 1 ,..., 2
l : số lượng tử từ
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong nguyên tử Hiđro Ví dụ:
(r,,) R (r)Y (,) 100 10 00 r 1 1 3/ 2 a0 2 R 2( ) e ; Y (4 ) 10 00 a0 4 2 0 a 53 , 0 Å 0 2 m e e
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong nguyên tử Hiđro
* Năng lượng của electron trong nguyên tử Hiđro: 1 m 4 e e E
(n = 1, 2, 3, ...: số lượng tử chính) n 2 n 2(4 )2 2 0 Rh E n 2 n 4 m e e 15 1 Với R , 3 27.10 s Hằng số Rydberg 2 3 4 (4 ) 0
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e)
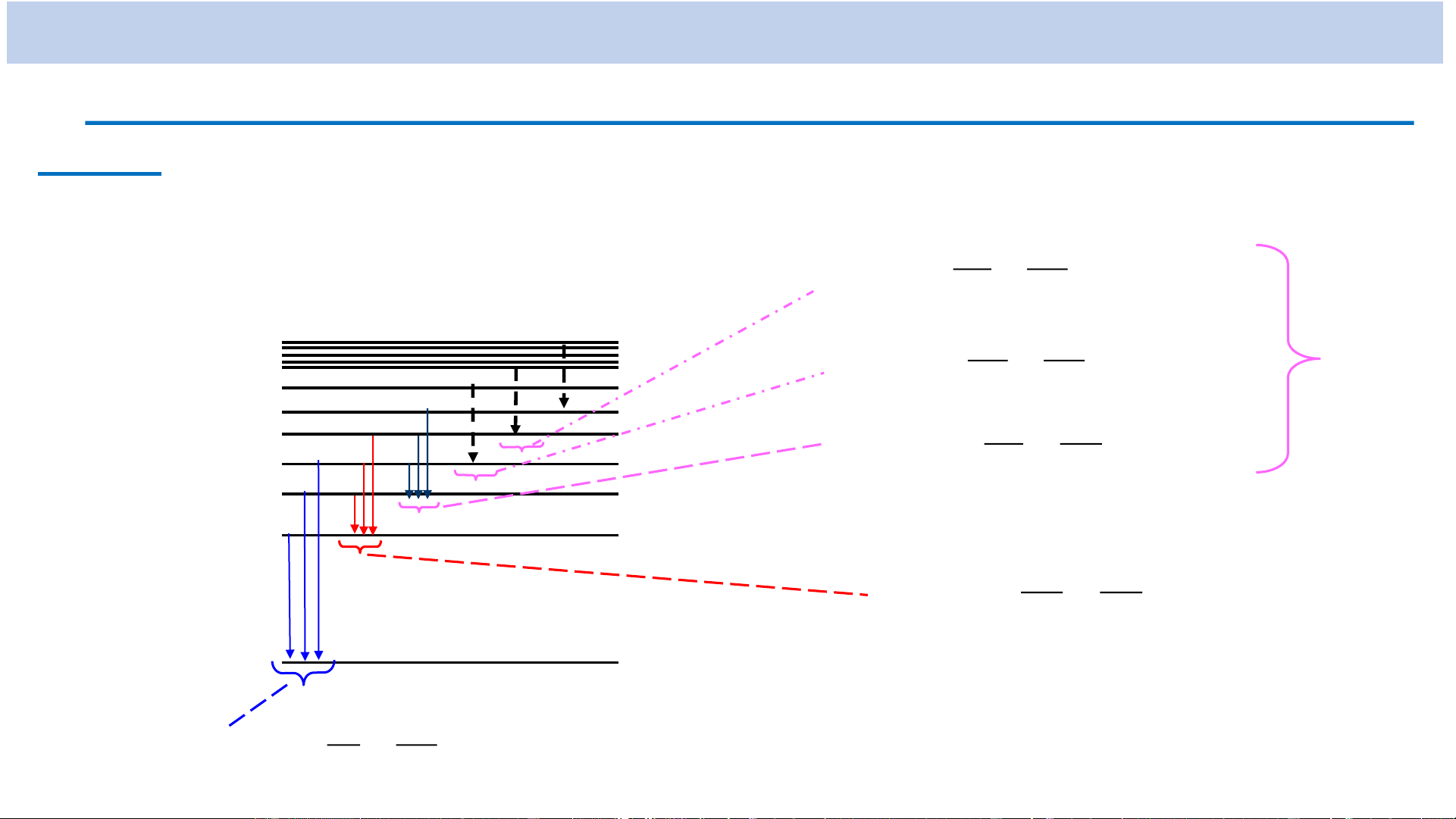
* Năng lượng của electron trong ntử H n=5
+ Năng lượng E n (n = 1, 2, 3, ...) O n=4 n N
→ Năng lượng biến thiên gián đoạn M n=3
→ Năng lượng bị lượng tử hóa L n=2
+ Năng lượng E < 0, năng lượng tăng n
theo số lượng tử chính n. + E
= E = - Rh = - 2,185.10-18J min 1 K n=1 = - 13,6eV
Sơ đồ các mức năng lượng
(mức năng lượng cơ bản)
+ Khi n → ∞ thì E → 0 n
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e)
* Năng lượng ion hóa của nguyên tử Hiđro
Năng lượng cần thiết để bứt electron ra khỏi nguyên tử
(Năng lượng cần thiết để đưa electron từ mức thấp nhất E đến mức E 1 ∞)
E = 0 - E = Rh = 2,185.10-18J = 13,6eV 1
* Độ suy biến của mức năng lượng En
+ Trạng thái lượng tử của e được mô tả bởi hàm sóng (r, , ) R (r).Y ( , ) n,,m n m
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e) Nhận thấy:
+ Ứng với mỗi giá trị của n (ứng với mỗi mức năng lượng E ) n
→ l có thể có n giá trị khác nhau (𝒍 = 0, 1, 2, ..., n-1)
+ Ứng với mỗi giá trị của l
→ m có thể có 2l + 1 giá trị khác nhau ( m , 0 , 1 ,..., 2 ) l
→ Với mỗi giá trị của n đã cho, có thể có n1 (2 )
1 1 3 ... (2n 2 ) 1
n trạng thái lượng tử 𝝍𝒏,𝒍,𝒎 0 khác nhau
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e)
→ Ứng với mỗi mức năng lượng E có n2 trạng thái lượng tử 𝛙 n 𝐧𝐥𝐦 khác
nhau → Mức năng lượng E suy biến bậc n2 n
+ Mức năng lượng E có 1 trạng thái 𝛙 1
𝟏𝟎𝟎: trạng thái cơ sở (cơ bản)
+ Mức năng lượng E (𝐧 ≥ 𝟐) suy biến bội n2: trạng thái kích thích n l trạng thái 0 s 1 p 2 d 3 f …..
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e)
* Cấu tạo vạch của quang phổ Hiđro
+ Khi bị kích thích e chuyển lên mức năng lượng cao hơn E (trạng thái n
kích thích) → Ở trạng thái kích thích trong thời gian ngắn
→ e chuyển về mức năng lượng thấp hơn En’
→ Phát ra năng lượng dưới dạng bức xạ điện từ (photon)
→ Theo định luật bảo toàn năng lượng:
𝑬𝒏 − 𝑬𝒏′ = 𝒉𝝂𝒏𝒏′ 𝟏 𝟏 𝝂𝒏𝒏′ = 𝑹( − ) 𝒏′𝟐 𝒏𝟐
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e) 1 1 R( Perfund ) n5 52 2 n i 1 1 oạ R( Brac ) ket ng n 4 2 2 O 4 n ng 1 1 N n=5 R( Pase ) n Hồ n=4 n3 2 2 M 3 n n=3 L n=2 1 1 R( Ba ) nme n 2 22 2 n n=1 K
Ánh sáng nhìn thấy 1 1 R( Liman ) Tử ngoại 1 n 12 2 n
8.1. Nguyên tử Hiđro
2. Các kết luận về nguyên tử Hiđro (năng lượng, trạng thái, xác suất tìm thấy e)
* Xác suất tìm thấy electron ở một trạng thái đã cho, trong thể tích V
| |2 dV | (r,,)|2 r2 sindrdd nm d𝝋 dr d𝜽
8.2. Nguyên tử kim loại kiềm
1. Năng lượng của electron trong nguyên tử kim loại kiềm - +
• Nguyên tử kim loại kiềm (Li, Na, K…): H
+ Cấu trúc có nhiều electron hơn nguyên tử hiđro
+ Có 1 electron ở lớp vỏ ngoài cùng (electron hóa trị) -
như nguyên tử hiđro + -
→ Năng lượng của e hóa trị trong nguyên tử kim loại - kiềm gồm: Li
+ Năng lượng tương tác giữa e hóa trị và hạt nhân - -
+ Năng lượng phụ gây bởi tương tác giữa e hóa trị và - - các e khác. + - - - -
→ Năng lượng của e hóa trị trong nguyên tử kim loại - - -
kiềm tính tương tự như trong nguyên tử H và thêm Na phần bổ chính
8.2. Nguyên tử kim loại kiềm
1. Năng lượng của electron trong nguyên tử kim loại kiềm Rh E n 2 (n x )
(n = 1, 2, 3, ...: số lượng tử chính 4 m e e 15 1 R , 3 27.10 s Hằng số Rydberg 2 3 4 (4 ) 0
x : Số hạng bổ chính Rydberg (
x l - số lượng tử quỹ đạo, loại nguyên tử))
8.2. Nguyên tử kim loại kiềm
1. Năng lượng của electron trong nguyên tử kim loại kiềm
E n, l
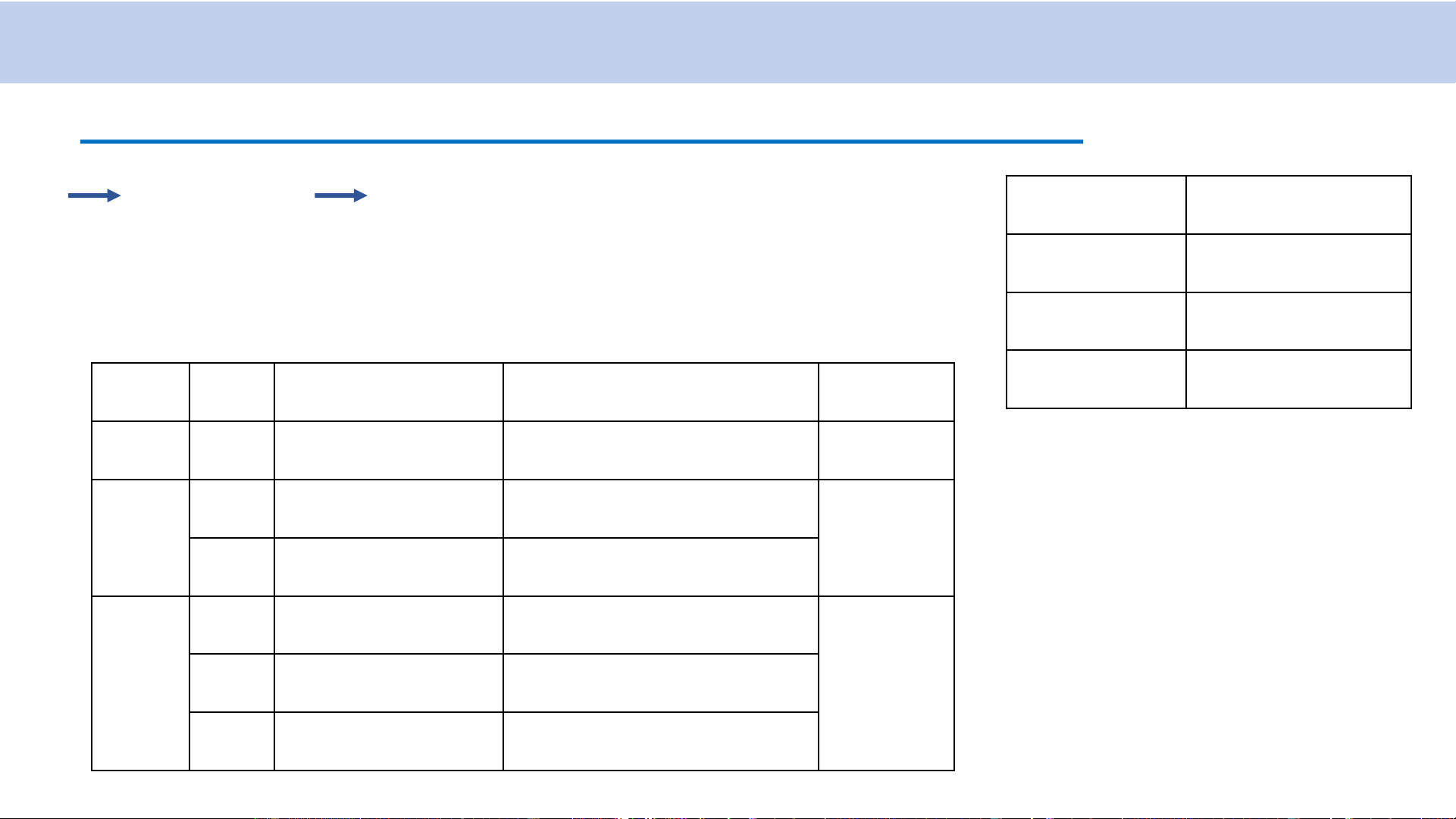
Kí hiệu các mức năng lượng: nX nl 𝐗 ≡ 𝑺 khi l = 0 𝐗 ≡ 𝑷 khi l = 1 𝐗 ≡ 𝑫 khi l = 2 𝐗 ≡ 𝑭 khi l = 3 n l
Trạng thái Mức năng lượng Lớp 1 0 1s 1S K Ví dụ: 0 2s 2S 2 L
Mức năng lượng 1P 1 2p 2P
có n = 1, l = 1 0 3s 3S 3 1 3p 3P M 2 3d 3D
8.2. Nguyên tử kim loại kiềm
2. Quang phổ của nguyên tử kim loại kiềm
+ Khi bị kích thích e hóa trị chuyển lên mức năng lượng cao hơn Enl
(trạng thái kích thích) → Ở trạng thái kích thích trong thời gian ngắn
→ e chuyển về mức năng lượng thấp hơn En’l’
→ Phát ra năng lượng dưới dạng bức xạ điện từ (photon)
Tuân theo quy tắc lựa chọn: Điện tử chuyển từ mức năng lượng cao
xuống mức năng lượng thấp hơn và ∆𝒍 = 𝒍 − 𝒍′ = ±𝟏
* Theo định luật bảo toàn năng lượng:
𝑬𝒏𝒍 − 𝑬𝒏′𝒍′ = 𝒉𝝂 𝟏 𝟏 𝝂 = 𝑹 − (𝒏′+𝒙𝒍′)𝟐 (𝒏 + 𝒙𝒍 )𝟐
∆𝒍 = 𝒍 − 𝒍′ = ±𝟏
8.2. Nguyên tử kim loại kiềm Mức năng lượng 1S
2. Quang phổ của nguyên tử kim loại kiềm Mức năng lượng 2S
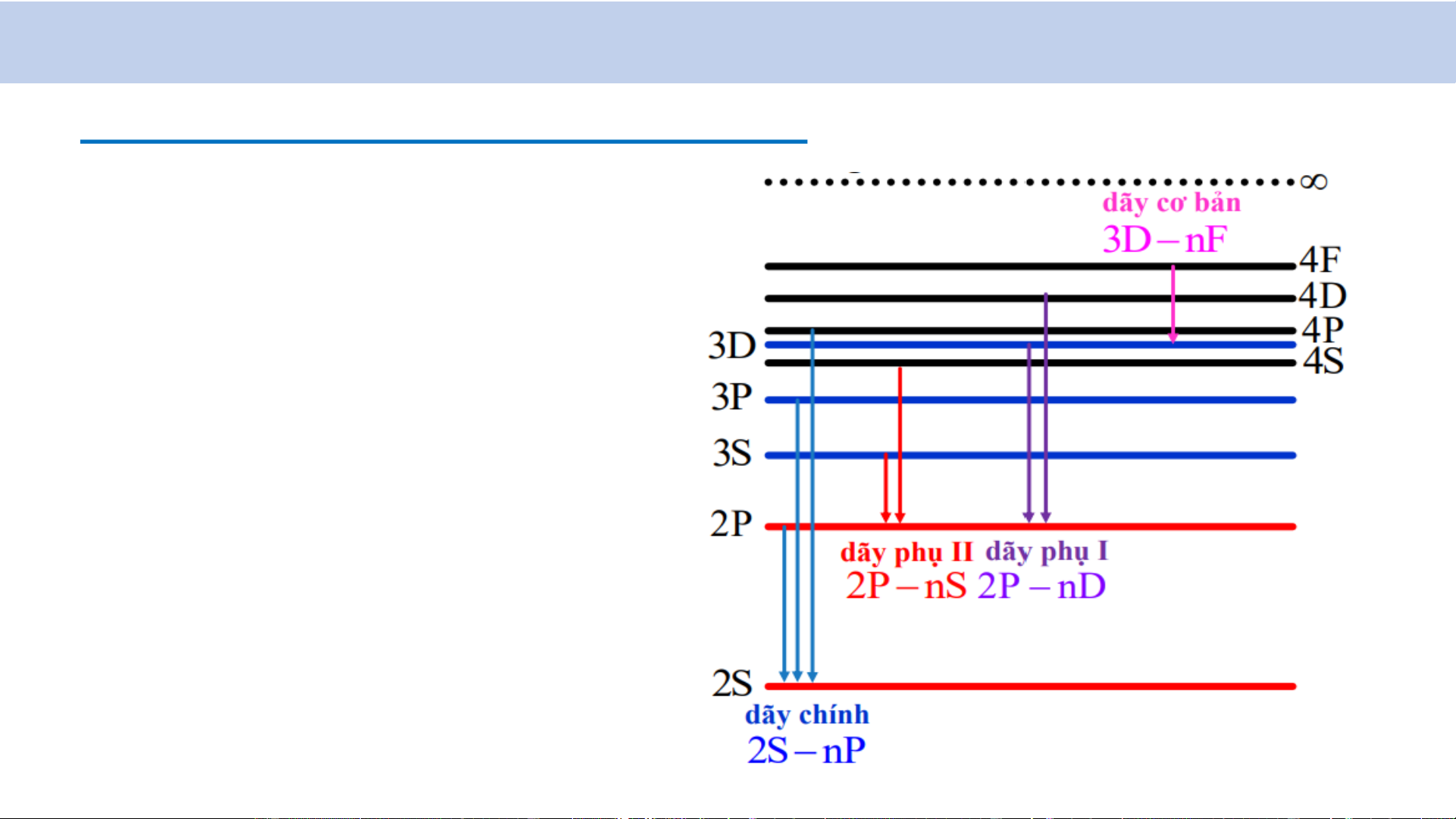
* Ví dụ: Xét nguyên tử Liti (Li; Z = 3). Cấu hình e: 1s2 2s1
- Theo quy tắc lựa chọn e hóa trị ở mức năng lượng cao hơn chuyển về mức:
+ 2S (l = 0): mức cao hơn chỉ có thể là mức nP (l = 1; n = 2, 3, 4…)
+ 2P (l = 1): mức cao hơn chỉ có thể là mức nS (l = 0; n = 3, 4…)
hay mức nD (l = 2; n = 3, 4…)
- Tần số của bức xạ điện từ phát ra:
𝒉𝝂 = 𝟐𝑺 − 𝒏𝑷 : Dãy chính
𝒉𝝂 = 𝟐𝑷 − 𝒏𝑺 : Dãy phụ II
𝒉𝝂 = 𝟐𝑷 − 𝒏𝑫 : Dãy phụ I
𝒉𝝂 = 𝟑𝑫 − 𝒏𝑭 : Dãy cơ bản
8.2. Nguyên tử kim loại kiềm
2. Quang phổ của nguyên tử kim loại kiềm -
Sơ đồ các mức năng lượng của Li
8.3. Mômen động lượng quỹ đạo và mômen từ quỹ đạo của electron. Hiệu ứng Zeeman
1. Mô men động lượng quỹ đạo của electron (orbital)
• Mô hình bán cổ điển Bohr: Trong nguyên tử Hiđro e coi là chất điểm
chuyển động với vận tốc 𝒗 trên quỹ đạo tròn quanh hạt nhân. Mô men
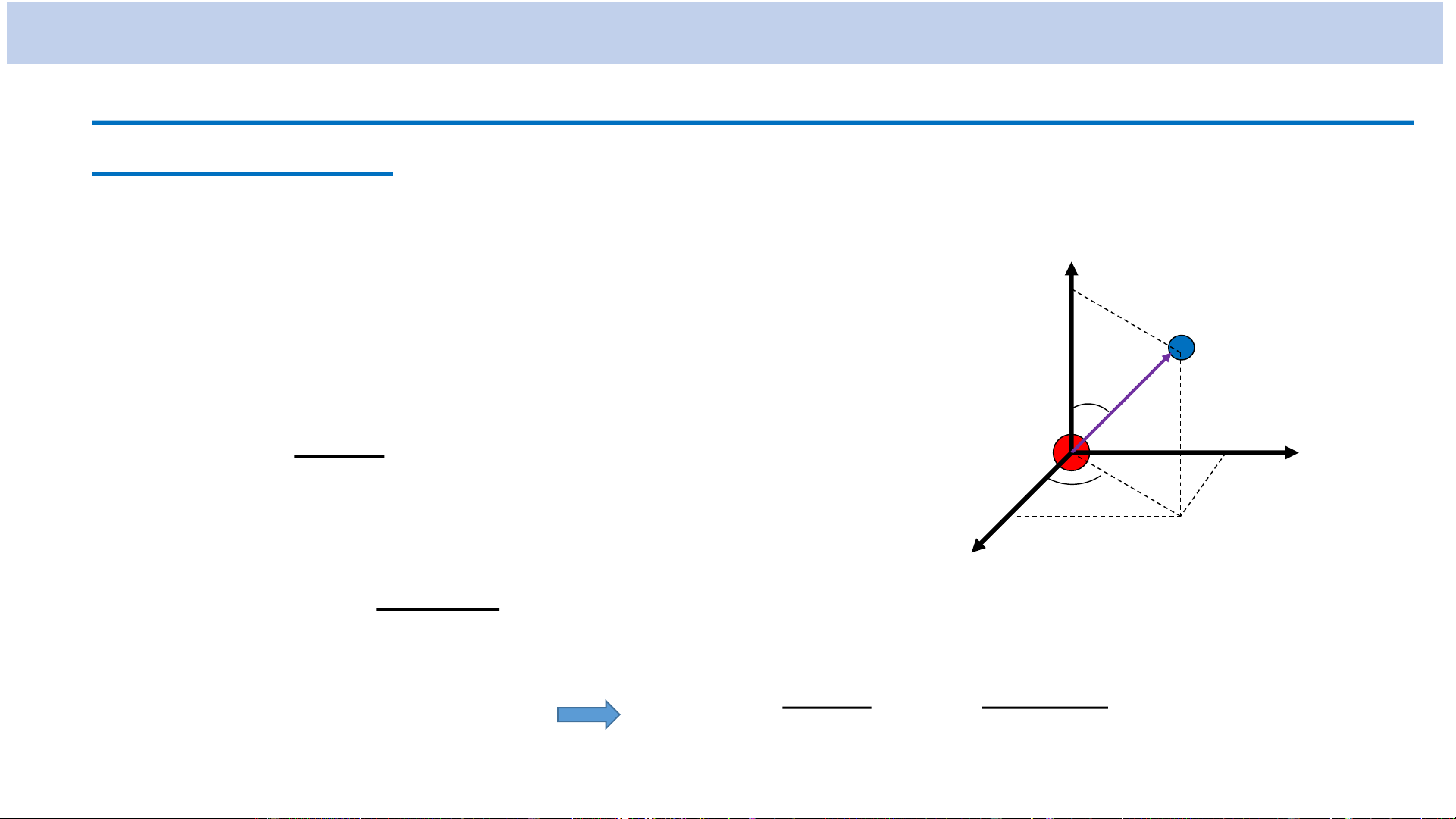
động lượng của e: 𝑳 = 𝒓 ∧ 𝒎𝒗
• Cơ học lượng tử: Electron quay quanh hạt nhân không có quỹ đạo xác
định → Ở mỗi trạng thái, mô men động lượng 𝑳:
+ Không có hướng xác định
+ 𝑳 = 𝑳 xác định và nhận các giá trị gián đoạn 𝑳 = ℏ 𝒍(𝒍 + 𝟏)
𝒍 = 𝟎, 𝟏, 𝟐, … , 𝒏 − 𝟏 : số lượng tử quỹ đạo
8.3. Mômen động lượng quỹ đạo và mômen từ quỹ đạo của electron. Hiệu ứng Zeeman
1. Mô men động lượng quỹ đạo của electron (orbital)
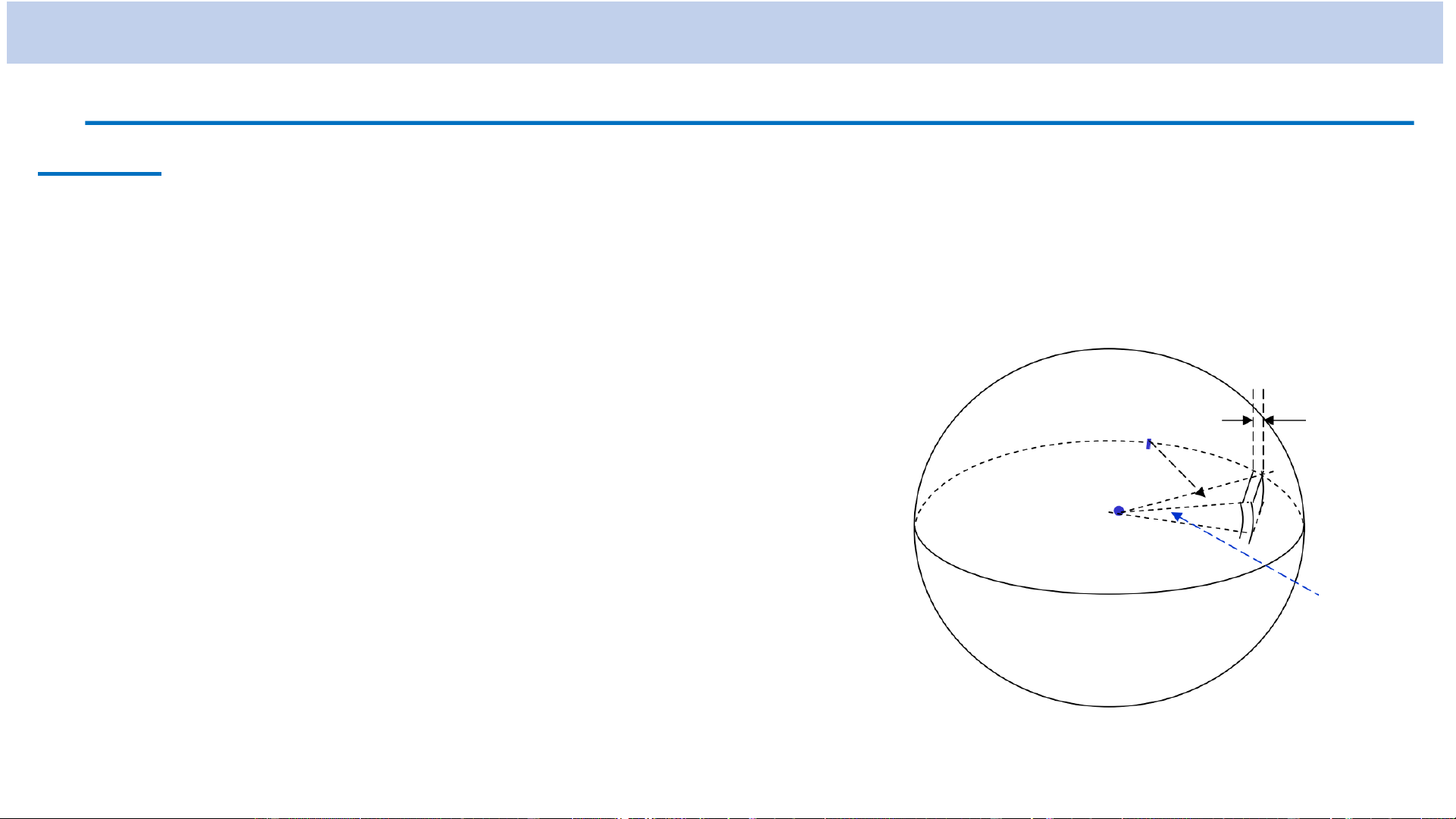
+ Hình chiếu của 𝑳 lên phương z bất kì (L ) xác định và nhận các giá trị z gián đoạn 𝑳𝒛 = 𝒎ℏ m , 0 , 1 ,..., 2
l : số lượng tử từ
(với mỗi trị số cho trước của l có 2l + 1 trị số của m)
→ Mômen động lượng 𝑳 và hình chiếu của nó lên phương z bất kì (L ) z
đều bị lượng tử hóa.
Ví dụ: Khi 𝒍 = 𝟏 𝒕𝒉ì 𝑳 = 𝟐ℏ 𝒗à 𝑳𝒛 = 𝟎; ±ℏ.
Khi l = 2 thì 𝑳 =
𝟔ℏ 𝒗à 𝑳𝒛 = 𝟎; ±ℏ; ±𝟐ℏ