



Preview text:
PHÚC TRÌNH Dược – K48
BÀI: PHẢN ỨNG ESTER HÓA & ĐỒNG PHÂN CIS-TRANS A. PHẢN ỨNG ESTER HÓA I. DỤNG CỤ - HÓA CHẤT
1. Dụng cụ, hóa chất Dụng cụ Hóa chất
Bình cầu đáy phẳng 250ml 1 Alcol n-butyl Becher 100ml 1 Acid acetic Erlen 100ml 1 H2SO4 đđ Ống nhỏ giọt 1 NaHCO3 bão hòa Bình tia 1 Na2SO4 khan Đũa thủy tinh 1 Đá bọt Mặt kính đồng hồ 1 Nước cất Bình lóng 100ml 1
2. Thiết bị thí nghiệm
- Bếp điện, cân kỹ thuật - Hệ thống đun hoàn lưu
- Hệ thống chưng cất thường II. THỰC HÀNH
1. Giai đoạn 1: Điều chế ester
Cho hỗn hợp gồm: 20ml acid acetic và 20ml C4H9OH vào bình cầu đáy tròn. Sau đó cho
từ từ từng giọt (và lắc kỹ) 5ml H2SO4 đđ (Chú ý: Cho từ
từ acid H2SO4 đđ bằng ống nhỏ giọt,
không đổ hết vào cùng một lúc) vào hỗn hợp phản ứng trên. Thêm vài viên đá bọt vào bình
phản ứng và đun hoàn lưu nhẹ trong khoảng 30-35 phút. (Chú ý: Đun sôi nhẹ - không quá
mãnh liệt), tắt bếp (không tháo hệ thống sinh hàn ngay), để nguội hỗn hợp.
2. Giai đoạn 2: Tinh chế và làm khan ester
Cho hỗn hợp ester vào bình lóng trên giá, thêm vào bình lóng 50ml nước cất để rửa ester,
lắc đều tay rồi để yên bình lóng cho hai lớp chất lỏng tách khỏi nhau, tách bỏ lớp nước phía dưới.
Thêm vào bình lóng 30ml dung dịch NaHCO3 bão hòa, đợi hết bọt khí rồi lắc đều bình
lóng. Luôn xả khóa một lần sau hai lần lắc để điều hòa áp suất trong bình, để yên bình lóng
cho hai lớp chất lỏng tách khỏi nhau, tách bỏ lớp nước muối phía dưới (rửa 3 lần với dd NaHCO3 bão hòa: 30ml x 3)
Cho ester vào 1 erlen khô rồi thêm từ từ Na2SO4 khan cho đến khi hút hết nước. Lắc nhẹ
erlen cho đều rồi để yên vài phút.
3. Giai đoạn 3: Chưng cất acetat n-butyl Dược – K48
Cho chất lỏng này vào bình cầu chưng cất có chứa sẵn một ít đá bọt. Tiến hành chưng cất
để lấy ester tinh khiết có độ sôi khoảng từ 1200C – 1300C.
Ester thu được chia làm ba giai đoạn:
+ Giai đoạn 1: 300C – 1200C: thu được ~2,5ml ester
+ Giai đoạn 2: 1200C – 1300C: thu được ~3ml ester (ta lấy ester thu được ở giai đoạn 2 vì
ester thu được ở giai đoạn này là tinh khiết nhất)
+ Giai đoạn 3: phần nhiệt độ cuối cùng: thu được 3ml ester III. CÂU HỎI
1. Dựa vào hằng số cân bằng K, tính giá trị C. Từ đó chứng minh rằng muốn cho hiệu
suất phản ứng eter hóa cao phải dựa vào những yếu tố nào?
CH3CH2CH2CH2OH + CH3COOH CH3COOCH2CH2CH2CH3 + H2O Ban đầu: C1 C2 0 0 Phản ứng: x x x x
Sau phản ứng: C1 -x C2 -x x x nCH3COOH=0,35 mol => C1 =
n(C4H9OH) = 0,219 mol => => C2 =
x là nồng độ mol phản ứng của C4H9OH (x < 10,95) Ta có: K=
là nồng độ ester lúc cân bằng
Các yếu tố ảnh hưởng đến cân bằng và hiệu suất: nồng độ, nhiệt độ, áp suất, xúc tác, diện tích tiếp xúc. Muốn tăng hiệu suất:
+ Tăng nhiệt độ, cho chất xúc tác trước
+ Lắc đều để tăng diện tích tiếp xúc
+ Tăng nồng độ ancol, acid, giảm lượng nước (H2SO4đ háo nước) để cân bằng chuyển dịch
theo chiều thuận tạo ester theo nguyên lí Le Chatelier.
2. Cho biết công dụng của NaHCO3 bão hòa? Có thể thay thế bằng NaHCO3 bằng
Na2CO3 hay NaOH được không?
NaHCO3 dùng để trung hòa acid dư, tạo môi trường trung tính. Không thể dùng Na2CO3
hay NaOH vì chúng tạo môi trường base mạnh.
3. Tính hiệu suất quá trình tổng hợp ester. Dược – K48 Cho d: C4H9OH = 0,81; CH3COOH = 1,05; CH3COOC4H9 = 0,88
CH3CH2CH2CH2OH + CH3COOH CH3COOCH2CH2CH2CH3 + H2O Ta có:
D= => m=D x V => n(C4H9OH)= nCH3COOH=
Số mol ester lí thuyết : nester lt =0,219 mol
Khối lượng ester theo lý thuyết: mester lt =116 x 0,219= 25,404g
Thể tích ester theo lí thuyết: Vester lt =
Thể tích ester thu được thực tế: Vester tt = 3 ml
Hiệu suất phản ứng: H=
4. Quan sát và giải thích sự thay đổi nhiệt độ trong quá trình chưng cất. B. ĐỒNG PHÂN CIS-TRANS IV. DỤNG CỤ - HÓA CHẤT
1. Dụng cụ, hóa chất Dụng cụ Hóa chất Ống đong 10ml, 100ml 1 Anhydreic maleic Erlen 250ml 2 HCl đđ Bình tia 500ml 1 Nước cất Đũa thủy tinh 1 Đá bọt Mặt kính đồng hồ 2 Ống nhỏ giọt 1 Giấy lọc 1
2. Thiết bị thí nghiệm
- Bếp điện, cân kỹ thuật
- Hệ thống lọc áp suất thấp - Hệ thống đun hoàn lưu V. THỰC HÀNH
Dùng erlen 250ml, hòa tan 10gr anhydric maleic với 10ml nước và đem đi đun nóng. Khi
anhydric maleic tan hết, để nguội erlen rồi đem làm lạnh (ngâm trong chậu nước), acid maleic
sẽ kết tinh. Đem lọc dưới áp suất kém bằng phễu buchner để lấy riêng tinh thể acid maleic.
Tinh thể to, óng ánh và trắng tinh.
Lượng tinh thể acid maleic thu được: 5,83g Dược – K48
Lấy phần dung dịch qua lọc (nước cái, có chứa acid maleic hòa tan) vào một erlen 250ml,
thêm vào đó 10ml dd HCl đđ.
Đun hoàn lưu nhẹ hỗn hợp cho đến khi vừa xuất hiện tinh thể acid fumaric trong dd nóng
thì ngưng đun. Chú ý không để hỗn hợp nguội mới tháo hệ thống sinh hàn ra. Để hỗn hợp
nguội rồi lọc dưới áp suất thấp kém bằng phễu buchner. Tinh thể thu được có màu trắng ngà, nhỏ và mịn.
Lượng tinh thể acid fumaric thu được: 2,06 VI. CÂU HỎI
1. So sánh độ bền của acid maleic và acid fumaric? Giải thích.
Acid fumaric bền hơn acid maleic do đồng phân trans có tính đối xứng cao hơn đồng phân
cis nên mạng tinh thể xếp chặt hơn dẫn đến nhiệt độ nóng chảy cao hơn.
2. So sánh độ tan của hai acid trên, làm sao để biết chất kết tinh trong nước cái là acid fumaric? Giải thích.
Acid maleic tan trong nước nhiều hơn acid fumaric. Do giá trị momen lưỡng cực của acid
maleic lớn hơn nhiều so với của acid fumaric. Acid maleic có 2 nhóm –COOH nằm cùng phía
nên momen lưỡng cực tạo thành theo quy tắc hình bình hành có giá trị µ1>0, còn acid fumaric
có 2 nhóm –COOH khác phía nên tổng hợp momen lực là µ2=0 vì vậy µ1>µ2 nên acid maleic
phân cực hơn acid fumaric vì thế tan tốt hơn trong nước.
3. Sau đây là những trị số pK của acid maleic và acid fumaric,
Acid maleic: pK1 = 2.0, pK2 = 6.3
Acid fumaric: pK1 = 3.0, pK2 = 4.5
Giải thích tại sao pK1 của acid maleic lại nhỏ hơn trị số tương ứng với của acid fumaric,
pK2 của acid maleic lớn hơn trị số tương ứng của acid fumaric.
Acid maleic tạo liên kết hiđro nội phân tử làm liên kết O – H còn lại phân cực nên H dễ bị
đứt hơn. Hơn nữa sau khi phóng thích H+ anion còn lại được ổn định hơn bởi liên kết hiđro
nội phân tử. Acid fumaric không tạo được liên kết hiđro nội phân tử nên H+ trong nhóm O –
H khó đứt hơn nên tính acid nấc thứ nhất của acid fumaric yếu hơn acid maleic hay pK1 của
acid fumaric yếu hơn của acid maleic. Sau khi phóng thích H+ thứ nhất, nguyên tử H còn lại
của maleic bị giữ chặt hơn do liên kết hiđro nội phân tử nên khó phóng thích H+ hơn nấc thứ
nhì của acid fumaric. Vì vậy tính acid thứ nhì của acid fumaric mạnh hơn acid maleic hay
pK2 của acid fumaric lớn hơn của acid maleic.
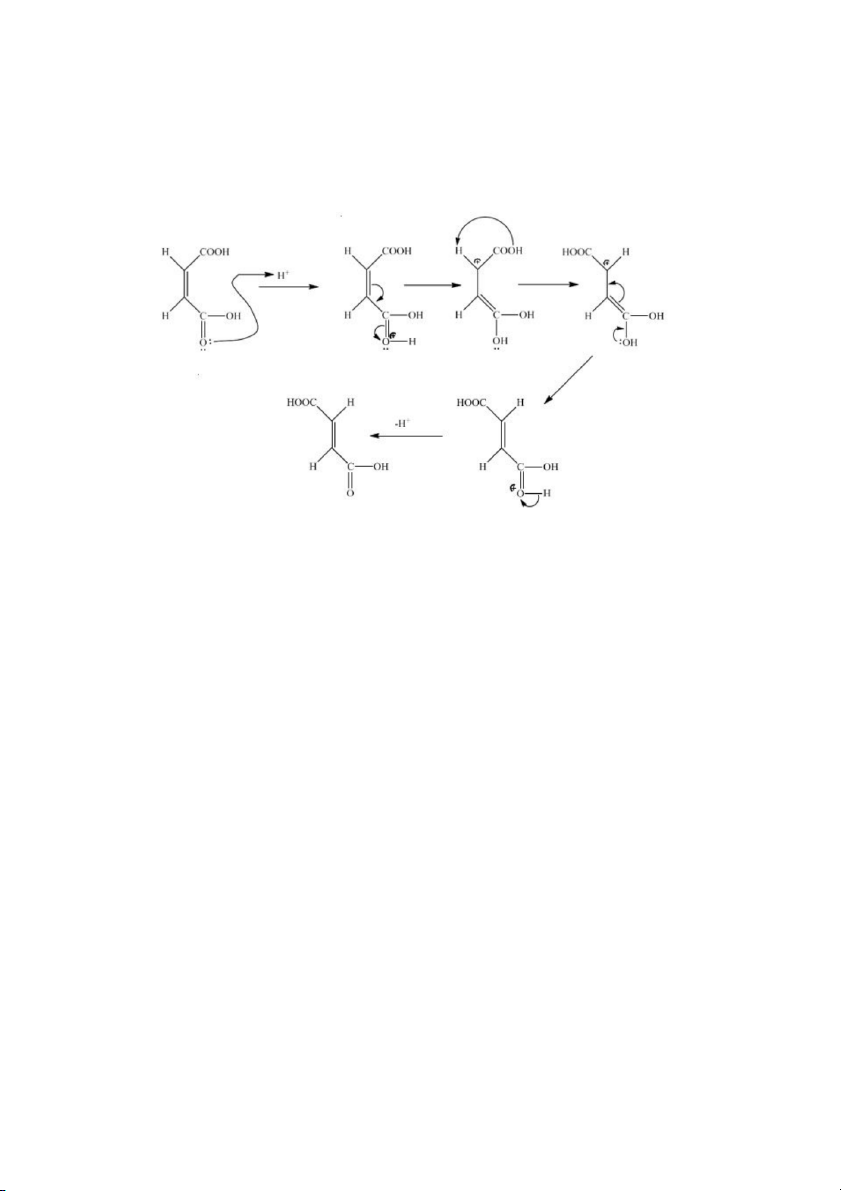
4. Trình bày cơ chế chuyển hóa từ acid maleic sang acid fumaric trong môi trường acid.
Một phân tử HCl cho phản ứng cộng 1,4 với hệ thống liên hợp để cho ra một
Dược – K48 chất
chuyển tiếp, cơ cấu của chất chuyển tiếp này không còn rắn chắc như cơ cấu của một acid
maleic và do đó có thể xoay đi để có vị trí trans bền hơn. Sau đó các nguyên tử bị loại ra để
nối đôi tái lập trở lại, cho ra acid fumaric.




