





Preview text:
5/3/2021 Một số định nghĩa:
Khi xét tính chất của các nguyên tố nhóm A và
hợp chất của chúng, chúng ta đã gặp một số
phản ứng tạo phức, ví dụ: Phøc chÊt
X(OH)2 + 2NaOH = Na2[X(OH)4] , X- Pb, Sn SnO2+ 4HCl = SnCl4 + 2H2O SnCl4 + 2HCl = H2[SnCl6] 2Al + 2NaOH +6H2O = 2Na[Al(OH)4] + 3H2 1 2
- Chất có khả năng tạo phức là các kim loại Al, 1. Phức chất:
Pb, Sn chúng đều là các kim loại nhóm A, nhưng
có đặc điểm là có các obitan trống ở các phân lớp
Phức chất là hợp chất phối trí, mà phân tử 3d hoặc 4d hoặc 5d.
của nó chứa ion phức. Ion phức bao gồm
nguyên tử hay ion được gọi là nhân trung
- Khả năng tạo phức của các kim loại chuyển tiếp
tâm, bao quanh nó là các nguyên tử, phân tử
lớn hơn nhiều so với các kim loại nhóm A vì
chúng có nhiều obitan hoá trị và có nhiều obitan
hay ion liên kết với nó được gọi là ligand hay
trống và có độ âm điện lớn hơn các kim loại kiềm
phối tử. Số phối tử thường lớn hơn hoá trị
và kiềm thổ nên rất có khả năng nhận cặp
electron và là chất tạo phức tốt. của nhân trung tâm. 3 4 1 5/3/2021 Ví dụ 1: Ví dụ 2:
Phân tử phức chất Na[Al(OH)4] chứa ion phức
Phân tử phức chất [Co(NH3)6]Cl3 chứa ion
[Al(OH)4]- , Al3+ là ion tạo phức và liên kết với phức [Co(NH nó là 4 nhóm OH-
3)6]3+, trong đó ion tạo phức là
Co3+ liên kết với 6 phối tử NH3 - -HO OH-
Ví dụ 3: [Ni(CO)4], chất tạo phức là nguyên Al
tử Ni liên kết với 4 phối tử CO -HO OH-
Như vậy phức chất có thể là cation, anion hay nguyên tử 5 6
* Cấu tạo của phức chất:
Như vậy phức chất có thể là cation, anion hay nguyên tử 7 8 2 5/3/2021
Ví dụ 1: Các phức có cấu tạo: [Co(NH3)6]Cl3
+ Cầu nội có thể là phân tử trung hoà về điện, [Co(NH3)5Cl]Cl2
không phân ly trong dung dịch: cầu nội cầu ngoại
Ví dụ: [Co(NH3)3Cl3], [Ni(CO)4], [B(NH3)F3] trong
trường hợp này phức chất không có cầu ngoại
+ CÇu néi cña phøc cã thÓ lµ cation VÝ dô 2:
+ Nhân trung tâm có thể là ion như Co3+, Al3+,… hay [Al(H
là nguyên tử kim loại như Co, Al, Zn, Ni. 2O)6]Cl3,
[Zn(NH3)4]Cl2, [Co(NH3)6]Cl3, [Pt(NH3)4]2+, [Ni(NH3)6](NO3)2
+ Phối tử có thể là các anion như OH-, F-, Cl-, Br-, I-,
+ CÇu néi cã thÓ lµ anion: CN-, NO - 2- 2-
2 , CO3 , C2O4 , …hay có thể là phân tử VÝ dô 3:
như NH3, H2O, CO, NO,…hay phân tử hữu cơ như H NH
2[SiF6], K2[Zn(OH)4], K3[PbI4], Na3[AlF6], [Ni(CN)4]2-,[PtCl4]2- 2CH2CH2NH2, (NH2)2CO … 9 10 -Ví dụ:
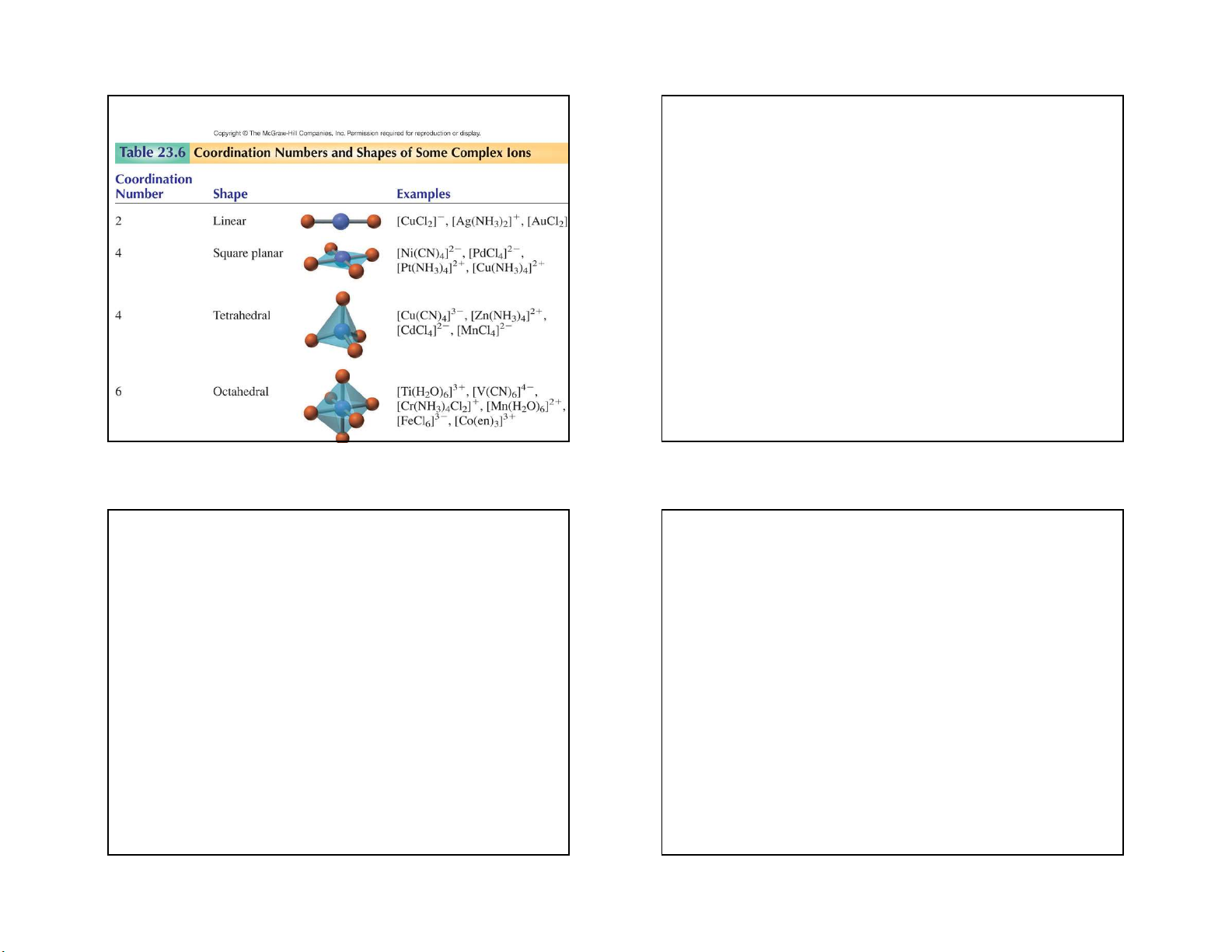
2. Số phối trí của nhân trung tâm:
+ Ni2+ có số phối trí là 6 trong ion [Ni(NH3)6]2+ hoặc có số
- Số phối trí của nhân trung tâm là số liên kết của nhân
phối trí là 4 trong ion phức [Ni(CN)4]2-
trung tâm liên kết với các phối tử.
+ Một số nhân trung tâm có số phối trí không đổi như
Cr3+, Co3+, Pt4+ và đều có số phối trí là 6. Hiện nay chưa
- Đa số nhân trung tâm có số phối trí biến đổi phụ thuộc
có lý thuyết hoàn chỉnh tiên đoán chính xác số phối trí
vào bản chất của chất tạo phức, của phối tử, số oxi hoá,
của nhân trung tâm, nhưng số phối trí thường gặp là 4 và
bản chất của dung môi, phụ thuộc vào nồng độ, nhiệt độ 6. và cầu ngoại. 11 12 3 5/3/2021
3. Dung lượng phối trí của phối tử: 2+ H H2 2
- Dung lượng phối trí của phối tử là số liên kết của H2C N N CH2
một phối tử liên kết với nhân trung tâm. Cu
Ví dụ: OH-, Cl-, I-, F-, NH3, CN-…trong các ví dụ trên H2C N N CH
có dung lượng phối trí bằng 1. 2 H2 H2
-Phối tử có dung lượng phối trí bằng 1 là phối tử đơn càng.
Mỗi phân tử etilenđiamin có 2 nguyên tử liên kết với
-Phối tử có dung lượng phối trí lớn hơn 1 là phối tử
nhân trung tâm. Khi phối tử đa càng liên kết với nhân
đa càng, ví dụ: etilenđiamin H
trung tâm sẽ tạo thành vòng và phức chất chứa phối 2N-CH2-CH2-NH2 có
dung lượng phối trí bằng 2 thể hiện trong phức sau:
tử đa càng được gọi là phức chất vòng. 13 14
5. Cách gọi tên các phức chất:
4. Cách gọi tên các phối tử thường gặp:
* Phức chất trung hoà: chỉ gồm một từ, bắt đầu CH3COO-: axetato H2O: aqua
bằng số và tên của phối tử, sau đó là tên của nhân CN- : xiano NH3: ammoni
trung tâm với chỉ số di, tri (trong trường hợp nhiều Cl- : clo CO: cacbonyl nhân) NO - : Ví dụ: 2 nitrito NO: nitrozin CO 2- [Al 3
: cacbonato NH2CH2CH2NH2: etylendiamin 2Cl6] – hexaclodialuminum OH- : hydroxyl (NH
[Ni(CO)4] – tetracacbonylnickel 2)2CO: cacbamid [Co SO 2-
2(CO)8] – octacacbonyldicoban 3 : sunfito C 2- : 2O4 oxalato
* Phức chất cation: bao gồm số và tên của phối tử và tên
của nguyên tố tạo phức
[Ag(NH3)2]+ - cation diamin bạc (I)
[Mn(H2O)6]2+ - cation hexaaqua mangan (II)
[Hg2(H2O)2](NO3)2 - nitrat diaqua di thuy ngan (II+) 15 16 4 5/3/2021
Thuyết liên kết hoá trị giải thích liên kết hoá học
* Phức chất anion: bao gồm số và tên của phối tử và trong phức chất
tên của nguyên tố tạo phức+ at và chỉ số số oxi hoá
1. Thuyết liên kết hoá trị: [BF4]- Tetrafloborat (III) ion
Thuyết axit-bazơ của Lewis ra đời năm 1927.
[Fe(CN)6]3- - hexaxiаnоferrat (III)- ion K
- Axit là phần tử nhận cặp electron hoá trị còn Bazơ
2[HgI4] – Tetariot thuy ngan (II) kali
là phần tử cho cặp electron hoá trị, ví dụ: F F F B + :NH F B 3 = NH3 F F 17 18
- Dựa vào thuyết liên kết hoá trị để giải thích liên kết Ví dụ 1:
hoá học trong các hợp chất phức chất.
Sự tạo thành ion phức [Co(NH3)6]3+, ion Co3+ kết hợp với 6 phân tử NH -Theo thuyết này:
3 tạo thành cation phức hình
bát diện nhờ 6 liên kết cho-nhận giữa các electron
+ Liên kết tạo thành trong phức chất là liên kết cho-
tự do của các phân tử NH3 và các obitan lai hoá
nhận giữa cặp electron tự do của phối tử và obitan
trống d2sp3 của ion Co3+ (3d6) được tạo thành do
trống của nhân trung tâm. Liên kết cho-nhận là liên
sự lai hoá của 2 obitan 3d, 1 obitan 4s và 3 obitan
kết cộng hoá trị và mỗi liên kết cho-nhận ứng với một 4p.
vị trí phối trí (một liên kết ).
+ Kết hợp với khái niệm lai hoá của Pauling, những
obitan trống đó phải là những obitan lai hoá của
nhân trung tâm mới có thể tiếp nhận được những
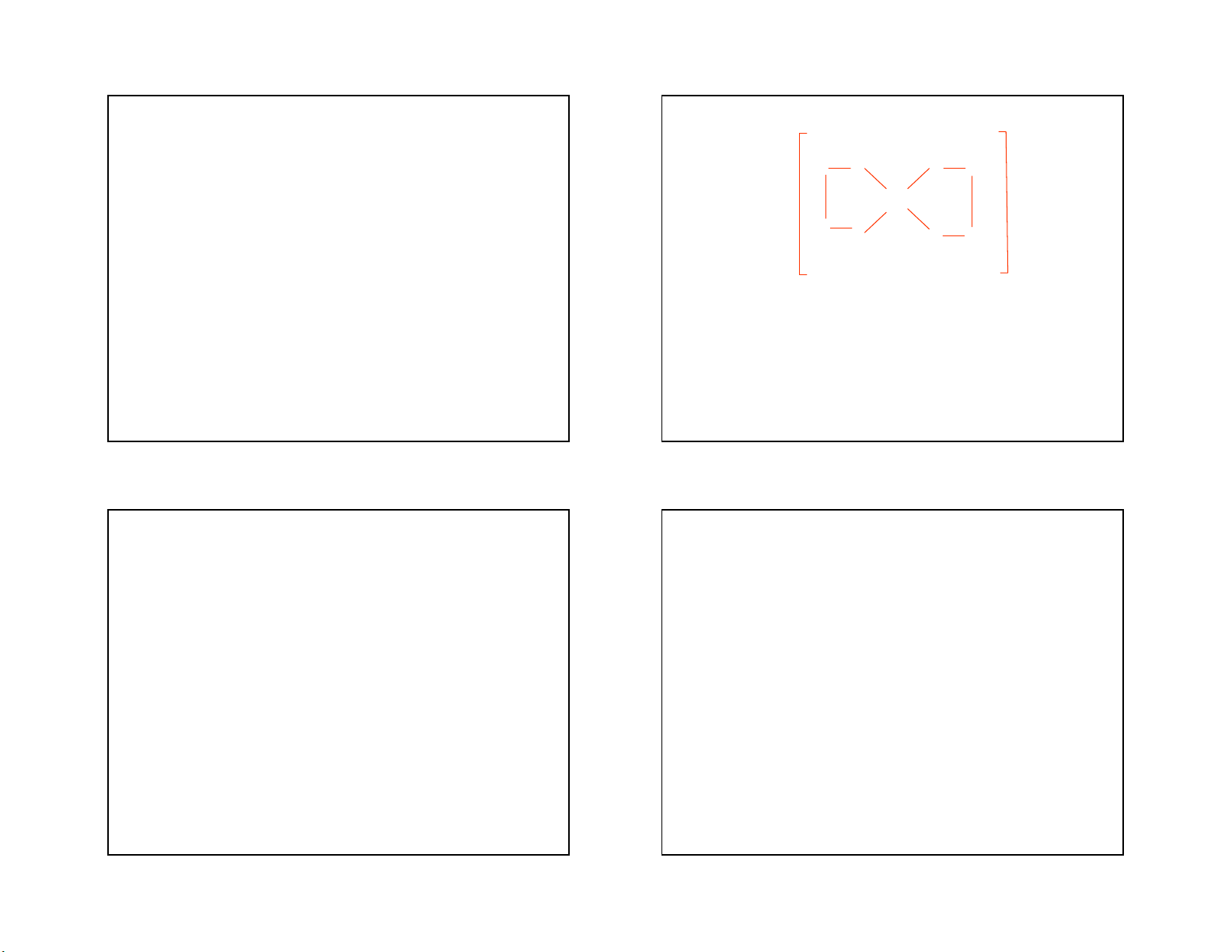
cặp electron của phối tử 19 20 5 5/3/2021 Ví dụ 2: [CoF
Sự lai hoá d2sp3 của các obitan hoá trị của ion Co3+, 6]3-
sự lai hoá này có được do 4e độc thân ở 3d phải
Ion phức [CoF6]3- được hình thành hơi khác so với
ghép cặp để giải phóng 2 obitan trống, đây được
ion [Co(NH3)6]3+, trong trường hợp này nhân trung
gọi là sự lai hoá trong. Loại phức này chứa ít hoặc
tâm là Co3+ có lai hoá sp3d2, tức là các obitan 3d ở
không chứa các electron độc thân so với nhân trung
lớp trong không tham gia lai hoá mà xảy ra sự lai
tâm ở trạng thái tự do, nên được gọi là phức chất
hoá của 1 obitan 4s, với 3 obitan 4p và 2 obitan 4d.
spin ghép cặp hoặc phức chất spin thấp hoặc phức Đây là sự lai hoá ngoài chất obitan trong.
Ion [Co(NH3)6]3+ không có electron độc thân nên nó có tính nghịch từ 21 22
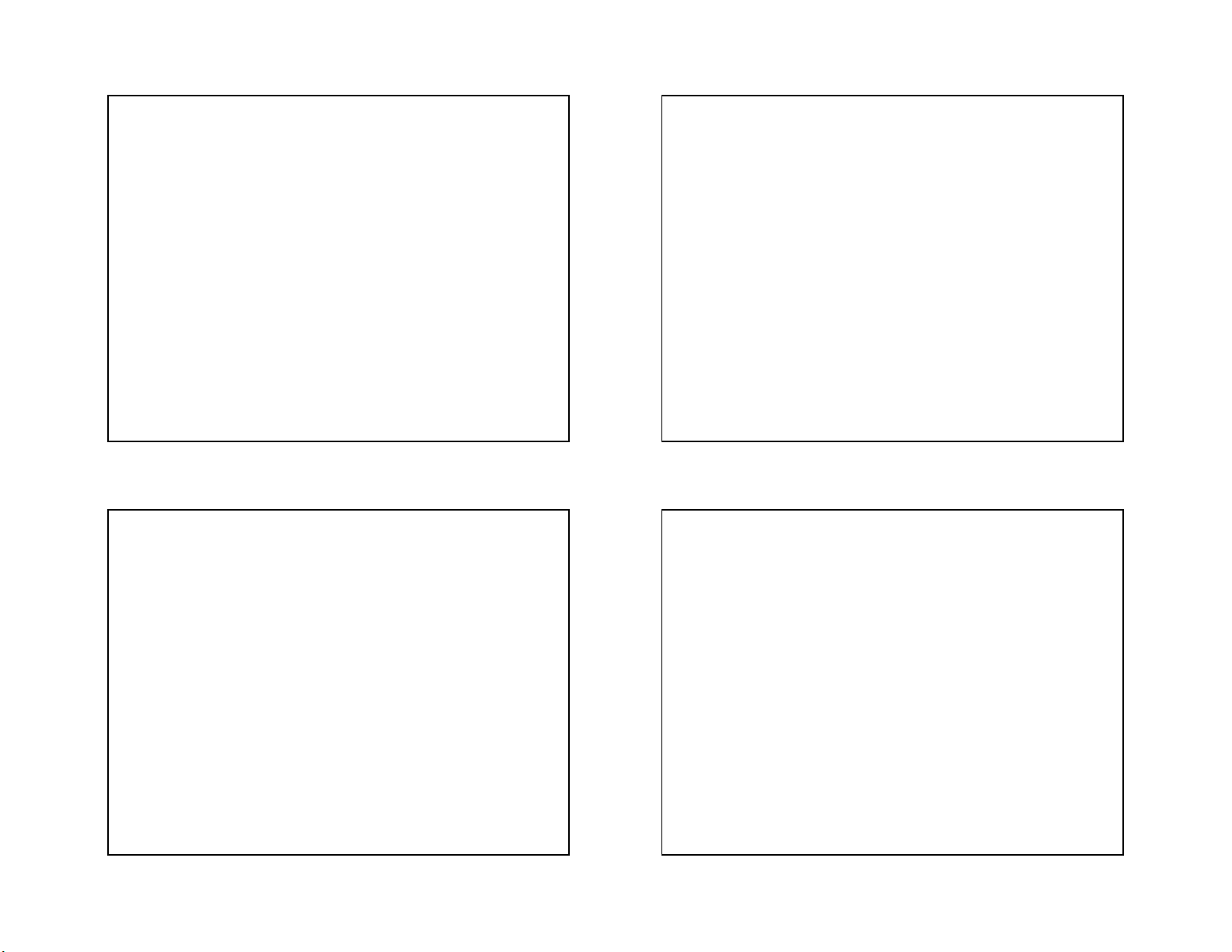
Một số dạng lai hoá obitan thường gặp và
Phức chất này tạo thành có sự tham gia của các
cấu trúc hình học tương ứng
obitan d hoá trị bên ngoài nên được gọi là phức
chất obitan ngoài (phức chất spin chưa ghép cặp
Sè phèi D¹ng lai CÊu h×nh cña VÝ dô
hoặc phức chất spin tự do). Phức chất này vẫn trÝ ho¸ phøc chÊt 2 sp Th¼ng [Cu(NH
giữ được số electron tự do của nhân trung tâm, 3)2]+, [Ag(NH3)2]+, [Ag(CN)2]-, nó có tính thuận từ. 4 sp3 Tø diÖn [Zn(NH3)4]2+, [Be(OH)4]2- 4 dsp2
Vu«ng ph¼ng [PtCl4]2-, [Ni(CN)4]2- 6 d2sp3 B¸t diÖn [Co(NH3)6]3+, 6 sp3d2 B¸t diÖn [Fe(CN)6]3-, [CoF6]3- 23 24 6 5/3/2021
Một số dạng lai hoá obitan thường gặp và
cấu trúc hình học tương ứng 2. Ưu nhược điểm
- Đơn giản, dễ hiểu, cho phép giải thích một
cách định tính liên kết của phức chất, giải
thích tính thuận từ và nghịch từ của chúng.
- Không giải thích được một số tính chất của
phức chất như tính cộng hưởng từ, tính dị
hướng, tính chất quang học cũng như màu của các phức chất. 25 26
Thuyết trường tinh thể dựa vào các giả thuyết sau Thuyết trường tinh thể đây:
Thuyết trường tinh thể do hai nhà Bác học
- Phức chất được hình thành là nhờ vào lực hút tĩnh
Vật lý Bethe và Van Vleck đề ra năm 1933
điện giữa chất tạo phức và phối tử
để giải thích tính chất của các chất dạng tinh
- Khảo sát vị trí của các obitan d của nguyên tử trung
thể, mãi đến năm 1950 nó mới được áp
tâm (chất tạo phức) và khảo sát sự biến thiên năng
dụng vào phức chất của các kim loại chuyển tiếp
lượng của 5 obitan d dưới tác dụng của điện trường
của các phối tử. Thuyết này coi các phối tử là các
điện tích điểm hay phân tử lưỡng cực, chúng được
sắp xếp trong không gian sao cho năng lượng đẩy
giữa các điện tích đó là cực tiểu 27 28 7 5/3/2021
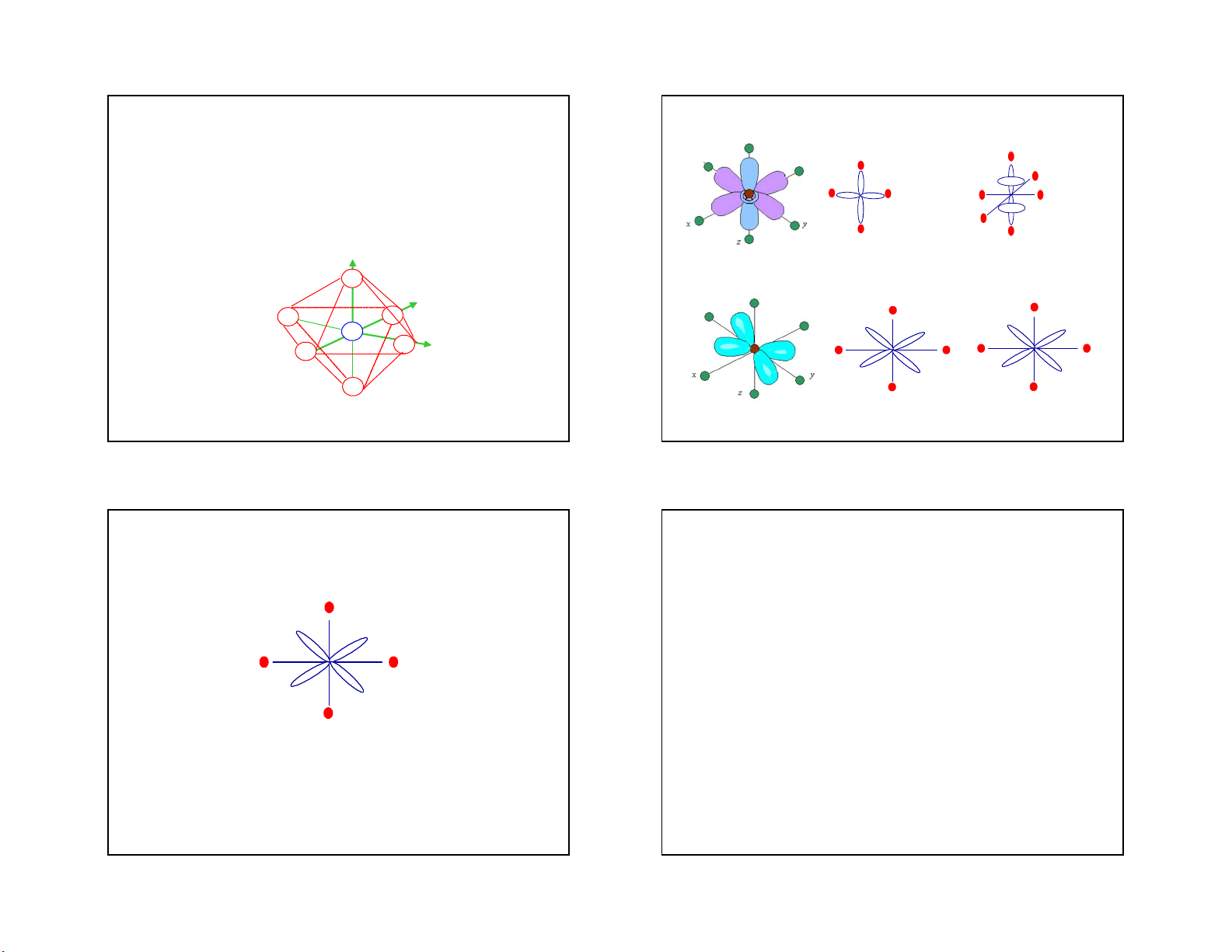
1. Sự tách các obitan hoá trị d của nguyên
tử trung tâm dưới tác dụng của trường các L 5 L3
phối tử trong ion phức tám mặt đều L3 L dz2 2 L L 1 dx2-y2 2 L1
CÊu tróc h×nh häc cña ion phøc t¸m mÆt ®Òu: L4 L6 L L 4 5 z L 3 y L L5 3 L2 A L L 2 4 L3 x L 1 L4 L1 d xy dzy L L 6 L4 6 29 30
- Nguyên tử trung tâm có 5 obitan hoá trị d, ở
trạng thái tự do các obitan này có năng lượng L bằng nhau 5 L
-Khi các ion phức tiến lại gần để tạo liên kết thì 2 L1
do lực hút tĩnh điện giữa các phối tử với các
obitan d của nhân trung tâm, năng lượng của L dzx 6 L3
các obitan d tăng lên. Tuy nhiên do tương tác
giữa phối tử với nhân không giống nhau nên
năng luợng của các obitan này tăng lên không đều: 31 32 8 5/3/2021
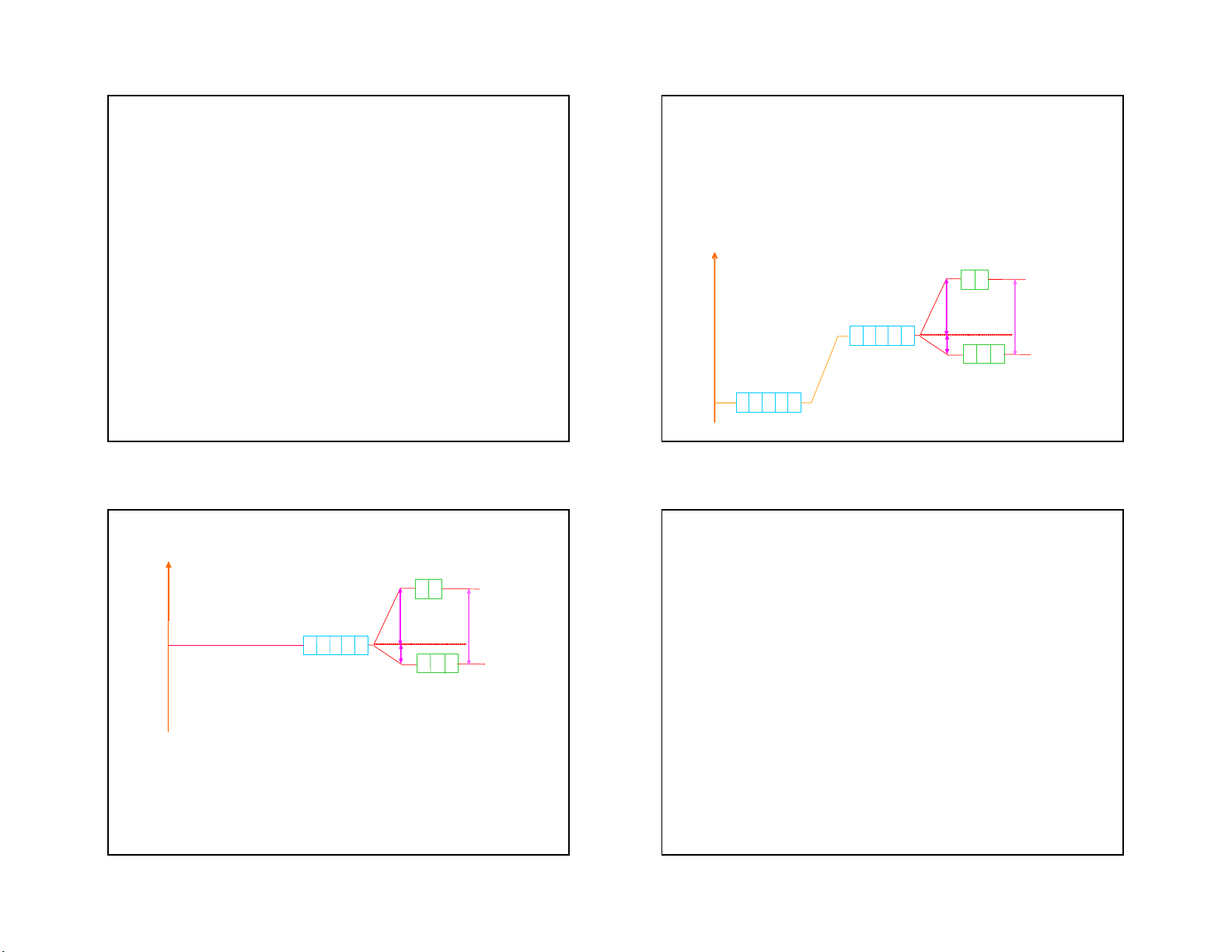
- Dưới tác dụng của điện trường sáu phối tử
+ Hai obitan dz2 và dx2-y2 của nguyên tử trung
trong ion phức tám mặt xảy ra hiện tượng tách
tâm hướng trực tiếp đến các phối tử nên dưới
các obitan hoá trị d của nguyên tử trung tâm:
tác dụng của điện trường các phối tử năng
thành hai mức khác nhau: eg và t2g, mức eg có
năng lượng cao hơn mức t
lượng của hai obitan này tăng lên mạnh. 2g E + Ba obitan còn lại d e xy, dxz, dzy định hướng g giữa các phối tử do tương tác giữa các 0,6Do Do
obitan này với các phối tử kém hơn nên năng 0,4D o t2g
lượng của chúng tăng lên ít hơn Sù t¸ch n¨ng lîng cña c¸c obitan d trong trêng tinh thÓ 33 34 E
- Hiệu số giữa hai mức năng lượng eg và e E g t 2
2g được gọi là thông số tách, ký hiệu là D 0,06 ,D o = E2- E1 o Δo Cã E0 Do
-Mức năng lượng trung bình của 5 obitan 0,4Do 0,4Δot2g
d trong phức chất nằm khoảng giữa hai E N¨ N n ă g n gl î l n ư g ợ t n r g u t n r g un b g ×nh 1 cñ b a ì n 5 h o c b ủ i a t a c n á cd t O ro A- ndg Sù t¸ch n¨ng lîng
mức eg và t2g, coi mức này năng lượng trêng tinh thÓ cña c¸c obitan d này bằng 0, tức là: 3E trong trêng tinh thÓ 1 + 2E2 = 0
Ta có: E1 = -0,4Do và E2= 0,6Do 35 36 9 5/3/2021 e
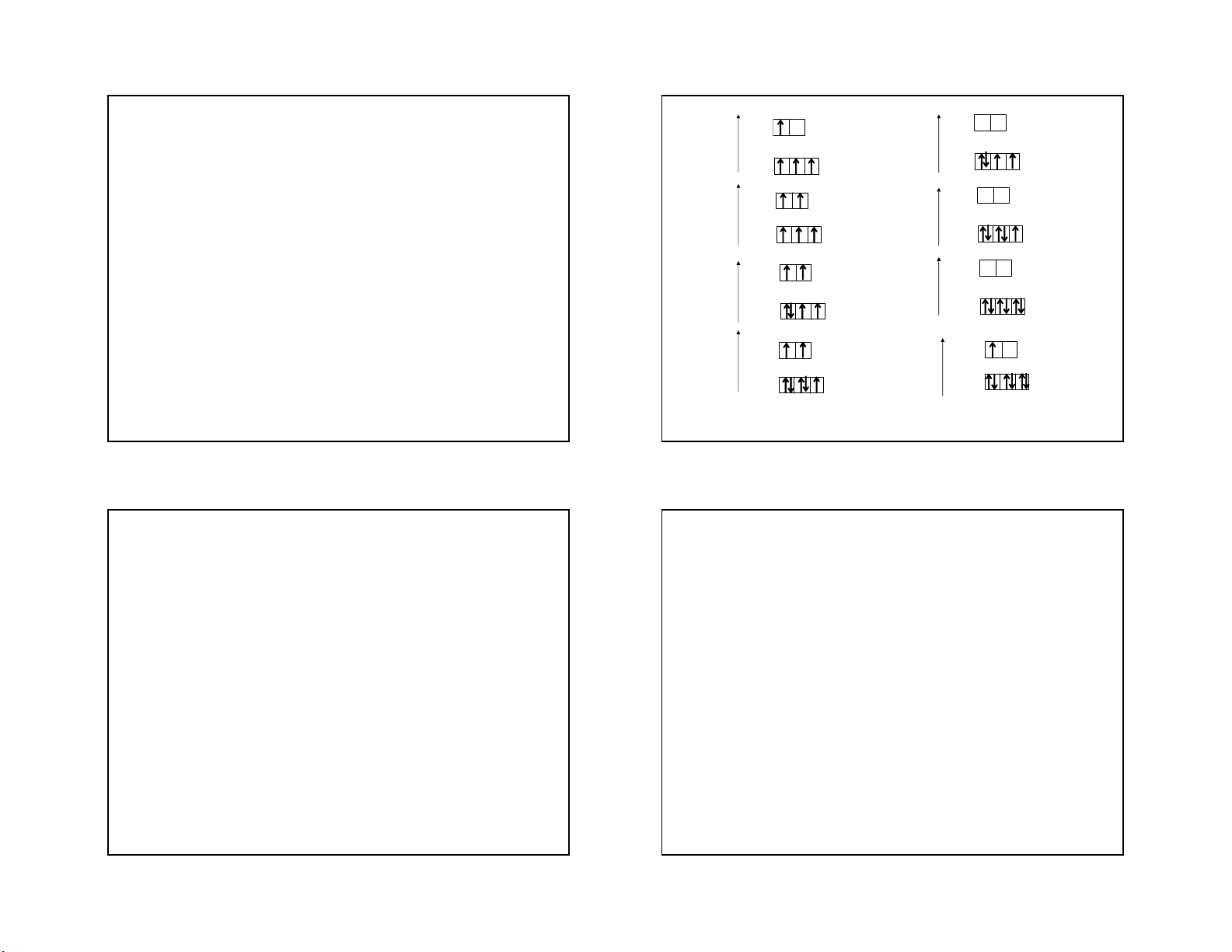
2. Sự phân phối các electron hoá trị d trong eg g ion phức bát diện đều: t t 2g D 2g
- Nguyên lý vững bền: các electron chiếm trước o
Do>P e
hết các obitan có năng lượng thấp eg g
- Nguyên lý Pauli: mỗi obitan chứa nhiều nhất 2e t2g t2g
- Quy tắc Hund: đối với các obitan có cùng năng e eg
lượng thì các e được phân bố vào các obitan sao g
cho số e độc thân với spin song song là lớn nhất. t t2g 2g
Tuy nhiên đối với phức chất sự tuân theo quy tắc
này phức tạp hơn so với nguyên tử, đặc biệt đối e e g g
với ion có từ 4, 5, 6 và 7 e trên obitan d. t t 2g 2g T¹o phøc spin cao T¹o phøc spin thÊp 37 38
P là năng lượng cần thiết để cặp đôi electron, là
3. Năng lượng làm bền bởi trường tinh thể W
năng lượng cần thiết để chuyển hai electron độc s
thân với số lượng tử từ spin m
Đối với ion phức tám mặt với số electron d lớn hơn s cùng dấu từ hai
obitan cùng năng lượng vào cùng một obitan.
1 thì năng lượng làm bền bởi trường tinh thể được tính theo công thức sau:
+ Nếu P > Do thì e thứ tư và năm sẽ không ghép đôi ở t Ws = (0,4n1 - 0,6n2)Do
2g vì sự ghép đôi tốn nhiều năng lượng hơn
+ Ngược lại nếu P < D
Trong đó: n1- số electron trên các obitan t2g
o thì sự ghép đôi ở t2g xảy ra dễ dàng hơn.
n2- số electron trên obitan eg
+ Nếu số electron hoá trị d của nguyên tử
trung tâm lớn hơn 7 thì không có sự khác
Năng lượng làm bền bởi trường tinh thể không phải là
nhau giữa hai trường hợp trên. Ion phức có
năng lượng liên kết trong ion phức, mà nó chỉ đóng
góp vào năng lượng liên kết. Năng lượng này mà cấu hình electron: t 6 2 6 3 2g eg (8e); t2g eg (9e)
càng lớn thì phức càng bền. 39 40 10 5/3/2021
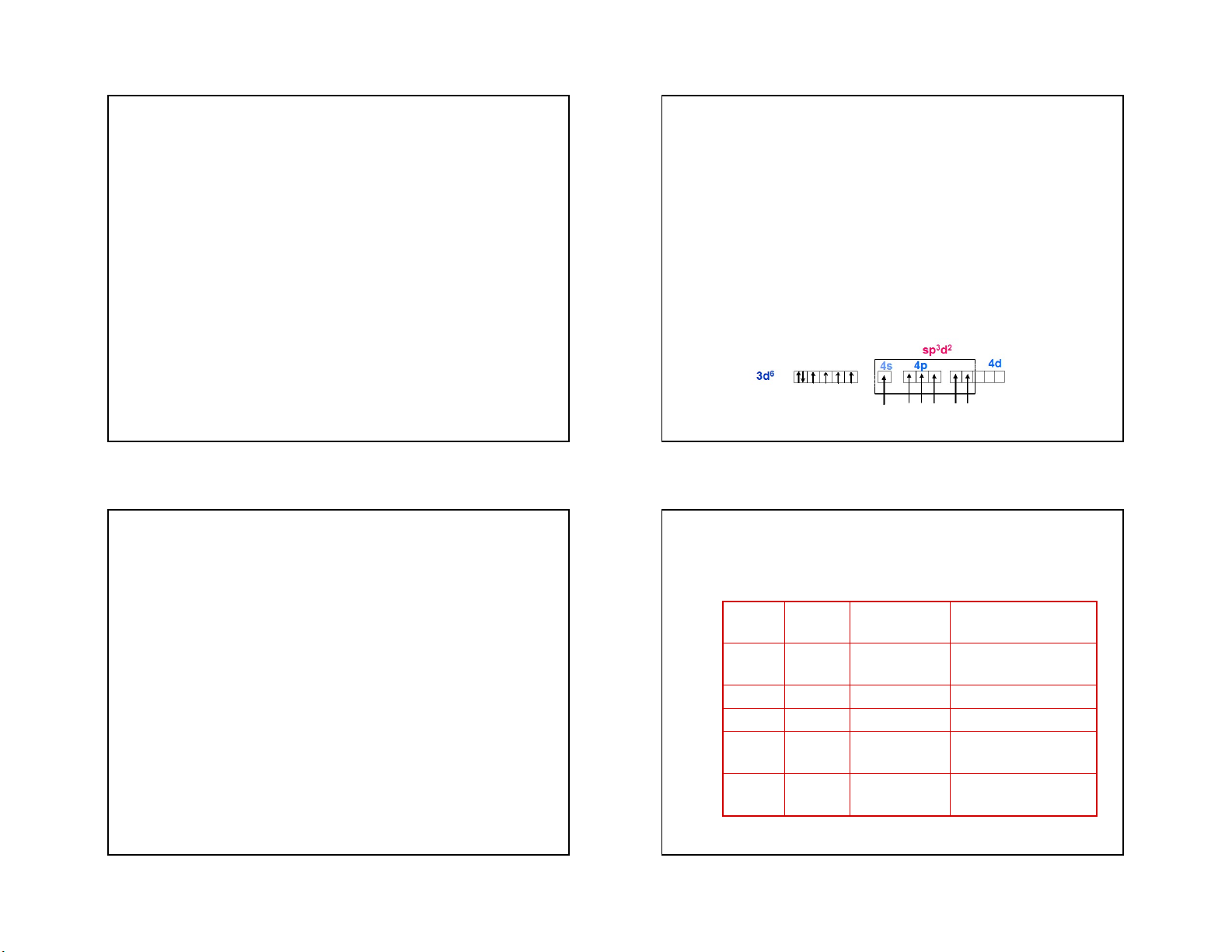
4. Các yếu tố ảnh hưởng đến thông số tách:
Bảng 1: Năng lượng làm bền bởi trường tinh thể
Giá trị của thông số tách được xác định dựa vào phổ
của các ion phức tám mặt đều
hấp thụ của phức chất.
- Nó phụ thuộc vào bản chất của nguyên tử trung tâm,
vào cấu trúc của ion phức tạo thành và bản chất của phối tử.
- Độ âm điện và kích thước của phối tử: D lớn khi phối
tử có độ âm điện lớn, kích thước nhỏ, vì khi đó phối
tử có thể lại gần nhân hơn, tạo nên điện trường
mạnh, do đó tương tác mạnh với các obitan d của
nguyên tử trung tâm. Ví dụ các ion halogenua tạo ra
giá trị thông số tách giảm dần theo thứ tự: F- - Cl- -
Br-- I-, có nghĩa là theo thứ tự tăng dần của kích thước phân tử 41 42
+ Độ phân cực của phối tử: Phối tử có độ phân cực
Các phối tử mạnh thường tạo ra các phức spin thấp,
lớn và kích thước càng nhỏ sẽ tạo ra D lớn. Hoặc
còn các phối tử yếu thường tạo ra các phức spin cao.
phối tử có 1 cặp e hoá trị chưa tham gia liên kết thì
Các phối tử gây ra thông số tách lớn như CO, CN- vì
khả năng xâm nhập vào các obitan d của nhân trung
trong chúng tồn tại liên kết cộng hoá trị, chúng có khả
tâm dễ hơn so với các phối tử có nhiều cặp e hoá trị,
năng tạo liên kết với nhân trung tâm.
ví dụ H2O tạo ra thông số tách kém hơn so với NH3
- Điện tích của ion trung tâm cũng ảnh hưởng đến
thông số tách: Ion có điện tích lớn có D lớn, vì ion có
+ Tuy nhiên bằng thực nghiệm cho thấy khả năng
điện tích lớn có khả năng hút mạnh phối tử về nó và
tạo ra thông số tách của các phối tử khác nhau đối
phối tử có tác dụng mạnh lên các obitan d của nhân.
với cùng một nhân trung tâm tăng dần theo thứ tự
Ví dụ các ion phức Cr2+ và Co2+ có thông số tách nhỏ sau đây:
hơn các ion phức Cr3+ và Co3+
I- < S2- < Br- < Cl- < OH- < F- < H O < SCN- < NH < NO - < CN- < CO
- Kích thước của ion trung tâm của ảnh hưởng đến 2 3 2
Trêng phèi tö yÕu trêng phèi tö trung b×nh trêng phèi tö m¹nh
thông số tách: Ion phức của Cr3+ có thông số tách
nhỏ hơn ion phức tương tự Rh3+ 43 44 11 5/3/2021
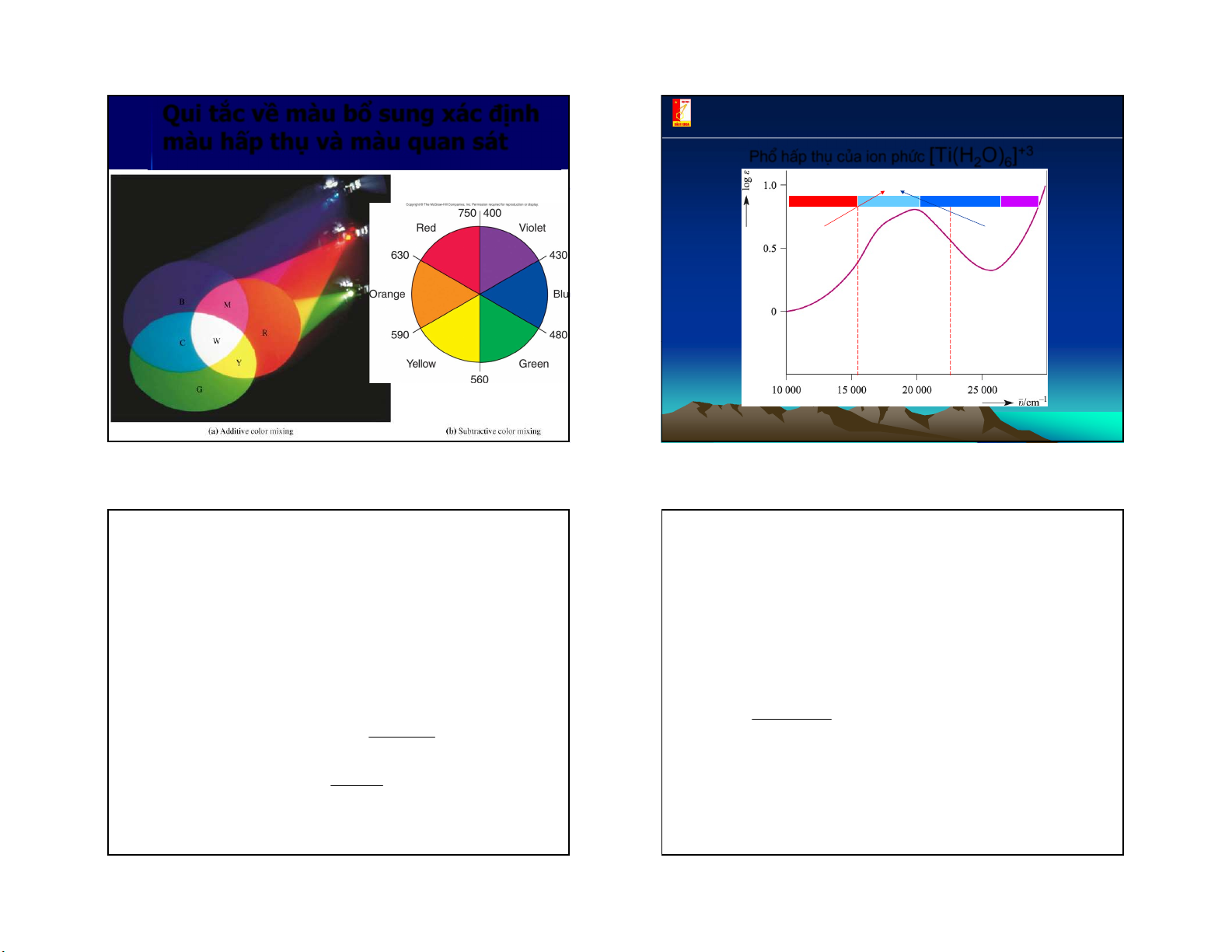
Nguyên nhân gây ra màu của phức chất Quang phæ hÊp thô
§©y lµ kÕt qu¶ næi bËt cña thuyÕt trêng tinh thÓ: nã ®· gi¶i
thÝch mµu cña phøc chÊt cña c¸c kim lo¹i chuyÓn tiÕp bëi ®a
sè phøc chÊt cña kim lo¹i chuyÓn tiÕp lµ cã mµu. [Fe(H2O)6]3+ [Co(H2O)6]2+
[Ni(H2O)6]2+ [Cu(H2O)6]2+ [Zn(H2O)6]2+ 45 46
Sự hấp thụ ánh sáng và Quan nguyên nhân tạo màu sắc hệ … còn lại ánh giữa Ánh sáng sáng xanh đi vàng bị hấp chất qua làm dung thụ… dịch được nhìn hấp thấy màu xanh thụ và … còn lại ánh sáng Ánh sáng xanh vàng đi qua làm màu bị hấp thụ… dugn dịch có màu vàng quan blue: 400-490 nm yel ow-green: 490-580 nm sát red: 580-700 nm 47 48 12 5/3/2021
Qui tắc về màu bổ sung xác định Hanoi university of technology
màu hấp thụ và màu quan sát
Phæ hÊp thô cña ion phøc [Ti(H2O)6]+3 Phøc chÊt cã mµu tÝm Vïng cho Vïng cho ¸nh s¸ng ®i ¸nh s¸ng ®i qua qua Vïng hÊp thô 49 50
5. Hằng số điện ly và hằng số bền của ion phức:
Trong dung dịch phức chất thường bị phân ly thành
Tổng của hai phản ứng trên ta có: cầu nội và cầu ngoại: [Ag(NH [Ag(NH 3)2]+ ⇋ Ag+ + 2NH3 3)2]Cl [Ag(NH3)2]+ + Cl-
Sau đó ion phức lại bị phân ly thành ion trung tâm và
các phối tử. Đại lượng đặc trưng cho sự điện ly của
Hằng số điện ly của quá trình phân ly:
ion phức được gọi là hằng số điện ly: Ag .NH32 K = = K [A ( gNH)] .[NH] 1.K2 Ag(N )H32 [Ag(NH K 3 3 3)2]+ ⇋ [Ag(NH3)]+ + NH3; 1 [A ( gNH) ] 3 2 [A ] g .[NH ] 3 [Ag(NH )]+ K ⇋ Ag+ + NH 2 3 3 ; [A ( g NH )] 3 51 52 13 5/3/2021
Hằng số điện ly K càng lớn khi ion phức phân ly càng
Hằng số bền tổng và hằng số bền từng nấc:
mạnh, nghĩa là ion phức càng kém bền. Bởi vậy hằng
Quá trình tạo thành và quá trình phân ly của ion phức
xảy ra theo từng nấc, ứng với mỗi nấc có một hằng số
số điện ly K chỉ độ bền của ion phức trong dung dịch
bền và hằng số không bền, đối với ion phức [Ag(NH
còn được gọi là hằng số không bền ký hiệu là K 3)2]+: kb. Ag(NH ) 3
Đa số các ion phức là chất kém điện ly, quá trình Ag+ + NH K 3 ⇆ [Ag(NH3)]+ 1 b [Ag ].[NH 3 ]
phân ly chuyển dịch mạnh về phía trái của quá trình [Ag(NH Ag(NH)32 tạo phức. 3)]+ + NH3 ⇆ [Ag(NH3)2]+; K 2b Ag(NH 3 ) [NH ] 3
Để chỉ khả năng tạo phức của nguyên tử trung tâm,
người ta dùng hằng số cân bằng của quá trình ngược
Trong trường hợp tổng quát hằng số bền tổng cộng của
với quá trình phân ly, gọi là hằng số bền K
một ion phức bất kỳ được tính bằng công thức sau: b và là
nghịch đảo của hằng số không bền: K -1 nb = (K1.K2…Kn)b b= Kkb 53 54 Ví dụ:
Trong 1 lit dung dịch chứa 1mol AgCl và 2 mol NH
Tinh độ hoà tan AgCl trong dung dịch NH3 1M, so sánh 3
với độ tan trong nước biết
TAgCl= 1.10-10 , Kb ([Ag(NH3)2]+)= 1,6.107 55 56 14 5/3/2021 57 15



