




Preview text:
4/20/2019 Phức chất Một số định nghĩa:
Khi xét tính chất của các nguyên tố nhóm A và
Chromate and Dichromate Ions
hợp chất của chúng, chúng ta đã gặp một số
phản ứng tạo phức, ví dụ: X(OH) + 2NaOH = Na [X(OH) ] , X- Pb, Sn 2 2 4 SnO + 4HCl = SnCl + 2H O 2 4 2 In acid In base SnCl + 2HCl = H [SnCl ] 4 2 6 2Al + 2NaOH +6H O = 2Na[Al(OH) ] + 3H 2 4 2 1 2
- Chất có khả năng tạo phức là các kim loại Al, 1. Phức chất:
Pb, Sn chúng đều là các kim loại nhóm A, nhưng
có đặc điểm là có các obitan trống ở các phân lớp
Phức chất là hợp chất phối trí, mà phân tử 3d hoặc 4d hoặc 5d.
của nó chứa ion phức. Ion phức bao gồm
nguyên tử hay ion được gọi là nhân trung
- Khả năng tạo phức của các kim loại chuyển tiếp
tâm, bao quanh nó là các nguyên tử, phân tử
lớn hơn nhiều so với các kim loại nhóm A vì
chúng có nhiều obitan hoá trị và có nhiều obitan
hay ion liên kết với nó được gọi là ligand hay
trống và có độ âm điện lớn hơn các kim loại kiềm
phối tử. Số phối tử thường lớn hơn hoá trị
và kiềm thổ nên rất có khả năng nhận cặp
electron và là chất tạo phức tốt. của nhân trung tâm. 3 4 1 4/20/2019 Ví dụ 1: Ví dụ 2:
Phân tử phức chất Na[Al(OH)4] chứa ion phức
Phân tử phức chất [Co(NH3)6]Cl3 chứa ion
[Al(OH)4]- , Al3+ là ion tạo phức và liên kết với phức [Co(NH nó là 4 nhóm OH-
3)6]3+, trong đó ion tạo phức là
Co3+ liên kết với 6 phối tử NH3 - -HO OH-
Ví dụ 3: [Ni(CO)4], chất tạo phức là nguyên Al
tử Ni liên kết với 4 phối tử CO -HO OH-
Như vậy phức chất có thể là cation, anion hay nguyên tử 5 6
* Cấu tạo của phức chất:
Như vậy phức chất có thể là cation, anion hay nguyên tử 7 8 2 4/20/2019
Ví dụ 1: Các phức có cấu tạo: [Co(NH3)6]Cl3
+ Cầu nội có thể là phân tử trung hoà về điện, [Co(NH3)5Cl]Cl2
không phân ly trong dung dịch: cầu nội cầu ngoại
Ví dụ: [Co(NH3)3Cl3], [Ni(CO)4], [B(NH3)F3] trong
trường hợp này phức chất không có cầu ngoại
+ CÇu néi cña phøc cã thÓ lμ cation VÝ dô 2:
+ Nhân trung tâm có thể là ion như Co3+, Al3+,… hay [Al(H O) ]Cl , [Zn(NH ) ]Cl , [Co(NH ) ]Cl , [Pt(NH ) ]2+,
là nguyên tử kim loại như Co, Al, Zn, Ni. 2 6 3 3 4 2 3 6 3 3 4 [Ni(NH ) ](NO ) 3 6 3 2
+ Phối tử có thể là các anion như OH-, F-, Cl-, Br-, I-,
+ CÇu néi cã thÓ lμ anion: CN-, NO - 2- 2-
2 , CO3 , C2O4 , …hay có thể là phân tử VÝ dô 3:
như NH3, H2O, CO, NO,…hay phân tử hữu cơ như
H [SiF ], K [Zn(OH) ], K [PbI ], Na [AlF ], [Ni(CN) ]2-,[PtCl ]2- NH2CH2CH2NH2, (NH2)2CO 2 6 2 4 3 4 3 6 4 4 … 9 10 -Ví dụ:
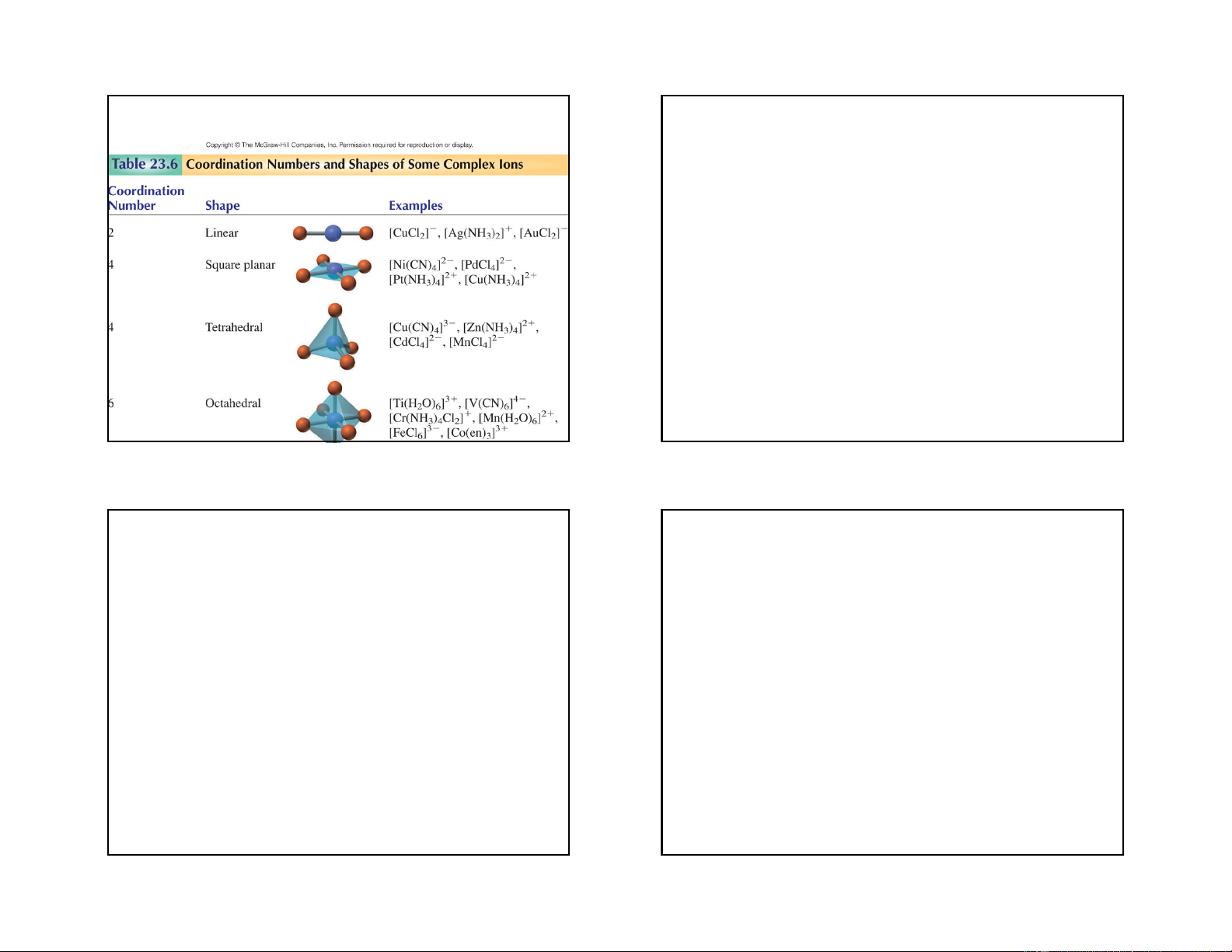
2. Số phối trí của nhân trung tâm:
+ Ni2+ có số phối trí là 6 trong ion [Ni(NH3)6]2+ hoặc có số
- Số phối trí của nhân trung tâm là số liên kết của nhân
phối trí là 4 trong ion phức [Ni(CN)4]2-
trung tâm liên kết với các phối tử.
+ Một số nhân trung tâm có số phối trí không đổi như
Cr3+, Co3+, Pt4+ và đều có số phối trí là 6. Hiện nay chưa
- Đa số nhân trung tâm có số phối trí biến đổi phụ thuộc
có lý thuyết hoàn chỉnh tiên đoán chính xác số phối trí
vào bản chất của chất tạo phức, của phối tử, số oxi hoá,
của nhân trung tâm, nhưng số phối trí thường gặp là 4 và
bản chất của dung môi, phụ thuộc vào nồng độ, nhiệt độ 6. và cầu ngoại. 11 12 3 4/20/2019
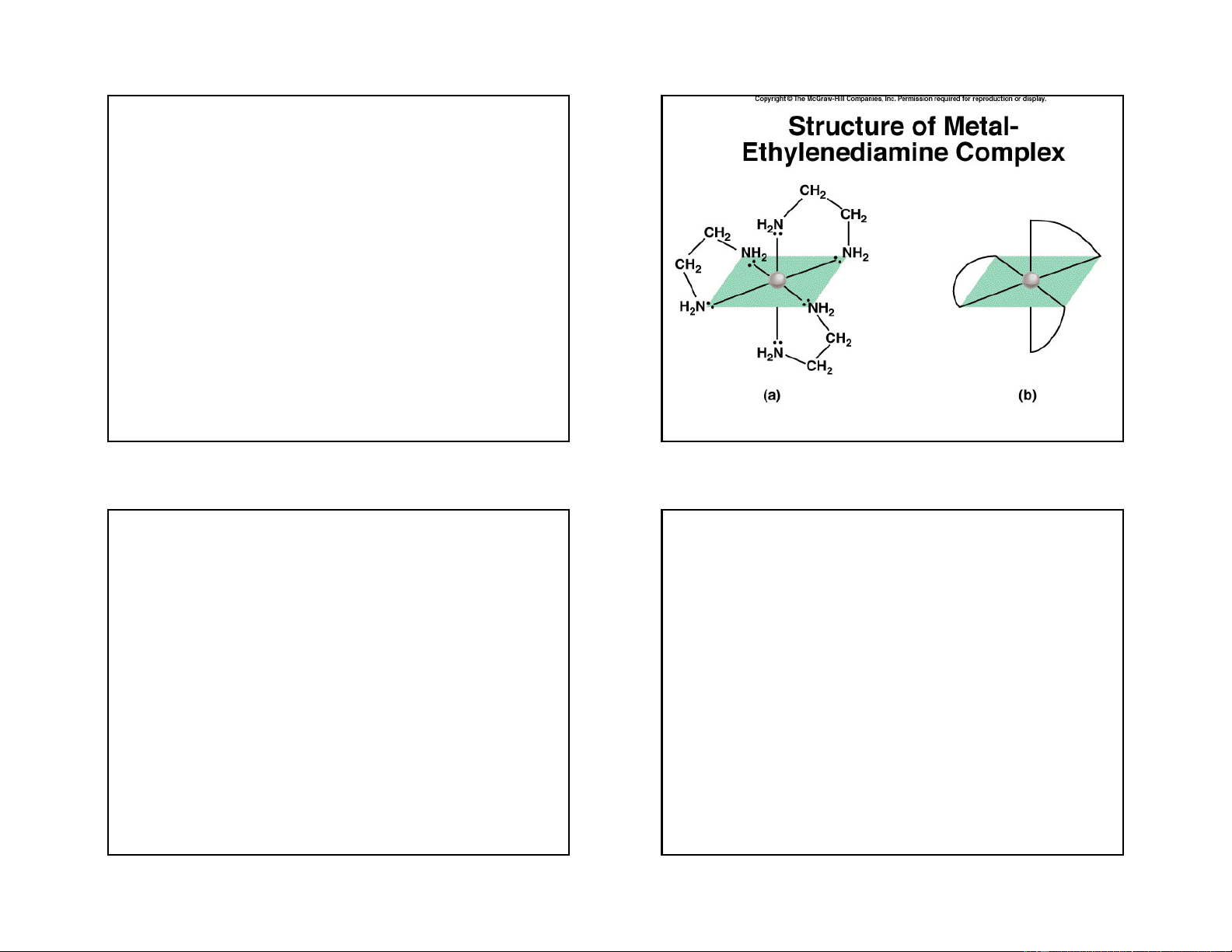
3. Dung lượng phối trí của phối tử: 2+ H H 2 2
- Dung lượng phối trí của phối tử là số liên kết của H N 2C N CH2
một phối tử liên kết với nhân trung tâm. Cu
Ví dụ: OH-, Cl-, I-, F-, NH3, CN-…trong các ví dụ trên H2C N N
có dung lượng phối trí bằng 1. CH2 H2 H2
-Phối tử có dung lượng phối trí bằng 1 là phối tử đơn càng.
Mỗi phân tử etilenđiamin có 2 nguyên tử liên kết với
-Phối tử có dung lượng phối trí lớn hơn 1 là phối tử
nhân trung tâm. Khi phối tử đa càng liên kết với nhân
đa càng, ví dụ: etilenđiamin H
trung tâm sẽ tạo thành vòng và phức chất chứa phối 2N-CH2-CH2-NH2 có
dung lượng phối trí bằng 2 thể hiện trong phức sau:
tử đa càng được gọi là phức chất vòng. 13 14
5. Cách gọi tên các phức chất:
4. Cách gọi tên các phối tử thường gặp:
* Phức chất trung hoà: chỉ gồm một từ, bắt đầu CH3COO-: axetato H2O: aqua
bằng số và tên của phối tử, sau đó là tên của nhân CN- : xiano NH3: ammoni
trung tâm với chỉ số di, tri (trong trường hợp nhiều Cl- : clo CO: cacbonyl nhân) NO - : Ví dụ: 2 nitrito NO: nitrozin CO 2- [Al 3
: cacbonato NH2CH2CH2NH2: etylendiamin 2Cl6] – hexaclodialuminum OH- : hydroxyl (NH
[Ni(CO)4] – tetracacbonylnickel 2)2CO: cacbamid [Co SO 2-
2(CO)8] – octacacbonyldicoban 3 : sunfito C 2- : 2O4 oxalato
* Phức chất cation: bao gồm số và tên của phối tử và tên
của nguyên tố tạo phức
[Ag(NH3)2]+ - cation diamin bạc (I)
[Mn(H2O)6]2+ - cation hexaacva mangan (II)
[Hg2(H2O)2](NO3)2 - nitrat diacva di thuy ngan (II+) 15 16 4 4/20/2019
Thuyết liên kết hoá trị giải thích liên kết hoá học
* Phức chất anion: bao gồm số và tên của phối tử và trong phức chất
tên của nguyên tố tạo phức+ at và chỉ số số oxi hoá
1. Thuyết liên kết hoá trị: [BF4]- Tetrafloborat (III) ion
Thuyết axit-bazơ của Lewis ra đời năm 1927.
[Fe(CN)6]3- - hexaxiаnоferrat (III)- ion K
- Axit là phần tử nhận cặp electron hoá trị còn Bazơ
2[HgI4] – Tetariot thuy ngan (II) kali
là phần tử cho cặp electron hoá trị, ví dụ: F F F B + :NH = F B NH 3 3 F F 17 18
- Dựa vào thuyết liên kết hoá trị để giải thích liên kết Ví dụ 1:
hoá học trong các hợp chất phức chất.
Sự tạo thành ion phức [Co(NH3)6]3+, ion Co3+ kết hợp với 6 phân tử NH -Theo thuyết này:
3 tạo thành cation phức hình
bát diện nhờ 6 liên kết cho-nhận giữa các electron
+ Liên kết tạo thành trong phức chất là liên kết cho-
tự do của các phân tử NH3 và các obitan lai hoá
nhận giữa cặp electron tự do của phối tử và obitan
trống d2sp3 của ion Co3+ (3d6) được tạo thành do
trống của nhân trung tâm. Liên kết cho-nhận là liên
sự lai hoá của 2 obitan 3d, 1 obitan 4s và 3 obitan
kết cộng hoá trị và mỗi liên kết cho-nhận ứng với một 4p.
vị trí phối trí (một liên kết ).
+ Kết hợp với khái niệm lai hoá của Pauling, những
obitan trống đó phải là những obitan lai hoá của
nhân trung tâm mới có thể tiếp nhận được những
cặp electron của phối tử 19 20 5 4/20/2019 Ví dụ 2:
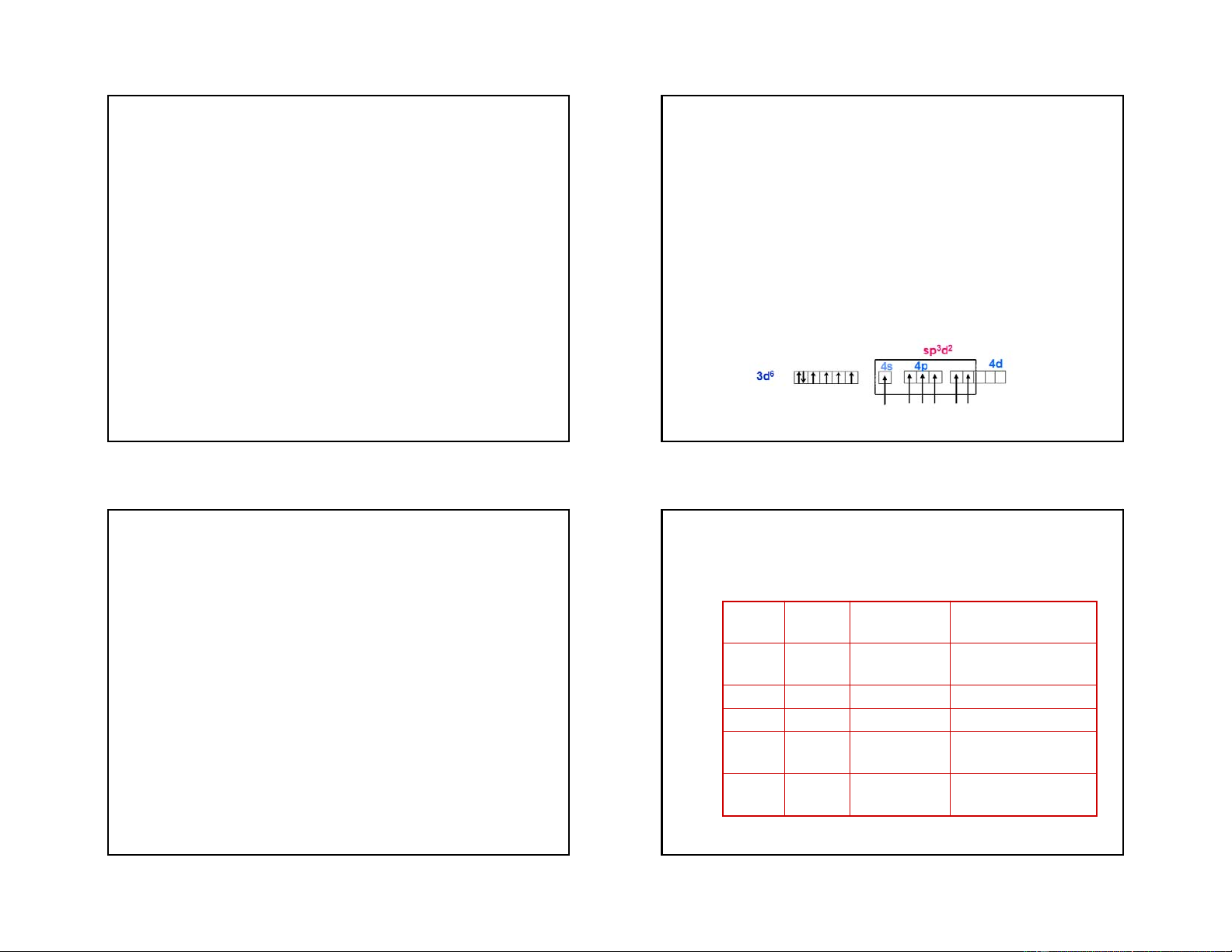
Sự lai hoá d2sp3 của các obitan hoá trị của ion Co3+,
sự lai hoá này có được do 4e độc thân ở 3d phải
Ion phức [CoF6]3- : nhân trung tâm là Co3+ có lai
ghép cặp để giải phóng 2 obitan trống, đây được
hoá sp3d2, tức là các obitan 3d ở lớp trong không
gọi là sự lai hoá trong. Loại phức này chứa ít hoặc
tham gia lai hoá mà xảy ra sự lai hoá của 1 obitan
không chứa các electron độc thân so với nhân trung
4s, với 3 obitan 4p và 2 obitan 4d. Đây là sự lai hoá
tâm ở trạng thái tự do, nên được gọi là phức chất ngoài
spin ghép cặp hoặc phức chất spin thấp hoặc phức chất obitan trong.
Ion [Co(NH3)6]3+ không có electron độc thân nên nó có tính nghịch từ 21 22
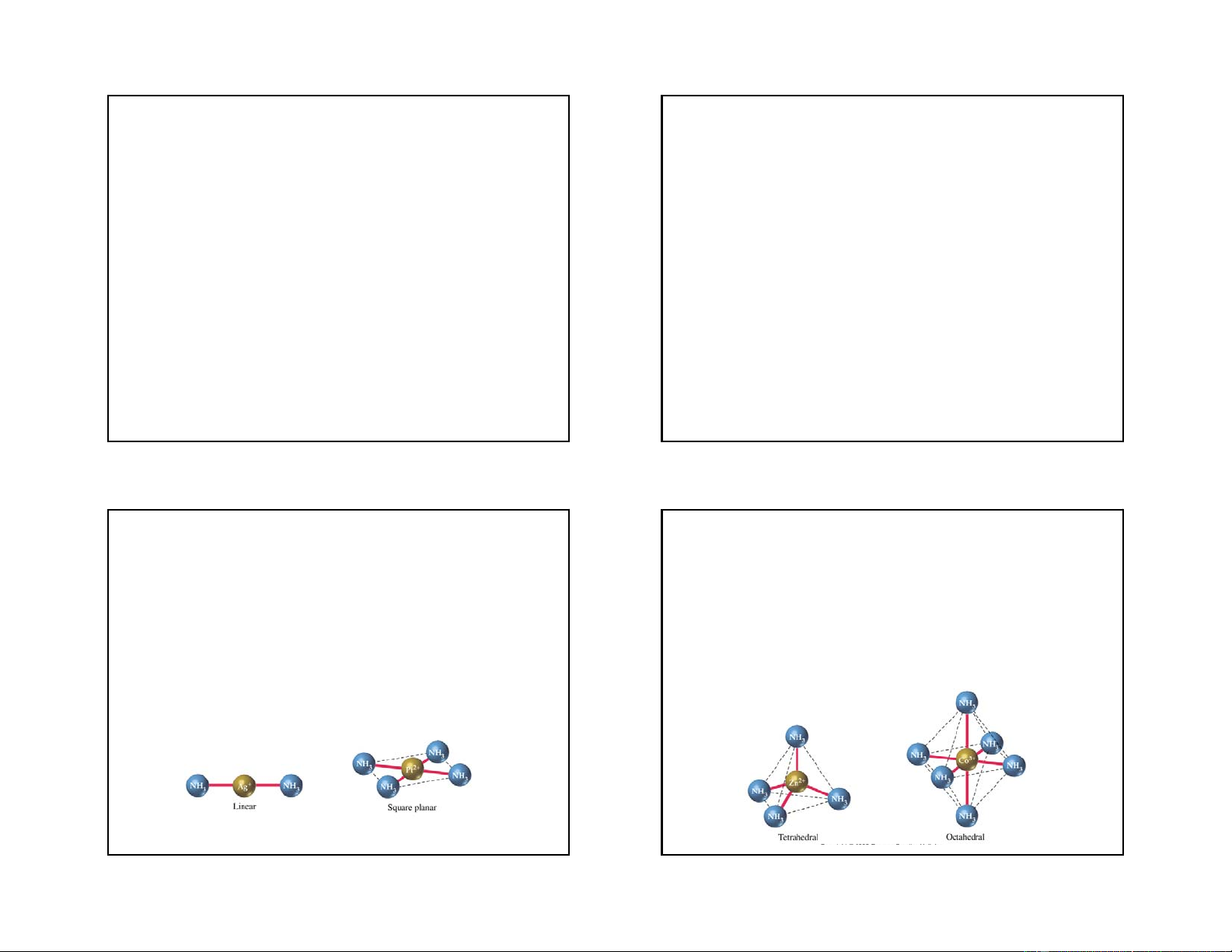
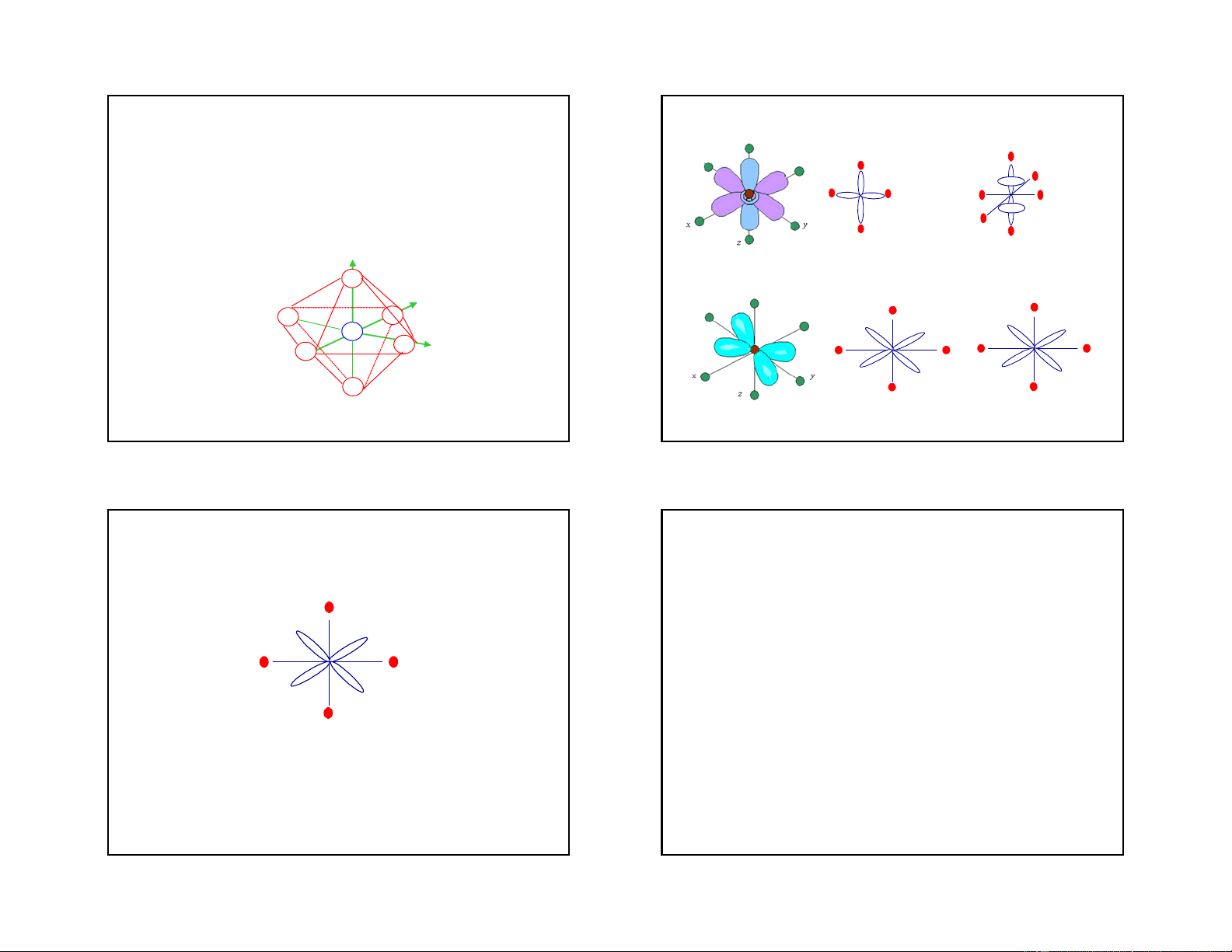
Một số dạng lai hoá obitan thường gặp và
Phức chất này tạo thành có sự tham gia của các
cấu trúc hình học tương ứng
obitan d hoá trị bên ngoài nên được gọi là phức
chất obitan ngoài (phức chất spin chưa ghép cặp Sè phèi D¹ng lai CÊu h×nh cña VÝ dô
hoặc phức chất spin tự do). Phức chất này vẫn trÝ ho¸ phøc chÊt 2 sp
giữ được số electron tự do của nhân trung tâm, Th¼ng [Cu(NH ) ]+, 3 2 [Ag(NH ) ]+, [Ag(CN) ]-, 3 2 2
nó có tính thuận từ. 4 sp3 Tø diÖn [Zn(NH ) ]2+, [Be(OH) ]2- 3 4 4 4 dsp2 Vu«ng ph¼ng [PtCl ]2-, [Ni(CN) ]2- 4 4 6 d2sp3 B¸t diÖn [Co(NH ) ]3+, 3 6 6 sp3d2 B¸t diÖn [Fe(CN) ]3-, [CoF ]3- 6 6 23 24 6 4/20/2019
Một số dạng lai hoá obitan thường gặp và
cấu trúc hình học tương ứng 2. Ưu nhược điểm
- Đơn giản, dễ hiểu, cho phép giải thích một
cách định tính liên kết của phức chất, giải
thích tính thuận từ và nghịch từ của chúng.
- Không giải thích được một số tính chất của
phức chất như tính cộng hưởng từ, tính dị
hướng, tính chất quang học cũng như màu của các phức chất. 25 26
Thuyết trường tinh thể dựa vào các giả thuyết:
Thuyết trường tinh thể
- Phức chất được hình thành là nhờ vào lực hút tĩnh
Thuyết trường tinh thể do hai nhà Bác học
điện giữa chất tạo phức và phối tử
Vật lý Bethe và Van Vleck đề ra năm 1933
- Khảo sát vị trí của các obitan d của nguyên tử trung
để giải thích tính chất của các chất dạng tinh
tâm (chất tạo phức) và khảo sát sự biến thiên năng
thể, mãi đến năm 1950 nó mới được áp
lượng của 5 obitan d dưới tác dụng của điện trường
dụng vào phức chất của các kim loại
của các phối tử. Thuyết này coi các phối tử là các chuyển tiếp
điện tích điểm hay phân tử lưỡng cực, chúng được
sắp xếp trong không gian sao cho năng lượng đẩy
giữa các điện tích đó là cực tiểu 27 28 7 4/20/2019
1. Sự tách các obitan hoá trị d của nguyên
tử trung tâm dưới tác dụng của trường các L 5 L3
phối tử trong ion phức tám mặt đều L3 L dz2 2 L L2 1 dx2-y2 L1
CÊu tróc h×nh häc cña ion phøc t¸m mÆt ®Òu: L4 L6 L L 4 5 z L3 y L L 5 3 L2 A L L 2 4 L 3 x L 1 L4 L1 d x y dzy L6 L L 4 6 29 30
- Nguyên tử trung tâm có 5 obitan hoá trị d, ở
trạng thái tự do các obitan này có năng lượng L bằng nhau 5
-Khi các ion phức tiến lại gần để tạo liên kết thì L2 L1
do lực hút tĩnh điện giữa các phối tử với các
obitan d của nhân trung tâm, năng lượng của L dzx 6 L3
các obitan d tăng lên. Tuy nhiên do tương tác
giữa phối tử với nhân không giống nhau nên
năng luợng của các obitan này tăng lên không đều: 31 32 8 4/20/2019
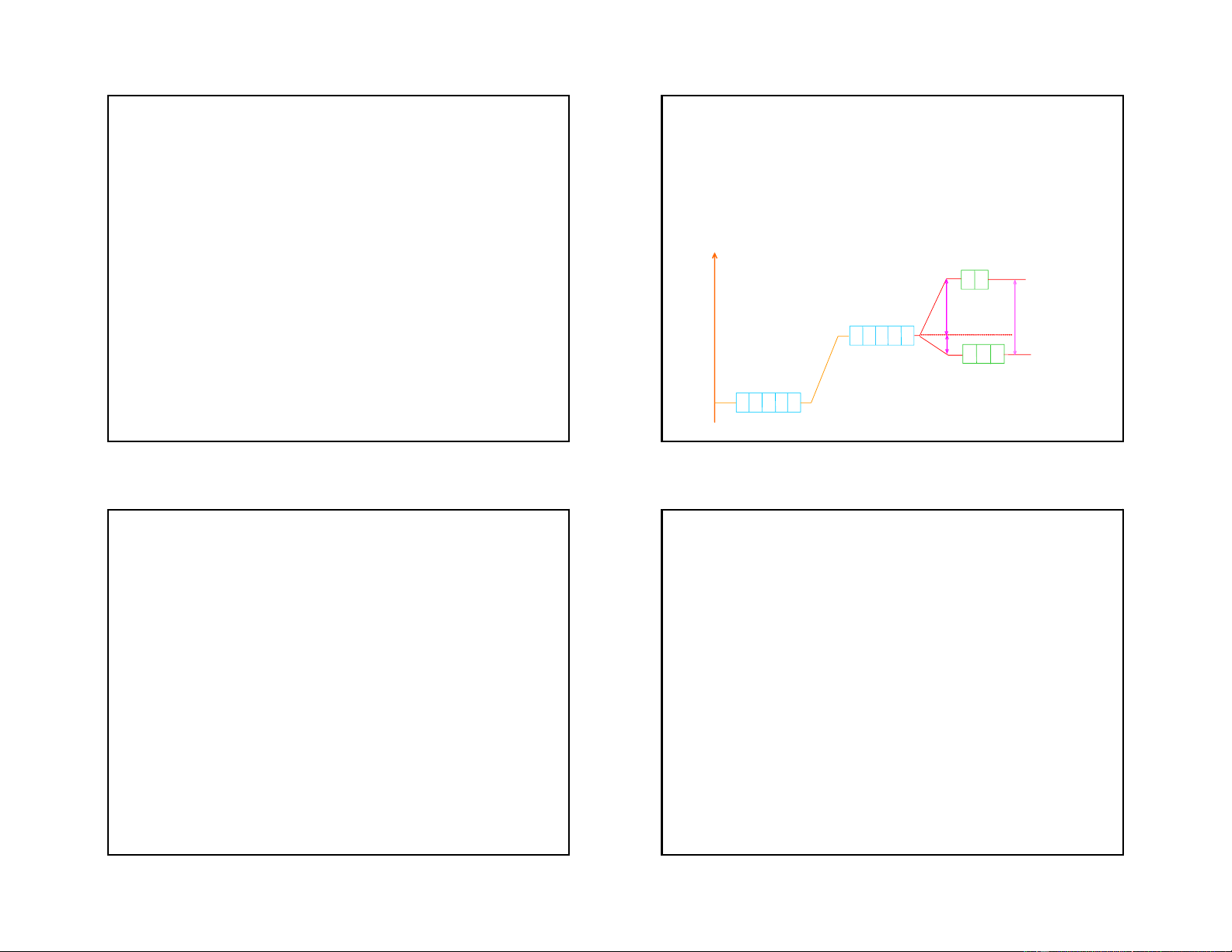
- Dưới tác dụng của điện trường sáu phối tử
+ Hai obitan dz2 và dx2-y2 của nguyên tử trung
trong ion phức tám mặt xảy ra hiện tượng tách
tâm hướng trực tiếp đến các phối tử nên dưới
các obitan hoá trị d của nguyên tử trung tâm:
tác dụng của điện trường các phối tử năng
thành 2 mức: eg và t2g, mức eg có năng lượng cao hơn mức t
lượng của hai obitan này tăng lên mạnh. 2g E
+ Ba obitan còn lại dxy, dxz, dzy định hướng eg giữa các phối tử do tương tác giữa các 0,6o o
obitan này với các phối tử kém hơn nên năng 0,4o t2g
lượng của chúng tăng lên ít hơn Sù t¸ch n¨ng lîng cña c¸c obitan d trong trêng tinh thÓ 33 34
2. Sự phân phối các electron hoá trị d trong ion
- Hiệu số giữa hai mức năng lượng eg và t2g
phức bát diện đều:
được gọi là thông số tách, ký hiệu là o = E2- E
- Nguyên lý vững bền: các electron chiếm trước hết 1
-Mức năng lượng trung bình của 5 obitan d
các obitan có năng lượng thấp
trong phức chất nằm khoảng giữa hai mức e
- Nguyên lý Pauli: mỗi obitan chứa nhiều nhất 2e g
và t2g, coi mức này năng lượng này bằng 0,
- Quy tắc Hund: đối với các obitan có cùng năng tức là: 3E1 + 2E2 = 0
lượng thì các e được phân bố vào các obitan sao
Ta có: E1 = -0,4o và E2= 0,6o
cho số e độc thân với spin song song là lớn nhất.
Tuy nhiên đối với phức chất sự tuân theo quy tắc
này phức tạp hơn so với nguyên tử, đặc biệt đối với
ion có từ 4, 5, 6 và 7 e trên obitan d. 35 36 9 4/20/2019
P là năng lượng cần thiết để cặp đôi electron, là e e g g
năng lượng cần thiết để chuyển hai electron độc
thân với số lượng tử từ spin m t t 2g 2g >P s cùng dấu từ hai
o o
obitan cùng năng lượng vào cùng một obitan. e e g g
+ Nếu P > o thì e thứ tư và năm sẽ không ghép đôi ở t t2g t2g
2g vì sự ghép đôi tốn nhiều năng lượng hơn
+ Ngược lại nếu P < o thì sự ghép đôi ở t2g xảy ra e eg dễ dàng hơn. g t
+ Nếu số electron hoá trị d của nguyên tử t 2g 2g
trung tâm lớn hơn 7 thì không có sự khác e e
nhau giữa hai trường hợp trên. Ion phức có g g cấu hình electron: t 6 2 6 3 t t 2g 2g 2g eg (8e); t2g eg (9e) T¹o phøc spin cao T¹o phøc spin thÊp 37 38
3. Năng lượng làm bền bởi trường tinh thể Ws
Bảng 1: Năng lượng làm bền bởi trường tinh thể
Đối với ion phức tám mặt với số electron d lớn hơn
của các ion phức tám mặt đều
1 thì năng lượng làm bền bởi trường tinh thể được tính theo công thức sau: Ws = (0,4n1 - 0,6n2)o
Trong đó: n1- số electron trên các obitan t2g
n2- số electron trên obitan eg
Năng lượng làm bền bởi trường tinh thể không phải là
năng lượng liên kết trong ion phức, mà nó chỉ đóng
góp vào năng lượng liên kết. Năng lượng này mà
càng lớn thì phức càng bền. 39 40 10 4/20/2019
4. Các yếu tố ảnh hưởng đến thông số tách:
+ Độ phân cực của phối tử: Phối tử có độ phân cực
Giá trị của thông số tách được xác định dựa vào phổ
lớn và kích thước càng nhỏ sẽ tạo ra lớn. Hoặc
hấp thụ của phức chất.
phối tử có 1 cặp e hoá trị chưa tham gia liên kết thì
- Nó phụ thuộc vào bản chất của nguyên tử trung tâm,
khả năng xâm nhập vào các obitan d của nhân trung
vào cấu trúc của ion phức tạo thành và bản chất của
tâm dễ hơn so với các phối tử có nhiều cặp e hoá trị, phối tử.
ví dụ H2O tạo ra thông số tách kém hơn so với NH3
- Độ âm điện và kích thước của phối tử: lớn khi phối
tử có độ âm điện lớn, kích thước nhỏ, vì khi đó phối
+ Tuy nhiên bằng thực nghiệm cho thấy khả năng
tử có thể lại gần nhân hơn, tạo nên điện trường
tạo ra thông số tách của các phối tử khác nhau đối
mạnh, do đó tương tác mạnh với các obitan d của
với cùng một nhân trung tâm tăng dần theo thứ tự
nguyên tử trung tâm. Ví dụ các ion halogenua tạo ra sau đây:
giá trị thông số tách giảm dần theo thứ tự: F- - Cl- -
I- < S2- < Br- < Cl- < OH-< F- < H O < SCN- < NH < NO - < CN- < CO
Br-- I-, có nghĩa là theo thứ tự tăng dần của kích 2 3 2
Tr−êng phèi tö yÕu tr−êng phèi tö trung b×nh tr−êng phèi tö m¹nh thước phân tử 41 42
Các phối tử mạnh thường tạo ra các phức spin thấp,
còn các phối tử yếu thường tạo ra các phức spin cao. Quang phæ hÊp thô
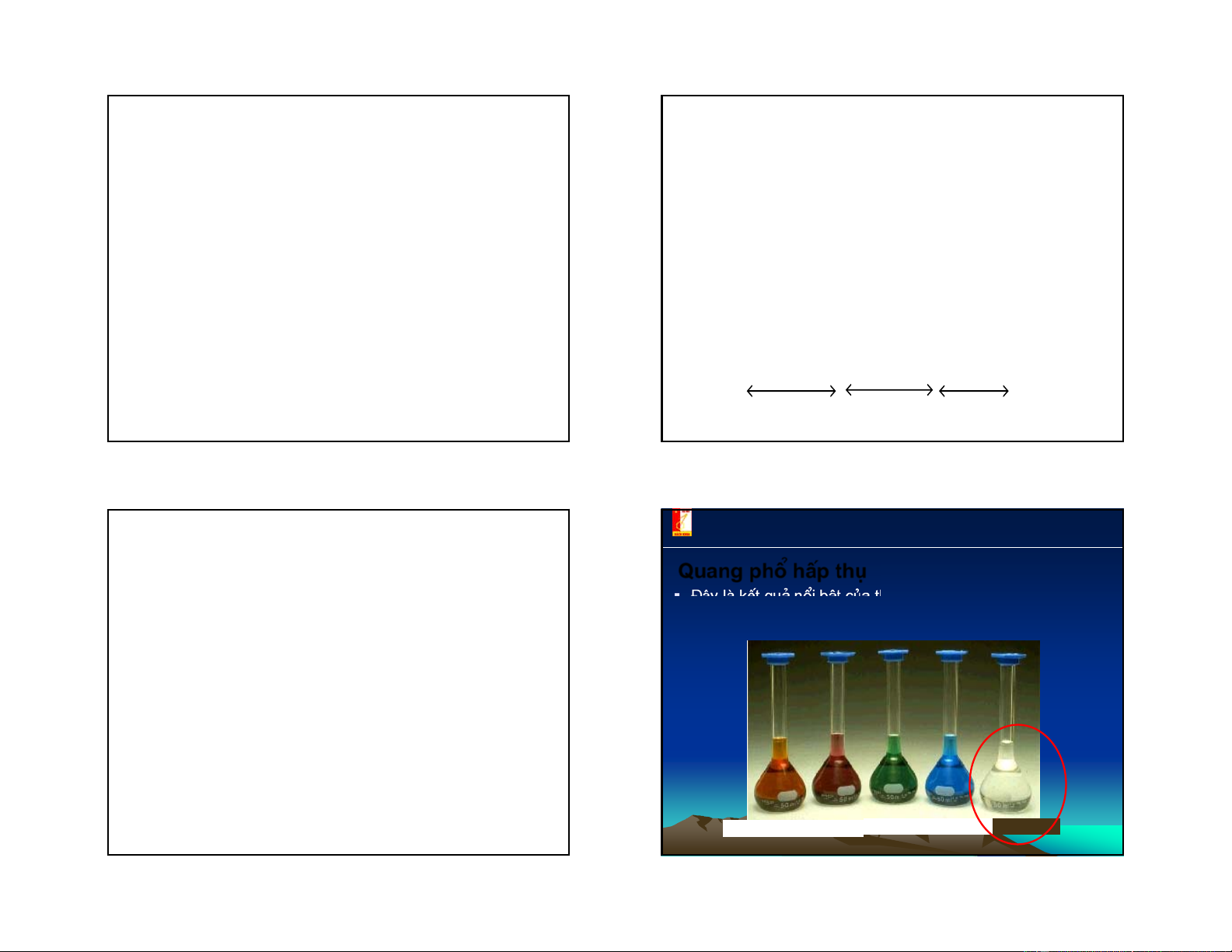
Các phối tử gây ra thông số tách lớn như CO, CN- vì
§©y lμ kÕt qu¶ næi bËt cña thuyÕt trêng tinh thÓ: nã ®· gi¶i
trong chúng tồn tại liên kết cộng hoá trị, chúng có khả
thÝch mμu cña phøc chÊt cña c¸c kim lo¹i chuyÓn tiÕp bëi ®a
năng tạo liên kết với nhân trung tâm.
sè phøc chÊt cña kim lo¹i chuyÓn tiÕp lμ cã mμu.
- Điện tích của ion trung tâm cũng ảnh hưởng đến
thông số tách: Ion có điện tích lớn có lớn, vì ion có
điện tích lớn có khả năng hút mạnh phối tử về nó và
phối tử có tác dụng mạnh lên các obitan d của nhân.
Ví dụ các ion phức Cr2+ và Co2+ có thông số tách nhỏ
hơn các ion phức Cr3+ và Co3+
- Kích thước của ion trung tâm của ảnh hưởng đến
thông số tách: Ion phức của Cr3+ có thông số tách
nhỏ hơn ion phức tương tự Rh3+ [Fe(H O) ]3+ [Co(H O) ]2+ [Ni(H O) ]2+
[Cu(H O) ]2+ [Zn(H O) ]2+ 2 6 2 6 2 6 2 6 2 6 43 44 11 4/20/2019
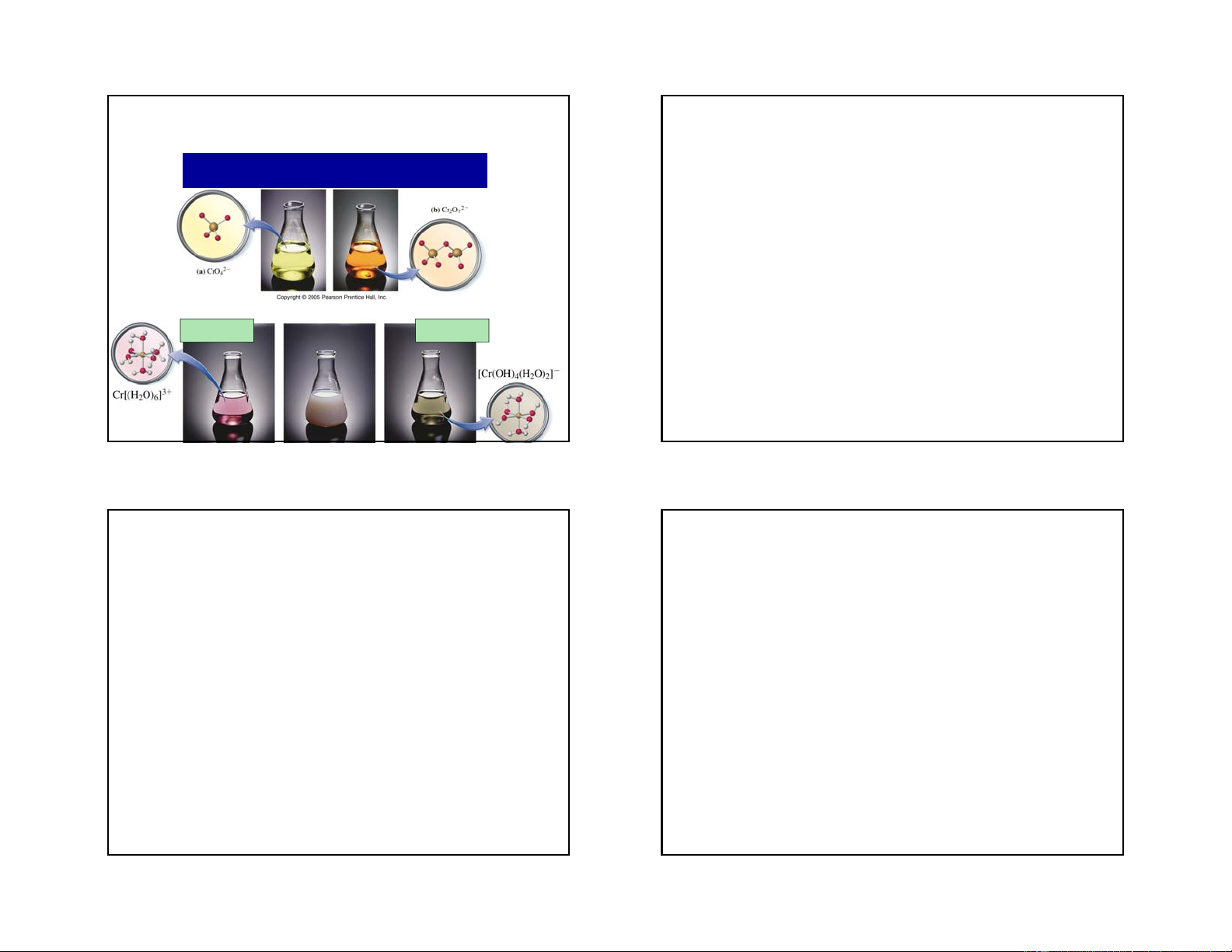
Nguyên nhân gây ra màu của phức chất
Sự hấp thụ ánh sáng và
nguyên nhân tạo màu sắc … còn lại ánh Ánh sáng sáng xanh đi vàng bị hấp qua làm dung thụ… dịch được nhìn thấy màu xanh
… còn lại ánh sáng Ánh sáng xanh vàng đi qua làm bị hấp thụ… dugn dịch có màu vàng blue: 400-490 nm yellow-green: 490-580 nm red: 580-700 nm 45 46
Qui tắc về màu bổ sung xác định Quan
màu hấp thụ và màu quan sát hệ giữa chất hấp thụ và màu quan sát 47 48 12 4/20/2019
Hanoi university of technology
5. Hằng số điện ly và hằng số bền của ion phức:
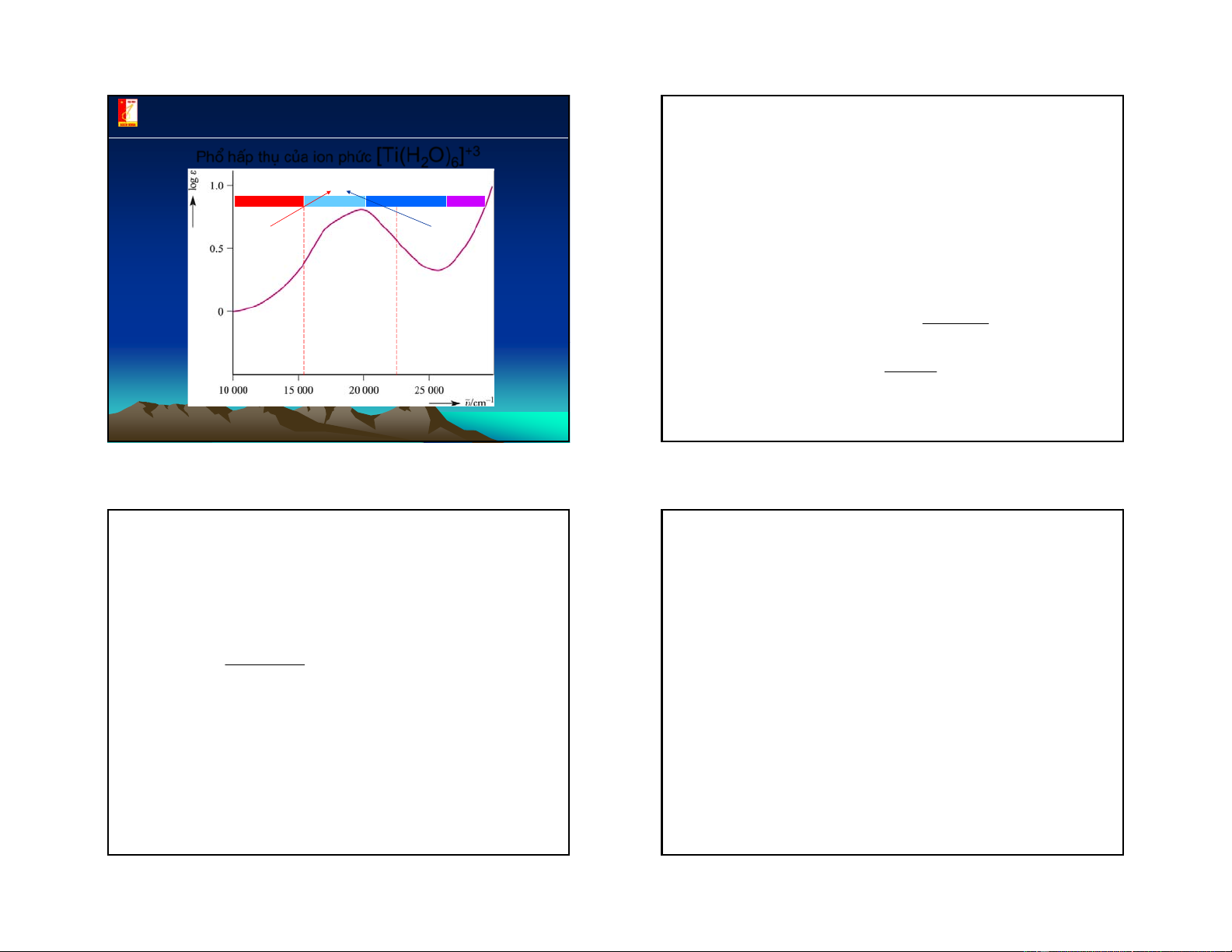
Phæ hÊp thô cña ion phøc [Ti(H
Trong dung dịch phức chất thường bị phân ly thành 2O)6]+3 cầu nội và cầu ngoại: Phøc chÊt cã mμu tÝm
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
Sau đó ion phức lại bị phân ly thành ion trung tâm và Vïng cho Vïng cho
các phối tử. Đại lượng đặc trưng cho sự điện ly của ¸nh s¸ng ®i ¸nh s¸ng ®i qua
ion phức được gọi là hằng số điện ly: qua Vïng hÊp thô [ ( Ag NH)] .[NH] 3 3
[Ag(NH ) ]+ ⇋ [Ag(NH )]+ + NH K 3 2 3 3; 1 [ ( Ag NH) ] 3 2 K [ ] Ag .[NH ] 3 [Ag(NH )]+ ⇋ Ag+ + NH ; 2 3 3 [ ( Ag NH )] 3 49 50
Hằng số điện ly K càng lớn khi ion phức phân ly
càng mạnh, nghĩa là ion phức càng kém bền. Bởi
Tæng cña hai ph¶n øng trªn ta cã:
vậy hằng số điện ly K chỉ độ bền của ion phức trong
dung dịch còn được gọi là hằng số không bền ký [Ag(NH3)2]+ ⇋ Ag+ + 2NH3 hiệu là Kkb.
H»ng sè ®iÖn ly cña qu¸ tr×nh ph©n ly:
Đa số các ion phức là chất kém điện ly, quá trình 2 K = Ag .NH3 = K
phân ly chuyển dịch mạnh về phía trái của quá trình 1.K2 ) Ag(NH tạo phức. 3 2
Để chỉ khả năng tạo phức của nguyên tử trung tâm,
người ta dùng hằng số cân bằng của quá trình
ngược với quá trình phân ly, gọi là hằng số bền Kb
và là nghịch đảo của hằng số không bền: K = K -1 b kb 51 52 13 4/20/2019
H»ng sè bÒn tæng vμ h»ng sè bÒn tõng nÊc:
Qu¸ tr×nh t¹o thμnh vμ qu¸ tr×nh ph©n ly cña ion phøc x¶y ra theo
tõng nÊc, øng víi mçi nÊc cã mét h»ng sè bÒn vμ h»ng sè kh«ng
bÒn, ®èi víi ion phøc [Ag(NH ) ]+: 3 2 Ag(NH ) 3 Ag+ + NH ⇆ K 3 [Ag(NH3)]+ 1 b [Ag ].[NH 3 ] Ag(NH) 3 2
[Ag(NH )]+ + NH ⇆ [Ag(NH ) ]+; 3 3 3 2 K 2b Ag(NH3 ) [NH ] 3
Trong trường hợp tổng quát hằng số bền tổng cộng của
một ion phức bất kỳ được tính bằng công thức sau: = (K .K …K ) nb 1 2 n b 53 54 55 14



