

Preview text:
Bài Phúc Trình
Bài 2: Chuẩn Độ Phức Chất
III. Chuẩn Độ Phức Chất: Xác Định Hàm Lượng Ca2+ Và Mg2+ Bằng Dung Dịch EDTA 0,01M. 1) Thực hành:
a) Xác định hàm lượng tổng cộng các ion Ca2+ và Mg2+ : ─
Dùng pipet lấy 50ml mẫu nước phân tích cho vào erlen 250ml, thêm vào 3ml
dung dịch đệm amoniac và một ít chỉ thị Eriocrom Blank T → dung dịch có màu đỏ rượu vang. ─
Rửa sạch buret bằng nước cất, dung dịch EDTA 0,01N. ─
Rót dung dịch EDTA 0,01N vào buret rồi điều chỉnh về vạch 0. ─
Mở khóa cho dung dịch EDTA 0,01N chảy từ từ vào erlen, đến khi dung dịch
chuyển sang màu xanh dương rõ thì ngừng chuẩn độ và ghi thể tích EDTA.
( lập lại thí nghiệm 4 lần).
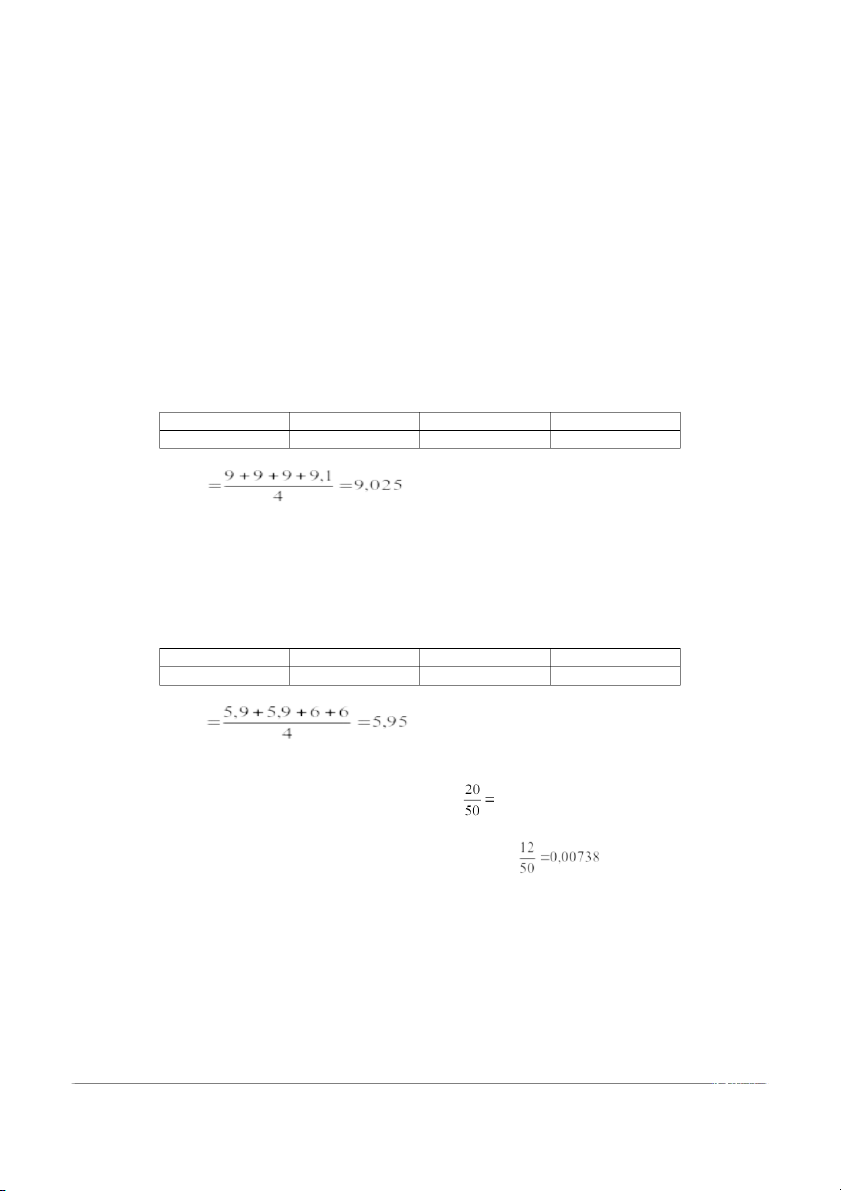
Thể tích sau 4 lần chuẩn độ: Vlần1 Vlần2 Vlần3 Vlần4 9 9 9 9,1 → V1 b) Xác định Ca2+ : ─
Dùng pipet lấy 50ml mẫu nước phân tích cho vào erlen 250ml, thêm vào 3ml
dung dịch NaOH 1M và một ít chỉ thị Murexit
→ dung dịch có màu hồng cam nhạt. ─
Rót dung dịch EDTA 0,01N vào buret cho đầy rồi điều chỉnh về vạch 0. ─
Mở khóa cho dung dịch EDTA 0,01N chảy từ từ vào erlen, đến khi dung dịch nghiệm 4 lần).
Thể tích sau 4 lần thí nghiệm: Vlần1 Vlần2 Vlần3 Vlần4 5,9 5,9 6 6 → V2 c) Kết quả: Hàm lượng Ca2+ : mCa2+= 0,01. V1 . ECa / 50 =0,01 . 5,95 . 0,0238 Hàm lượng Mg2+:
mMg2+= 0,01. ( V1 - V2 ). EMg / 50 =0,01 . ( 9,025-5,95).
Bài 3: Khảo Sát Ảnh Hưởng Của Nồng Độ, Nhiệt Độ Và Chất Xúc Tác
Đến Tốc Độ Phản Ứng. A. Thực Hành:
I. Ảnh Hưởng Của Nồng Độ Đến Tốc Độ Phản Ứng: ─
Chuẩn bị đồng hồ bấm giây ─
Khi bắt đầu thả một giọt H2SO4 vào tiếp xúc với dung dịch Na2S2O3 thì bấm
đồng hồ để tính thời gian của Na2S2O3 bắt đầu tiếp xúc với H2SO4 đến khi bắt
đầu xuất hiện màu trắng đục của bột S thì ghi nhận thời gian. ↓ Ống Na2S2O3 H2O H2SO4 2N Thể tích Thời gian nghiệm chung kết tủa 1 4 giọt 8 giọt 1 giọt 13 giọt 11,76 giây 2 8 giọt 4 giọt 1 giọt 13 giọt 7,53 giây 3 12 giọt 0 giọt 1 giọt 13 giọt 5,52 giây
Nhận xét: nồng độ của Na2S2O3 càng tăng thì thời gian kết tủa cành nhanh.
II. Ảnh Hưởng Của Nhiệt Độ Đến Tốc Độ Phản Ứng:
1) Thí nghiệm ở nhiệt độ nước bình thường ( t0 C ). 0 ─
Cho nước vào khoảng 1/2 becher 250ml, dùng nhiệt kế đo được 25 C +
Ống nghiệm 1: cho ba giọt Na2S2O3 + 9 giọt H2O +
Ống nghiệm 2: cho 20 giọt H2SO4 2N ─
Nhúng cả hai ống nghiệm vào trong becher nước ở trên trong hai phút ─
Dùng ống nhỏ giọt lấy một giọt H2SO4 ở ống nghiệm 2 cho vào ống nghiệm 1.
dùng đồng hồ bấm giây tính được thời gian kết tủa là 23 giây.
2) Làm thí nghiệm ở nhiệt độ H 0 2O + 10 C . 0 ─
Cho nước đã đun sôi vào becher chứa 1/2 nước ở trên, nhiệt độ là 35 C +
Ống nghiệm 3: cho 3 giọt Na2S2O3 + 9 giọt H2O +
Ống nghiệm 4: cho 20 giọt H2SO4 2N ─
Nhúng cả hai ống nghiệm vào trong becher nước ở trên trong hai phút. ─
Dùng ống nhỏ giọt lấy một giọt H2SO4 ở ống nghiệm 4 cho vào ống nghiệm 3.
dùng đồng hồ bấm giây tính được thời gian kết tủa là 14,37 giây.
3) Làm thí nghiệm ở nhiệt độ H 0 2O + 20 C . 0 ─
Tiếp tục cho nước đun sôi vào becher chứa 1/2 nước ở trên, nhiệt độ là 45 C +
Ống nghiệm 5: cho 3 giọt Na2S2O3 + 9 giọt H2O +
Ống nghiệm 6: cho 20 giọt H2SO4 2N ─
Nhúng cả hai ống nghiệm vào trong becher nước ở trên trong hai phút. ─
Dùng ống nhỏ giọt lấy một giọt H2SO4 ở ống nghiệm 6 cho vào ống nghiệm 5.
dùng đồng hồ bấm giây tính được thời gian kết tủa là 6,48 giây.
Nhận xét: nhiệt độ càng tăng thì tốc độ phản ứng diễn ra càng nhanh.
III. Ảnh Hưởng Của Xúc Tác Đến Tốc Độ Phản Ứng. ─
Lấy becher nhỏ dùng ống đong đong 20ml H2O + 4 giọt dung dịch FeCl3 + 4
giọt dung dịch KSCN bão hòa, lăc đều thu được Fe(SCN)3 có màu đỏ máu. ─ Chuẩn bị 4 ống nghiệm +
Ống nghiệm 1: cho vào 5ml dung dịch Fe(SCN)3 +
Ống nghiệm 2: cho vào 1ml dung dịch Na2S2O3 0,5N
→ Đổ ống nghiệm 2 vào ống nghiệm 1→ thời gian mất màu hoàn toàn là 14,67 giây +
Ống nghiệm 3: cho vào 5ml dung dịch Fe(SCN)3 + 2 giọt CuSO4 bão hòa +
Ống nghiệm 4: cho vào 1ml dung dịch Na2S2O3 0,5N
→ Đổ ống nghiệm 4 vào ống nghiệm 3→ thời gian mất màu hoàn toàn là 3,28 giây IV. Cân Bằng Hóa Học. ─
Cho vào becher 15ml dung dịch NH3 2M + 8 giọt phenolphthalein, chia đều vào 5 ống nghiệm. +
Ống nghiệm 1: giữ nguyên để so sánh +
Ống nghiệm 2: đun nóng từ từ vừa đến sôi, ta thấy màu của dung dịch chỉ nhạt hơn một chút. +
Ống nghiệm 3: Cho thêm một ít (hạt ngô) tinh thể NH4C1, lắc mạnh cho
NH4C1 tan ra hết trong dung dịch, màu sắc dung dịch trong ống nghiệm 3 có
màu nhạt hơn ống nghiệm 1. +
Ống nghiệm 4: Thêm từ từ từng giọt dung dịch H2SO4 2 M, lắc mạnh, dung
dịch mất màu ( đục) hoàn toàn. +
Ống nghiệm 5: Thêm từ từ từng giọt dung dịch Al2(SO4)3 , lắc mạnh, dung
dịch mất màu ( kết tủa dạng keo) hoàn toàn. Nhận xét:
Ảnh hưởng của nhiệt độ làm cho dung dịch nhạt màu
Ảnh hưởng của nồng độ làm cho dung dịch mất màu




