



Preview text:
CƠ CHẾ SINH UNG THƯ
Nguyễn Quốc Bảo, Đoàn Trọng Nghĩa
MỤC TIÊU BÀI GIẢNG
1. Mô tả các dạng tổn thương DNA và cơ chế sửa chữa
2. Hiểu ược chức năng của tiền gen sinh ung, gen sinh ung và các con ường dẫn
truyền tín hiệu tế bào (TB)
3. Hiểu ược chức năng của gen è nén bướu và sự mất dị hợp tử
4. Hiểu ược chức năng của Telomere, Telomerase
5. Hiểu ược cơ chế chết TB theo lập trình
6. Hiểu ược cơ chế ngoài gen của sự sinh ung thư 1. MỞ ĐẦU
Ung thư hiện là gánh nặng sức khỏe cho toàn cầu với xuất ộ và tử vong ngày càng
tăng nhanh. Theo ghi nhận ung thư toàn cầu năm 2018, ước tính có 18,1 triệu bệnh nhân
mới mắc ung thư và 9,6 triệu người tử vong vì căn bệnh này. Sự sinh ung thư ược xem
là một tiến trình a giai oạn, phức tạp với sự thay ổi về kiểu hình cũng như ở mức ộ phân
tử. Bướu ác tính có một số ặc trưng về mặt kiểu hình như tăng trưởng quá mức, xâm lấn
các mô lân cận và có khả năng di căn xa ến các cơ quan khác. Ở góc ộ phân tử, ung thư
là sự rối loạn của các tế bào bên trong cơ thể do sự tích lũy những tổn thương di truyền,
khiến cho những tế bào này có những ưu thế tăng trưởng hơn so với các tế bào bình
thường, hay còn gọi là sự tăng trưởng không kiểm soát ược. Trong phạm vi bài viết này
sẽ ề cập ến những cơ chế phân tử của sự sinh ung thư. 2. NỘI DUNG
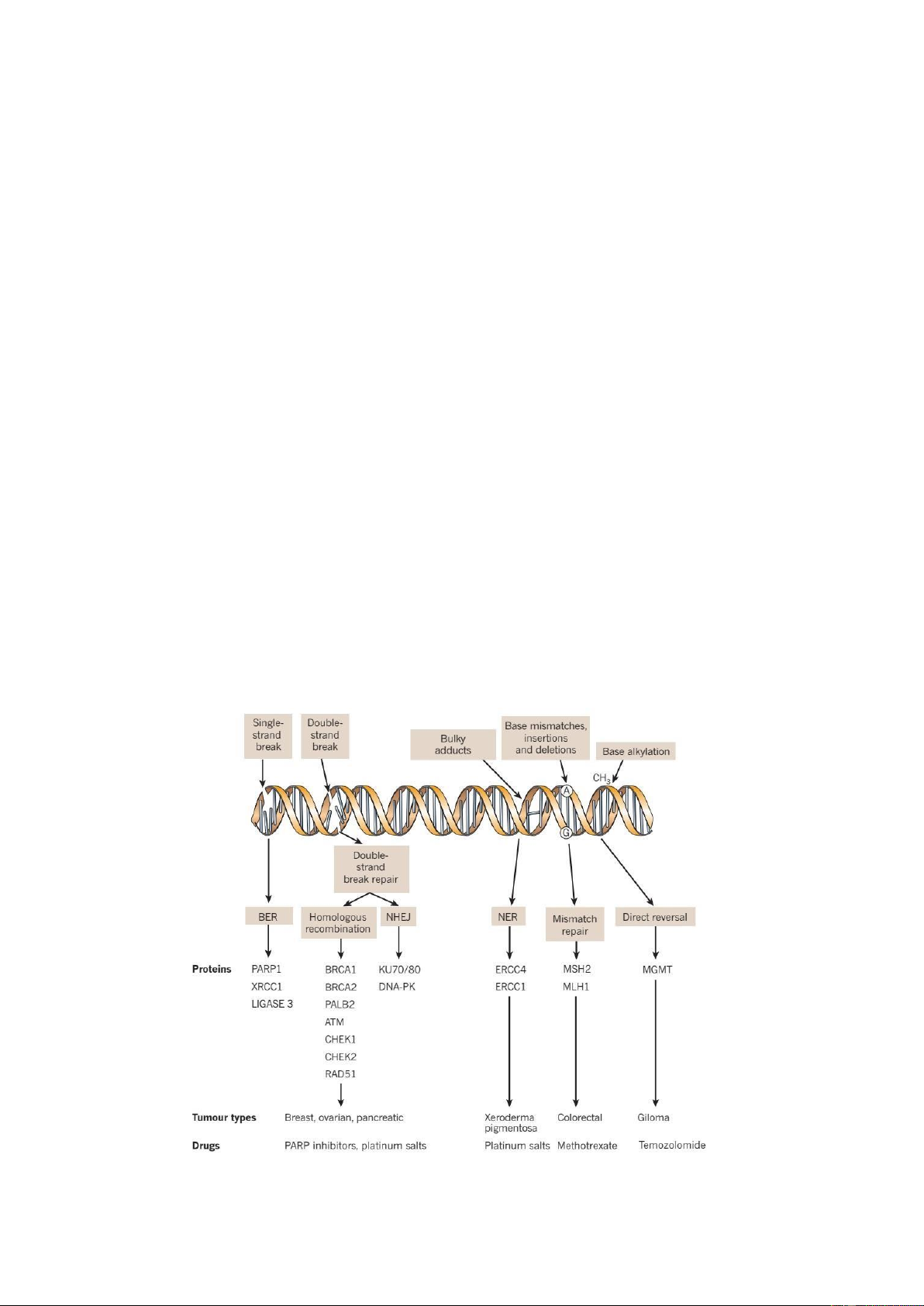
2.1. Tổn thương DNA và cơ chế sửa chữa
Tổn thương DNA hay còn gọi là ột biến gen là biến cố không thể tránh khỏi trong
quá trình sống. Có nhiều nguyên nhân gây nên các thay ổi về cấu trúc DNA mà y học
ngày càng hiểu rõ hơn. Phần lớn những ột biến gen này là kết quả của sự tiếp xúc của
cơ thể với những tác nhân từ môi trường bên ngoài, ược phân thành 3 nhóm: yếu tố vật
lý, hóa học và sinh học. Tia X, tia cực tím là những yếu tố vật lý thường ược nhắc ến và
ây cũng là nguyên nhân gây nên nhiều bệnh lý ung thư như ung thư da, ung thư tuyến
giáp… Các yếu tố hóa học thì có rất nhiều, có thể kể ến các hóa chất sinh ung thư có
trong khói thuốc lá (gây ung thư phổi, ung thư hốc miệng, thanh quản…) hoặc chất
Nitrosamine có trong những thực phẩm chế biến dạng muối (muối chua, mắm) gây ung
thư dạy dày. Yếu tố sinh học, cụ thể là virút, vi khuẩn ngoài việc gây nên các bệnh lý
viêm nhiễm, cũng có vai trò trong sự sinh ung thư. Ước tính, virút và vi khuẩn có liên
hệ với khoảng 20% các loại bệnh ung thư, iển hình là virút viêm gan B, C (ung thư gan),
virút sinh u nhú ở người (ung thư cổ tử cung, ống hậu môn) hoặc xoắn khuẩn môn vị
(ung thư dạ dày). Ngoài ra, những tổn thương DNA có thể xảy ra do sự sai sót trong quá
trình nhân ôi tế bào hoặc tế bào tiếp xúc với những sản phẩm hóa học sinh ra trong quá
trình chuyển hóa của cơ thể.
Những tổn thương DNA ( ột biến gen) ược phân chia thành 2 nhóm lớn là ột biến
về cấu trúc và ột biến về chức năng. Thay ổi về mặt cấu trúc có thể do thêm nucleotide,
mất nucleotide, thay nucleotide hoặc những ột biến phức tạp hơn (pha trộn nhiều loại ột
biến). Tất cả những sự thay ổi này sẽ dẫn ến sự thay ổi về mặt chức năng của gen, bao
gồm: ột biến làm tăng chức năng của gen hoặc làm mất chức năng. Ước tính, mỗi ngày
cơ thể người có thể xảy ra khoảng 104 ến 106 các tổn thương DNA với những mức ộ
khác nhau. Nếu như các ột biến gen này ược tích lũy dần theo thời gian sẽ tạo nên những
protein có chức năng không phù hợp, gây bệnh lý. Ngoài ra, nếu ột biến xảy ra ở tế bào
mầm sinh dục sẽ có khả năng di truyền cho thế hệ sau.
Nói như vậy không ồng nghĩa với việc xảy ra tổn thương DNA là gây nên bệnh
lý. May mắn thay, cơ thể người ã ược trang bị sẵn các cơ chế nhằm phục hồi hoặc loại
bỏ những tổn thương DNA này, mà cơ chế tự sửa chữa DNA là một trong số ó. Mục ích
của quá trình tự sửa chữa DNA của tế bào là giúp oạn DNA bị tổn thương phục hồi lại
trình tự nucleotide vốn dĩ bình thường trước ây. Có nhiều cơ chế sửa chữa DNA khác
nhau, sẽ ược sử dụng tùy thuộc vào những loại tổn thương DNA khác nhau. Có cơ chế
chỉ là ơn giản sửa chữa các bazơ nitơ và cũng có những cơ chế phức tạp hơn như cắt bỏ
oạn DNA bị tổn thương và dùng nhánh ối diện ể tạo nên trình tự DNA bình thường, dựa
theo nguyên tắc bổ sung. Tuy nhiên không phải lúc nào các cơ chế này cũng hoạt ộng
hoặc hoạt ộng có hiệu quả. Nếu như iều này xảy ra thì các tổn thương DNA sẽ không
ược sửa chữa, lâu dần cơ thể sẽ tích lũy ủ các ột biến gây bệnh.
Hình 1: Các loại tổn thương DNA và những cơ chế / protein tham gia sửa chữa
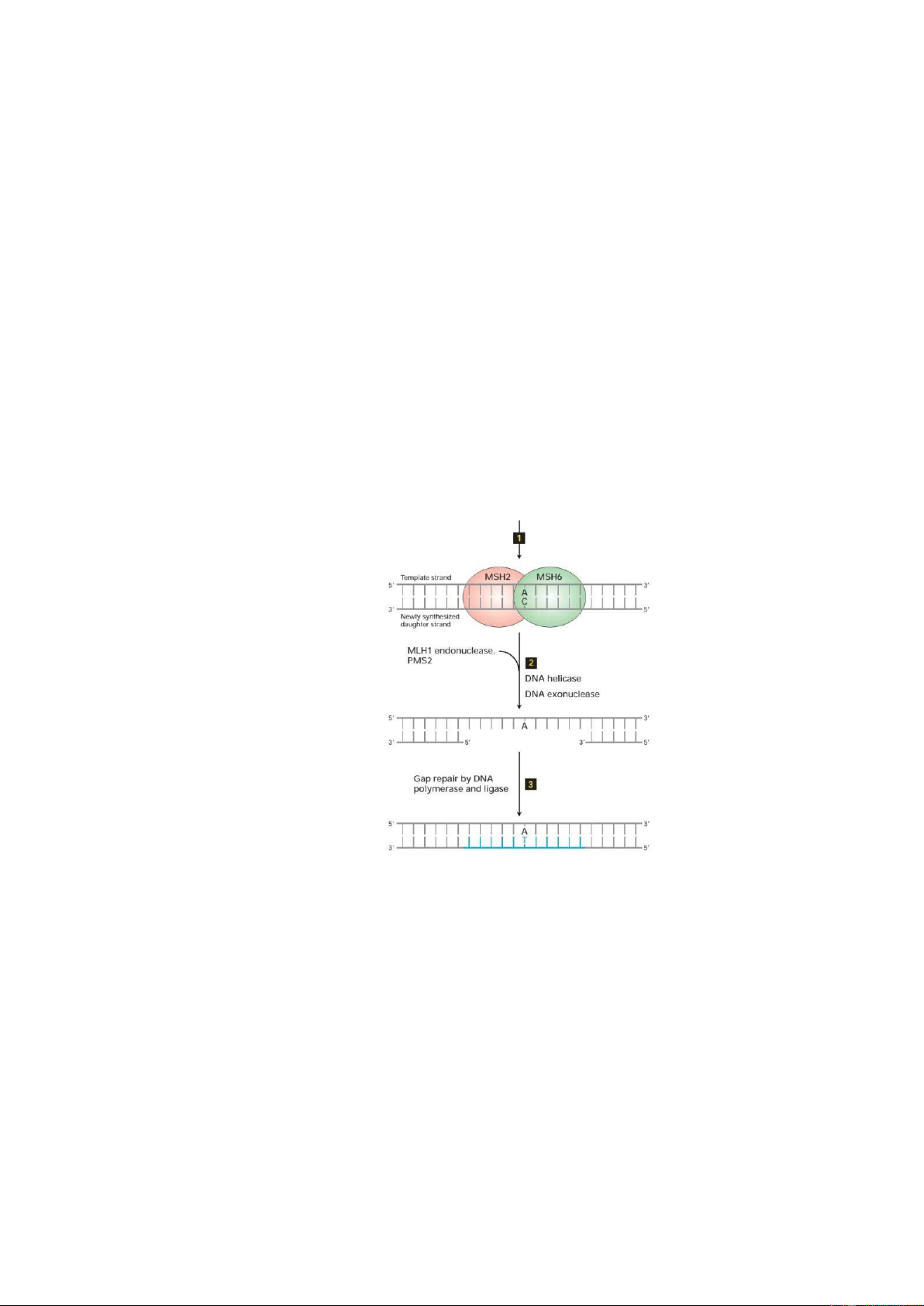
Lấy ví dụ là cơ chế sửa chữa sự bắt cặp sai (MMR: miss-match repair), có thể gặp
trong hội chứng Lynch (hay ung thư ại trực tràng di truyền không polyp). Hội chứng
Lynch chiếm tỉ lệ 2-5% các trường hợp ung thư ại trực tràng, ngoài ra còn có thể gây
một số loại bệnh lý khác như ung thư nội mạc tử cung, dạ dày, ruột non, tụy, tuyến tiền
liệt và da …. Đây là hội chứng di truyền theo gen trội, làm mất chức năng của protein
sửa chữa bắt cặp sai như MSH2, MSH6, MLH1, PMS2. Các protein này óng vai trò quan
trọng trong việc sửa chữa các sai lệch bắt cặp của DNA trong quá trình nhân ôi. Bình
thường protein MSH6, MSH2 sẽ i kiểm tra dọc theo chiều dài oạn DNA, nếu như phát
hiện ra có sự bắt cặp sai các bazơ nitơ như Adenin với Cytosin sẽ thông báo và huy ộng
những protein MLH1 và PMS2 ến vị trí này, thực hiện tháo xoắn DNA và cắt bỏ oạn
DNA bị sai sót. Tiếp theo, men DNA polymerase sẽ giúp tổng hợp nên oạn
DNA mới dựa vào nhánh ối diện theo nguyên tắc bổ sung. Sau ó, ligase sẽ giúp
gắn oạn DNA mới tổng hợp vào khuyết hổng trước ó. Trong iều kiện các gen MMR bị
ột biến mất chức năng thì cơ chế sửa chữa này sẽ bị bất hoạt và gây nên bệnh lý.
Hình 2: Vai trò sửa chữa DNA của các protein sản phẩm của gen MMR
2.2. Tiền gen sinh ung – gen sinh ung
Tiền gen sinh ung (proto-oncogene) có trong các tế bào bình thường của cơ thể
và có chức năng liên quan ến tăng sinh tế bào. Khi tiền gen sinh ung bị ột biến theo kiểu
tăng hoạt ộng và trở thành gen sinh ung. Các gen này sẽ mã hóa cho các protein sinh
ung. Protein sinh ung có thể óng vai trò của bất cứ thành phần nào trong con ường dẫn
truyền tín hiệu tế bào, bao gồm: yếu tố tăng trưởng (EGF, TGF, FGF…), thụ thể yếu tố
tăng trưởng, yếu tố dẫn truyền tín hiệu tế bào, protein G, những thành phần của chu kỳ
tế bào hoặc yếu tố sao chép. Gen sinh ung bị ột biến do nhiều cơ chế như ột biến làm
chuyển vị gen (chuyển tiền gen sinh ung nằm ngay phía sau vùng khởi ộng), chèn oạn
gen sinh ung từ virút, biểu hiện quá mức protein sinh ung do sự khuếch ại tiền gen sinh
ung hoặc gen sinh ung hoặc xảy ra ột biến iểm làm thay ổi cấu trúc và chức năng của
tiền gen sinh ung làm gen sản xuất ra protein sinh ung, tham gia vào quá trình iều hoà
và thúc ẩy sự sinh sản tế bào.
Hình 3: Bản chất của các protein sinh ung
Các protein dẫn truyền tín hiệu nằm ở mặt trong màng tế bào, nhận tín hiệu từ sự
hoạt hóa thụ thể yếu tố tăng trưởng ngoài tế bào và dẫn truyền vào trong nhân tế bào.
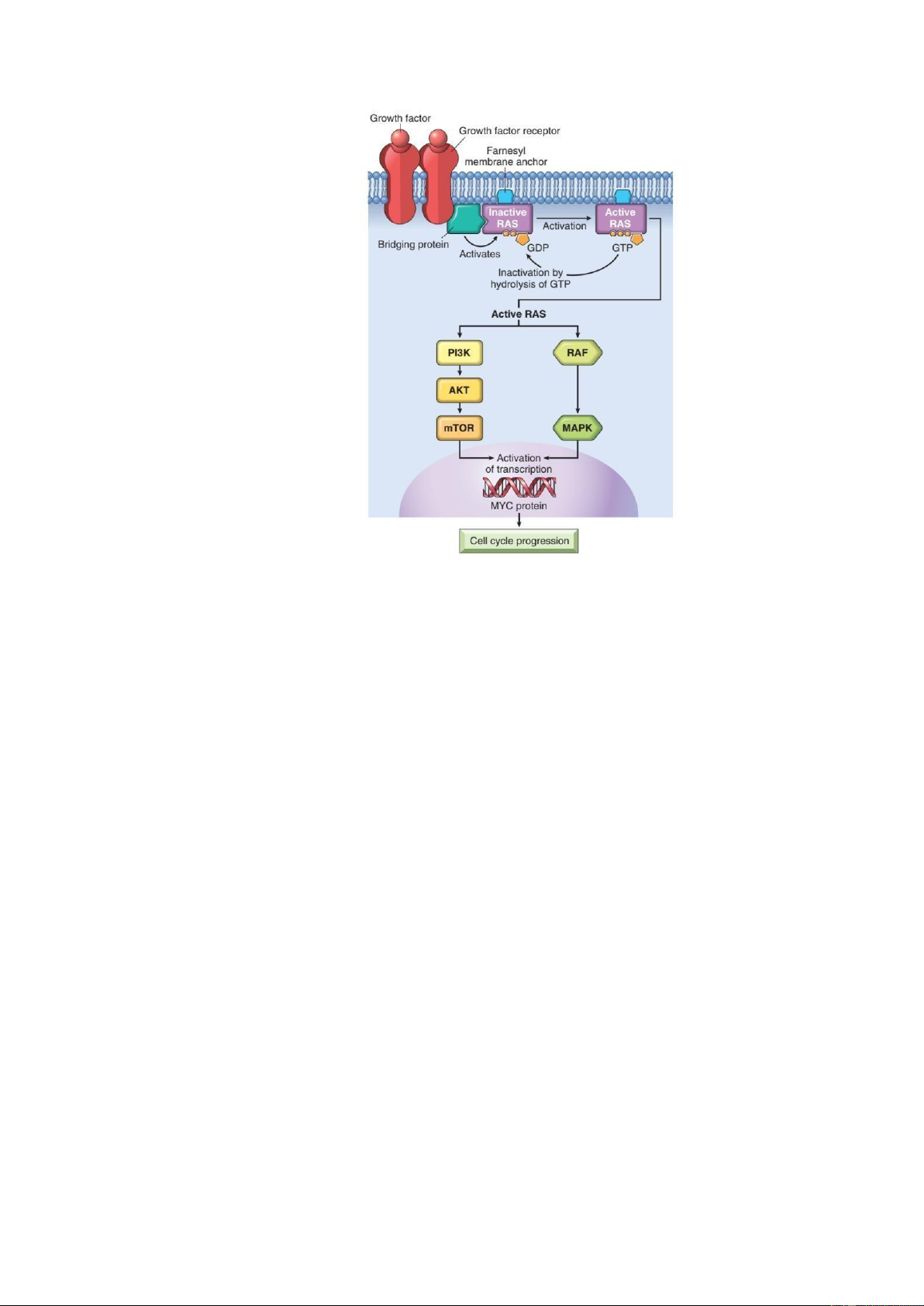
RAS là một protein dẫn truyền tín hiệu và ột biến gen RAS thường gặp trong các bệnh
lý ung thư (15 – 20% trường hợp ung thư ở người). Một số bệnh lý có tỉ lệ cao ột biến
gen RAS như carcinôm tuyến của tụy và carcinôm ường mật (90%), ung thư ại tràng,
nội mạc tử cung và tuyến giáp (50%), carcinôm tuyến ở phổi và bạch cầu dòng tủy
(30%). Dạng ột biến gen RAS thường gặp là ột biến iểm. Khi protein RAS gắn kết với
GDP sẽ ở trạng thái bất hoạt và ngược lại, khi gắn kết với GTP sẽ chuyển thành trạng
thái hoạt hoá. Protein RAS khi ược hoạt hóa sẽ hoạt ộng trên con ường dẫn truyền MAP
kinase, thu hút protein RAF-1. MAP kinase hoạt hóa yếu tố sao chép nhân, thúc ẩy sự
phân bào. Trong tế bào bình thường, sự hoạt hóa protein RAS là thoáng qua do men
GTPase nội sinh sẽ thủy phân GTP thành GDP ể chuyển RAS từ trạng thái hoạt ộng
thành không hoạt ộng. Vì vậy, mà tín hiệu phân bào là không liên tục. Ở tế bào mang
gen RAS bị ột biến thì protein RAS ược hoạt hóa liên tục do mất khả năng thủy phân
GTP nên sẽ kích thích tế bào tăng sinh liên tục. Một ví dụ khác về protein sinh ung óng
vai trò là thụ thể yếu tố tăng trưởng. Protein RET ược mã hóa từ tiền gen sinh ung RET,
óng vai trò là thụ thể cho tế bào thần kinh ệm, giúp thúc ẩy sự sống còn tế bào trong quá
trình phát triển thần kinh. Bình thường, gen RET biểu hiện ở những tế bào thần kinh –
nội tiết, bao gồm: tế bào cận nang tuyến giáp (tế bào C), tế bào vùng tủy thượng thận,
tiền thân của tế bào tuyến phó giáp. Nếu tiền gen sinh ung RET (chức năng thúc ẩy sự
tăng sinh tế bào) không bị ột biến theo hướng tăng chức năng trong bệnh lý ung thư mà
ột biến theo hướng mất chức năng sẽ gây ra bệnh Hirchsprung (phình ại tràng bẩm sinh).
Ở những bệnh nhân Hirchsprung, ám rối thần kinh ruột không phát triển ược nên sẽ gây
ra táo bón kéo dài và tắc ruột.
Hình 4: Cơ chế hoạt ộng của protein RAS 2.3.
Gen è nén bướu và sự mất dị hợp tử
Ngược lại với gen sinh ung, gen è nén bướu (tumor suppressor gene) là những
gen mã hóa cho những protein có chức năng kìm hãm sự phân bào. Một số ý kiến cho
rằng tên gen è nén bướu là dùng sai thuật ngữ do chức năng sinh lý của các gen này là ể
iều hòa sự tăng trưởng tế bào, chứ không ơn thuần chỉ là ngăn ngừa sự thành lập bướu.
Trong quá trình sinh ung thư, bên cạnh sự hoạt hoá liên tục các gen có chức năng phân
bào (gen sinh ung) thì cũng cần phải bất hoạt chức năng của những gen có chức năng
kìm hãm sự phân bào. Các tác giả ã mượn hình ảnh của chiếc xe ể minh hoạ cho cơ chế
hoạt ộng của gen sinh ung và gen èn nén bướu trong quá trình sinh ung thư.
Tay ga trên chiếc xe ược ví như là gen sinh ung và tay thắng chính là gen è nén bướu.
Vậy ể khối tế bào tăng trưởng liên tục thì cần tăng cường hoạt ộng của gen sinh ung (lên
tay ga hết mức) và ồng thời phải bất hoạt chức năng của gen è nén bướu (gỡ tay thắng
của chiếc xe). Do mỗi gen trong tế bào gồm 2 alen có cùng 1 chức năng nên ể gây mất
chức năng gen è nén bướu cần thiết phải bất hoạt cả 2 alen này. Các cơ chế làm ột biến
mất chức năng của gen è nén bao gồm: ột biến iểm (tạo ra protein mất chức năng hoặc
sai lệch chức năng), ột biến mất oạn DNA (làm mất oạn gen è nén bướu và các gen kế
cận) hoặc do xảy ra lỗi trong quá trình tách ôi nhiễm sắc thể (dẫn ến một số tế bào bị
mất toàn bộ một nhiễm sắc thể).
Về lịch sử, gen è nén bướu ược phát hiện khi thực hiện nghiên cứu bệnh bướu
nguyên bào võng mạc (bệnh lý hiếm gặp ở trẻ em, tần suất mắc bệnh là 1 / 20.000 trẻ).
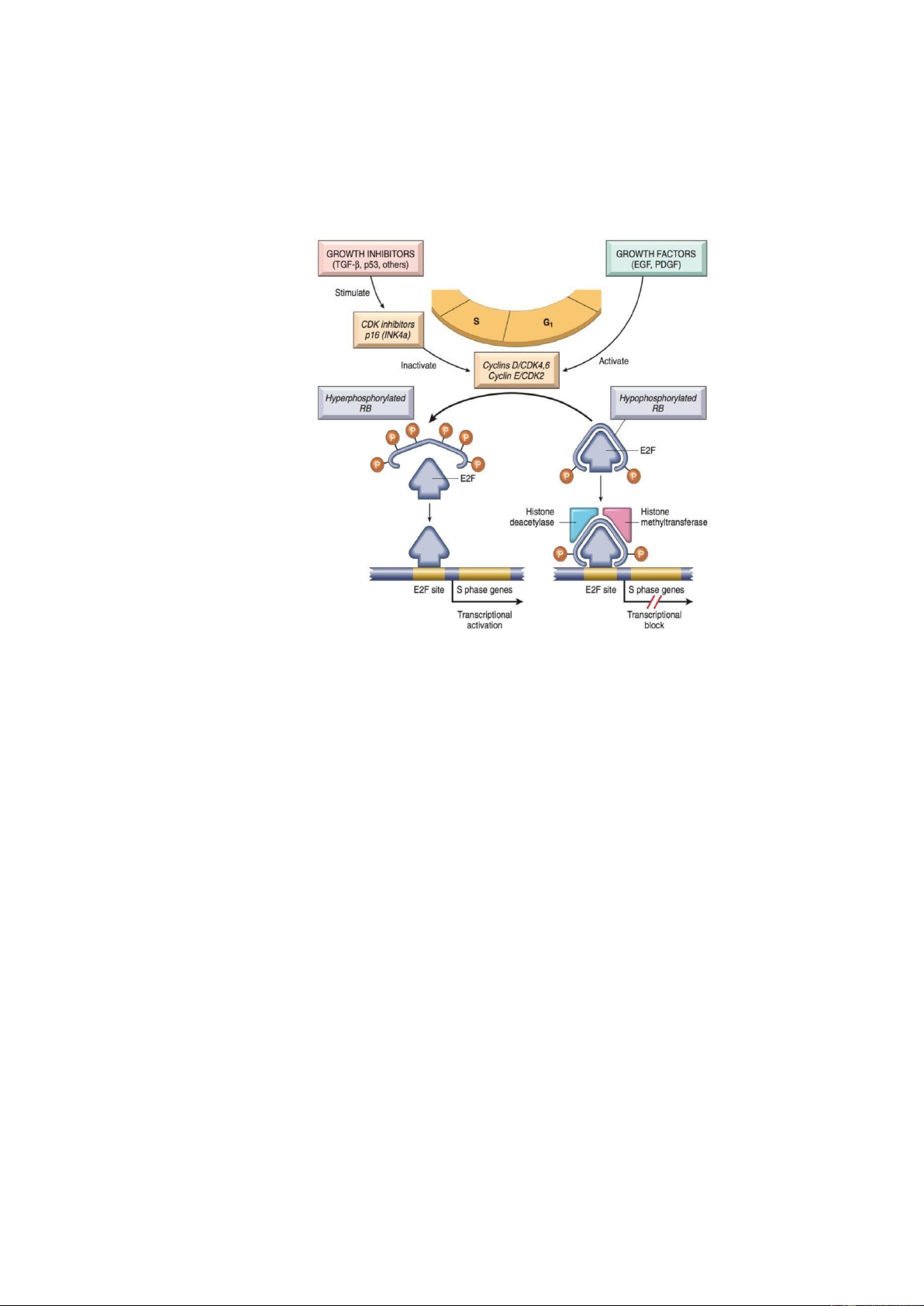
Bướu nguyên bào võng mạc xảy ra là do ột biến gen è nén Rb, nằm trên nhiễm
sắc thể 13. Gen Rb mã hoá cho protein Rb, óng vai trò then chốt trong iều hòa chu kỳ tế
bào. Ở trạng thái hoạt hóa, Rb gắn kết và gây bất hoạt yếu tố sao chép E2F; từ ó sẽ kìm
hãm không cho tế bào từ pha G1 i vào pha S ( iểm kiểm soát G1/S). Ngược lại, ở trạng
thái bất hoạt, protein Rb bị mất chức năng, sẽ làm hoạt hóa yếu tố E2F. Yếu tố E2F sẽ
gắn với vùng khởi ộng của gen Cyclin E làm tăng biểu hiện protein Cyclin E và sự tổng
hợp phức hợp Cdk2-cyclin E và sau cùng sẽ thúc ẩy tăng sinh tế bào.
Hình 5: Cơ chế hoạt ộng của gen Rb
Tác giả Alfred Knudson, năm 1971 ã ề xuất ra giả thuyết “2 cú ánh” ể giải thích
cho 2 thể bệnh của bướu nguyên bào võng mạc, gồm thể di truyền (chiếm 1/3 các trường
hợp) và thể ơn lẻ (chiếm 2/3 các trường hợp). Hai cú ánh này là cần thiết và lần lượt
tương ứng cho sự bất hoạt 2 alen của gen Rb. Trong thể bệnh di truyền thì ột biến ã hiện
diện từ giao tử của tế bào cha hoặc mẹ. Khi hợp nhất lại thành hợp tử thì trong hợp tử
này ã mang sẵn 1 alen ột biến. Vì vậy, khi từ tế bào hợp tử này nhân ôi ể tạo ra những
thế hệ tế bào sau này thì tất cả các tế bào trong cơ thể khi em bé vừa chào ời ều có mang
1 ột biến. Đây chính là cú ánh ầu tiên. Vì vậy, trong quá trình sống sau này theo thời
gian, khi tiếp xúc với các yếu tố môi trường, chỉ cần xảy ra thêm 1 ột biến trên bất cứ
nguyên bào võng mạc nào cũng có thể tạo nên bướu (cú ánh thứ 2). Trong khi ó ở thể
bệnh ơn lẻ thì tế bào hợp tử hoàn toàn bình thường, không mang ột biến. Do vậy mà tất
cả các tế bào ược nhân ôi ở thế hệ sau cũng không mang ột biến alen của gen Rb. Để
hình thành nên bướu nguyên bào võng mạc thì cần xảy ra cú ánh ầu tiên là ột biến gây
bất hoạt 1 trong 2 alen của gen Rb ở trong nguyên bào võng mạc. Tiếp ó, phải cần thêm
cú ánh thứ 2 nhằm bất hoạt alen còn lại của gen Rb của cùng tế bào ó. Do tất cả các thế
hệ tế bào trong thể di truyền ều mang sẵn ột biến 1 alen của gen Rb nên thể bệnh này có
những ặc iểm thường xảy ra ở trẻ nhũ nhi, tổn thương thường ở 2 bên mắt và có thể i
kèm với các bệnh lý ung thư khác như sarcôm xương, sarcôm phần mềm, mêlanôm.
Ngược lại, ở thể bệnh ơn lẻ thường xảy ra ở lứa tuổi muộn hơn (2-5 tuổi), tổn thương
thường ở 1 bên mắt và không i kèm với các bệnh lý ác tính khác.
Hình 6: Bệnh sinh của bướu nguyên bào võng mạc thể di truyền và thể ơn lẻ
Về phân loại, có 2 nhóm gen è nén bướu gồm nhóm gen gác cổng (gatekeepers)
(Rb / E2F, APC / Beta-catenin) và nhóm chăm sóc bộ gen (caretakers). Nhóm gen có
vai trò chăm sóc bộ gen sẽ tham gia vào việc duy trì tính toàn vẹn của bộ gen thông qua
việc mã hoá những protein thực hiện sửa chữa những tổn thương cấu trúc nhiễm sắc thể,
những thay ổi trong trình tự DNA xảy ra trong quá trình nhân ôi DNA. Trong khi ó nhóm
gen gác cổng mã hoá những protein thực hiện chức năng tại các iểm kiểm soát trong chu
kỳ tế bào nhằm ngăn chặn tế bào bước qua những pha tiếp theo của chu kỳ tế bào nếu
như phát hiện có những bất thường ở tại iểm kiểm soát trước ó hoặc thậm chí sẽ thúc ẩy
tế bào này i vào con ường chết theo lập trình. Vì vậy sẽ ngăn chặn ược sự tăng sinh tế
bào trong những iều kiện bất thường. Gen p53 là gen è nén bướu ược biết ến nhiều nhất,
có vai trò trong hơn 50% trường hợp bệnh ung thư. Đây là gen a chức năng, ược ví như
“người canh gác bộ gen”. Chức năng bình thường của gen p53 bao gồm dừng chu kỳ tế
bào, tham gia sửa chữa DNA và thúc ẩy chết tế bào theo lập trình ối với những tổn
thương DNA không thể sửa chữa.
2.4. Telomere và telomerase
Có 2 vấn ề về cấu trúc của nhiễm sắc thể ã ược nêu ra trong các bài báo khoa học.
Đầu tiên, các ầu tận tự do của các nhiễm sắc thể có thể kết hợp với các nhiễm sắc thể kế
cận ể tạo nên tổ hợp nhiễm sắc thể mới, và ây có thể là một dạng ột biến gen. Ngoài ra,
mỗi khi tế bào thực hiện côn việc nhân ôi thì luôn luôn có một phần nhỏ tại ầu tận của
nhiễm sắc thể không ược sao chép và bị mất i. Vấn ề ược ặt ra là nếu như oạn nhiễm sắc
thể bị mất i này chứa ựng thông tin di truyền thì iều gì sẽ xảy ra ? Những vấn ề này của
nhiễm sắc thể người ã ược tạo hóa giải quyết bằng một cấu trúc, gọi là Telomere.
Telomere chính là phần tận cùng của nhiễm sắc thể, gồm những trình tự giàu Guanin,
ược lặp i lặp lại (TTAGGG). Trình tự TTAGGG không mã hóa cho bất cứ loại protein
nào, vì vậy dù nhiễm sắc thể có bị “bào mòn” dần qua các chu kỳ nhân ôi tế bào cũng
không làm mất thông tin di truyền của tế bào. Hơn nữa, tại ầu tận của nhiễm sắc thể có
sự hình thành nên phức hệ protein – telomere (telomere capping) làm ầu tận cùng nhiễm
sắc thể cuộn lại, che chắn ầu tận của nhiễm sắc thể (như hình ảnh của ầu dây cột giày)
khiến cho các nhiễm sắc thể kế cận không thể tự kết hợp với nhau.
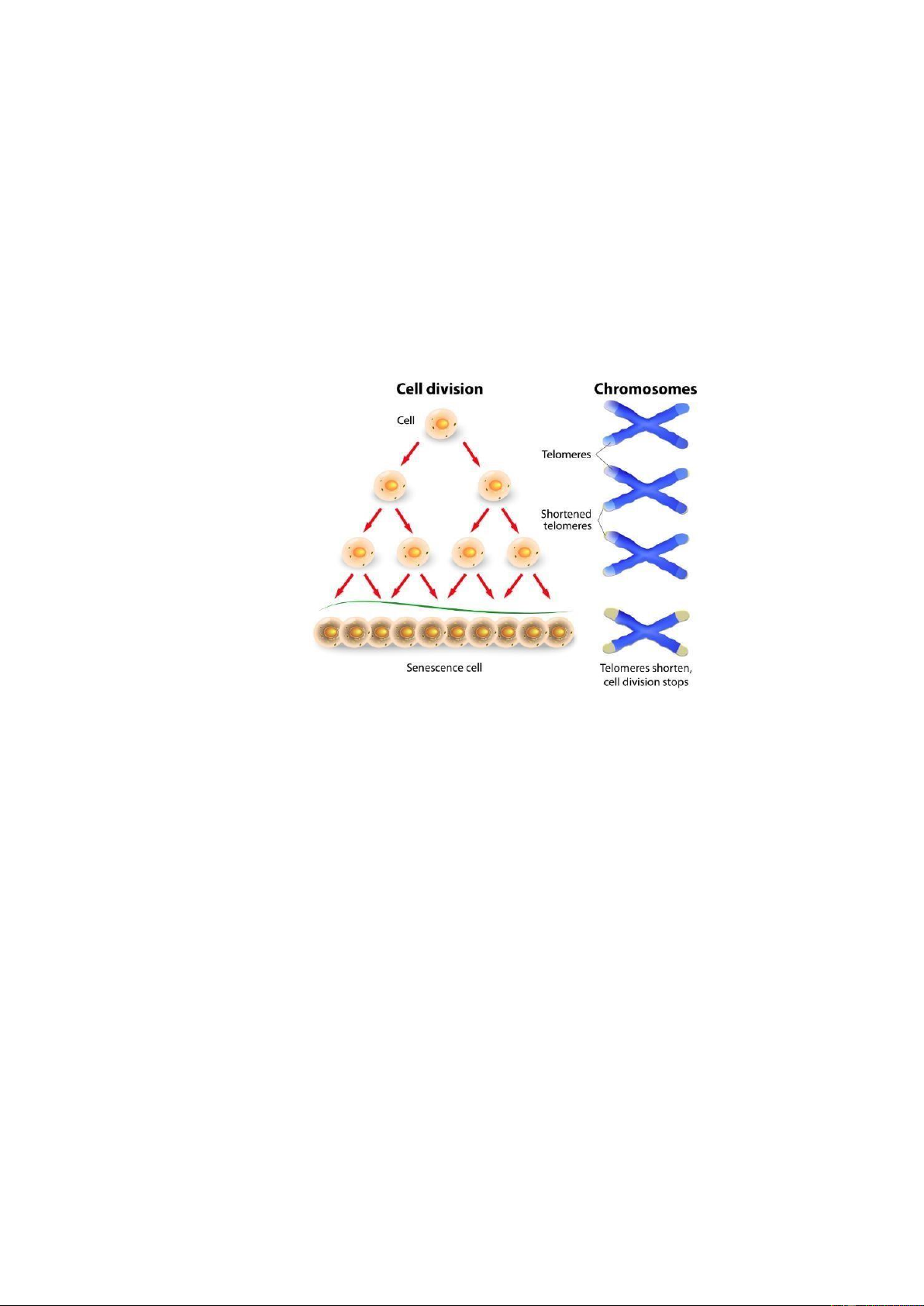
Sinh lý tế bào cho thấy, tế bào trải qua nhiều lần nhân ôi thì oạn Telomere bị “bào
mòn” dần. Khi oạn telomere bị “cắt cụt” thì tế bào ó sẽ không thể tiếp tục sinh sản, nhân
ôi ược nữa, và sẽ ược thúc ẩy vào con ường chết theo lập trình nhằm bảo vệ sự ổn ịnh
thông tin di truyền. Do ó, số lần phân bào của mỗi tế bào là có giới hạn (giới hạn Hayflick).
Hình 7: Vai trò của telomere trong kiểm soát sự phân bào của tế bào bình thường
Tế bào ung thư dù cho có ặc tính tăng sinh không kiểm soát ược, thì lẽ ra số lần
phân bào cũng phải có giới hạn, hay nói cách khác, sự tăng trưởng cũng phải có iểm
dừng khi oạn Telomere của tế bào ung thư cũng bị “cắt cụt” hoàn toàn. Vậy iều gì ã
khiến cho tế bào ung thư có thêm một ặc tính khác nữa, chính là số lần phân bào là vô
hạn, giúp cho tế bào ung thư có thể tăng sin không ngừng nghỉ. Câu trả lời chính là nhờ
vào một loại men, mang tên là Telomerase. Telomerase là men sao chép ngược (bản chất
là ribonucleprotein), giúp gắn kết trình tự “TTAGGG” vào ầu tận của chuỗi DNA (vùng
Telomere) bằng cách sử dụng chuỗi RNA ơn làm mẫu. Nói cách khác, men
Telomerase giúp làm tăng chiều dài của oạn Telomere. Nghiên cứu cho thấy hoạt ộng
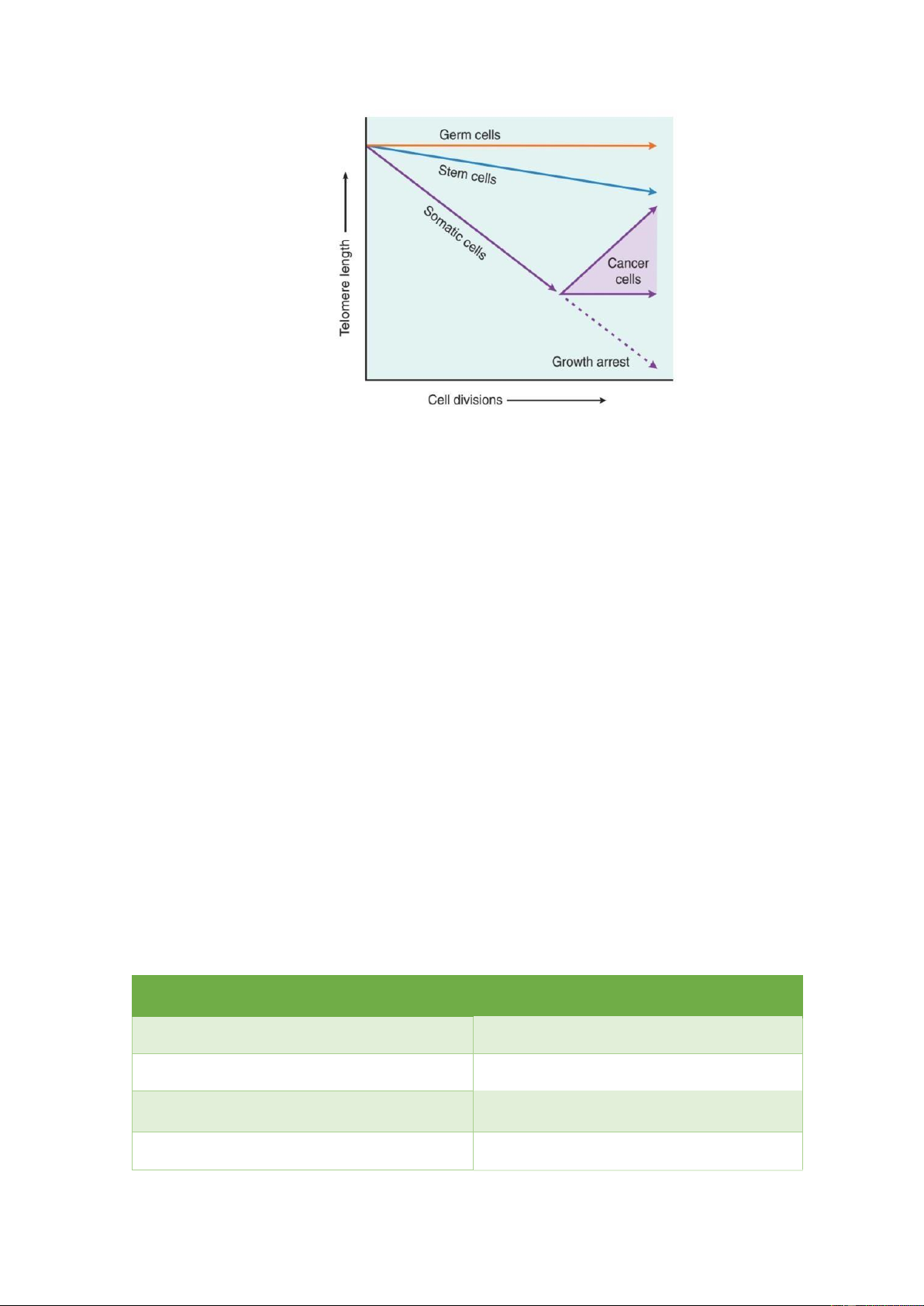
của Telomerase sẽ khác nhau tùy loại tế bào. Ở tế bào mầm (trứng, tinh trùng) và tế bào
gốc ều có telomerase hoạt ộng nhưng chỉ có tế bào mầm là có ủ nồng ộ Telomerase ể
duy trì ộ dài Telomere. Vì nếu ộ dài Telomere của tế bào mầm bị thay ổi thì giống loài
sẽ bị tuyệt chủng. Ở các tế bào sinh dưỡng bình thường thì không có sự hoạt ộng của
Telomerase, Telomere ngắn dần theo số lần phân bào cho ến khi ngừng tăng trưởng, lão hóa và chết.
Ngược lại, ở tế bào ung thư, Telomerase thường ược tái hoạt hóa và hoạt ộng
mạnh nhất nên chiều dài Telomere luôn ược giữ nguyên vẹn như ban ầu. Điều này làm
cho số lần phân bào của những tế bào ung thư là vô hạn.
Hình 8: Hoạt ộng của Telomerase ở các loại tế bào
Ngày nay, y học cũng ang ứng dụng những hiểu biết về Telomere và Telomerase
vào nghiên cứu iều trị ung thư. Về mặt lý thuyết, có thể sử dụng chất ức chế men
Telomerase ngăn ngừa sự phục hồi lại oạn Telomere, giúp giới hạn số lần nhân ôi của
tế bào ung thư và khiến các tế bào ung thư sẽ chết như những tế bào khác trong cơ thể.
Ở góc nhìn ngược lại, cũng có thể sử dụng các chất làm hoạt hóa men Telomerase, với
ích nhắm là các tế bào của hệ miễn dịch, ể có thể giúp kéo dài oạn Telomere của những
tế bào này, góp phần chống chọi lại TB ung thư.
2.5. Chết tế bào theo lập trình
Chết tế bào theo lập trình hay còn gọi là Apoptosis (gốc tiếng Hy Lạp có nghĩa là
lá vàng rụng trong mùa thu) là quá trình chết tự nhiên của các tế bào trong cơ thể, ược
tác giả Kerr mô tả lần ầu tiên hiện tượng này. Chết tế bào theo lập trình thực chất là một
quá trình iều hòa của cơ thể, cho phép các tế bào tự chết i nhằm loại bỏ các tế bào không
mong muốn hoặc các tế bào bị mất chức năng. Hiện tượng này có thể diễn ra trong tự
nhiên như quá trình loại bỏ các tế bào ở vùng uôi nòng nọc khi biến hoá thành ếch. Ở
người trưởng thành, ước tính mỗi ngày có khoảng 50-70 triệu tế bào trải qua chết theo
lập trình. So với kiểu chết tế bào do hoại tử với ặc iểm tế bào bị phồng lên, kèm sự thoát
men tiêu thể, màng tế bào bị vỡ ra và những mảnh vụn sẽ bị tiêu huỷ bởi ại bào và bạch
cầu a nhân trung tính thì ngược lại trong kiểu chết tế bào theo lập trình, tế bào sẽ bị co
lại, bào tương và màng tế bào bị phân thành từng mảnh nhỏ, nhân tế bào bị chia nhỏ,
chất nhiễm sắc bị cô ặc và có sự thành lập của thể chết theo lập trình. Bảng 1: So sánh
ặc iểm giữa chết tế bào theo lập trình và hoạt tử tế bào
Chết tế bào theo lập trình
Hoại tử tế bào
Có vai trò của ty thể và Cytochrome C Không có vai trò của ty thể
Không có sự thoát men tiêu thể
Có sự thoát men tiêu thể
Đặc trưng bởi những biến ổi nhân TB Nhân TB bị mất i
Thành lập “thể chết theo lập trình” Không có DNA bị chẻ nhỏ Không có
Có sự hoạt hóa men tiêu ạm ặc hiệu Không có
Tiến trình có thể iều hòa
Tiến trình không thể iều hòa
TB chết bị tiêu hủy bởi những TB xung TB chết bị tiêu hủy bởi ại bào và bạch quanh cầu a nhân trung tính
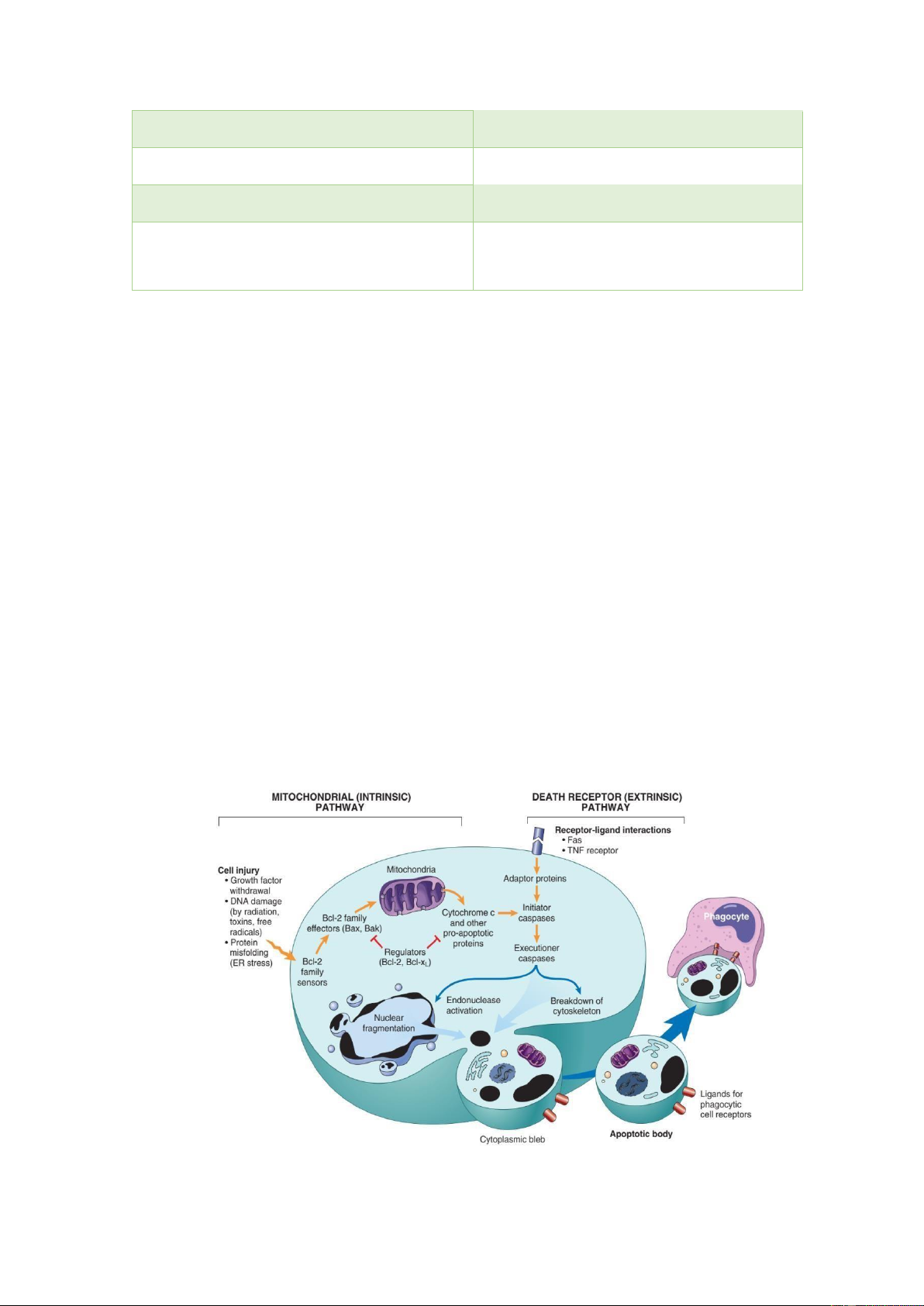
Trong cơ chế chết tế bào theo lập trình thì Caspases là yếu tố rất quan trọng, vừa
óng vai trò là yếu tố khơi mào và vừa là yếu tố gây chết trực tiếp. Có 2 con ường chính
ể kích hoạt Caspase, gồm: con ường nội sinh (thông qua sự hoạt ộng của ty thể), con
ường ngoại sinh (thông qua hoạt ộng của các thụ thể gây chết tế bào). Chết tế bào theo
lập trình theo con ường nội sinh ược gây ra bởi các kích thích nội bào như các tổn thương
gen không sửa chữa ược (do bức xạ, ộc tố, các gốc tự do), tình trạng thiếu Oxy, những
stress oxy hóa nghiêm trọng... Con ường chết tế bào theo lập trình nội sinh này ược iều
hòa chặt chẽ bởi những protein thuộc gia ình Bcl. Có 2 nhóm protein Bcl chính là protein
tiền chết TB theo lập trình (Bax, Bak, Bad, Bcl-Xs, Bid,
Bik, Bim và Hr) và protein chống lại chết TB theo lập trình (Bcl-2, Bcl-XL,Bcl-W,Bfl1
và Mcl-1). Sự iều hoà qua lại của 2 nhóm protein này có thể khởi phát việc tăng tính
thấm của ty thể và phóng thích ra các phân tử tiền phân bào (Cytochrome-C) vào bào
tương nhằm hoạt hoá Caspases. Trong khi ó, ể khởi ầu con ường chết tế bào theo lập
trình ngoại sinh cần phải có sự tương tác giữa các phối tử với thụ thể gây chết (Fas và
thụ thể yếu tố hoại tử bướu). Sau ó, bộ ôi này sẽ gắn kết với các protein tiếp hợp ể tạo
nên phức hợp tín hiệu gây chết (DISC: Deathinducing signaling complex) ể từ ó hoạt
hoá men pro-caspase 8 thành caspase 8. Chính yếu tố caspase 8 sẽ khởi ầu cho quá trình
chết tế bào theo lập trình bằng cách chia ra những Caspase xuôi dòng khác và những
Caspase gây chết trực tiếp.
Hình 9: Cơ chế gây chết tế bào theo lập trình
Bên cạnh ặc tính tăng trưởng tế bào không kiểm soát ược, số lần phân bào vô hạn
thì sự mất iều hoà chết tế bào theo lập trình cũng góp phần vào sự sinh ung thư. Sự mất
iều hoà chết tế bào theo lập trình có thể do sự suy yếu con ường dẫn truyền tín hiệu
(giảm biểu hiện thụ thể gây chết, giảm biểu hiện tín hiệu gây chết hoặc biểu hiện thụ thể
“mồi” không có miền gây chết) hoặc do sự mất cân bằng của những protein thuộc gia
ình Bcl (giảm biểu hiện những protein tiền chết theo lập trình hoặc tăng biểu hiện của
những protein chống lại chết theo lập trình). Trực tiếp hơn, sự mất iều hoà chết theo lập
trình này còn do sự giảm biểu hiện của Caspase hoặc do sự ột biến của gen p53. Như ã
ề cập ở phần gen è nén bướu (mục II.C), gen p53 là gen thường bị ột biến nhất ược tìm
thấy trong nhiều loại bệnh lý ung thư ở người. Gen p53 ược xem như là “người canh
gác bộ gen” vì ảm nhiệm nhiều chức năng trong cơ thể và một trong số vai trò của gen
p53 là hoạt ộng mã hóa cho protein Bax (có chức năng bình thường là thúc ẩy chết tế
bào theo lập trình). Vì vậy, những ột biến làm mất chức năng gen p53 sẽ làm mất biểu
hiện protein Bax, khiến cho tế bào không i con ường chết tế bào theo lập trình. Một ví
dụ về bệnh lý ung thư liên quan ến gen trong cơ chế chết tế bào theo lập trình là bệnh
bạch cầu lymphô mạn. Bệnh lý này có mang ột biến chuyển vị nhiễm sắc thể [t(14: 18)]
làm hoạt hóa gen Bcl-2. Gen Bcl-2 mã hoá cho protein Bcl-2, bản chất giúp chống lại
sự chết tế bào theo lập trình. Do vậy mà trong bệnh bạch cầu lymphô mạn, tế bào ác tính
tuy tăng sinh với tốc ộ bình thường nhưng vì những tế bào này không ược chết i nên số
lượng tế bào tích lũy chậm dần theo thời gian. Điều này hoàn toàn phù hợp với diễn tiến
lâm sàng chậm, mạn tính của bệnh.
2.6. Cơ chế ngoài gen của sự sinh ung thư
Như chúng ta ã biết trong tế bào có ít nhất 2 dạng thông tin, gồm những thông tin
về gen ể cung cấp các vật liệu tổng hợp protein cho tế bào hoạt ộng chức năng và những
thông tin ngoài gen có vai trò iều phối, hướng dẫn gen nên ược biểu hiện, sử dụng ở âu,
khi nào và như thế nào ? Năm 1943, tác giả C.H.Waddington ưa ra khái niệm về
epigenetics (ngoài gen). Epigenetics ược ịnh nghĩa là ngành học nghiên cứu những biến
ổi biểu hiện gen mà không có sự thay ổi trình tự của chuỗi DNA trong bộ gen. Bản chất
của sự biến ổi biểu hiện gen này là do thông qua các phản ứng hoá hoc trên chuỗi DNA
xảy ra trong quá trình iều tiết sự phiên mã như methyl hóa DNA (DNA methylation),
biến ổi phân tử Histone (Histone modification) và micro RNA (miRNA).
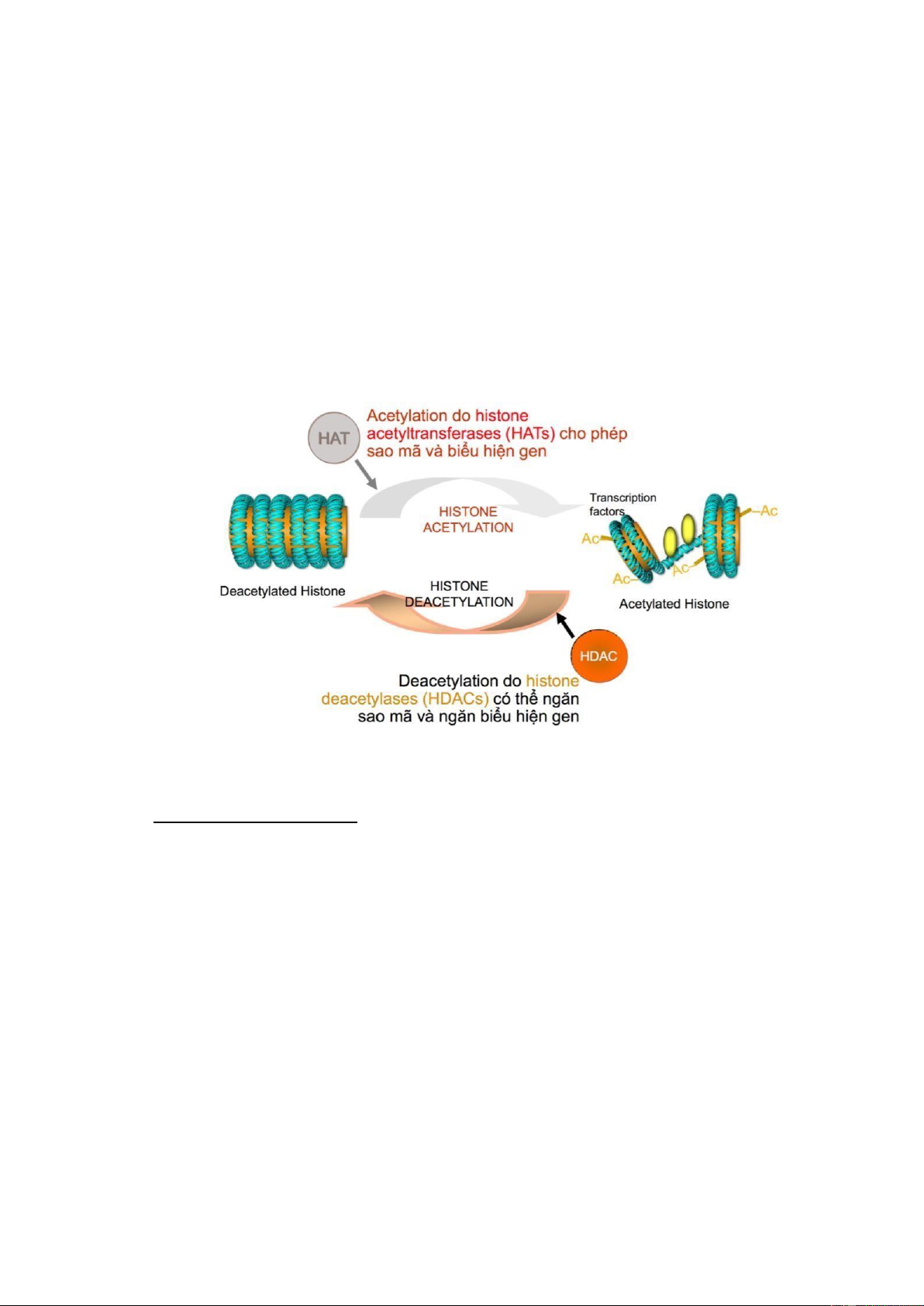
❖ Cơ chế biến ổi phân tử Histone
Trong tế bào, Histone là các protein có chức năng óng gói và sắp xếp DNA thành
các ơn vị cấu trúc là nucleosome, tạo thành nhiễm sắc chất (chromatin) và nhiễm sắc thể
(chromosome). Vì sợi DNA khi dãn ra sẽ có chiều dài ước tính khoảng 1,8 mét nên ể có
thể chứa trong nhân tế bào có kích thước nhỏ thì DNA phải cuộn quanh các thể Histone,
giống như sợi chỉ quấn quanh cuộn chỉ nhằm nén lại kích thước. Chiều dài DNA sau khi
cuộn quanh Histone còn khoảng 0,09 mm, nghĩa là ã giảm i 20.000 lần. Đây ược xem là
dạng óng của nhiễm sắc thể, với tính chất ông ặc và có rất ít hoạt ộng xảy ra trên chuỗi
DNA, gen ít ược biểu hiện. Tuy nhiên, khi cơ thể cần các protein hoạt ộng chức năng thì
nhiễm sắc thể sẽ ược tháo xoắn ể trở thành dạng mở (dạng hoạt ộng), giúp gen ược biểu
hiện ể thực hiện việc phiên mã thành mRNA và dịch mã thành protein. Sự tháo xoắn
nhiễm sắc thể hay chuyển nhiễm sắc thể từ dạng óng sang dạng mở là nhờ quá trình biến
ổi phân tử Histone gồm sự acetyl hoá Lysine, methyl hoá Lysine và Arginine,
phosphoryl hoá serine và threonine... Quá trình biến ổi này xảy ra tại vị trí ầu N của phân
tử Histone và do một số men tham gia. Do vậy những men này ược ví như có vai trò iều
hành nhiễm sắc thể. Lấy ví dụ như nhóm men HATs
(Histone acetyltransferases) thực hiện gắn gốc Acetyl (-COCH3) vào vị trí NH3+ của
Lysine giúp loại bỏ iện tích dương của NH3+. Do ó, ái lực giữa Histone và DNA sẽ giảm
i nên nhiễm sắc thể ược tách rời ra, các gen ược biểu hiện và thực hiện quá trình phiên
mã. Ngược lại, quá trình khử Acetyl làm nhiễm sắc thể cuộn chặt lại và gen không ược biểu hiện.
Hình 10: Sự biến ổi phân tử Histone
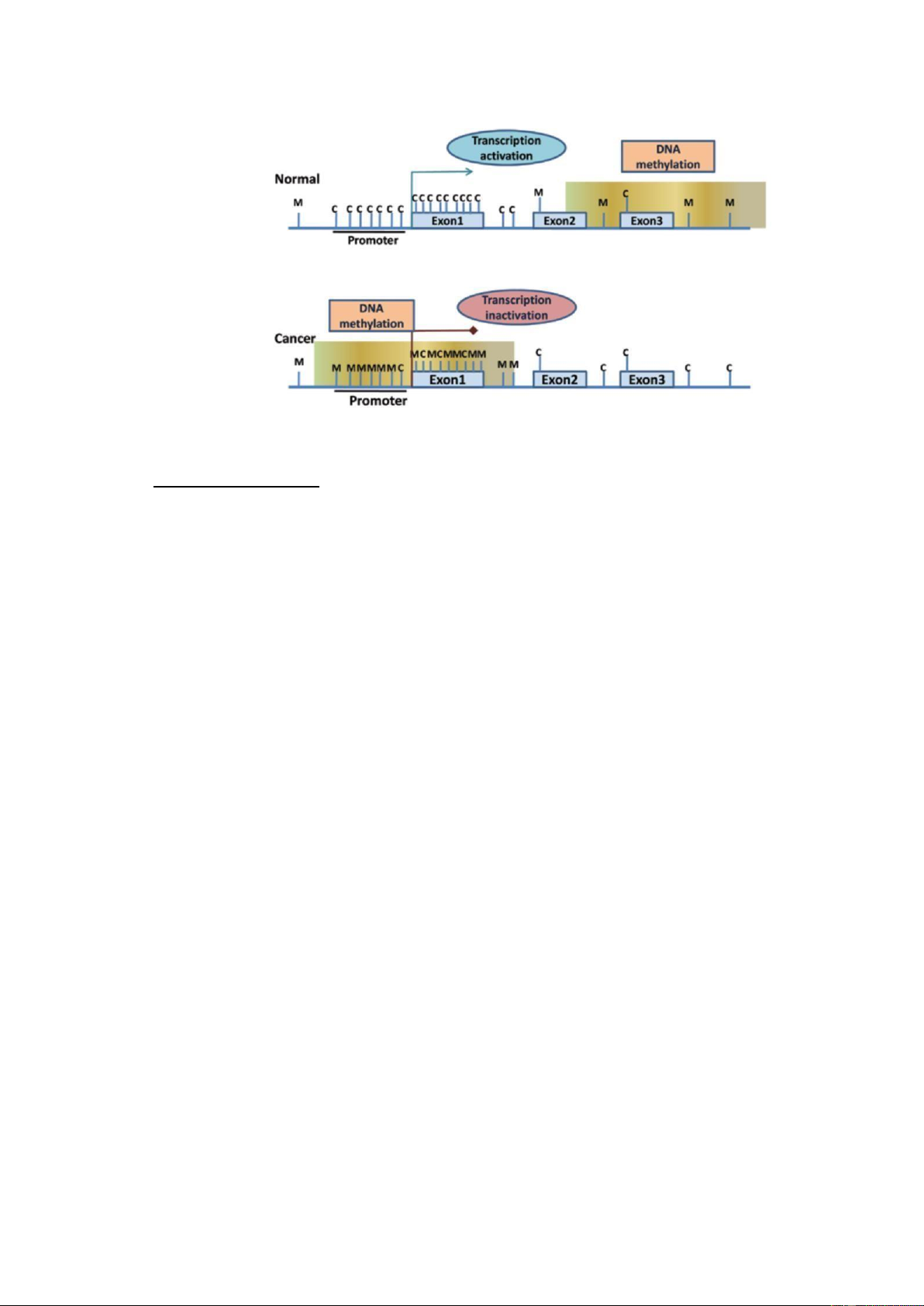
Cơ chế methyl hóa DNA
Sự methyl hóa DNA là cơ chế ngoài gen ơn giản nhất, bằng cách gắn thêm gốc
methyl (-CH3) hoặc acetyl (-COCH3) ở vị trí phân tử Carbon C5 của Cytosine trên chuỗi
DNA. Sự thay ổi này không làm thay ổi trình tự của DNA nhưng lại ngăn không
cho men RNA polymerase II tiếp cận với chuỗi DNA nên không có sự thành lập mRNA.
Ngoài ra, sự methyl hóa DNA tại vị trí CpG còn giúp huy ộng men HDAC (Histone
deacetylase). Như ã ề cập ờ phần trên thì sự khử Acetyl làm nhiễm sắc thể cuộn chặt lại
và gen không ược biểu hiện. Tóm lại, sự methyl hóa DNA cuối cùng sẽ ức chế quá trình
phiên mã, không thể thành lập ược mRNA, và do vậy không tổng hợp ược các protein
hoạt ộng chức năng. Phản ứng này ược xúc tác bởi những men trong gia ình DNMT như
DNMT1, DNMT3A, DNMT3B. Hiện nay, nhiều loại men iều hành nhiễm sắc thể ược
vào thử nghiệm lâm sàng trong nghiên cứu iều trị ung thư như DNMT và HDAC.
Hình 11: Cơ chế methyl hoá tại vị trí Cytosine trên chuỗi DNA
Cơ chế micro RNAs
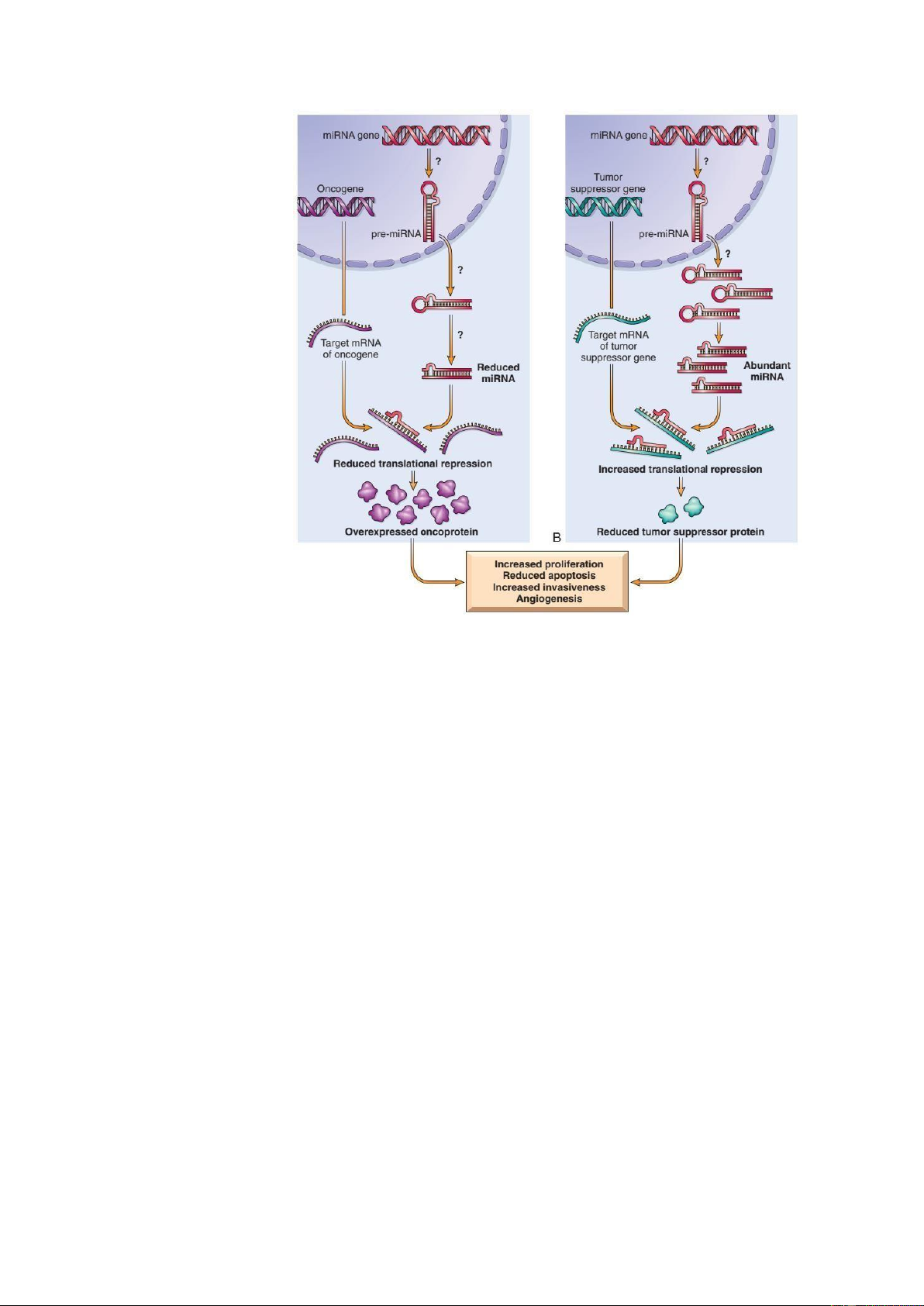
Micro RNAs (miRNA) là một nhóm các RNA không mã hóa, nội sinh, mạch ơn,
có chiều dài ngắn, chỉ khoảng 21-25 nucleotides. Sự hình thành và hoạt ộng của miRNA
có thể ược tóm tắt qua các bước sau. Đầu tiên các men RNA polymerase II sẽ giúp phiên
mã các gen miRNA ể tạo thành các pri-miRNA. Nhờ vào men Drosha, các pri-miRNA
ược cắt thành những oạn pre-miRNA có chiều dài ngắn hơn. Tiếp theo, các pre-miRNA
sẽ ược vận chuyển từ trong nhân tế bào ra ngoài bào tương. Tại ây, pre-miRNA sẽ ược
cắt thành các miRNA có mạch ôi nhờ vào men Dicer. Sau ó, một mạch miRNA ược lựa
chọn và kết hợp với RISC (RNA-inducing silencing complex) ể tạo thành phức hợp
RISC/miRNA. Phức hợp RISC/miRNA này sẽ tương tác với oạn mRNA ích và gây thoái
biến mRNA hay ức chế sự dịch mã. Ước tính cho thấy có khoảng hơn 30% gen người là
ích nhắm của miRNA và miRNA tham gia chức năng trong hầu hết những quá trình sinh
học của cơ thể như iều hòa chu kỳ tế bào, tăng trưởng tế bào, chết tế bào theo lập trình ,
biệt hóa tế bào... Vai trò của miRNA trong cơ chế sinh ung thư có thể chia thành 2 nhóm
lớn. Đầu tiên là những miRNA có vai trò sinh ung thư (còn ược gọi là Onco-miR),
thường sẽ ược tăng biểu hiện ể gia tăng tác ộng vào các mRNA cùa gen è nén bướu, gen
kiểm soát sự biệt hóa tế bào hoặc chết tế bào theo lập trình, gây ức chế sự tổng hợp các
protein chức năng. Tiếp theo là những miRNA có vai trò è nén bướu (còn gọi là Tumor
suppressor miR) với ích nhắm là mRNA của các gen sinh ung. Để ung thư ược hình
thành thì các miRNA có vai trò è nén bướu này cần ược giảm biểu hiện ể không can
thiệp vào quá trình ức chế sự dịch mã những mRNA của gen sinh ung... Hiện nay,
miRNA ang ược nghiên cứu nhiều trong lĩnh vực ung thư như là một dấu ấn sinh học
góp phần trong chẩn oán (chẩn oán bệnh ở giai oạn sớm, phân biệt bướu lành tính và ác
tính), tiên oán (khả năng áp ứng với các phương pháp iều trị), theo dõi tái phát và tiên lượng bệnh.
Hình 12: Sự hình thành và vai trò của microRNAs trong sự sinh ung thư
III. KẾT LUẬN
Sự sinh ung thư là tiến trình phức tạp, cần có thời gian ể các tế bào tích lũy những
tổn thương di truyền (cơ chế gen) và những phản ứng hóa học, những sự thay ổi trên
chuỗi DNA mà không làm thay ổi cấu trúc của gen (cơ chế ngoài gen). Những rối loạn
của cơ chế gen, ngoài gen chủ yếu là do sự tác ộng của môi trường bên ngoài (yếu tố vật
lý, hóa học, sinh học) và chỉ một số ít là do di truyền. Ngày nay, với sự tiến bộ về những
kỹ thuật sinh học phân tử ã giúp y học có những hiểu biết sâu hơn, rõ hơn về cơ chế sinh
ung thư. Hy vọng những thành tựu ạt ược trong lĩnh vực này sẽ góp phần cải thiện khả
năng chẩn oán sớm, iều trị, tiên lượng cũng như phòng ngừa bệnh ung thư.
TÀI LIỆU THAM KHẢO
1. Chen Q.W, Zhu X.Y, Li Y.Y, Meng Z.Q.. “Epigenetic regulation and cancer
(review)”. Oncol Rep. 2014 Feb;31(2):523-32.
2. Craig A.A and Sheila A.B. “Cancer: Basic Science and Clinical Aspects, 2010”. Wiley-Blackwell.
3. Kumar V, Abbas A.K, Aster J.C. “Robbins Basic Pathology 9th, 2013”. Elsevier Saunders.
4. Lord C.J, Ashworth A. “The DNA damage response and cancer therapy”.
Nature (2012). 481(7381):287-94.
5. https://docplayer.net/10006876-Molecular-basis-of-cancer.html


![[Sinh học và di truyền] Giải phẫu bệnh ung thư - Đại học Y dược Thành phố Hồ Chí Minh](https://docx.com.vn/storage/uploads/images/documents/banner/fecc62e7aa9c229dbfdd2b67de61aa57.jpg)

![[Sinh học di truyền] Nguyên nhân ung thư - Đại học Y dược Thành phố Hồ Chí Minh](https://docx.com.vn/storage/uploads/images/documents/banner/3c14836966fb80c6e8af991763cce716.jpg)