










Preview text:
Bài dịch TLTK
Giới thiệu: Tăng cholesterol máu gia đình (FH) là một bệnh di truyền phổ biến do
đột biến một hoặc nhiều gen quan trọng đối với sự dị hóa (LDL-C). Hội chứng lâm
sàng (kiểu hình) được đặc trưng bởi nồng độ LDL-C quá cao và có khuynh hướng
dẫn đến khởi phát sớm bệnh tim, xơ vữa động mạch. Người đồng hợp tử nói chung
biểu hiện bệnh ở thời thơ ấu. (Chủ đề này sẽ ko tập trung vào phần phương pháp điều trị)
Định nghĩa: Một người được xác định là bệnh FH di truyền khi có 1 trong 2 điều sau
Đột biến gen LDLR, PCSK9 hoặc APOB
Các đặc điểm lâm sàng thường bao gồm LDL-C cao
Tiêu chí của Hiệp hội Tim mạch Hoa
Kỳ để chẩn đoán lâm sàng CASE 9: CASE LÂM SÀNG CHUNG
tương đối đầu tiên với LDL-C> 190
mg / dL hoặc đã biết bệnh mạch
vành sớm (nam 55 tuổi; nữ <60 tuổi).
Các xem xét về FH di truyền: là bệnh di truyền trội trên NST thường phổ biến nhất.
Bệnh nhân FH thường có đột biến chức năng của một trong ba gen:
Gen thụ thể lipoprotein mật độ thấp (LDLR; đôi khi được gọi là thụ thể apoB / E)
Đột biến tăng chức năng của gen proprotein convertase subtilisin kexin 9 (PCSK9)
Đột biến gen apolipoprotein B (chủ yếu là APOB3500).
Mỗi đột biến trong số ba đột biến này làm suy yếu quá trình dị hóa hạt
LDL qua trung gian thụ thể LDL, dẫn đến LDL-C cao hơn trong máu. Trong
số này, đột biến LDLR cho đến nay là phổ biến nhất. Các đột biến trong
các gen này biểu hiện tác động bổ sung liều lượng gen như vậy các
cá thể mang hai đột biến gây bệnh (đồng hợp tử (2 đột biến cùng gen)
hoặc dị hợp tử phức hợp (2 đột biến trên 2 gen khác nhau)) bị ảnh
hưởng bất lợi hơn so với những cá thể có một đột biến gây bệnh (dị hợp tử).
Tỷ lệ đột biến gây bệnh ở ít nhất một trong ba gen này thay đổi tùy theo mức CASE 9: CASE LÂM SÀNG CHUNG
độ chắc chắn đã mắc bệnh FH, ước tính khoảng 80% là ĐB ở những bệnh nhân
đã xác định là mắc hội chứng FH lâm sàng và 20 -
30% ở những người có khả năng mắc hội chứng FH. Trong số những người có
một trong ba đột biến này:
85 - 90 % có đột biến LDLR
2 - 4 % đột biến tăng chức năng PCSK9 1 - 12 % đột biến APOB
Những người phù hợp với các tiêu chuẩn kiểu hình cho bệnh FH lâm sàng
và không xác định được đột biến gen đơn gây bệnh (lên đến 20% trong tổng
số), được coi là bị tăng cholesterol máu đa gen nặng, theo đó sự kết hợp của
các ĐBG nhỏ, riêng rẻ tác động cùng nhau dẫn đến LDLC tăng cao đáng kể.
Người ta thường sử dụng 1 thang đo nguy cơ đa gen để ước tính nguy cơ di
truyền của một người. Phương pháp ước lượng độ ảnh hưởng của các ĐB đa
gen thường gặp đang trở nên hữu dụng đối với chứng tăng cholesterol máu.
Hiệu ứng tích lũy của nhiều locus tác động nhỏ lên mức LDL-C cũng tương tự
như hiệu ứng của một gen chính duy nhất liên kết với FH dị hợp tử. Ngoài ra,
một số cá nhân có điểm số nguy cơ đa gen cao nhất (những người trên phân vị
thứ 90 của nguy cơ di truyền) cũng mang thêm các biến thể đơn gen có hại.
Có khả năng là chỉ một tỷ lệ rất nhỏ bệnh nhân FH có một số đột biến gen đơn
nguyên nhân chưa được phát hiện.
Ảnh hưởng trên biểu hiện lâm sàng:
Sự phát triển của bệnh tim mạch xơ vữa động mạch (ASCVD) do LDL-C tăng cao
liên quan nhiều hơn đến thời gian và mức độ tăng LDL-C hơn là với (các) khiếm
khuyết di truyền cụ thể. Người trưởng thành có FH dị hợp tử (và đồng hợp tử)
đã có mức LDL-C cao kể từ khi sinh ra, trong đó khi với người có mức LDLC cao
không phải do FH lại có LDL-C cao trong một thời gian ngắn hơn và do đó có
phần nào nguy cơ thấp hơn ASCVD sớm.
Do các tác động cộng gộp được mô tả ở trên của sự thay đổi gây bệnh đối với
mức LDL-C, những bệnh nhân có hai biến thể gây bệnh hoặc một biến thể gây
bệnh và điểm nguy cơ cholesterol đa nguyên cao có thể mắc ASCVD sớm trong CASE 9: CASE LÂM SÀNG CHUNG
cuộc đời. Ngoài ra, ở mức LDL-C tương tự khi trưởng thành, sự hiện diện của
FH đơn nguyên làm tăng nguy cơ mắc bệnh tim mạch sớm lên khoảng 2-4 lần
so với những người không có biến thể gây FH. Điều này phù hợp với quan sát
rằng bệnh nhân FH dị hợp tử thường có mức LDL-C cao ngay từ khi sinh ra và
có nguy cơ mắc bệnh tim sớm cao hơn. Các biến thể di truyền khác với ba biến
thể chính được mô tả ở trên gây ra tăng LDL-C nhẹ hơn và cũng có thể ảnh
hưởng đến LDL-C ở bệnh nhân FH và góp phần vào tuổi khởi phát và mức độ
nghiêm trọng của nguy cơ tim mạch.
Nhìn chung, những bệnh nhân FH dị hợp tử có mức LDL-C cao ngay từ khi
sinh ra và có nguy cơ mắc bệnh tim sớm cao hơn so với những người đa
gen thường không có mức LDL-C rất cao trong thời kỳ đầu đời.
Dường như không có sự liên quan giữa tăng nguy cơ CVD và FH đa gen ở những
bệnh nhân có LDL-C tăng và không có biến thể gây FH. Tuy nhiên, sự hiện diện của
điểm nguy cơ đa gen cao ở bệnh nhân FH đơn gen lại có khả năng rất cao.
ĐB mất thụ thể LDL (LDLR)
Ở dạng phổ biến nhất, FH là một rối loạn đơn gen gây ra bởi các khiếm khuyết trong
gen mã hóa cho thụ thể apo B / E (LDL).
ĐB mất gen (hoặc mất chức năng) dẫn đến giảm độ thanh thải của các LDL ra
khỏi tuần hoàn và tăng LDL-C trong huyết tương.
Ngoài ra còn có sự gia tăng sự hấp thu LDL đã biến đổi (bị oxy hóa hoặc các biến đổi
khác) bởi các thụ thể của đại thực bào, dẫn đến sự tích tụ lipid của đại thực bào và
hình thành tế bào bọt. Có 4 loại allele ĐB:
Loại I - Không có protein, trong đó quá trình tổng hợp bị lỗi.
Loại II - Vận chuyển khiếm khuyết, trong đó vận chuyển nội bào từ lưới nội chất thành Golgi bị suy giảm. CASE 9: CASE LÂM SÀNG CHUNG
Loại III – Liên kết khiếm khuyết, trong đó các protein được tổng hợp và được vận
chuyển đến bề mặt TB một cách bình thường, nhưng liên kết của LDL bị lỗi.
Loại IV - Nội tạng bị lỗi, trong đó các protein tiếp cận bề mặt tế bào và liên kết
LDL một cách bình thường nhưng các thụ thể không tụ lại trong các hố được
phủ, do đó giảm thiểu nội hóa LDL.
Về mức độ hoạt động của lượng LDLR còn lại, có thể chia thành 2 nhóm:
ĐB còn ít hơn 2% LDLR binh thường hoạt động ĐB còn 2 - 25% ĐBG PCSK9
Proprotein convertase subtilisin kexin 9 (PCSK9) là một protease serine được
tiết ra bởi gan. Ở ngoại bào, nó liên kết với LDLR được biểu hiện chủ yếu trên các tế bào gan.
Một khi phức PCSK9-LDLR được đưa vào bên trong tế bào gan một cách sinh lý
thông qua vùng hố được phủ trên màng ngoài của nó, các receptor LDL liên kết
với PCSK9 sẽ bị ngăn không tái chế trở lại bề mặt tế bào và bị phá hủy bên trong tế bào gan.
Ít thụ thể LDL hơn dẫn đến ít thanh thải LDL-C hơn và nồng độ huyết thanh cao hơn.
Đột biến tăng chức năng trong PCSK9 rất hiếm, nhưng dẫn đến giảm biểu hiện
LDLR, giảm dị hóa LDL, mức LDL-C cao hơn, hội chứng lâm sàng FH dị hợp tử, và
tăng nguy cơ mắc bệnh tim thiếu máu cục bộ; đột biến mất chức năng phổ biến
hơn và có liên quan với việc giảm cả LDLC và nguy cơ mắc bệnh tim thiếu máu cục bộ.
ĐB di truyền khiếm khuyết APOB 100
Apolipoprotein B-100 khiếm khuyết do di truyền là một rối loạn trội NST
thường có liên quan đến việc suy giảm liên kết của các phần tử LDL với thụ thể
apo B / E (LDL). Khiếm khuyết được bản địa hóa ở phối tử apo B-100 trên hạt
LDL (đột biến ở gốc 3500), không phải thụ thể apo B / E (LDL). CASE 9: CASE LÂM SÀNG CHUNG
Hiệu quả thực là độ thanh thải của LDL bị giảm và nồng độ trong huyết tương
tăng gấp 2-3 lần. Tần số đột biến apo B 3500 ở những bệnh nhân được phân
loại là dị hợp tử FH cao tới 3%.
Các yếu tố khác tạo biến thể LDL-C
Gồm chế độ ăn uống, bệnh đi kèm (ví dụ: suy giáp, bệnh gan) hoặc các bất
thường di truyền không liên quan đến thụ thể LDL, PCSK9 hoặc gen
apolipoprotein B có thể làm thay đổi mức LDL-C.
Ngoài ra, bệnh do vi rút cấp tính hoặc trạng thái viêm hoặc trạng thái sau phẫu
thuật có thể ức chế thoáng qua tổng hợp lipid, thường làm giảm LDL-C.
1. Tổng quan, triệu chứng và dịch tễ Bệnh sơ vữa ĐM
Xơ vữa động mạch là sự hình thành các mảng được gọi là mảng xơ vữa bên
trong động mạch. Mảng xơ vữa được hình thành bởi: lipid, chủ yếu là
cholesterol, tế bào cơ trơn, tế bào máu, collagen và sợi đàn hồi, và đôi khi là canxi.
Sự hình thành xơ vữa động mạch là một bệnh của thành mạch gây ảnh hưởng lớn
đến tới sự lưu thông máu từ tim đến các mô trong cơ thể.
Tổn thương xơ vừa động mạch có thể nhìn thấy sớm nhất là vệt mỡ, đó là do sự
tích tụ của các tế bào bọt chứa nhiều lipid trên lớp nội mạc của động mạch (lớp
trong cùng của động mạch, tiếp xúc với dòng máu). Theo thời gian, mảng mỡ
phát triển thành mảng xơ vữa làm hạn chế lưu lượng máu giàu oxy đến các cơ
quan và các bộ phận khác của cơ thể. Xơ vữa động mạch có thể dẫn đến các vấn CASE 9: CASE LÂM SÀNG CHUNG
đề nghiêm trọng, bao gồm đau tim, đột quỵ, bệnh động mạch vành, bệnh mạch
máu ngoại biên hoặc thậm chí tử vong.
Khoảng 76% tổng số huyết khối mạch vành tử vong do vỡ mảng xơ vữa. Vỡ mảng
bám là nguyên nhân thường xuyên gây ra huyết khối mạch vành ở nam giới
(khoảng 80%) hơn ở nữ giới (khoảng 60%). Các mảng vỡ có đặc điểm là một lõi
lớn giàu lipid, một nắp xơ mỏng chứa ít tế bào cơ trơn và nhiều đại thực bào,
hình thành mạch, viêm cơ và tái tạo bề ngoài. Vỡ mảng bám là nguyên nhân phổ
biến nhất của huyết khối mạch vành. Triệu chứng
Xơ vữa động mạch có các triệu chứng biểu hiện phụ thuộc vào vị trí bị xơ vữa:
Xơ vữa động mạch trong động mạch tim, khiến lưu lượng máu về tim không đủ
dẫn đến đau ngực hoặc đau thắt ngực.
Xơ vữa động mạch trong động mạch dẫn đến não gây ra các triệu chứng như đột
ngột tê hoặc yếu ở tay hoặc chân, khó nói hoặc nói lắp, mất thị lực tạm thời ở
một mắt hoặc cơ mặt bị xệ. .
Những dấu hiệu này báo hiệu một cơn thiếu máu cục bộ thoáng qua (TIA), nếu
không được điều trị, có thể tiến triển thành đột quỵ.
Xơ vữa động mạch ở tay và chân dẫn đến các triệu chứng của bệnh động mạch
ngoại vi, như đau chân khi đi bộ (đau cách hồi) hoặc giảm huyết áp ở một chi bị
ảnh hưởng. Đau cách hồi là đau từng cơn với bất kỳ cường độ nào mà không có
bất kỳ cơn đau nào liên tục.
Xơ vữa trong động mạch dẫn đến thận sẽ bị cao huyết áp hoặc suy thận. CASE 9: CASE LÂM SÀNG CHUNG Dịch tễ học
Bệnh này gặp nhiều hơn ở các nước
phát triển như ở châu Âu, Mỹ, còn ở
các nước đang phát triển như châu
Á, Phi ít gặp hơn. Do người dân ở
châu Âu và châu Mỹ, đặc biệt là Tây
Âu có chế độ ăn uống, có tỷ lệ chất
béo cao hơn các khu vực khác.
Tuy nhiên, các nước có thu nhập cao,
tỷ lệ mắc bệnh xơ vữa động mạch
dẫn đến tử vong do thiếu máu cơ
tim và đột quỵ do thiếu máu cục bộ
đã giảm đáng kể kể từ giữa thế kỷ
20. Cụ thể, ở Vương quốc Anh, xác
suất tử vong do bệnh mạch máu ở
nam giới trung niên (35– 69 tuổi) đã
giảm từ 22% vào năm 1950 xuống
còn 6% vào năm 2010. Hầu hết các
quốc gia có thu nhập thấp và trung
bình cũng có tỷ lệ tử vong do đột
quỵ giảm trong vài thập kỷ qua,
nhưng xu hướng tử vong do thiếu
máu cơ tim đa dạng hơn, với một số
quốc gia báo cáo giảm và các quốc
gia khác báo cáo tăng (đặc biệt là ở Đông Âu và châu Á).
Những thay đổi rộng rãi trong hành vi
sức khỏe và việc sử dụng các
phương pháp điều trị các yếu tố nguy cơ này là
nguyên nhân dẫn đến một số tỷ lệ
tử vong giảm mạnh ở các nước có
thu nhập cao. Để các quốc gia đang
phát triển cũng giảm tỉ lệ mắc CASE 9: CASE LÂM SÀNG CHUNG
bệnh, cần phải có những nỗ lực
tăng cường để giải quyết các yếu tố
nguy cơ chính này, đặc biệt là hút
thuốc lá và đại dịch béo phì đang nổi lên.
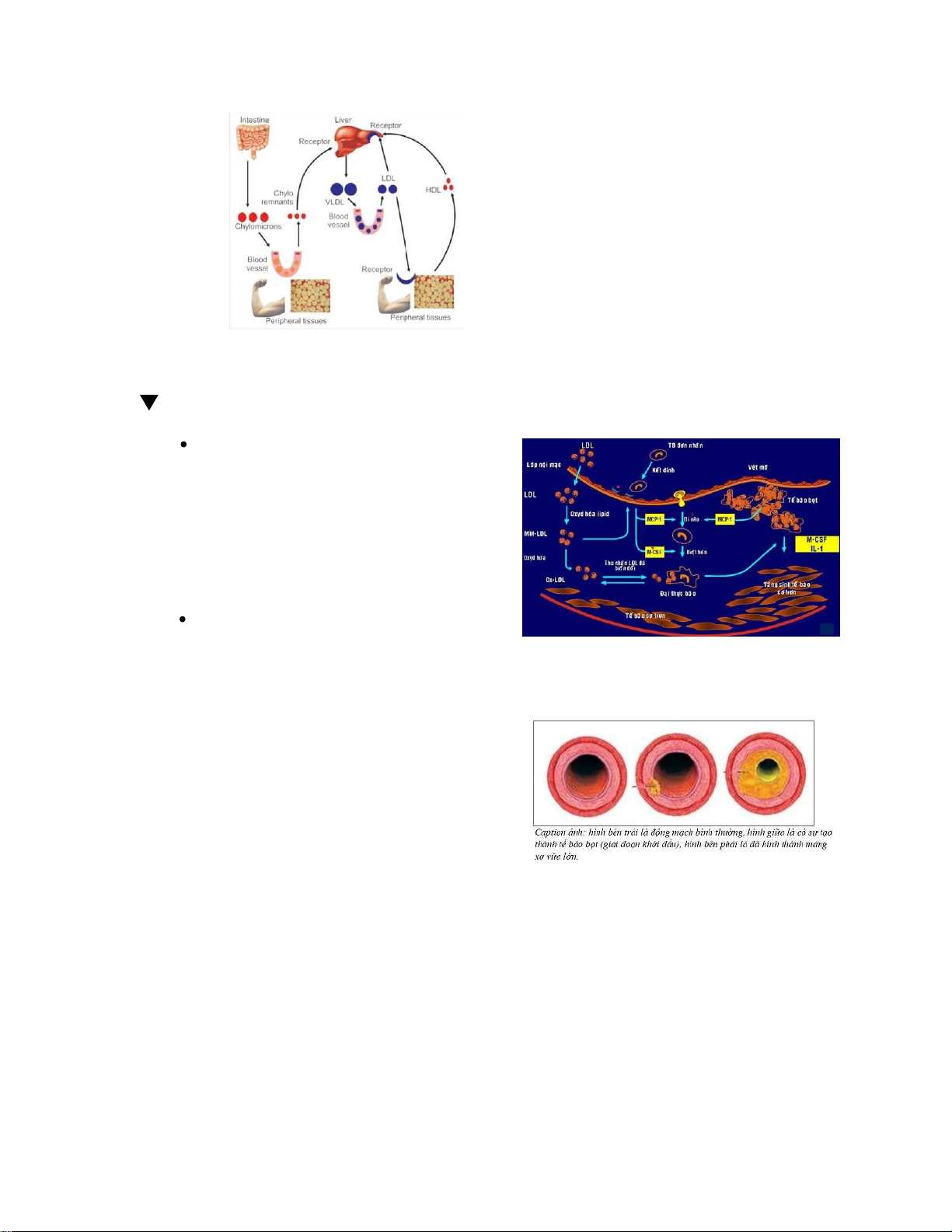
2. Các loại Lipoprotein Cấu tạo
Lipid do ko tan được trong nước nên
được vận chuyển bằng cách kết hợp
với protein gọi là lipoprotein
Protein kết hợp với lipid tạo LP được
gọi là apoprotein (apolipoprotein)
Chức năng Apoprotein (hình cầu
nhỏ) được biết như sau:
Ổn định cấu trúc LP, giúp LP phân tán
và vận chuyển được trong nước
Nhận diện thụ thể màng
Điều hòa hoạt tính của enz tham gia chuyển hóa LP
Dễ dàng trao đổi thành phần
lipid giữa các LP với nhau
Ở người, có 4 loại lipoprotein, là tiểu
phân hình cầu, có kích thước nhỏ
hơn hồng cầu, vận chuyển lipid
không tan trong máu. Lipoprotein
được cấu tạo gồm 2 lớp CASE 9: CASE LÂM SÀNG CHUNG
Lớp lõi trung tâm: chứa các lipid kị nước gồm TG và CE (cholesterol este)
Lớp áo bề mặt: chứa các protein
phân cực ở đầu bên ngoài và
phần kị nước quay vào trong, ngoài ra còn chứa
phospholipid và cholesterol tự do.
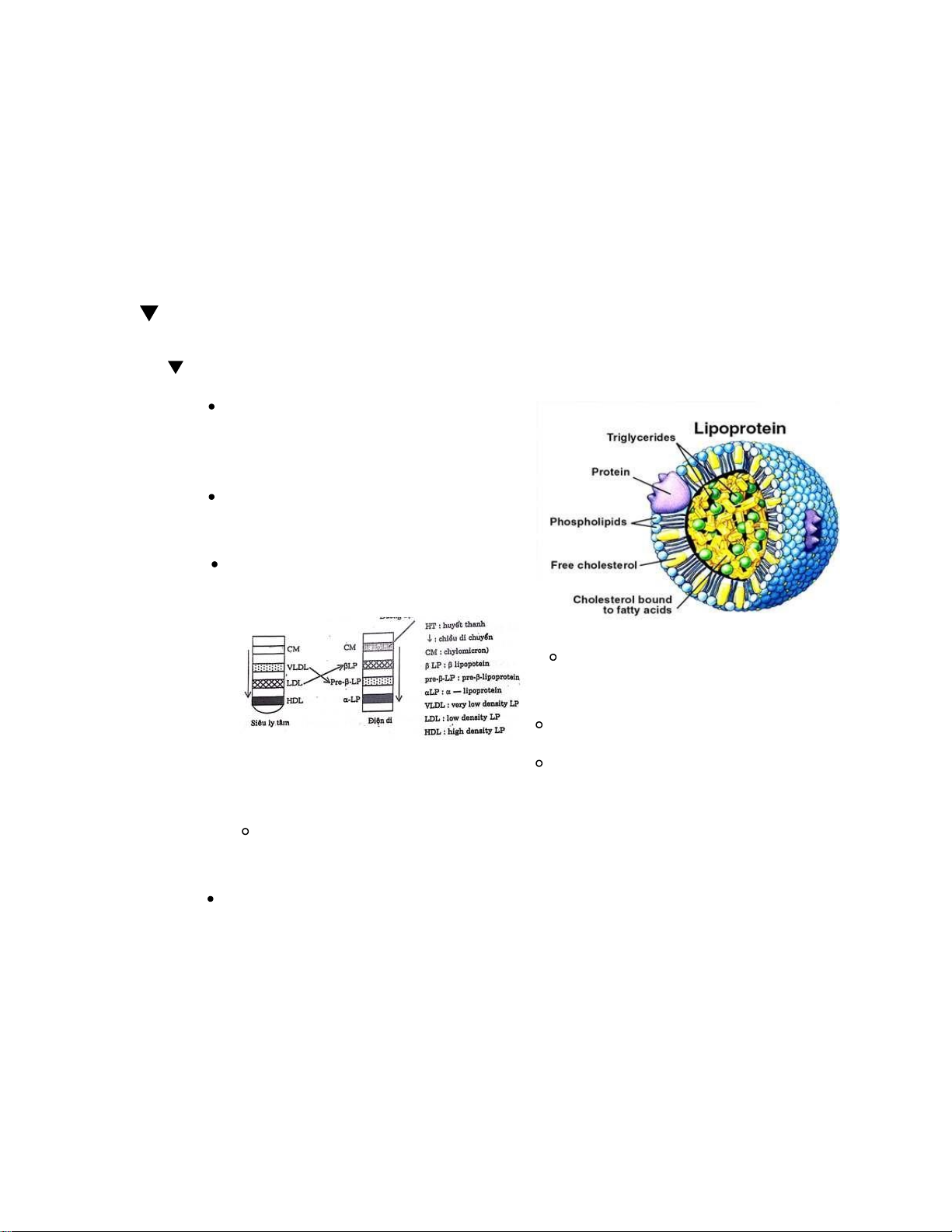
Dựa theo phương pháp điện di (xem
xét tính phân cực), người ta chia
lipoprotein thành các loại CM, β-LP, pre-β-LP, α-LP.
Còn nếu dựa theo phương pháp siêu
ly tâm (so sánh tỉ trọng), người ta
phân lipoprotein thành các loại
theo thứ tự tăng dần khối lượng riêng: CM, VLDL, LDL, HDL.
Chylomycron (tỉ trọng thấp nhất) → TG mô ngoại sinh về gan
Được tổng hợp ở tế bào niêm mạc ruột, tiết vào mạch bạch huyết. Khi tổng hợp ở
niêm mạc ruột thì chỉ có apo B-48 và apo A, apo C và apo E được thêm vào từ
HDL trong máu suốt quá trình vận chuyển
Giàu TG, thực hiện TĐC chủ yếu ở tế bào mỡ và cơ
Lipoprotein lipase (LpL) có trong lớp nội mô của mao mạch ở mô mỡ, mô cơ và
tim, không có trong gan. Apo C-II trong CM hoạt hóa LpL, xúc tác thủy phân TG
thành AB và glycerol. Mô mỡ và mô cơ hấp thụ AB này.
Phần còn lại (chylomicron remnants) CR được vận chuyển đến gan để xử lí tiếp. CASE 9: CASE LÂM SÀNG CHUNG
Tóm lại, chức năng CM là vận chuyển TG từ ruột đến mô mỡ để dự trữ, và đến
mô cơ, tim để cung cấp năng lượng. CM mất TG được gọi là hạt còn lại, được
đưa đến gan để xử lí.
VLDL (tỉ trọng thấp thứ 2) → TG từ gan đến mô ngoại sinh
Tổng hợp ở gan từ glycerol, AB và cholesterol ở tb gan, apo B-100, C-II và E. Apo
B-100 là phần chính, E và C-II được lấy từ HDL trong huyết tương.
Khi nó đến mô ngoại biên, apo C-II sẽ kích hoạt LpL, phóng thích ra AB và được
hấp thụ vào mô cơ, mỡ. Phần còn lại được gọi là IDL, chứa ít TG và chức nhiều
cholesterol hơn. Phần lớn IDL tiếp tục bị thủy phân
TG, để chuyển thành LDL. Con đường VLDL thành IDL và tiếp tục thành
LDL được coi như … Một phần IDL được hấp thụ bởi tb gan
CHỨC NĂNG: vận chuyển TG nội sinh từ gan đến mô ngoại biên cung caaos năng lượng.
LDL (tỉ trọng thấp) → CE về mô
LDL vận chuyển cholesterol từ gan
đến tế bào ngoại biên. Apoprotein
tồn tại duy nhất trong LDL là apo
B100. Hầu hết LDL có nguồn gốc từ
VLDL, một phần nhỏ được sản xuất trực tiếp từ gan.
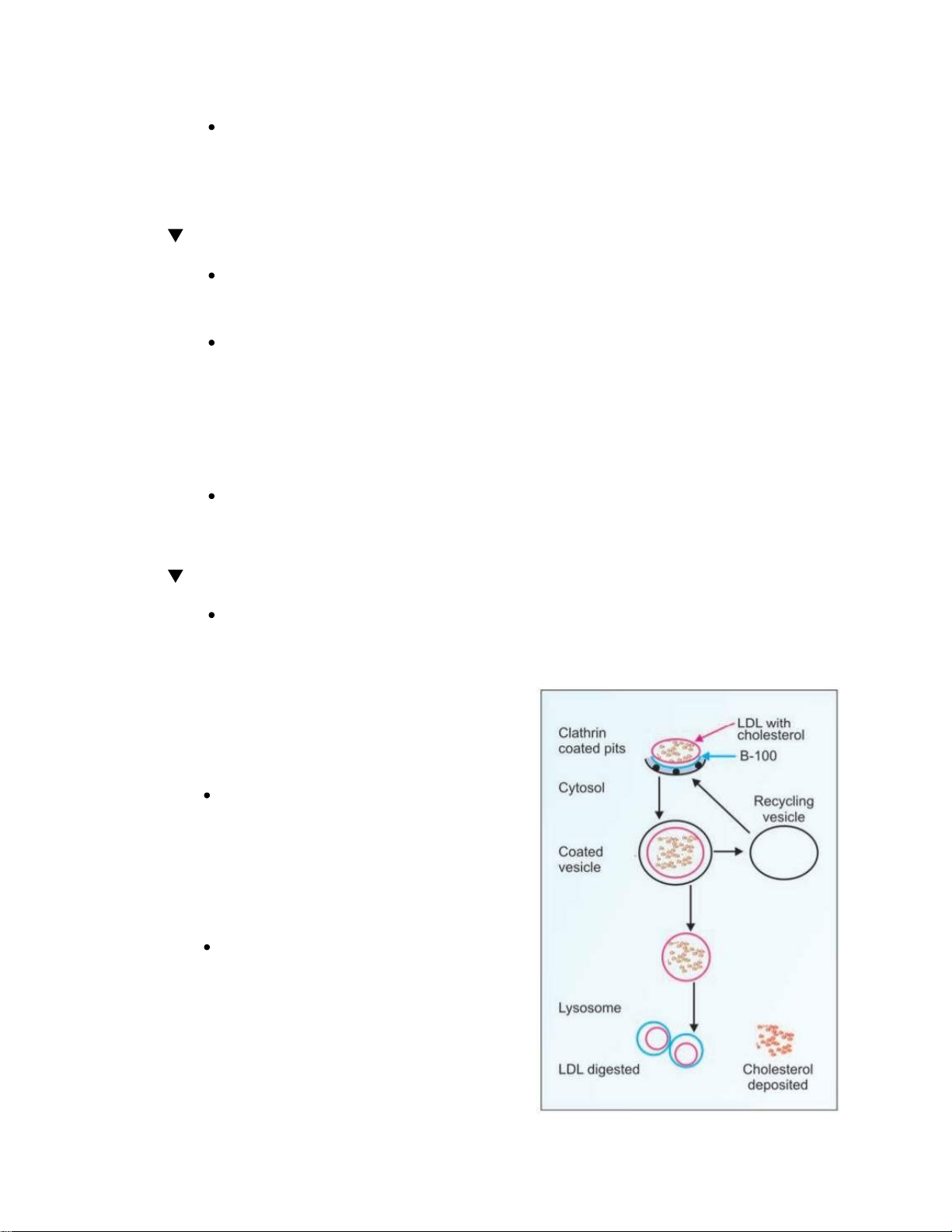
Quá trình gắn LDL vào thụ thể bởi apo
B-100 và hấp thụ cholesterol từ LDL
được điều hòa nghiêm ngặt. Thụ thể
LDL có trong mọi tế bào nhưng
nhiều nhất ở tế bào gan.
LDL sau khi gắn với thụ thể sẽ bị thủy
phân bởi enzym trong lysosome, tạo
amino acids và AB tự do. Thụ thể khi
này sẽ quay trở lại màng tế bào để
tiếp tục chu trình. Có khoảng 70% LDL thoái hóa ở gan CASE 9: CASE LÂM SÀNG CHUNG
Khoảng 75% cholesterol trong huyết
tương tồn tại trong LDL. LDL vận
chuyển cholesterol từ gan đến mô
ngoại biên. Cholesterol này được
phóng thích và có 3 con đường
1. Dùng cho tổng hợp steroid như hormone steroid.
2. Làm nhiệm vụ cấu trúc trên màng tế bào.
3. Cholestrol có thể được este hóa
thành chất béo đơn không bão hòa
(MUFA) bởi Acyl CoA- cholesterol-
acyl transferase (ACAT) để dự trữ.
Hàm lượng cholesterol trong tế bào
điều chỉnh quá trình nội sinh
cholesterol bởi việc kiểm soát enzym HMG CoA reductase.
Nồng độ LDL trong máu có liên quan
đến tỉ lệ mắc bệnh tim mạch. Một
lượng cholesterol bị hấp thụ bởi đại
thực bào, đây không phải là con
đường điều hòa. Nồng độ LDL cao
trong thời gian dài hay những chất
oxi hóa sẽ tăng tỉ lệ cholesterol bị
hấp thụ bởi đại thực bào, dấu hiệu
khởi đầu cho việc hình thành mảng xơ vữa động mạch CASE 9: CASE LÂM SÀNG CHUNG
HDL (tỉ trọng cao) → CE từ mô ngoại sinh về gan
Được tổng hợp tại gan và ruột non,
chứa nhiều Apo A-I. HDL như nguồn
chứa apoprotein C và E trong huyết
tương, có thể dùng để tạo ra VLDL và CM
Các hạt tiền chất HDL được tiết ra dưới
dạng cấu trúc hình đĩa và có thể hấp
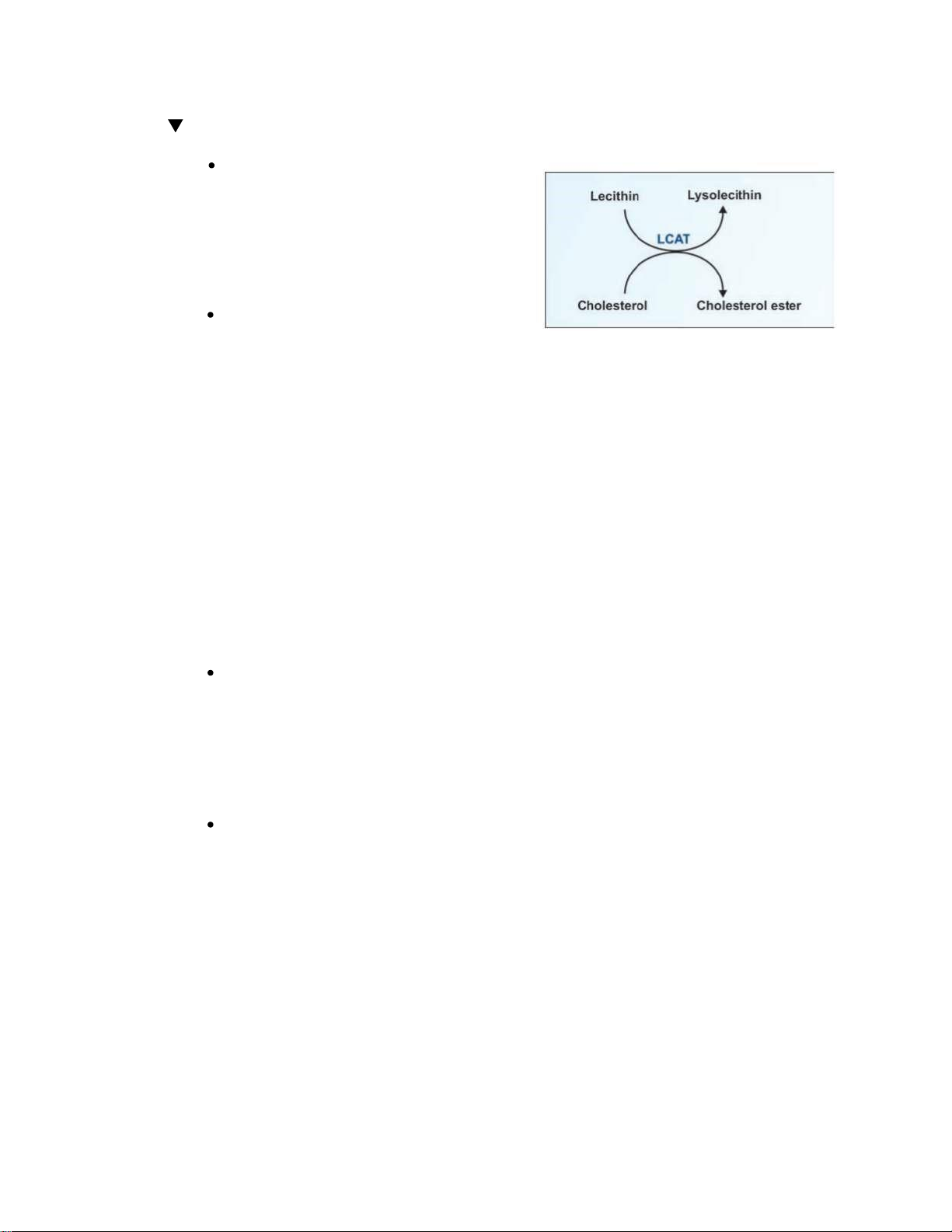
thụ cholesterol tự do. Apo A-I của HDL
hoạt hóa LCAT (lecithin cholesterol acyl
transferase) trong máu, tạo cholesterol
ester (CE). CE kị nước sẽ di chuyển vào
trong đĩa HDL. Qúa trình tiếp tục cho
đến khi HDL có hình cầu, chuyển thành
HDL-3, tiếp tục thu nhận thêm
apolipoprotein, cholesteryl este và triglycerid rồi chuyển
thành HDL-2 có kích thước lớn hơn
Tóm lại, HDL là dạng vận chuyển của
cholesterol từ mô ngoại biên về
gan, thoái hóa thành mật và tiết ra
ngoài (con đường duy nhất bài tiết
cholesterol của cơ thể người.
Để đánh giá nguy cơ xơ vữa động
mạch, thường dựa vào HDL-C, LDL- C, CASE 9: CASE LÂM SÀNG CHUNG
3. Cơ chế gây bệnh của LDL
Các yếu tố nguy cơ của xơ vữa động
mạch như rối loạn lipid máu, đái tháo
đường, hút thuốc, cao huyết áp, các tác
động gốc oxy hóa, … vẫn chưa được giải
thích cơ chế một cách rõ ràng. Có thể
hiểu một cách tổng thể như sau
Sự tăng nồng độ cholesterol trong LDL
trong thời gian dài sẽ gây nên những
cặn lắng đọng ở động mạch, như động
mạch chủ, động mạch vành, mạch
máu não. Như đã nói ở trên, một
phần nhỏ LDL cholesterol được hấp
thụ bởi đại thực bào, đặc biệt với các
tiểu phân LDL bị oxy hóa bởi các gốc
tự do sẽ gia tăng mức độ xảy ra của
điều này. Lâu dần, đại thực bào sẽ trở
nên quá tải với cholesterol, tích tụ
trên thành mạch, trở thành các tế bào
bọt (foam cells). Các tế bào bọt dần
dần tích tụ, cùng với việc tế bào cơ
trơn ở lớp trung mạc động mạch phân
chia và sản sinh lớp chất nền ngoại
bào đặc, sẽ tạo thành một mảng xơ CASE 9: CASE LÂM SÀNG CHUNG
vữa gây ảnh hưởng đến sự lưu thông máu.
Tổn thương nội mạc, cytokine tiền viêm
tiết ra bởi đại thực bào là yếu tố kích
thích sự phân chia của tế bào cơ trơn
ở lớp trung mạc. Sự tổn thương nội
mạc bởi các yếu tố như rối loạn lipid
máu, cao huyết áp, …sẽ kết tụ tiểu cầu
tại chỗ bị viêm, phóng ra nhiều chất
trong đó có các yếu tố tăng trưởng
kích thích sự di chuyển của tế bào cơ
trơn ra nội mạc và phát triển mạnh tại đó.
Ngoài ra, huyết khối (thrombosis) là
biến chứng cuối cùng của xơ vữa động
mạch. Thể hiện là sự đứt gãy của
mảng bám nắp xơ, cho phép các
thành phần đông máu đi vào tiếp xúc
với các yếu tố mô ở bên trong mảng
bám, gây ra huyết khối kéo dài vào
lòng mạch, nơi nó có thể cản trở lưu lượng máu.
4. Cơ chế bảo vệ động mạch của HDL
Những tính năng của High density Lipoprotein (HDL) tạo nên sự
bảo vệ động mạch trong cơ thể bao gồm: Kiểm soát sự tăng trưởng
của các tế bào cơ trơn ở trung mạc, chống oxi hóa LDL, điều hòa sự
đông máu, tiêu sợi huyết và kết dính tiểu cầu, ngăn chặn quá trình viêm.
Ức chế quá trình tạo tế bào bọt và sự tăng sinh của mô cơ trơn ở trung mạc: Sự
suy giảm NO sinh học (có tác dụng làm giãn mạch mạnh) có sẵn trong cơ thể sẽ gây suy CASE 9: CASE LÂM SÀNG CHUNG
giảm chức năng nội mạc, tăng ái lực của nội mạc với bạch cầu trong giai đoạn đầu xơ
vữa động mạch. Trong các mảng xơ vữa hình thành lâu, có thể thấy sự bào mòn của
lớp nội mạc, là hậu quả của quá trình chết tế bào apoptosis gia tăng. Một số nghiên
cứu in vivo cung cấp bằng chứng về tác dụng có lợi của HDL với nội mạc. So với những
bệnh nhân ít cholesterol máu, những người bị tăng cholesterol máu có sự giảm dãn
mạch phụ thuộc NO, và sự phục hồi được tìm thấy khi truyền thêm HDL. Việc tăng
nồng độ HDL trong huyết tương làm giảm interleukin IL-1, giảm sự biểu hiện của các
phân tử kết dính bạch cầu như E-selectin trong quá trình khởi đầu xơ vữa động mạch.
HDL làm giảm bớt quá trình oxy hóa LDL: HDL ức chế quá trình oxy hóa LDL bởi sự
chuyển tiếp các ion kim loại, ngăn cản sự hình thành lipid hydropeoxit. Sự ức chế
này là do HDL chứa hàm lượng chất chống oxi hóa cao, chẳng hạn như hoạt tính
chống oxi hóa của apo A-I và sự hiện diện của các enzym như paraxonase. CASE 9: CASE LÂM SÀNG CHUNG

![[Sinh học và di truyền] Giải phẫu bệnh ung thư - Đại học Y dược Thành phố Hồ Chí Minh](https://docx.com.vn/storage/uploads/images/documents/banner/fecc62e7aa9c229dbfdd2b67de61aa57.jpg)
![[Sinh học Di truyền] Cơ chế sinh ung thư - Đại học Y dược Thành phố Hồ Chí Minh](https://docx.com.vn/storage/uploads/images/documents/banner/08927c3620cd0a94b977684a74aa567f.jpg)
![[Sinh học di truyền] Nguyên nhân ung thư - Đại học Y dược Thành phố Hồ Chí Minh](https://docx.com.vn/storage/uploads/images/documents/banner/3c14836966fb80c6e8af991763cce716.jpg)