














Preview text:
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
MỘT SỐ PHƯƠNG PHÁP TỦA PROTEIN
I. Phương pháp tủa bằng các tác nhân gây tủa là dung môi hữu cơ (Ethanol 80%, Aceton)
Độ hòa tan của protein trong dung dịch phụ thuộc vào nhiều yếu tố, một trong số đó là
hằng số điện môi của dung dịch. Nhìn chung, những phân tử dung môi có hằng số điện môi
lớn (như nước, dimethylsulphoxid) có thể ổn định tương tác giữa chúng với các phân tử protein
và tạo điều kiện thuận lợi cho sự hòa tan của protein trong dung dịch. Ngược lại, các dung môi
với hằng số điện môi nhỏ (aceton, ethanol…) ngăn cản sự phân tán của các phân tử protein
trong môi trường. Do đó, độ hòa tan của những phân tử protein giảm và xảy ra kết tủa do sự
làm giảm hằng số điện môi hiện hữu của môi trường. Điều này có được bằng cách thêm một
dung môi hòa tan trong nước như aceton vào dung dịch chứa protein. Sự tủa bằng aceton hoặc
ethanol 80% có nhiều thuận lợi hơn vì nó tương đối rẻ, có sẵn ở dạng tinh khiết với ít chất tạp
nhiễm gây độc hay ức chế đối với enzym, do nhiệt độ bay hơi của dung môi thấp nên dễ tách
bỏ dung môi khỏi chế phẩm enzym bằng phương pháp sấy nhẹ bằng quạt gió.
II. Phương pháp tủa bằng muối
Người ta có thể dùng muối (NH4)2SO4, NaCl… để tủa protein vì các muối này vừa làm
trung hòa điện (do các ion tác động tương hỗ với các nhóm tích điện trái dấu), vừa loại bỏ lớp
vỏ hydrat của phân tử protein. Các protein khác nhau có thể bị kết tủa với nồng độ muối khác
nhau, vì vậy có thể dùng muối để tách riêng các protein ra khỏi hỗn hợp của chúng.
Phần thí nghiệm
1. Dụng cụ và hóa chất Dụng cụ Hóa chất Pipet 5ml, 10ml Nguyên liệu thơm (dứa) Becher 50ml, 100ml, 250ml Etanol 96% Bình tia Muối (NH4)2SO4 Máy ly tâm 2. Thực hành
Cân khoảng 80g đến 100g thơm, giã nát vắt lấy nước rồi ly tâm ở 6000 vòng/phút trong
15 phút rồi đong xem thể tích của nước thơm là bao nhiêu, ghi nhận thể tích V. Sau đó chia
đôi thể tích V nước thơm vùa thu được thành hai phần bằng nhau rồi tiến hành tủa protein
bắng hai tác nhân tủa khác nhau: Ethanol 80% và muối (NH4)2SO4
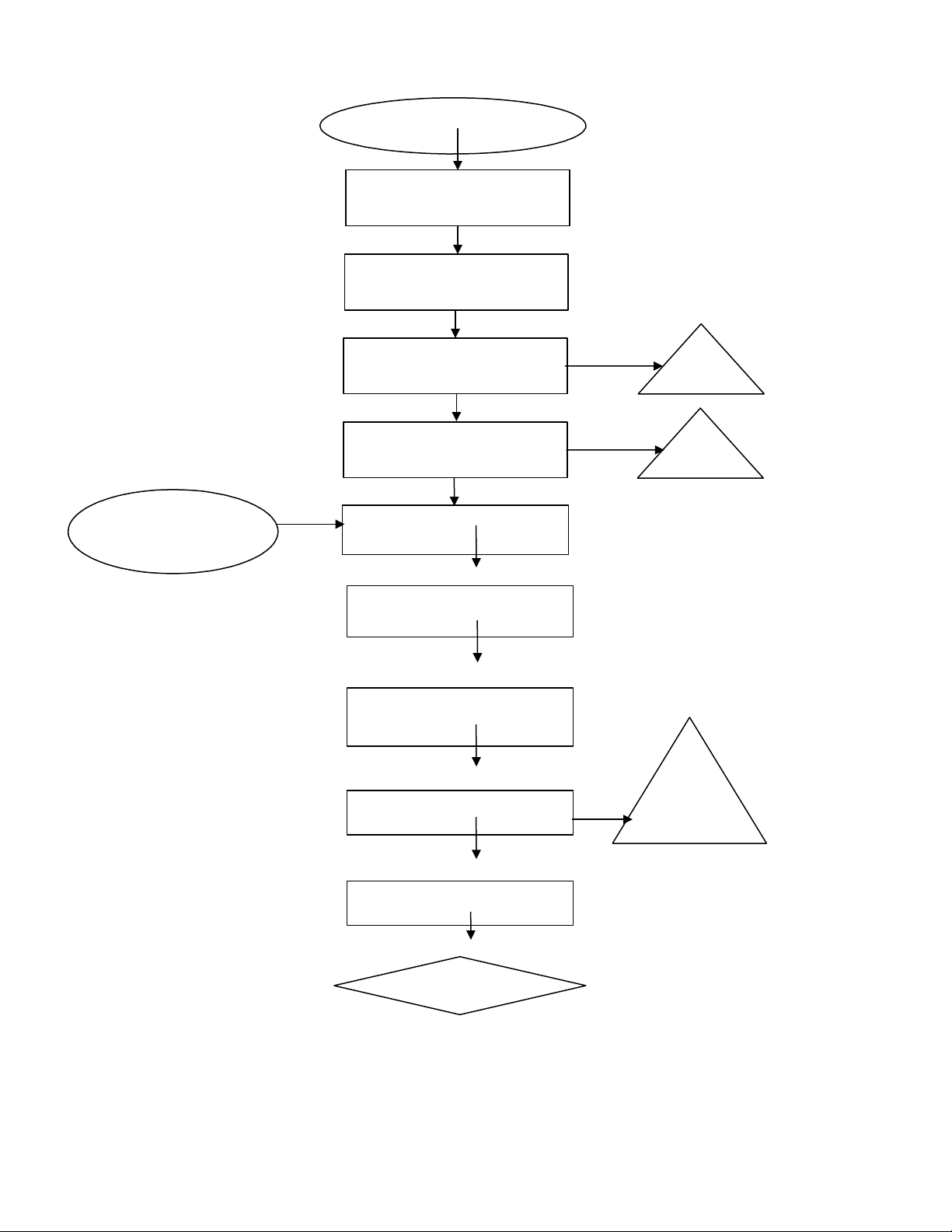
Quy trình kết tủa enzym Bromelin bằng cồn 80% 1
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH Chồi ngọn, vỏ quả Làm sạch Nghiền ép, xay nhuyễn Bã Lọc Ly tâm 6000 v/p, trong 15 phút Bã cồn 80%, làm Dịch trong lạnh 4 0 C Tủa cồn 4 o C / 2 giờ Ly tâm 6000 v/p, trong 20 phút Thu tủa Bỏ dịch trong Sấy khô Bromelin
Lưu ý: Phối trộn cồn với dịch dứa theo tỉ lệ 4:1 (1 dứa : 4 cồn) 2
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
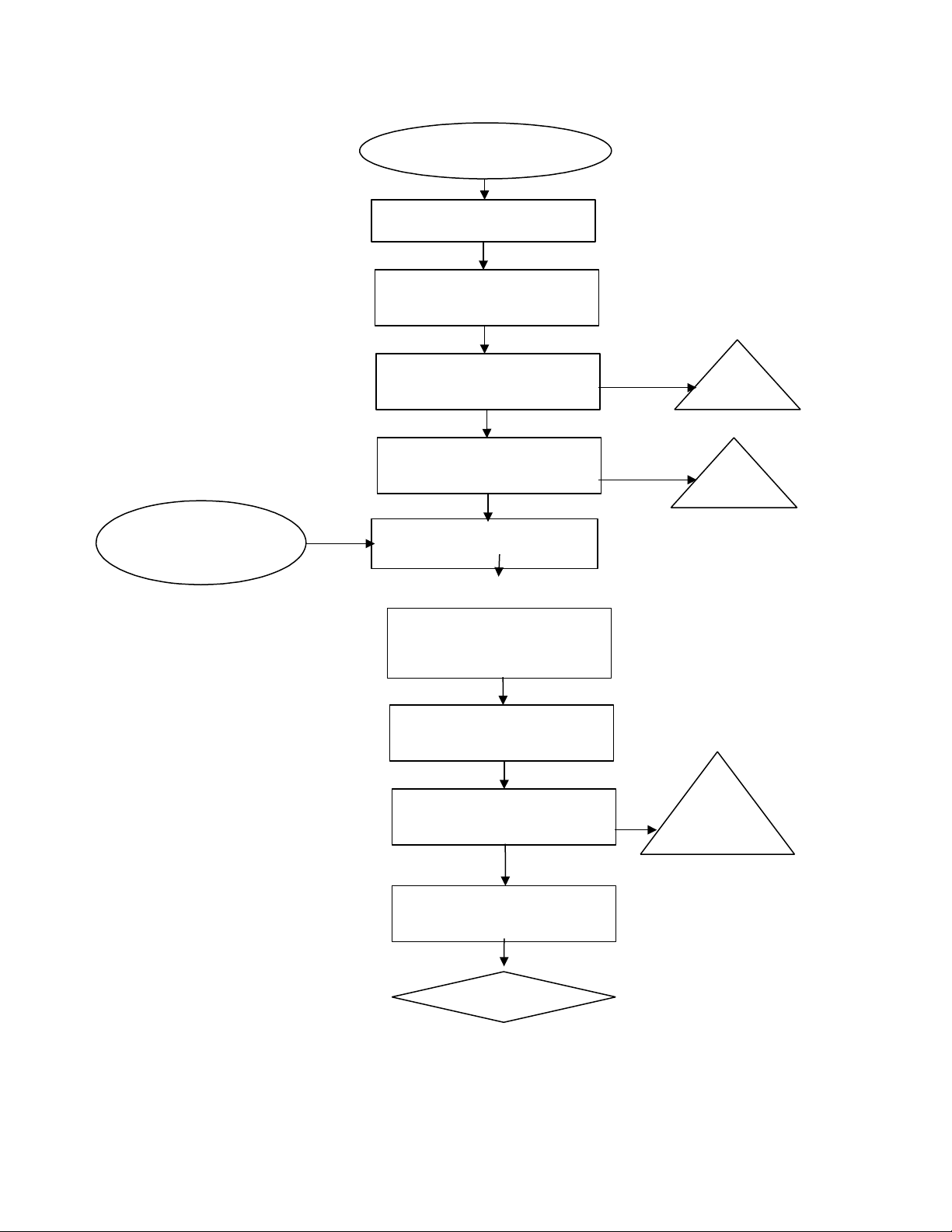
Quy trình thu nhận enzym Bromelin bằng muối (NH4)2SO4 Chồi ngọn, vỏ quả Làm sạch Nghiền ép, xay nhuyễn Bã Lọc Ly tâm 6000 v/p, 15 – 20phút Bã Ammonium Dịch trong sulfate 70% bão
Hỗn hợp dịch dứa, để ở nhiệt độ phòng 30 phút Ly tâm 6000 v/p, trong 15 phút Thu tủa Bỏ dịch trong Sấy khô Bromelin
Lưu ý: Để có muối(NH4)2SO4 bão hòa 70% ta phối trộn với tỷ lệ 47,2g muối trong 100ml nước thơm.
3. Kết quả: Hãy tính hàm lượng protein có trong 100g nguyên liệu ban đầu. 3
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
III. Phương pháp tủa protein bằng điểm đẳng điện. 1. Nguyên tắc
Giá trị pH mà tại đó phân tử protein trung hòa điện gọi là điểm đẳng điện của protein
(pI), ở giá trị pH = pI phân tử protein trung hòa điện sẽ không chuyển dịch trong điện trường,
phân tử protein sẽ kém bền nhất dễ kết tủa.
Người ta lợi dụng tính chất này để kết tủa protein.
2. Dụng cụ và hóa chất Dụng cụ Hóa chất Máy khuất từ Dung dịch NaOH 20% Máy ly tâm Dung dịch HCl 10% Cân phân tích Ete Bercher 100ml, 250ml Etanol Pipet 5ml, 10ml Giấy pH 3. Thực hành
Tách chiết protein cá:
Cân 100g cá đã xay nhuyễn trong một bercher rồi cho 4 lần nước. (1 cá : 4 nước, g/l)
Khuấy đều rồi cho từ từ NaOH 20% vừa cho vừa khuấy cho đến pH 11 thử bằng giấy pH,
khuấy khoảng 45 phút rồi ly tâm, giữ lại dịch chiết trong một bercher 250ml, bã còn lại thêm
nước chiết tiếp lần hai rồi ly tâm lấy dịch bỏ bã. Dịch thu được cho vào bercher 250ml gộp
chung với phần dịch chiết bên trên.
Cho từ từ HCl 100% vào dịch chiết vừa cho vừa khuấy đến pH thích hợp là 6 sẽ thấy
kết tủa, ly tâm 4000 vòng/phút trong 30 phút, rồi bỏ dịch thu tủa protein, rửa tủa với ete :
ethanol với tỷ lệ 2:1, tủa protein sạch khi rửa tủa vài lần với ete : ethanol. Cân lượng tủa protein
thu được (mg tủa) để tính ra hiệu suất protein có trong 100g cá.
KHẢO SÁT HOẠT TÍNH ENZYM BROMELIN
(Xác định hoạt tính enzym Bromelin bằng phương pháp Anson cải tiến) 1. Nguyên tắc
Phương pháp này dựa trên sự thủy phân protein casein bằng enzym Bromelin có
trong dịch nghiên cứu, tiếp đó làm vô hoạt enzym và kết tủa protein chưa bị thủy phân bằng
dung dịch acid trichloracetic. Định lượng sản phẩm được tạo thành trong phản ứng thủy phân
bằng phản ứng màu với thuốc thử Folin. Dựa vào đồ thị chuẩn của Tyrosin để tính lượng sản
phẩm do enzym xúc tác tạo nên. 4
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
2. Dụng cụ và hóa chất Dụng cụ Hóa chất Ống nghiệm Dung dịch Casein 1%
Pipet 1ml, 2ml, 3ml, 5ml, 10ml Dung dịch TCA 5% Máy quang phổ Dung dịch NaOH 0,5N Becher 50ml, 250ml, 500ml Thuốc thử Folin Bình tia Dung dịch HCl 0,2N
Dung dịch Tyrosin chuẩn 1 mM/l trong dung dịch HCl 0,2N
3. Chuẩn bị đường chuẩn Tyrosin Các bước dựng đường chuẩn Tyrosin Dung dịch hóa chất Ống nghiệm 1 2 3 4 5 6
Dung dịch Tyrosin chuẩn (ml) 0 0,2 0,4 0,6 0,8 1,0
Lượng Tyrosin tương ứng (µM) 0 0,2 0,4 0,6 0,8 1,0 Dung dịch HCl 0,2N (ml) 5,0 4,8 4,6 4,4 4,2 4,0 Dung dịch NaOH 0,5N (ml) 10 10 10 10 10 10 Thuốc thử Folin (ml) 3 3 3 3 3 3
Lắc mạnh, sau 10 phút đo OD ở bước sóng 660nm
Ống số 1 là ống thử không (TK), các ống còn lại là ống thí nghiệm (TN). Vẽ đường
chuẩn Tyrosin tương quan giữa lượng Tyrosin (µM) và ΔOD (ΔOD = ODTN – ODTK).
4. Phương pháp tiến hành
Lấy 6 ống nghiệm sạch, khô, tiến hành làm 3 ống thử thật, 3 ống thử không Các
bước chuẩn bị mẫu enzym để đo hoạt tính Ống nghiệm Dung dịch hóa chất Thử thật Thử không Dung dịch Casein 1% (ml) 5 5 Dung dịch TCA 5% (ml) 0 10 Dung dịch enzym mẫu (ml) 1 1
Lắc đều và giữ ở 35,5oC trong 20 phút Dung dịch TCA 5% (ml) 10 0
Để yên 30 phút, lọc lấy dịch trong
Lấy 2 ống nghiệm mới khác, cho vào ống thứ nhất 5ml dịch lọc của ống thử thật và cho vào
ống thứ hai 5ml dịch lọc cùa ống thử không.
Tiếp tục thêm vào mỗi ống 10ml NaOH 0,5N và 3ml thuốc thử Folin, lắc mạnh, sau 10
phút đo OD ở bước sóng 660nm. Tính ΔOD = ODTT – ODTK, sau đó dựa vào đồ thị chuẩn suy ra được số µM Tyrosin. 5
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH 5. Tính kết quả
Định nghĩa đơn vị Anson: một đơn vị Anson là lượng enzym tối thiểu trong điều kiện
thí nghiệm (35,50C: pH 7,6 …) thủy phân Casein trong 1 phút tạo thành sản phẩm hòa tan
trong TCA, phản ứng với thuốc thử Folin cho ta độ hấp thu OD ở bước sóng 660nm tương
ứng với 1µM Tyrosin trong đường chuẩn.
M Tyro sin*V * L (UI) Hđ Protease = t *m v*
Với: Hđ Protease : hoạt độ enzym protease (UI/g)
V : tổng thể tích hỗn hợp trong ống thử thật hoặc ống thử không
(ml) v : thể tích dịch lọc đem phân tích (ml) t : thời gian thủy phân (phút)
m : khối lượng mẫu enzym đem đi xác định hoạt tính (g) L: độ pha loãng enzym
µM Tyrosin: lượng µM Tyrosin trong v (ml) suy ra từ đường chuẩn
KHẢO SÁT HOẠT TÍNH INVERTASE I. Nguyên tắc:
Invertase là một enzym thủy giải saccharose thành glucose và fructose.
Trong bài này ta dùng enzym invertase trích trong men bia để cho thủy giải saccharose,
từ đó tính được hoạt tính của enzym này. II. Dụng cụ và thuốc thử Dụng cụ
Hóa chất dung Becher 100ml – 250ml dịch saccharose 10% Erlen 250ml dung dịch NaOH N/10 Ống nghiệm 50ml Dung dịch Iod N/10 Pipet 5ml – 10ml Dung dịch H2SO4 N Buret 25ml Hồ tinh bột 1% Phễu lọc Dung dịch Na2S2O3 N/20
III. Cách tiến hành
Điều chế dung dịch invertase: cân 0,5g men bia hòa tan trong 50ml nước cất. Khuấy
đều trong 5 phút. Để lắng đem lọc lấy dịch lọc. 6
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
Thực hiện ba ống nghiệm như sau: Số ống 1 2 3 ml dung dịch saccharose 10% 10 10 ml nước cất 10 ml enzym invertase 10 10
ml enzym invertase đã đun sôi 10
Để thủy giải trong 30 phút ở nhiệt độ phòng. Tiếp đó, đem tất cả các ống đun cách thủy
trong 2 phút, làm lạnh dưới vòi nước.
Hút 5 ml của hỗn hợp cho vào một erlen 250ml và định phân đường glucose như sau:
cho thêm vào bình 10ml dung dịch Iod N/10 và 15 ml dung dịch NaOH N/10. Thời gian nhỏ
NaOH phải kéo dài khoảng 2 phút (nhỏ từng giọt). Để yên trong bóng tối 15 -20 phút. Lấy ra
thêm vào 2ml dung dịch H2SO4 N. Định phân lượng iod thêm còn thừa bằng dung dịch Na2S2O3
N/20 (dùng hồ tinh bột cho thêm vào lúc cuối phản ứng để làm chất chỉ thị màu). IV. Kết quả
Hoạt tính của invertase được biểu thị bằng số mol saccharose thủy giải bởi lượng enzym
invertase có trong 1g men bia trong 1 phút ở nhiệt độ phòng thí nghiệm.
Gọi V1 và V2 là số ml Na2S2O3 N/20 dùng định phân ống số 1 và số 2.
Có nhận xét gì về kết quả định phân trong ống số 3?
Hoạt tính invertase được tính theo công thức sau:
3 (V20 21 V2)*a b t mA B** * mol g phút/ / 10
a: thể tích lấy ra trong mỗi ống để định đường glucose (ml)
A: thể tích tổng cộng trong mỗi ống (ml) b: thể tích dung
dịch enzym cho vào mỗi ống (ml)
B: tổng thể tích dung dịch enzym có được từ mg – men (ml) t:
thời gian thủy giải tính bằng phút. 7
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
XÁC ĐỊNH HOẠT TÍNH ENZYM ALPHA – AMYLASE
(THEO PHƯƠNG PHÁP SMITH & ROE) I. Nguyên tắc:
Hoạt tính α - amylase biểu thị khả năng của enzym amylase xúc tác phản ứng thủy phân
tinh bột đến dextrin trong 1 phút ở 500C và được thể hiện bằng số đơn vị của enzym trong 1g
mẫu. Khi phản ứng thủy phân tinh bột xảy ra, lượng tinh bột còn lại chưa được thủy phân hủy
sẽ tạo phản ứng màu với iod và được so màu bằng máy so màu quang học ở bước sóng 620 nm.
II. Dụng cụ và hóa chất Dụng cụ Hóa chất
Bình định mức 50ml, 100ml, 250ml Cồn 960 Bếp ổn nhiệt
Dung dịch tinh bột 1% trong đệm pH 5,6
Pipet 1ml, 2ml, 3ml, 5ml, 10ml Dung dịch HCl 1N Becher 50ml, 100ml, 250ml Dung dịch NaCl 3% Máy quang phổ Thuốc thử Lugol
III. Thực hành 1. Ly trích Amylase
Amylase là 1 tạp chất protein không tan trong rượu mạnh. Cân 10g lúa nảy mầm cho
vào cối với 30ml nước cất, giã nát lúa dưới nước. Để yên trong 15 phút, đem lọc. Lấy tất cả
nước qua lọc, thêm 4 lần thể tích cồn 960. Khuấy đều, ta sẽ thấy amylase và các protein khác
tủa dưới dạng nùi lớn.
Để lắng, ly tâm lấy tủa. Hòa tan tủa trong 20ml nước cất. Ta có dung dịch amylase khá
tinh sạch. Đặc biệt dung dịch này không có chất đường khử (thử 1ml dung dịch thuốc thử
Fehling, đun cách thủy 3 phút, ta không có kết tủa đỏ xuất hiện)
2. Khảo sát hoạt tính α-amylase
Lấy sáu ống nghiệm chia thành 2 lô, mỗi lô 3 ống nghiệm gồm thử thật và thử không để lấy trung bình. 8
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
Tiến hành thí nghiệm theo bảng sau: Ống nghiệm
Dung dịch hóa chất
Ống thử thật (t) Ống thử không (o) Nước cất (ml) 0 1 Dịch chiết α - amylase 1 0 Dung dịch đệm (ml) 1 1
Dung dịch tinh bột 1% (ml) 1 1 Dung dịch NaCl 3% (ml) 0,5 0,5 Dung dịch HCl 1N (ml) 0 1
Đem ủ ở 500C trong 30 phút Dung dịch HCl 1N (ml) 1 0 Nước cất (ml) 5,5 5,5 Thuốc thử Lugol (ml) 0,5 0,5
Lắc đều hỗn hợp trong ống nghiệm rồi mang đi so màu ở bước sóng 620nm IV. Kết quả:
(OD0 ODt )*C*L (UI) Hđ A= OD0 *t
Với OD0: mật độ quang của ống thử không
ODt: mật độ quang của ống thử thật
C: lượng tinh bột ban đầu tham gia phản ứng (mg)
T: thời gian phản ứng (phút) L:
hệ số pha loãng mẫu enzym.
XÁC ĐỊNH ĐẠM TỔNG SỐ THEO PHƯƠNG PHÁP KJELDAHL I. Vô cơ hóa: 9
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
• Nguyên tắc: Sự vô cơ hóa chất đạm là sự biến đổi tất cả các chất đạm dù nằm dưới dạng
nào (hữu cơ, vô cơ, protein) thành hợp chất vô cơ là amonium sulfat (NH4)2SO4 bằng cách
đun sôi với H2SO4 đậm đặc và chất xúc tác. H2SO4 đậm đặc Chất đạm (NH4)2SO4 Xúc tác, t0
• Thực hành: hút chính xác 1ml nếu là nguyên liệu lỏng hay cân chính xác 1g nếu là nguyên
liệu khô đã nghiền nhuyễn để cho đồng nhất, cho vào một bình cổ cao có dung tích từ 60ml
đến 100ml (bình kjeldahl). Thêm vào đó 5ml H2SO4 đậm đặc và khoảng 0,5g chất xúc tác.
Đun sôi hỗn hợp trong tủ hút khí độc từ 2 đến 3 giờ cho đến khi dung dịch trở thành trong
suốt và có màu xanh do trời nhạt. Để nguội và pha loãng thành 100ml với nước.
Chất xúc tác dùng ở đây là hỗn hợp đã xay nhuyễn của: K2SO4 và CuSO4 có tỷ lệ theo trọng lượng là 9: 1
Thực hiện 3 sự thử thật (có chất đạm) và 3 sự thử không có chất đạm (thay chất đạm bằng nước cất)
II. Phương pháp kjeldahl:
• Nguyên tắc: Chất đạm đã được vô cơ hóa nằm dưới dạng Amonium sulfat đem cho tác
dụng với chất kiềm mạnh như NaOH sẽ phóng thích ra amoniac
(NH4)2SO4 + 2NaOH 2NH4OH + Na2SO4
Sau đó lượng amoniac được hơi nước nôi cuốn bằng một dụng cụ máy Parnas – Wargner
và được dẫn đến một bình tam giác có chứa một lượng thừa H2SO4. Từ đây cho phép chúng
ta xác định được lượng amoniac phóng thích ra, có nghĩa là xác định được lượng đạm có trong mẫu nguyên liệu.
• Dụng cụ và hóa chất: Dụng cụ: - Bình kjeldahl
- Máy cất đạm Parnas – Wargner - Bếp đun
- Bình xịt nước cất - Erlen 250ml
- Becher 250 ml, 100ml, 50ml 10
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
- Bình định mức 100ml, 50ml -
- Dung dịch NaOH N/100 (dung Buret 25ml
dịch này sau khi pha xong dùng
ngày thì đúng nồng độ, nhưng để
- Pipet 1ml, 5ml, 10ml, 20ml.
lâu sẽ bị carbonat hóa nên nồng độ - ống đong 25ml
không còn đúng như ban đầu, vì
thế phải xác định lại hệ số chỉnh lý
x bằng cách định phân nó với
Hóa chất: - Dung dịch
dung dịch acid chuẩn (acid oxalic, acid phtalic…) NaOH đậm đặc (10N) Cách thực
- Dung dịch đỏ metil 0,5% pha hành: trong rượu etylic.
- Dung dịch H2SO4 N/100
Đun sôi bình nước máy Parnas – Wargner. Đặt erlen có chứa 25ml H2SO4N/100 và vài giọt
đỏ metil vào phần đuôi của máy sao cho phần nhọn nhúng chìm vào dung dịch. Hút 10ml dung
dịch vô cơ hóa đã pha loãng thành 100ml, đem đổ vào máy Parnas – Wargner; thêm vào đó
10ml NaOH đậm đặc ( ghi nhó là khi cho mẫu cũng như NaOH đậm đặc vào máy, phải cho
xuống từ từ bằng kẹp Mohr, nếu cho chảy xuống quá nhanh thì dung dịch sẽ bị máy hút ra
ngoài). Tiếp tục đun sôi bình nước và để cho hơi nước lôi cuốn amoniac sang erlen trong 3
phút, hạ erlen xuống và tiếp tục đun thêm 2 phút nữa, tráng vòi của máy bằng một tia nước
cất, tất cả đều cho chảy vào erlen đựng H2SO4 N/100. Lấy erlen ra và định phân H2SO4 thừa
bằng dung dịch NaOH có chuẩn độ là x N/100 cho đều. Khi dung dịch đổi màu (từ màu hồng
nhạt sang màu da cam): thực hiện 3 sự thử thuật và 3 sự thử không để lấy trị số trung bình. • Cách tính:
Nếu nguyên liệu là chất lỏng, thông thường lượng đạm được tính bằng số gam đạm trong
1 lít, nếu nguyên liệu là chất rắn, thì trước hết phải tính độ ẩm, sau đó lượng đạm đươc tính
bằng phần trăm (số gam đạm có trong 100g nguyên chất liệu) theo độ khô tuyệt đối) Giả sử
nguyên liệu là chất lỏng. Lấy 1ml nguyên liệu đem vô cơ hóa và pha loãng thành 100ml, sau
đó hút 10ml đem chưng cất bằng máy Parnas – Wargner.
Gọi V0 là thể tích dung dịch NaOH x N/100 (trị số trung bình của 3 lần thử không). Gọi
Vt thể tích dụng dịch NaOH x N/100 (trị số trung bình của 3 lần thử thật). Vậy: V V0 Vt
là lượng NaOH tương đương với lượng amoniac phóng thích bởi 10ml dung dịch vô cơ hóa đã pha loãng.
1mol amoniac tương đương với 1mol NaOH.
Do đó số mol amoniac phóng thích bởi 10ml dung dịch vô cơ hóa đã pha loãng là: 11
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH CM
Vx(1/100) mol Vx10 5mol 1000
Số gam đạm có trong 10ml dung dịch vô cơ hóa đã pha loãng là:
14. V x. .10 5 g
Số gam đạm có trong 1000gl dung dịch vô cơ hóa đã pha loãng hay trong 1ml nguyên liệu 14. Vx10 4 g
Số gam đạm có trong 1 lít nguyên liệu:
14. V x. .10 .1000 4g lít/ 1,4. V xg lít. /
MỘT SỐ PHƯƠNG PHÁP ĐỊNH TÍNH CHẤT ĐƯỜNG
I. Phản ứng màu tổng quát (phản ứng Molish)
Tất cả các chất đường đều cho màu tím đối với dung dịch α – Naphthol trong H2SO4
đậm đặc. Đổ trong ống nghiệm 1 ml dung dịch đường 1% và 2 giọt dung dịch α – Naphthol 12
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
15% trong rượu. Lắc đều, nghiêng ống và cho H2SO4 đậm đặc từ từ theo thành ống. Có sự tạo
thành một lớp màu tím hiện ra ở mặt ngăn cách 2 chất lỏng.
II. Phân biệt giữa monosaccharid và disaccharid (phản ứng Barfoed)
Khả năng khử của những monosaccharid có thể lớn hơn nhiều khả năng khử của
disaccharid cho nên, thay vì sử khử ở môi trường base, sự khử ở môi trường acid yếu có thể
giúp ta phân biệt được monosaccharid và disaccharid.
Trong ống nghiệm đựng 2ml thuốc thử Barfoed, ta thêm vào 1ml dung dịch đường muốn khảo sát.
Ta thực hiện đồng thời ba sự thử chứng với các dung dịch glucose 1% , lactose 1% và
nước cất. Đun sôi cách thủy trong 5 phút. Làm lạnh, quan sát ống có trầm hiện đỏ. Đun tiếp
tục 8 phút, quan sát ống có trầm hiện đỏ. Giải thích hiện tượng.
III. Phản ứng với thuốc khử Fehling
Thuốc khử này là dung dịch CuSO4 với dung dịch soude đậm đặc và tartrat kép natrium
và kalium. Tác dụng của dung dịch soude đậm đặc lên CuSO4 cho hydroxyd đồng (CuO, H2O)
tan trong dung dịch nhờ sự hiện diện của tartrat.
Trong một ống nghiệm, đổ 1ml thuốc thử Fehling và 1ml dung dịch glucose. Đun sôi
cách thủy trong 5 phút có trầm hiện đỏ gạch Cu2O nhờ sự khử đồng nhị thành đồng nhất bởi glucose. KHẢO SÁT LIPID
I. Khảo sát tính hòa tan của lipid 1. Nguyên tắc:
Lipid không hòa tan trong nước do có sức căng bề mặt rất cao. Nếu dùng lực cơ học
tác động vào hỗn hợp lipid nước thì chúng phân tán thành từng hạt nhỏ, nhưng ngưng tác dụng
chúng lại phân thành 2 lớp: lipid ở trên và nước ở dưới. Nếu ta thêm vào hỗn hợp các chất
muối kiềm, xà phòng, mật.. sẽ có tác dụng làm giảm sức căng bề mặt của các hạt lipid do đó 13
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
việc trở lại hai lớp khó hơn và dung dịch lúc này sẽ có màu trắng đục như sữa (nhũ tương),
lipid ở dưới dạng các hạt nhỏ liti các micell đấy là hiện tượng nhũ hóa mỡ. Nếu thay nước
bằng các dung môi hữu cơ: acetone, ether, chloroform, benzen thì lipid sẽ hòa tan vào các dung môi nói trên. 2. Hóa chất
Dầu thực vật hay mỡ động vật
Dung môi hữu cơ: alcohol, acetone, bezen 3. Cách làm Cho vào ba ống nghiệm: Ống 1: 2ml alcohol Ống 2: 2ml acetone Ống 3: 2ml benzen
Nhỏ thêm vào mỗi ống 1 giọt dầu hoặc mỡ, lắc nhẹ, quan sát sự hòa tan của lipid trong ba dung môi hữu cơ.
II. Khảo sát một số chỉ số đặc trưng của chất béo 1. Chỉ số acid:
Là số mg KOH dùng trung hòa các acid béo tự do trong 1g chất béo. Nguyên tắc
Dùng KOH 0,1N trong rượu để trung hòa các chất béo tự do trong 1g nguyên liệu,
chất chỉ thị màu là phenolphtalein. Cách làm
Dụng cụ và hóa chất Hóa chất Dụng cụ KOH 0,1N Erlen 100ml Ether ethylic Pipet 10ml
Phenolphtalein 0,5% trong alcohol Becher 100ml Dầu để khảo sát Bình tia
Cân 1g (1ml) chất béo cho vào erlen, thêm 10ml ether ethylic, lắc đều cho tan chất béo.
Cho 1 giọt phenolphtalein và chuẩn độ bằng KOH 0.1N cho đến khi xuất hiện màu hồng bền trong 30 giây.
Tính toán kết quả: Chỉ số acid = 5.61 * V/m
5,61 là số mg KOH tương ứng 1ml KOH
0.1N V là số ml KOH m là trọng lượng lipid đã cân (gram) 14
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH 2. Chỉ số savon
Là số mg KOH cần thiết để savon hóa các ester chứa trong 1g chất béo. Nguyên tắc:
Cho nguyên liệu kết hợp với 1 lượng thừa KOH để savon hóa chất béo. Định lượng
KOH thừa bằng HCl giúp suy ra chỉ số savon.
Dụng cụ và hóa chất: Dụng cụ Hóa chất Erlen KOH 0.5N trong rượu Pipet 10ml HCl 0.5N Becher 100ml Ethanol tuyệt đối Bộ chưng cất hoàn lưu
Phenolphtalein 0,5% trong alcohol
Chất béo để khảo sát Cách làm:
Cân chính xác 500mg chất béo cho vào erlen, thêm 10ml KOH 0.5N. Đun sôi hoàn lưu
45’, định phân KOH bằng HCl 0.5N với chất chỉ thị màu là phenolphtalein. Thực hiện một
bình đối chứng thay 500mg chất béo bằng 500mg nước.
Tính toán kết quả:
Chỉ số savon = 28.05 * (V0 – V1)/m
28.05 là số mg KOH tương ứng 1ml HCl 0.5N
V0 là thể tích dung dịch HCl 0.5N của bình đối chứng
V1 là thể tích dung dịch HCl 0.5N của bình thí nghiệm
m là trọng lượng chất béo đã cân (gram)
ĐỊNH LƯỢNG VITAMIN C
(Phương pháp định lượng vitamin C bằng IOD) 1. Nguyên tắc
Để xác định nhanh chóng hàm lượng vitamin C trong nguyên liệu khi có chất màu
người ta thường dùng phương pháp chuẩn độ iod. Tất cả acid ascorbic bị oxi hóa bởi iod. Phần
iod thừa sẽ cho màu xanh với dung dịch tinh bột. Điều đó nói lên là phản ứng đã kết thúc. 15
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
2. Dụng cụ và hóa chất Dụng cụ Hóa chất - Erlen 100ml - Dung dịch HCl 5% - Pipet 5ml, 10ml
- Dung dịch Na2S2O3 0,01N - Buret
- Dung dịch tinh bột 1%
- Bình định mức 50ml
- Dung dịch iod 0,01N - Becher - Cối chày sứ - Phễu thủy tinh 3. Cách thực hành
a. Chuẩn bị mẫu vật:
Cân N (g) mẫu vật và nghiền nhanh chóng trong cối sứ với 5ml HCl 5%. Vitamin C rất
dễ bị oxi hóa trong không khí nhất là khi có sự hiện diện của các ion kim loại (Fe, Cu). Vì vậy
trong khi chuẩn bị mẫu phải cắt hoặc nghiền bằng dao không rỉ và làm nhanh.
Dịch chiết thu được cho vào bình định mức 50ml và thêm nước cất (rửa cối chày và bã
vài lần bằng nước cất rồi đổ vào bình), khuấy đều rồi lọc. b. Định phân: -
Định chuẩn lại dung dịch iod N/100 với dung dịch Na2S2O3 0,01N để tính hệ số
hiệu chỉnh T của dung dịch iod. -
Chuẩn bị hai erlen. Hút vào mỗi bình 20ml dịch chiết có chứa vitamin C, 5 -10
giọtdung dịch hồ tinh bột 1% và chuẩn độ ngay bằng dung dịch iod 0,01N đến khi có màu xanh 4. Kết quả
Số mg vitamin C trong 1g mẫu vật được tính như sau: x%
a: thể tích (ml) dung dịch iod 0,01N dùng khi chuẩn độ. 16
KHOA CN SINH HỌC – MÔI TRƯỜNG THÍ NGHIỆM HÓA SINH
T: hệ số hiệu chỉnh dung dịch iod 0,01N với dung dịch Na2S2O3 0,01N
V: thể tích chung của dịch chiết (50ml) v: thể tích dịch chiết lấy để chuẩn độ (20ml)
N: trọng lượng mẫu phân tích
0,00088: số gram vitamin C tương ứng với 1ml dung dịch iod 0,01N 17




