











Preview text:
ĐẠI HỌC CẦN THƠ
VIỆN CÔNG NGHỆ SINH HỌC & THỰC PHẨM TÀI LIỆU THỰC TẬP
HÓA SINH CÔNG NGHIỆP (CS219) Giảng viên: Trần Hồng Quân
Nguyễn Thị Thu Thủy 11-2025 MỤC LỤC
Bài 1: Phân tách và định lượng casein ................................................................ 1
Bài 2: Khảo sát định tính carbohydrate ............................................................. 4
Bài 3: Định lượng đường khử bằng phương pháp DNS ..................................... 6
Bài 4: Vitamin ..................................................................................................... 8
Bài 5: Xác định các chỉ số của chất béo ............................................................ 11
Bài 6: Khảo sát hoạt tính enzyme ..................................................................... 14
BÀI 1. PHÂN TÁCH VÀ ĐỊNH LƯỢNG CASEIN 1. Nguyên tắc
Casein là protein quan trọng trong sữa. Casein có những chức năng bao gồm:
chức năng dự trữ protein, bên cạnh đó casein cũng có chức năng như là thành phần
dinh dưỡng của động vật. Casein có thể được phân tách từ sữa bằng cách acid hóa ở
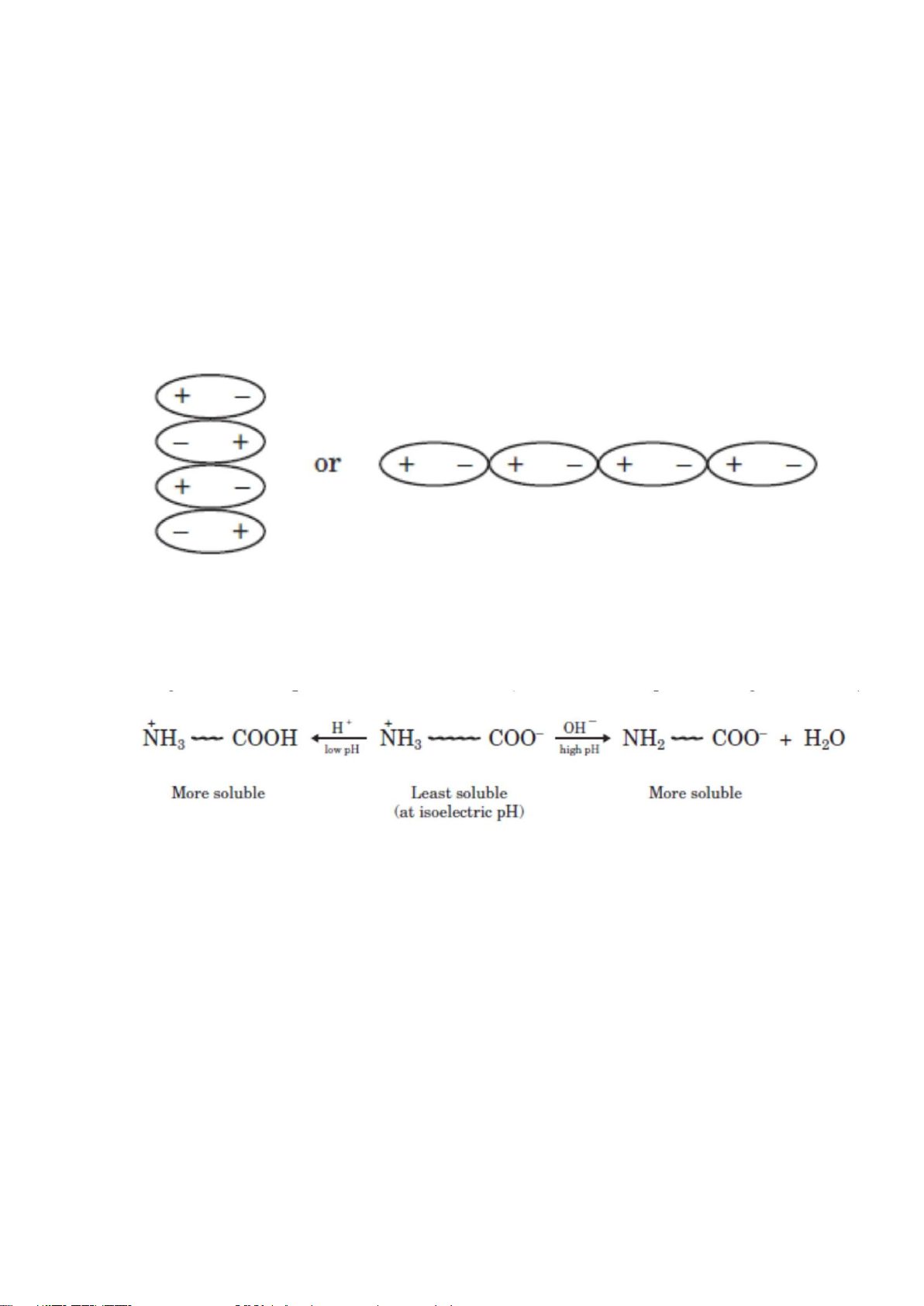
điều kiện điểm đẳng điện. Tại điểm đẳng điện, số lượng các nhóm tích điện dương trên
một protein cân bằng với số tích điện âm. Protein sẽ ít hòa tan trong nước tại các điểm
đẳng điện của chúng vì chúng có xu hướng kết tủa gây ra bởi những tương tác tĩnh
điện. Phần mang điện tích dương sẽ tương tác với nhóm điện tích âm kết quả protein bị kết tủa (Hình 1.1).
Hình 1.1 Sự tương tác tính điện của casein tạo kết tủa
Ngược lại, nếu 1 phân tử protein mang điện tích dương (pH thấp hoặc điều kiện
acid), hoặc mang điện tích âm (pH cao hoặc điều kiện base), Sự hòa tan của protein
trong nước sẽ tăng (Hình 1.2).
Hình 1.2. Sự hòa tan của protein phụ thuộc vào pH
Ở phần đầu tiên của thí nghiệm, nguyên liệu để tách chiết casein từ sữa có pH
khoảng 7. Casein sẽ được tách ra như là một thành phần không hòa tan bằng cách acid
hóa sữa đến điểm đẳng điện (pH 4.6). Các chất béo kết tủa cùng với casein có thể được
loại bỏ bằng cách hòa tan nó trong rượu.
Trong phần thứ hai của thí nghiệm này, sản phẩm kết tủa sẽ được xác định là
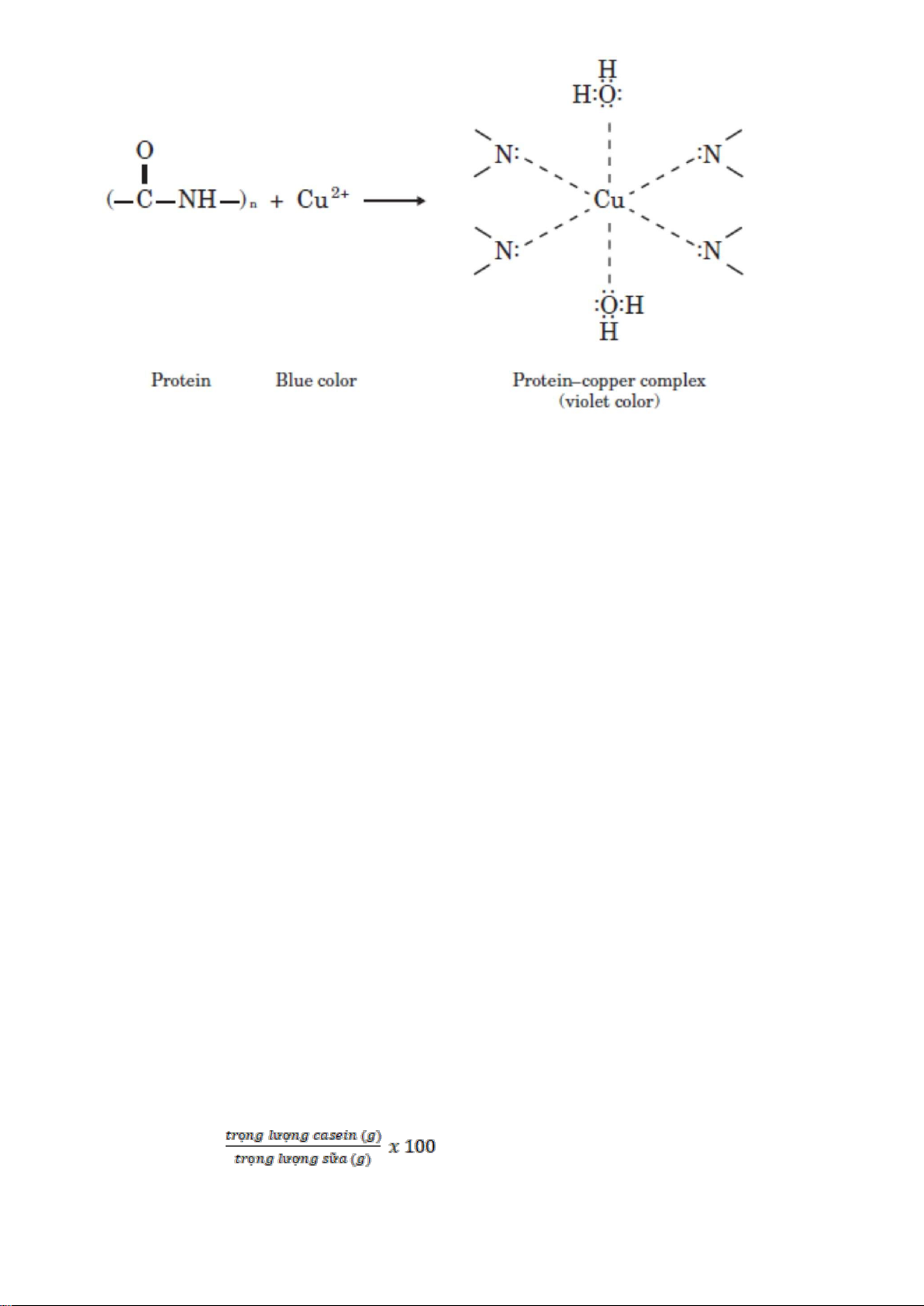
protein hay là hợp chất khác. Việc xác định sẽ được thực hiện một bằng phương pháp Biuret.
Biuret test: khi một protein phản ứng với CuSO4, phức hợp Cu hình thành có màu tím (Hình 1.3). 1
Hình 1.3. Phản ứng Biuret
2. Nội dung thực hành
2.1. Dụng cụ-hóa chất 2.1.1 Dụng cụ - Bình tam giác 250 ml - Đũa thủy tinh - Cốc 100 ml - Ống nghiệm - Phểu lọc - Giấy lọc - Bình định mức 1000 ml - Cốc 500 ml - Bể ổn nhiệt - Máy đo quang phổ UV-VIS 2.1.2 Hóa chất - Acid acetic - Diethyl ether - Ethanol - CuSO4
- Sodium potassium tartrate - NaOH
- Bovine serum albumin (BSA)
2.2. Phân tách casein trong sữa
Cân 50 g sữa vào bình tam giác 250 ml và đun dưới bể ổn nhiệt 40oC. Khuấy đều
dung dịch. Thêm vào khoảng 10 giọt acid acetic và khuấy đều. Quan sát hiện tượng.
Lọc kết tủa bằng giấy lọc hoặc ly tâm. Thu kết tủa. Loại bỏ tất cả nước. Cho kết
tủa vào 1 cốc 100 ml. Thêm 25 ml ethanol 95% vào cốc 100 ml. Sau khi khuấy đều
trong vòng 5 phút chất rắn trong hỗn hợp sẽ lắng xuống. Cẩn thận đổ bỏ chất lỏng
chứa chất béo. Thêm vào hỗn hợp chất rắn 25 ml hỗn hợp diethyl ether-ethanol tỉ lệ
1:1. Thu nhận chất rắn bằng giấy lọc và sấy khô (60oC đến khối lượng không đổi). Cân
trọng lượng casein thô thu được. % casein = 2
2.3. Phân tích hàm lượng protein theo phương pháp Biuret
2.3.1 Hóa chất
- Thuốc thử Biuret: hòa tan 1.5 g CuSO4 + 6.0 g sodium potassium tartrate + 30 g
NaOH trong cốc 500 ml bằng nước cất. Sau đó định mức cho đến vạch bình định mức 1000 ml.
- Chất chuẩn: bovine serum albumin (BSA) nồng độ 10 mg/ml
2.3.2 Các bước tiến hành
- Xây dựng đường chuẩn: Thực hiện theo bảng sau đây: Ống nghiệm Nước (μl)
10 mg/ml BSA Nồng độ protein Thuốc thử Biuret (μl) (mg/ml) (ml) 1 500 0 0 2 2 400 100 2 2 3 300 200 4 2 4 200 300 6 2 5 100 400 8 2 6 0 500 10 2
Sau khi các ống nghiệm được trộn đều theo lượng ở bảng 1. Phản ứng được ủ ở
điều kiện nhiệt độ phòng trong 30 phút. Sau đó, lấy 1 ml dung dịch trong từ ống
nghiệm đi đo giá trị OD ở bước sóng 540 nm.
Xây dựng đường chuẩn bằng cách vẽ đồ thị giữa giá trị OD và nồng độ protein
của từng ống nghiệm. Phương trình hồi quy y = ax + b được xác định từ phần mềm excel.
- Đối với mẫu Casein phân tách bên trên (pha trong nước cất): 1 g + 10 ml nước cất
Mẫu casein cũng được tiến hành tương tự như mẫu BSA: 500 μl dung dịch casein
+ 2 ml thuốc thử Biuret, trộn đều và đo giá trị OD. Sử dụng phương trình hồi quy đã
xây dựng để tính hàm lượng protein trong mẫu casein.
3. Báo cáo thí nghiệm bài thực hành 1
3.1. Mô tả hiện tượng thí nghiệm
3.2. Phân tách casein trong sữa
- Trọng lượng sữa: ____________g
- Trọng lượng khô của casein: ____________g
- Hiệu suất thu hồi casein (%): ____________%
3.3. Hàm lượng protein trong mẫu casein:
- Đồ thị đường chuẩn - Phương trình hồi quy
- Kết quả tính hàm lượng protein trong mẫu 3
BÀI 2. KHẢO SÁT ĐỊNH TÍNH CARBOHYDRATE I. Mục đích
Khảo sát các tính chất của các hợp chất thuộc nhóm carbohydrate:
- Monosaccharide: là polyalcol aldehydehoặc polyalcol keton, là đơn vị nhỏ
nhất trong nhóm carbohydrate và không bị thủy phân. Chúng có tính khử.
- Oligosaccharide: là các polysaccharide có từ 2 đến 10 monomer. Tùy theo đặc
tính cấu tạo, chúng thể hiện tính khử (đường khử) hoặc không thể hiện tính khử
(đường không khử). Khi thủy phân chúng bằng acid hoặc enzyme thích hợp để cho ra
các thành phần cấu tạo tương ứng.
- Polysaccharide: là các polysaccharide có khối lượng phân tử lớn, không có
tính khử. Khi thủy phân chúng bằng acid hoặc enzyme thích hợp để cho ra các thành
phần cấu tạo tương ứng.
II. Dụng cụ - Hóa chất - Ống nghiệm - HCl đậm đặc - Giá ống nghiệm - Thuốc thử iod - Bình tam giác 100 mL - Hồ tinh bột 1%. - Pipet 10 mL - Dung dịch glucose 1% - Ống đong 10 mL, 20 mL - Dung dịch maltose 1%
- Cốc thủy tinh 50 mL, 100 mL - Dung dịch sucrose 1% - Pipet nhựa - Thuốc thử Fehling A - Dĩa sứ - Thuốc thử Fehling B - Bếp đun cách thủy - Dung dịch NaOH 10%
III. Nội dung thực hành
Thí nghiệm 1: Khảo sát tinh bột
Tinh bột là chất dự trữ của thực vật, là nguồn thức ăn và nguồn cung cấp năng
lượng chính cho người và động vật.
Tinh bột chứa 2 polysaccharide là amylose và amylopectin. Tùy theo tỉ lệ 2
thành phần này, mà tinh bột cho màu xanh hoặc màu tím đỏ với iod.
Chuẩn bị 3 ống nghiệm, cho vào mỗi ống nghiệm các hóa chất theo bảng sau: Hóa chất Ống nghiệm 1 Ống nghiệm 2 Ống nghiệm 3 Hồ tinh bột 1% 5 mL 0 0 Hồ tinh bột A 0 5 mL 0 Hồ tinh bột B 0 0 5 mL Thuốc thử iod 2 giọt 2 giọt 2 giọt
Sau khi cho dung dịch iod, lắc đều mỗi ống nghiệm, ghi nhận kết quả và so
sánh sự hiện màu ở ống nghiệm 2 và 3 so với ống nghiệm 1. 4
Thí nghiệm 2: Định tính tính khử của carbohydrate Nguyên tắc
Trong môi trường kiềm đun nóng, monosaccharide ở dạng enol-diol không bền,
dễ dàng khử các kim loại nặng như Cu2+, Ag+, Hg2+. Monosaccharide sẽ khử đồng II
trong dung dịch thuốc thử Fehling thành Cu (I) dưới dạng hợp chất Cu2O (kết tủa đỏ
gạch). Các disaccharide có nhóm -OH glycoside tự do đều có tính khử. Tiến hành
Chuẩn bị 5 ống nghiệm, đánh số 1 - 4 và cho vào mỗi ống nghiệm các hóa chất theo bảng sau: Ống nghiệm Hoá chất 1 2 3 4 Glucose 1% 2 mL 0 0 0 Maltose 1% 0 2 mL 0 0 Sucrose 1% 0 0 2 mL 0 Hồ tinh bột 1% 0 0 0 2 mL Thuốc thử Fehling A 1,5 mL 1,5 mL 1,5 mL 1,5 mL Thuốc thử Fehling B 1,5 mL 1,5 mL 1,5 mL 1,5 mL
Đem các ống nghiệm đun cách thủy trong 3-5 phút, ghi nhận và giải thích kết
quả ở từng ống nghiệm. Viết phương trình phản ứng xảy ra. 5
BÀI 3. ĐỊNH LƯỢNG ĐƯỜNG KHỬ BẰNG PHƯƠNG PHÁP DNS 1. Nguyên tắc
Phương pháp này dựa trên cơ sở phản ứng tạo màu giữa đường tổng và đường
khử với thuốc thử acid dinitrosalisylic (DNS). Cường độ màu của hỗn hợp phản ứng tỉ
lệ thuận với nồng độ đường khử acid dinitrosasylic sẽ tính được đường khử của mẫu nghiên cứu.
2. Nội dung thực hành 2.1. Hóa chất
- Nguyên liệu: Trái cây chứa đường. - H2SO4 10%
- Glucose chuẩn (0,5 mg/ml): cân 0,05 g D-glucose pha trong nước thành 100 ml.
- Thuốc thử acid ditrosalisylic (DNS): Cân 1 g DNS pha trong 20 ml NaOH 2N,
thêm vào 50 ml nước cất và 30 g muối sodium potasium tartrate, đun cách thủy cho
tan rồi định mức tới 100 ml bằng nước cất. 2.2. Dụng cụ - Máy đo quang phổ UV-VIS - Ống nghiệm - Bình định mức 100 ml - Bình tam giác 250 ml - Cối chày sứ - Phễu lọc - Pipette 1 ml - Pipette 5 ml - Nồi cách thủy 2.3. Tiến hành
Chuẩn bị mẫu thí nghiệm:
Cân chính xác 1 g mẫu nguyên liệu. Cắt nhỏ và nghiền nguyên liệu sau đó cho
một lượng H2SO4 10% sao cho vừa ngập mẫu. Đem đun cách thủy khoảng 1 giờ. Lấy
mẫu ra cho vào NaOH 20 % để trung hòa mẫu (thử bằng giấy quì tím, pH 6,5-7,5).
Mẫu sau khi được trung hòa và định mức thành một thể tích nhất định (50 ml). Nếu
dung dịch có cặn cần phải đem lọc. Dung dịch này dùng để định lượng đường khử.
Nếu nồng độ dung dịch đường khử quá cao ngoài đồ thị chuẩn thì cần phải pha loãng dung dịch đường.
Xây dựng đồ thị chuẩn
Từ dung dịch glucose chuẩn 0,5 mg/ml, pha các dung dịch glucose có nồng độ từ 0-500 (μg/ml) Ống nghiệm Hóa chất 1 2 3 4 5 6
Nồng độ glucose tương ứng (μg/ml) 0 100 200 300 400 500
Dung dịch glucose (0,5 mg/ml) (ml) 0 1 2 3 4 5 Nước cất (ml) 5 4 3 2 1 0 6
Lắc đều và hút ra 0,5 ml từ mỗi ống nghiệm trên cho vào các ống nghiệm sạch và
khô khác; thêm vào mỗi ống 0,5 ml thuốc thử DNS. Đem đun cách thủy ở 100°C trong
5 phút, làm nguội và thêm 4 ml nước cất; tiến hành đo mật độ quang ở bước sóng 540
nm mẫu thử và mẫu trắng (thay bằng nước cất) nên làm cùng đồng thời với nhau. Vẽ
đồ thị chuẩn glucose với trục tung là mật độ quang, trục hoành là nồng độ glucose.
Xác định hàm lượng đường khử trong dịch trích
Phản ứng của dung dịch đường cần phân tích với thuốc thử DNS cũng được tiến
hành tương tự như trên phần xây dựng đồ thị chuẩn (0,5 ml dung dịch đường, 0,5 ml
dung dịch thuốc thử DNS và 4 ml nước cất). Nồng độ đường trong mẫu được xác định
nhờ vào đường chuẩn glucose đã dựng bên trên. 2.4. Tính kết quả:
Vẽ các đồ thị chuẩn giữa độ hấp thu A và nồng độ C. Sau đó xác định chỉ số
đường của mẫu đo được bằng cách dóng trên đồ thị. Trị số này chính là lượng đường
thật sự có trong mẫu nguyên liệu lúc đầu bằng cách nhân với hệ số pha loãng K.
3. Báo cáo thí nghiệm bài thực hành 3
- Vẽ đồ thị chuẩn glucose
- Dựa vào kết quả đường chuẩn anh chị hãy tính hàm lượng đường khử trong
mẫu trái cây là bao nhiêu? (mg/g)
- Dựa vào kết quả tính hàm lượng đường khử trong mẫu, anh chị hãy giải thích
và so sánh kết quả với các kết quả đã được công bố khác. 7 BÀI 4. VITAMIN I. Mục đích
Định tính vitamin và định lượng vitamin C trong thực phẩm
II. Dụng cụ - vật liệu – thuốc thử 1. Dụng cụ - Burret 25 ml
- Cốc thủy tinh 50 ml, 100 ml - Ống đong 10 ml, 50 ml - Cối chày sứ - Ống nghiệm - Giấy lọc - Bình tam giác 100 ml - Bình định mức 100 ml - Pipet 10 ml 2. Hóa chất - NaOH 15% - Dung dịch K3Fe(CN)6 1% - Acid oxalic 1% - Vitamin B1, B2 - HCl 1%, 5% - Isobutylic
- Dung dịch thuốc chỉ thị DPIP 0,001N: Cân 0,15g DPIP cho vào cốc, sau đó cho 350
ml nước cất hòa tan DPIP cho vào bình định mức 500ml, cho tiếp dung dịch đệm
phosphate pH = 6,9-7,0 định mức đến vạch.
- Dung dịch đệm phosphate pH = 6,9-7,0: trộn 2 thể tích KH2PO4 (9,075g KH2PO4
trong 1 lít nước cất) và 3 thể tích Na2HPO4 (11,867g Na2HPO4.2H2O trong 1 lít nước
cất) với nhau trước khi đem dùng.
- Dung dịch iot 0,01N: 1,27g iot và 1,91g KI, trộn 2 chất này và thêm 2-5ml nước vào
cốc khuấy đều. Tiếp tục thêm 1 lượng nước (xấp xỉ 5ml mỗi lần) trong khi khuấy cho
đến khi dung tích đạt 50-60ml. Để yên dung dịch trong vòng ít nhất 4 giờ để đảm bảo
tất cả hòa tan hoàn toàn. Thỉnh thoảng khuấy dung dịch trong 4 giờ này để giúp quá
trình hòa tan. Cho dung dịch vào bình định mức 1 lít và đổ thêm nước cất đến vạch mức. - Dung dịch tinh bột 1%
III. Nội dung thực hành
Thí nghiệm 1: Định tính vitamin a. Định tính vitamin B1 Nguyên tắc
Trong môi trường kiềm, dưới tác dụng của kalifericyanua (K3Fe(CN)6), thiamin
bị oxy hóa thành thiochrome. Dưới ánh sáng của tia tử ngoại, thiochrome phát hùy
quang có màu đặc trưng. Phương trình phản ứng: 8 Tiến hành
Chuẩn bị 2 ống nghiệm, cho vào mỗi ống các hóa chất theo bảng sau: Hóa chất Ống nghiệm 1 Ống nghiệm 1 Dung dịch vitamin B1 2 ml 0 Nước cất 0 2 ml NaOH 15% 1 ml 1 ml K3Fe(CN)6 1% 0,5 ml 0,5 ml
Lắc đều cho đến khi dung dịch xuất hiện màu Isobutylic 2 ml 2 ml
Lắc đều các ống nghiệm sau đó để yên, dung dịch trong ống tách thành 2 lớp rõ
rệt. Để ống nghiệm dưới ánh sáng mặt trời hoặc ánh đèn tia cực tím, quang sát sự tạo
thành huỳnh quang. Ghi nhận và giải thích kết quả.
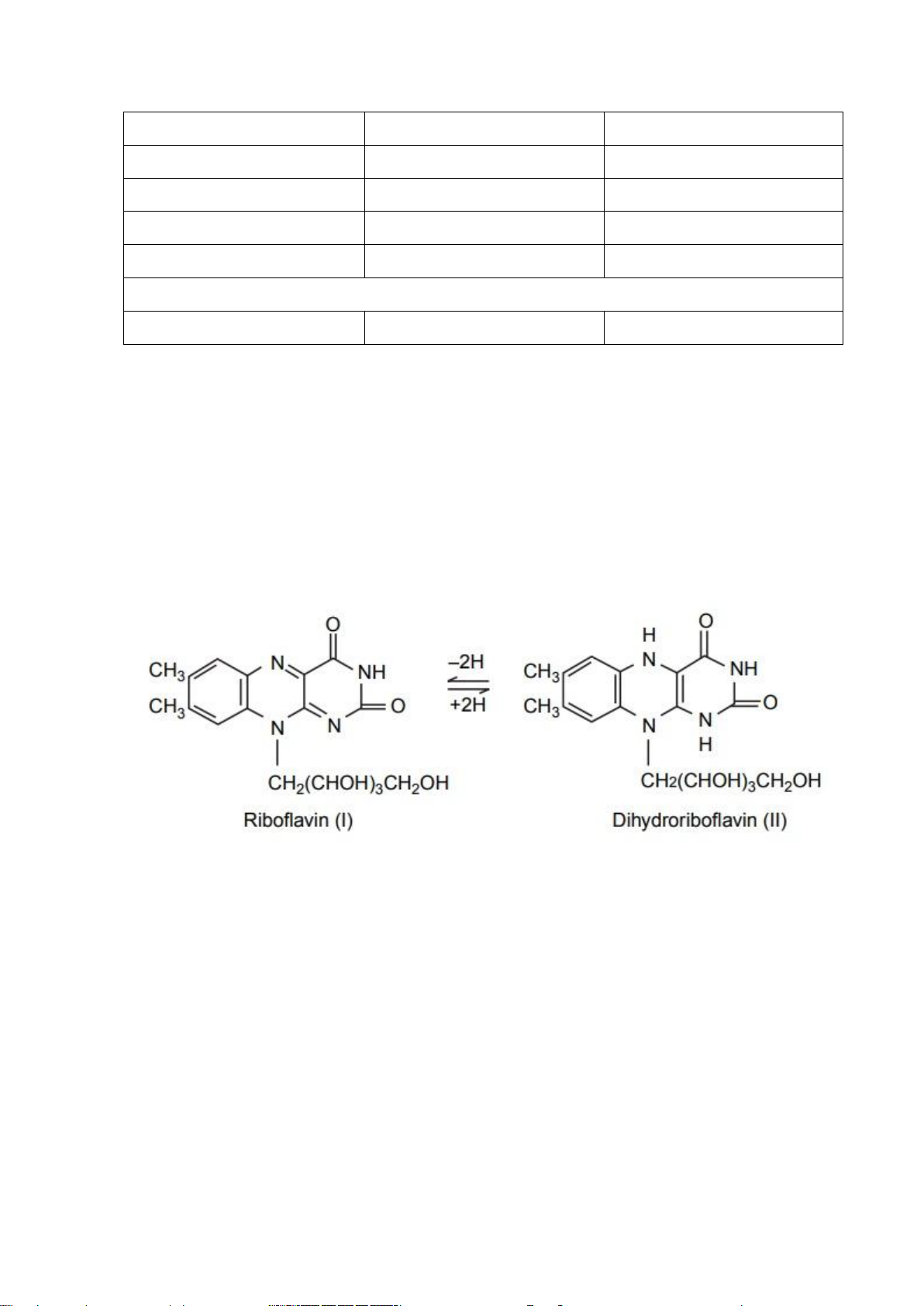
b. Định tính vitamin B2 Nguyên tắc
Vitamin B2 là dẫn xuất ribitol của izoalloxazin, nó có khả năng phản ứng oxy
hóa khử thuận nghịch. Vitamin B2 ở dạng oxy hóa (riboflavin) có màu vàng, ở dạng
khử (dihydroriboflavin) thì không màu. Người ta sử dụng phản ứng này để phát hiện
vitamin B2. Phương trình phản ứng được trình bày như sau:
Khi cho HCl đậm đặc (hoặc acid acetic đặc) và kẽm vào dung dịch vitamin B2
thì hydro bay lên và dung dịch màu vàng sẽ mất màu. Tiến hành
Cho vào ống nghiệm 2 ml dung dịch vitamin B2, cho thêm 1 ml HCl đậm đặc
(hoặc 1 ml acid acetic) và 1 ít bột kẽm cho đến khi dung dịch mất màu. Giải thích kết
quả thí nghiệm. Viết các phương trình phản ứng xảy ra.
Thí nghiệm 2: Định lượng vitamin C
a. Xác định hàm lượng vitamin C bằng phương pháp sử dụng DPIP Nguyên tắc
Vitamin C (acid ascorbic) hòa tan trong nước, dễ bị phân hủy dưới tác dụng của
các chất oxi hóa và bền trong môi trường acid. Vì vậy người ta thường chiết acid
ascorbic của mẫu phân tích bằng các acid như acetic 5%, metaphotphoric 2%. 9
Phương pháp dựa trên nguyên tắc acid ascorbic có khả năng oxy hóa khử thuận
nghịch chất chỉ thị DPIP. Dựa vào lượng chất chỉ thị tiêu tốn tính ra lượng acid
ascorbic có trong mẫu phân tích. Tiến hành
Cân 5 gam mẫu và hút 20 ml HCl 1% cho vào cối sứ và nghiền mịn. Cho tất cả
vào bình định mức 100 ml và thêm acid oxalic cho đến vạch. Để yên 10 phút và lọc,
hút 10 ml dung dịch lọc cho vào bình tam giác và chuẩn độ. Mẫu đối chứng (8 ml acid
oxalic 1% và 2ml HCl 1%) cũng được chuẩn độ bằng 2-6 diclophenol-indophenol
đến khi có màu phớt hồng. Đọc thể tích 2-6 diclophenol-indophenol đã chuẩn.
Phương pháp tính kết quả
a bV 100 088 , 0 1 X (mg%) V m 2 Trong đó:
V1: thể tích dung dịch chiết ban đầu (ml)
V2: thể tích dung dịch lấy để chuẩn (ml) m: khối lượng mẫu (g)
0,088: số mg vitamin C tương ứng với 1 ml thuốc thử 2-6 diclophenol-indophenol nồng độ 0,0001N
a: số ml thuốc thử 2-6 diclophenol-indophenol khi chuẩn mẫu
b: số ml thuốc thử 2-6 diclophenol-indophenol khi chuẩn mẫu đối chứng
b. Xác định hàm lượng vitamin C bằng phương pháp sử dụng iot
Nguyên tắc: vitamin C có thể khử dung dịch iot. Dựa vào lượng iot bị khử bởi
vitamin C có trong mẫu, suy ra hàm lượng vitamin C. Tiến hành:
Cân 5g mẫu, nghiền nhỏ trong cối sứ với 5ml HCl 5%, nghiền kỹ cho vào bình
định mức dẫn đến vạch 50ml bằng nước cất. Khuấy đều để yên 10 phút và lọc; lấy
20ml dung dịch lọc cho vào bình tam giác 100ml, chuẩn độ bằng dung dịch iot 0,01N
có tinh bột làm chỉ thị màu cho đến màu xanh. Tính kết quả
V V 100 88 , 0 1 X (mg%) V m 2 Trong đó:
V – số ml dung dịch iot 0,01N dùng chuẩn độ
V1 – Thể tích dịch mẫu thí nghiệm (50ml)
V2 – Thể tích dịch mẫu lấy để xác định (20ml)
m – Khối lượng mẫu (g)
0,88 - số mg vitamin C tương ứng với 1ml dung dịch iot 0,01N
IV. Yêu cầu phúc trình
Xác định hàm lượng vitamin C có trong mẫu bằng phương pháp sử dụng DPIP và iot. 10
BÀI 5. XÁC ĐỊNH CÁC CHỈ SỐ CỦA CHẤT BÉO I. Mục đích
Các chỉ số của chất béo dùng để đánh giá chất lượng chất béo như mức độ
không no của chất béo, mức độ thủy phân và mức độ oxi hóa chất béo,… Bài thí
nghiệm xác định các chỉ số: acid, iod và chỉ số peroxide của chất béo.
II. Dụng cụ - Vật liệu - Hóa chất
- Bình tam giác 100 mL, 250 mL - Dung dịch iod 0,1N - Buret 25 mL - Hồ tinh bột 1%. - Pipet 10 mL - Dung dịch Na2S2O3 0,01 N - Ống đong 10 mL - Cồn 96o
- Cốc thủy tinh 50 mL, 100 mL - KOH 0,01N/alcol - Dầu thực vật - Dung dịch I2 0,1N - Ether etylic - KI bão hòa
III. Nội dung thực hành
1. Xác định chỉ số acid
Định nghĩa: Chỉ số acid là số miligam KOH cần thiết để trung hòa hết những
acid béo tự do có trong 1 gam chất béo.
Nguyên tắc: Người ta dùng KOH 0,01N để trung hòa các acid béo tự do có
trong chất béo dùng để phân tích với phenolphtalein làm chỉ thị màu. Tiến hành
Dùng 1 bình tam giác 100 mL cho vào 5 mL alcol tuyệt đối và 5 mL ether
ethylic (theo tỷ lệ 1:1) cho thêm vào bình này 2-3 giọt phenolphtalein 1%.
Trung hòa hỗn hợp dung môi bằng dung dịch KOH 0,01N trong alcol đến khi
xuất hiện màu hồng nhạt.
Thêm vào hỗn hợp vừa trung hòa 0,5 gam dầu cần phân tích.
Chuẩn độ để xác định chỉ số acid của dầu (dùng dung dịch KOH 0,01N trong
alcol chuẩn độ cho đến khi có màu hồng bền vững sau 30 giây).
Đọc thể tích KOH 0,01N đã dùng để trung hòa hỗn hợp có dầu.
Tính kết quả
Ta biết 1 mL KOH 0,01N tương ứng với 0,56 mg KOH
Chỉ số acid được tính theo công thức sau: Trong đó: - Ca: Chỉ số acid
- a: Số mL KOH 0,01N đã dùng để trung hòa hỗn hợp có dầu
- m: Khối lượng dầu lấy làm thí nghiệm (tính bằng gam) 11
2. Xác định chỉ số iod
Định nghĩa: Chỉ số iod là số gam iod kết hợp với 100 gam chất béo. Chỉ số iod xác
định tổng quát các acid béo không no trong chất béo Nguyên tắc
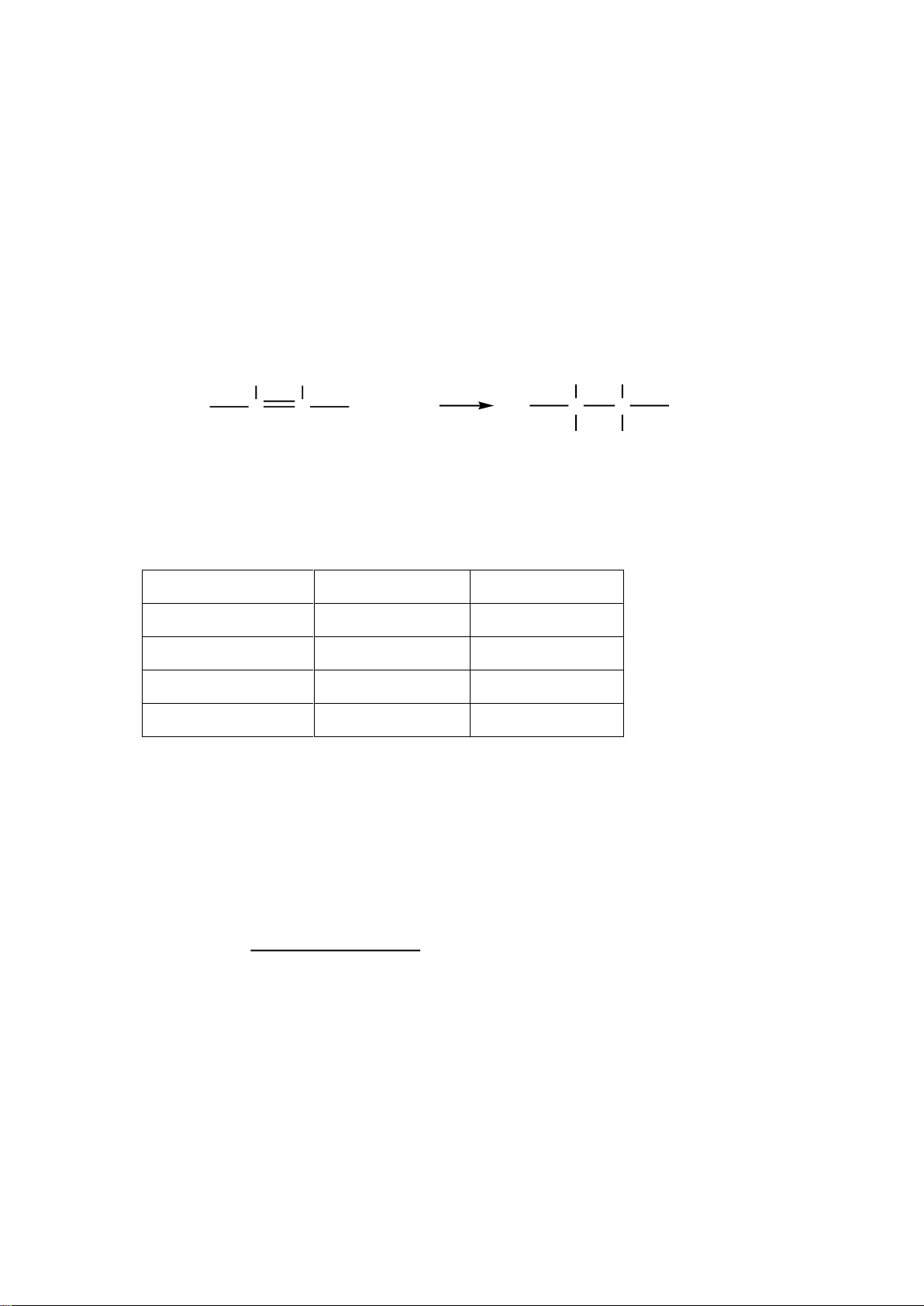
Trong những điều kiện thí nghiệm xác định những nối đôi -CH=CH- cho với
halogen phản ứng cộng, phản ứng này dùng xác định độ không no của chất béo.
Cho một lượng thừa iod tác dụng với chất béo cần phân tích trong bóng tối để
phản ứng cộng xảy ra hoàn toàn. Lượng iod đã phản ứng được xác định dựa vào lượng
iod thừa được xác định bằng cách chuẩn độ với dung dịch Na2S2O3 chuẩn với hồ tinh bột làm chỉ thị màu.
Các phương trình phản ứng được trình bày như sau: H H H H C C + I C C 2 I I
Na2S2O3 + I2 2 NaI + Na2S4O6 Tiến hành
Chuẩn bị 2 bình tam giác 250 mL (có nút nhám), đánh số trên từng bình và cho
vào mỗi bình các hóa chất theo bảng sau: Hóa chất Bình 1 Bình 2 Nước cất 1 mL 0 Dầu thực vật 0 1 gam Cồn 96o 10 mL 10 mL Dung dịch I2 0,1N 10 mL 10 mL
Lắc kỹ bình, để yên 1 giờ trong bóng tối. Thêm vào mỗi bình 10 mL nước cất.
Tiến hành chuẩn độ lượng iod thừa bằng dung dịch Na2S2O3 0,1N đến khi có
màu vàng nhạt, thêm 1 mL hồ tinh bột 1%. Nếu có màu xanh xuất hiện thì tiếp tục
chuẩn độ cho đến khi dung dịch mất màu xanh.
Tính kết quả
Ta biết 1mL Na2S2O3 0,1N tương ứng 0,01269 g I2 0,01269 x 100 x (a - b) Ci = m Trong đó: - Ci: Chỉ số iod
- a: Số mL Na2S2O3 0,1 N dùng chuẩn độ bình thử không (bình 1)
- b: Số mL Na2S2O3 0,1 N dùng chuẩn độ bình thí nghiệm (bình 2)
- m: Lượng dầu dùng thí nghiệm (tính bằng gam)
- 100: Để tính trong 100 gam chất béo 12
3. Xác định chỉ số peroxid
Định nghĩa: Chỉ số peroxid là số gam iod được giải phóng ra bởi peroxid có trong 100 gam mẫu.
Nguyên tắc: Trong không khí, các acid béo có trong chất béo, đặc biệt là các
acid béo không no dễ dàng bị oxy hóa một phần tạo thành peroxid, gây ra hiện tượng
ôi hóa chất béo. Xác định chỉ số peroxid dựa trên phản ứng sau: H H H H R + KI + 2 CH C C R + I2 + 2 CH + H 1 C C R2 3COOH R1 2 3COOK 2O O O O
Lượng iod giải phóng ra được chuẩn độ bằng dung dịch Na2S2O3 với tinh bột làm chỉ thị màu.
Na2S2O3 + I2 2 NaI + Na2S4O6 Tiến hành
Chuẩn bị 2 bình tam giác 250 mL, đánh số trên từng bình và cho vào mỗi bình
các hóa chất theo bảng sau: Hóa chất Bình 1 Bình 2 Nước cất 2 mL 0 Dầu thực vật 0 2 gam CH3COOH 7 mL 7 mL Cloroform 3 mL 3 mL Lắc kỹ bình KI bão hòa 1 mL 1 mL
- Đậy nắp, lắc kỹ bình và để yên trong bóng tối 10 phút. - Tiến hành chuẩn độ:
Thêm vào mỗi bình 25 mL nước cất và tiến hành định lượng iod giải phóng ra
bằng dung dịch Na2S2O3 0,1N đến khi có màu vàng nhạt rồi thêm 1 mL hồ tinh bột
1%. Nếu có màu xanh xuất hiện thì tiếp tục chuẩn độ cho đến khi dung dịch mất màu xanh. Tính kết quả
Ta biết 1mL Na2S2O3 0,1N tương ứng 0,01269 g I2
Chỉ số peroxid được tính theo công thức sau: 0,01269 x ( a - b) x 100 Cp = m Trong đó: - Cp: Chỉ số peroxid
- a: Số mL Na2S2O3 0,1 N dùng chuẩn độ bình thử không (bình 1)
- b: Số mL Na2S2O3 0,1 N dùng chuẩn độ bình thí nghiệm (bình 2)
- m: Lượng dầu dùng thí nghiệm (tính bằng gam) 13
BÀI 6. KHẢO SÁT HOẠT TÍNH ENZYME I. Mục đích
Enzyme là những chất có bản chất là protein, xúc tác cho các chuyển hóa diễn
ra trong cơ thể sống. Do enzyme có tính đặc hiệu cao và hiệu lực xúc tác lớn, nên được
ly trích và ứng dụng trong y học, dược phẩm, công nghệ thực phẩm,…
Thí nghiệm khảo sát hoạt tính của enzyme và tính đặc hiệu của enzyme trên cơ chất tương ứng.
II. Dụng cụ - Vật liệu - Hóa chất - Ống nghiệm - Dung dịch urea 5% - Bình tam giác 100 mL - Dung dịch thiourea 5% - Buret 25 mL - Dung dịch H2O2 0,1%. - Pipet 10 mL - Dung dịch KMnO4 0,1 N - Ống đong 10 mL - Dung dịch H2SO4 10%
- Cốc thủy tinh 50 mL, 100 mL - Na2CO3 tinh thể - Cối chày sứ - Bột đậu nành - Cát sạch - Khoai tây
III. Nội dung thực hành
Thí nghiệm 1: Khảo sát hoạt tính enzyme urease Nguyên tắc
Urease xúc tác phản ứng thủy phân urea tạo thành CO2 và NH3 theo phương trình phản ứng sau: H2N C O + H2O CO2 + 2NH3 H2N
Amoniac tạo thành sẽ làm giấy quỳ tím chuyển sang màu xanh. Tiến hành
- Dùng 3 giấy cân mẫu, cân 3 mẫu thí nghiệm, mỗi mẫu 1 gam bột đậu nành sống.
- Chuẩn bị 3 ống nghiệm, đánh số và cho vào mỗi ống các dung dịch/mẫu thí nghiệm theo bảng sau:
Hóa chất/mẫu vật
Ống nghiệm 1 Ống nghiệm 2 Ống nghiệm 3 Nước cất 3 mL 0 0 Dung dịch urea 5% 0 3 mL 0 Dung dịch thiourea 5% 0 0 3 mL Bột đậu nành 1 gam 1 gam 1 gam
Lắc đều các ống nghiệm. 14
Đặt giấy quỳ tím vào thành miệng ống nghiệm, đậy kín ống nghiệm. Quan sát
sự thay đổi màu giấy quỳ sau 5 phút. Giải thích kết quả thí nghiệm.
Thí nghiệm 2: Xác định hoạt độ enzyme catalase Nguyên tắc
Catalase xúc tác phản ứng phân giải H2O2 theo phương trình sau: 2H2O2 2H2O + O2
Để xác định hoạt độ catalase, cần xác định lượng H2O2 bị phân giải bằng phản
ứng với KMnO4 trong môi trường acid:
5H2O2 + 2 KMnO4 + 3 H2SO4 2MnSO4 + K2SO4 + 5O2 + 8H2O Tiến hành
- Chuẩn bị dịch trích enzyme catalase: Cân 2 gam khoai tây, nghiền nhuyễn với
một ít cát sạch và một ít Na2CO3 để trung hòa dịch chiết (đến khi ngừng tạo bọt CO2).
Chuyển toàn bộ mẫu vào bình định mức 100 mL, thêm nước cất đến vạch, lắc đều. Để
lắng khoảng 30 phút, lọc, thu dịch lọc để xác định hoạt tính enzyme.
- Xác định hoạt tính enzyme: Chuẩn bị 2 bình tam giác 100 mL:
+ Bình 1 (đối chứng): Cho vào bình 10 mL dịch trích enzyme, đem đun cách
thủy 5 phút để vô hoạt enzyme, làm nguội bình dưới vòi nước chảy. Thêm vào bình 10
mL dung dịch H2O2 0,1%. Giữ 30 phút ở 30oC. Thêm 3 mL dung dịch H2SO4 10% và
chuẩn độ bằng dung dịch KMnO4 0,1N cho đến khi có màu hồng nhạt bền vững. Đọc
thể tích dung dịch KMnO4 đã dùng (A).
+ Bình 2: Cho vào bình 10 mL dịch trích enzyme, thêm vào bình 10 mL dung
dịch H2O2 0,1%. Giữ 30 phút ở 30oC. Thêm 3 mL dung dịch H2SO4 10% và chuẩn độ
bằng dung dịch KMnO4 0,1N cho đến khi có màu hồng nhạt bền vững. Đọc thể tích
dung dịch KMnO4 đã dùng (B).
Tính kết quả:
Số đơn vị catalase trong 1 gam khoai tây (số micromol H2O2 bị phân giải sau 1
phút) được tính theo công thức sau: Với:
- A: Số mL KMnO4 0,1 N dùng chuẩn độ bình đối chứng (bình 1)
- B: Số mL KMnO4 0,1 N dùng chuẩn độ H2O2 còn lại trong bình thí nghiệm (bình 2)
- 1,7: số mg H2O2 tương ứng với 1 ml dung dịch KMnO4 0,1N dùng chuẩn độ
- V1: Tổng thể tích dịch trích enzyme (100 mL)
- V2: Thể tích dịch trích enzyme dùng thí nghiệm (10 mL)
- m: khối lượng khoai tây dùng thí nghiệm (gam)
- 30: thời gian phản ứng (phút) - 0,034: micromol H2O2 15



