







Preview text:
lOMoARcPSD| 60380256
BÀI 5 : QUAN SÁT HÌNH THÁI VI SINH VẬT
DƯỚI KÍNH HIỂN VI I. MỤC ĐÍCH THÍ NGHIỆM
- Thao tác sử dụng thành thạo kính hiển vi,quan sát vi sinh vật. - Đánh
giá lượng canh trường(độ thuần khiết sống/chết tỉ lệ nảy chồi....) -Làm
tiêu bản cố định nhộm màu và quan sát. II.CÁC BƯỚC TIẾN HÀNH
1.Tiêu bản giọt ép
1.1.1Tiêu bản vi khuẩn E.coli
-Dùng 1 bóp nhỏ giọt 3 mL, hút và nhỏ 2 giọt (0,2 mL) nước cất vô trùng lên 2 lame kính
sạch (1 giọt/lame) đã được vệ sinh bằng 2 miếng giấy lau kính (10x15 cm); Đặt ống giống
có VSV vào giữa ngón cái và ngón trỏ của bàn tay trái, lòng bàn tay ngửa ra. Ống nghiệm
để hơi nghiêng nhưng không được để canh trường VSV chạm vào nút bông;
-Vô trùng que cấy vòng bằng cách nhúng vào ống nghiệm có chứa Ethanol 96 o và đốt dưới
ngọn lửa đèn cồn, để nguội;
-Kẹp nút bông vào giữ ngón út và áp út xoay nhẹ 1 vòng để lấy bông ra hơ miệng ống
nghiệm dưới ngọn đèn cồn và đưa que cấy đã nguội vào lấy một vòng dịch cấy tiếp tục hơ
miệng ống nghiệm dưới ngọn đèn cồn và đậy nút bông lại.
- Đưa que cấy lên Lam kính và hòa chung với nước cất vô trùng.
- Đậy Lamen lên giọt canh trường bằng cách để một cạnh Lamen tiếp xúc với Lam kínhsát
mép giọt canh trường,nghiên góc 60 độ từ từ hạ Lamen nằm lên mặt Lam kính tránh đậy
nhanh sẽ có bọt khí ở trong mẫu. Chú ý:
-Tất cả các thao tác làm tiêu bản cần thực hiện ở gần ngọn đèn cồn tránh nhiễm.
-Nếu giọt dịch nhiều và tràn ra và dùng khăn giấy lau bớt đi.
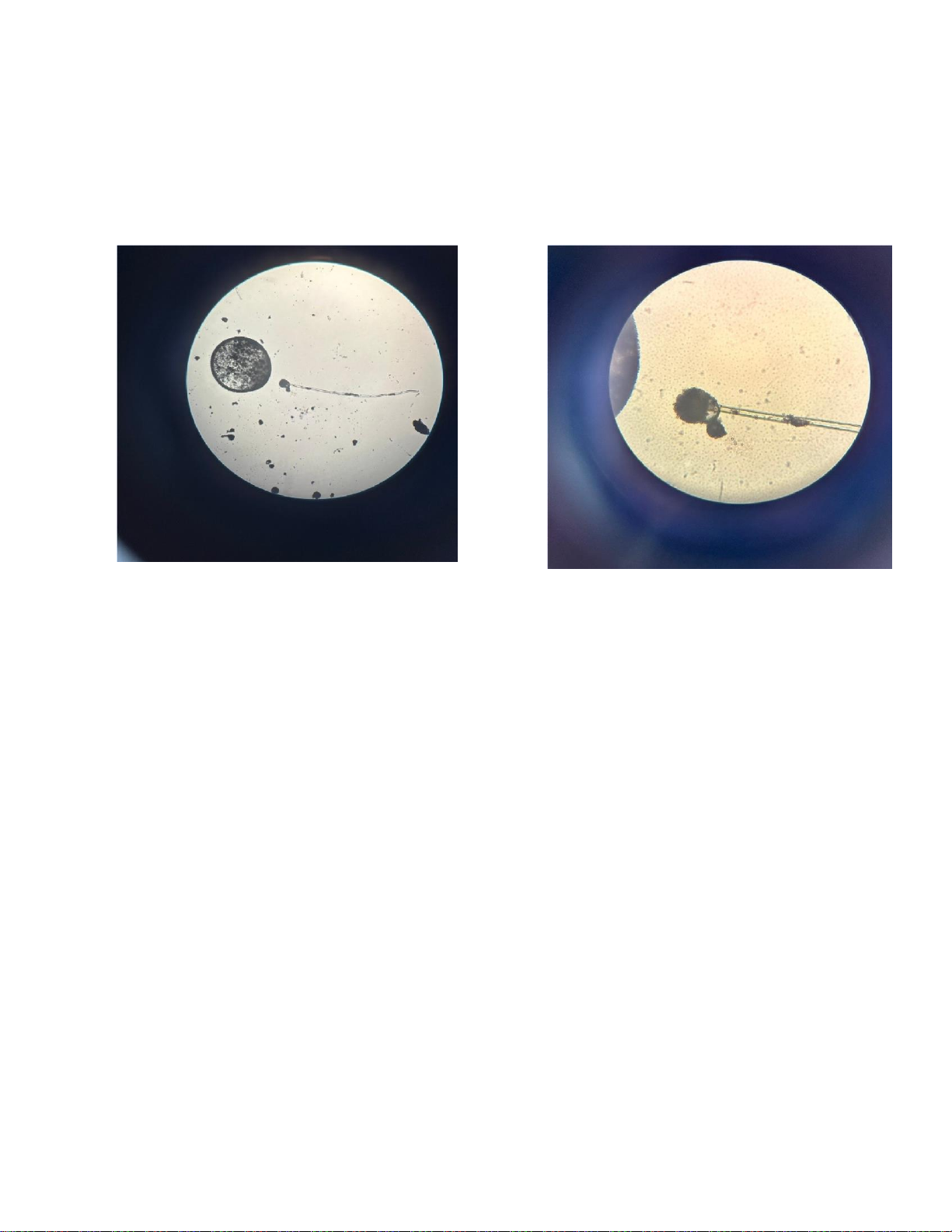
Đặt tiêu bản lên bàn kính hiển vi và quang sát ở vật kính 10x và 40x. *Kết quả:
Hình 1.1 E.coli ở vật kính 10x Hình 1.2 E.coli vật kính 40x lOMoARcPSD| 60380256
1.1.2Làm tiêu bản vi khuẩn B. subtilis:
Thực hiện các bước tương tự như trên. Sử dụng 1 bóp nhỏ giọt 3 mL, 2 giọt (0,2 mL) nước
cất vô trùng, 2 lame kính sạch, 2 miếng giấy lau kính (10x15 cm), 2 lamen. Kết quả:
Hình 1.3 B.subtilis trong tiêu bản giọt ép vật kính 10x
1.1.3 Làm tiêu bản giọt ép và quan sát nấm men
-Dùng 1 ống bóp hút nhỏ giọt hút 2ml nước cất vô trùng lên Lam kính đã được vô trùng bằng Ethanol trước đó.
-Vô trùng que cấy vòng dưới ngọn đèn cồn và để nguội và lấy que cấy chạm nhẹ vào bìa
mép khuẩn lạc của nấm men rồi hòa vào giọt nước vô trùng.
-Đậy Lamen từ từ để tránh tạo bọt khí. -
Đặt Lam kính lên bàn kính hiển vi và soi ở vật kính 10x 40x.*Kết quả:
Làm tiêu bản giọt ép và quan sát nấm mốc.
1.1.4 Làm tiêu bản Aspergillus -
Dùng 1 bóp nhỏ giọt 3 mL, hút và nhỏ 0,6 mL lactophenol lên 2 lame
kính sạch (0,3 ml/lame) đã được vệ sinh bằng 2 miếng giấy lau kính (10x15 cm);
-Vô trùng que cấy móc bằng cách nhúng vào ống nghiệm có chứa Ethanol 96
o và đốt dưới ngọn lửa đèn cồn, để nguội;
-Dùng que cấy móc lấy khuẩn lạc nấm (sợi nấm và bào tử) Aspergillus niger dìm vào
giọt lactophenol được chuẩn bị sẵn trên phiến kính và đồng thời tách rời các sợi khuẩn ty ra;
-Đậy lại bằng 2 lamen, tránh không tạo bọt khí; lOMoARcPSD| 60380256
-Đặt tiêu bản lên bàn kính hiển vi quang học và quan sát ở vật kính 10x và 40x; *Chú ý:
-Dùng que cấy móc sợi nấm nhẹ nhàng để tránh đứt sợi nấm -Không
lấy quá nhiều tạo thành bảng to rất khó soi kính hiển vi. *Kết quả:
Hình 1.4 Nấm mốc ở vật kính 10x Hình 1.5 Nấm mốc ở vật kính 40x
1.1.5 Làm tiêu bản Mucor
-Dùng 1 bóp nhỏ giọt 3 mL, hút và nhỏ 0,6 mL lactophenol lên 2 lame kính sạch (0,3
ml/lame) đã được vệ sinh bằng 2 miếng giấy lau kính (10x15 cm);
-Vô trùng que cấy móc bằng cách nhúng vào ống nghiệm có chứa Ethanol
96 o và đốt dưới ngọn lửa đèn cồn, để nguội;
-Dùng que cấy móc lấy khuẩn lạc nấm Mucor dìm vào giọt lactopenol trên Lam kính và
tách các sợi ra để không vón cục.
-Đậy Lamen lại tưd từ để không tạo bọt khí.
-Đặt tiêu bản lên kính hiển vi và quang sát ở vật kính 10x 40x.
IIIThực hành làm tiêu bản nhộm đơn 3 chủng vị sinhn vật. 1 Mục đích
-Mục đích nhộm đơn giúp phân biệt được hai nhóm vi khuẩn dựa trên sự khác nhaunveef đặc điểm tế bào.
-Mục đích kép giúp ta quan sát và phân biệt cấu trúc tế bào dễ dàng hơn so với việc nhộm đơn
2 Quy trình thực hiện 2.1 Nhuộm đơn 2.2.1 Làm viết bôi lOMoARcPSD| 60380256
-Chuẩn bị phiến kính sạch và khô
-Lấy viết bút lông khoanh 1 vòng tròn 2cm lên mặt kính của Lam kính quay ngược lại và
để lên giá ống nghiệm.
-Vô trùng que cấy vòng bằng cách nhúng vào Ethanol và đốt dưới ngọn đèn cồn và để nguội.
-Dùng que cấy vòng lấy 1 giọt nước cất vô trùng cho lên Lam kính sau đó lấy khuẩn lạc
hòa đều với giọt nước vô trùng.
-Nghiên que cấy nhẹ nhàng dàn giọt canh trường đều vào vòng tròntheo hình soắn ốc từ trong ra ngoài *Chú ý:
-Lấy vi sinh vật vừa đủ không lấy quá nhiều
-Dàn đều vi sinh vật không để vón thành cục hoặc thành nhiều lớp -Không
để tràn ra ngoài vòng tròn sẽ khó soi hơn. 2.2.2Cố định vết bôi:
Cố định bằng cách hơ nhẹ trên ngọn đèn cồn hơ vừa phải không quá nóng hơ khoảng 4-5
lần trên ngọn đèn cồn. 2.2.3Nhộm tiêu bản:
Viết bôi phải thật khô mới nhộm được
Đặt tiêu bản lên cầu thủy tinh được đặt n gang trên chậu nhộm.
Đặt 1 miếng giấy lọc lên tiêu bản phủ lên toàn bộ vết bôi.
Dùng 1 ống nhỏ giọt nhỏ thuốc nhuộm Fuchsin giữ trong 2-3 phút.
Sau khi đủ thời gian rửa vết bôi bằng cách nghiên phiến kính và dùng bình tia nước cất để
rửa vết bôi cho dòng nước chảy nhẹ qua vết bôi cho đến khi không còn màu nữa. Thấm
khô tiêu bản bằng cách thấm nhẹ giấy lên vết bôi Quan sát tiêu bản ở vật kính 40x 100x.
Nhỏ 1 giọt dầu soi vật kính lên vết bôi và chỉnh kính cho vật kính chạm vào dầu. *Chú ý :
Không rửa vết bôi mạnh quá sẽ bị trôi vi sinh vật.
Để vết bôi đúng thời gian nếu không đủ vết bôi sẽ không lên màu được. Kết quả: lOMoARcPSD| 60380256
Hình 2.1.Nấm men ở vật kính 100x
Hình 2.2 Nấm men ở vật kính 100x
Hình.3.E.coli ở vật kính 40x
Hình 2.4 E.coli ở vật kính 100x (B. 2.2 NHUỘM GRAM lOMoARcPSD| 60380256 Bước 1: Làm vết bôi
+ Chuẩn bị phiến kính sạch và khô.
+ Dùng que cấy lấy 1 – 2 giọt canh trường dàn lên phiến kính.
+ Chú ý: Lấy lượng vi sinh vật vừa phải, dàn vết bôi tròn, gọn và thật mỏng, các tế bào vi
sinh vật được dàn đều.
Bước 2: Làm khô và cố định vết bôi:
+ Hơ nhẹ trên ngọn lửa đèn cồn đến khi vết bôi khô. Tránh đốt nóng trực tiếp làm tế bào
mất nước quắt lại, cấu trúc tế bào bị thay đổi. Vết bôi thật khô mới tiếp tục. Đặt giấy lọc
lên vết bôi đã cố định
Bước 3: Nhuộm màu phức tạp
+ Nhỏ thuốc nhuộm kết tinh phủ đều lên vết bôi, chú ý không cho quá nhiều. Để yên
khoảng 1 - 2 phút. đổ hết thuốc nhuộm đi, rửa sạch bằng cách nghiêng phiến kính và cho
dòng nước chảy nhẹ qua.
+ Tiếp tục nhỏ dung dịch lugol lên để trong 1 phút, rửa sạch bằng cách nghiêng phiến kính
và cho dòng nước chảy nhẹ qua.
+ Nhúng vào cồn 95° trong 30s. Thao tác cần cẩn thận ở bước này, rửa nước và thấm khô
+ Nhuộm bổ sung bằng Funshin loãng trong 1 phút, rửa sạch bằng cách nghiêng phiến kính
và cho dòng nước chảy nhẹ qua và thấm khô.
+ Quan sát tiêu bản dưới vật kính dầu 100x. *Kết quả: lOMoARcPSD| 60380256
Hình 2.2.1 thực hành nhuộm Gram Bac.subtilis
Hình.2.3 hình E.coli nhuộm Gram ở vật kính 100x lOMoARcPSD| 60380256
Hình 2.2.2 Bac.subtilis nhuộm Gram ở vật
kính2.2.2 hình Bac.subtilis ở vật kính 40x 100x
-E.coli có màu hồng là vi khuẩn Gram âm vì lớp vách peptidoglycan mỏng hơn và có thêm
lớp màng phía ngoài khi nhúng cồn bị tẩy dễ dàng nên không giữ được màu tím của thuốc
nhuộm mà sẽ bắt màu thuộc nhuộm sau là Fuchsin hoãng.
-Bac.subtilis nhuộm màu tím nên vi khuẩn Gram dương vì có vách tế bào peptidoglycan
dày,cũng vì lớp dày đó nên việc nhúng cồn sẽ khó khăn hơn vì giữ được màu tím của thuốc nhuộm. 2.3.NHUỘM BÀO TỬ.
Làm vết bôi với Bac.subtilis
-Chuẩn bị phiến kính sạch và khô.
-Dùng que cấy lấy 1 – 2 giọt canh trường dàn lên phiến kính. -
Chú ý: Lấy lượng vi sinh vật vừa phải, dàn vết bôi tròn, gọn và thật mỏng, các tế
bào visinh vật được dàn đều.
Bước 2: Làm khô và cố định vết bôi -
Nhỏ vài giọt HCl 0,5% lên vết bôi, hơ nhẹ vết bôi trên phần không khí nóng của
đèn cồn để làm khô và cố định. Tránh đốt nóng trực tiếp ví sẽ làm tế bào mất nước quắt
lại, cấu tạo tế bào bị thay đổi. Vết bôi thật khô mới tiếp tục. Đặt giấy lọc lên vết bôi đã cố định.
H ì nh 2.3.1 Bac.subtilis nhuộm bào tử ở vật kính 100x lOMoARcPSD| 60380256 Bước 3: Nhuộm bào tử
-Nhỏ Fuchsin Ziehl 3-5 phút. Trong khi nhuộm hơ nóng cho đến bốc hơi nhẹ. Nếu thuốc
nhuộm cạn phải thêm vào, không để bị khô. Sau đó rửa vết bôi và để khô.
-Tẩy màu bằng cách nhúng phiến kính vào dung dịch H2SO4 15 trong 1-2 phút và rửa nước -
Nhuộm vết bôi bằng xanh methylen Loeffler trong 1-2 phút, rửa sạch và thấm khô *Kết quả:




