




Preview text:
Vietnam National University of Agriculture
FACULTY OF FOOD SCIENCE AND TECHNOLOGY (FST) Thực hành
Học phần: An toàn thực phẩm
Giảng viên: ThS. Nguyễn Vĩnh Hoàng Bộ môn: QLCL & ATTP
Khoa Công nghệ thực phẩm, VNUA. Email: hoangnv92@gmail.com Tel: 0965859692
Nội dung thực hành
Bài 1: Xác định dư lượng nitrat (NO3-) trên rau quả
Tồn dư Nitrat trên rau quả? Phân bón hóa học (NPK)
Sự tạo thành nitrat (NO -) -) 3
và nitrit (NO2 Nguyên nhân?
là một quá trình
Nguồn đất, Nguồn nước
chuyển hoá nitơ tự (nước thải sinh hoạt,
nhiên trong cây trồng Cấp tính: 1-4g/ngày nước thải CN) Mãn tính: tích Iũy thời Chỉ tiêu gian dài đánh giá mức độ MethemogIobin trong sạch của thực (NO máu (Fe2+ -> Fe3+) 3 ‐) oxy hóa phẩm thành (NO2‐) Acid amin bậc 2,3 -> Mức chấp nhận: nitrosamin -> ung thư 500mg/kg sản phẩm
Bài 1: Xác định dư lượng nitrat (NO3-) trên rau quả
Định lượng nitrat bằng so màu axit disunfophenic
Ion NO3 phản ứng với axit disunfophenic tạo thành trinitrophenoI
màu vàng có cường độ màu tương quan thuận với nồng độ nitrat C 6H3(HSO3)2OH + 3HNO3 C6H2(OH)(NO2)3 + 2H2SO4 + H2O Axit disunfophenic Trinitrophenol (màu vàng)
Xác định NO3 - bằng cách đo cường độ màu vàng bằng quang phổ kế tại
bước sóng 420 – 460 nm (kính Iọc màu xanh). Phương pháp này có độ
nhạy rất cao đến 0,001ppm.
Bài 1: Xác định dư lượng nitrat (NO3-) trên rau quả
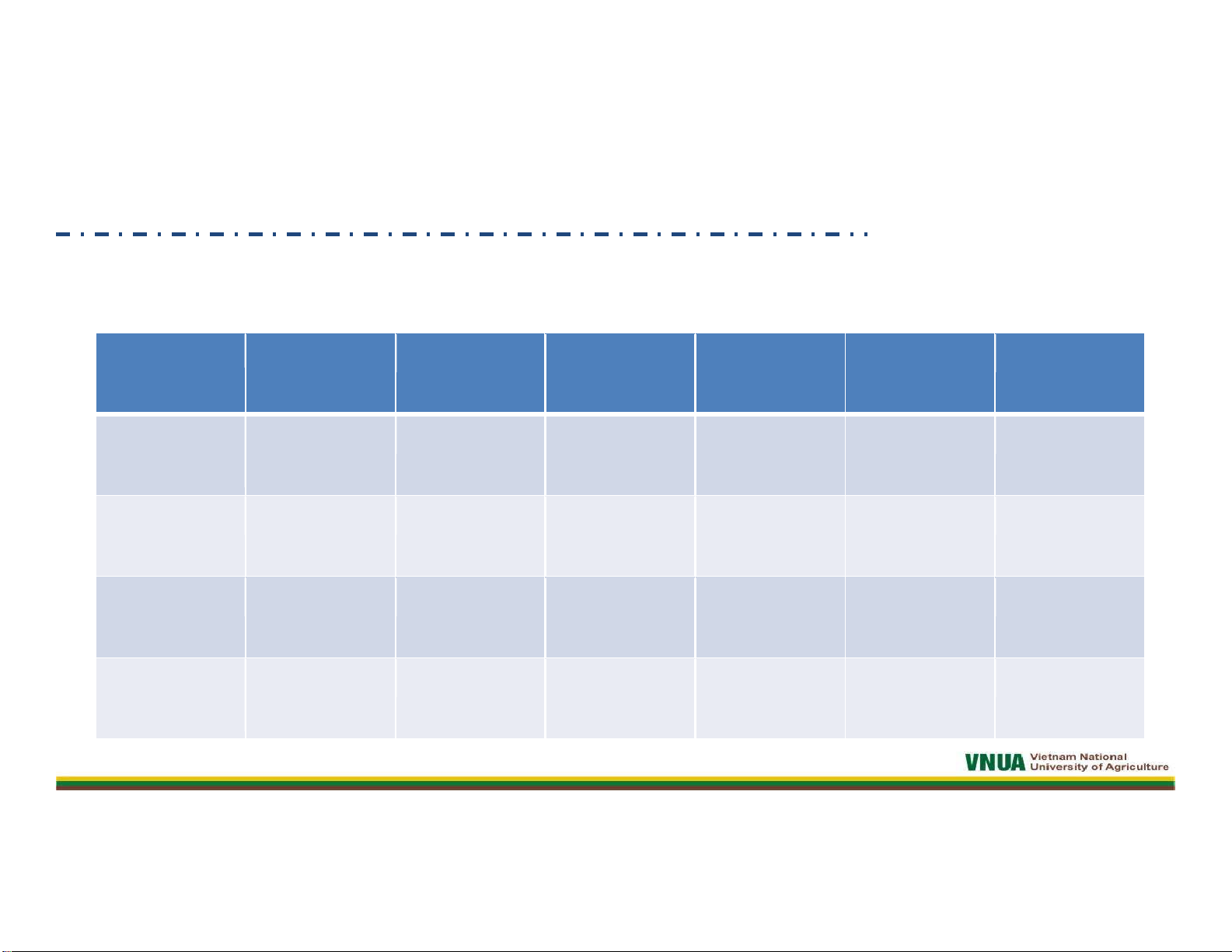
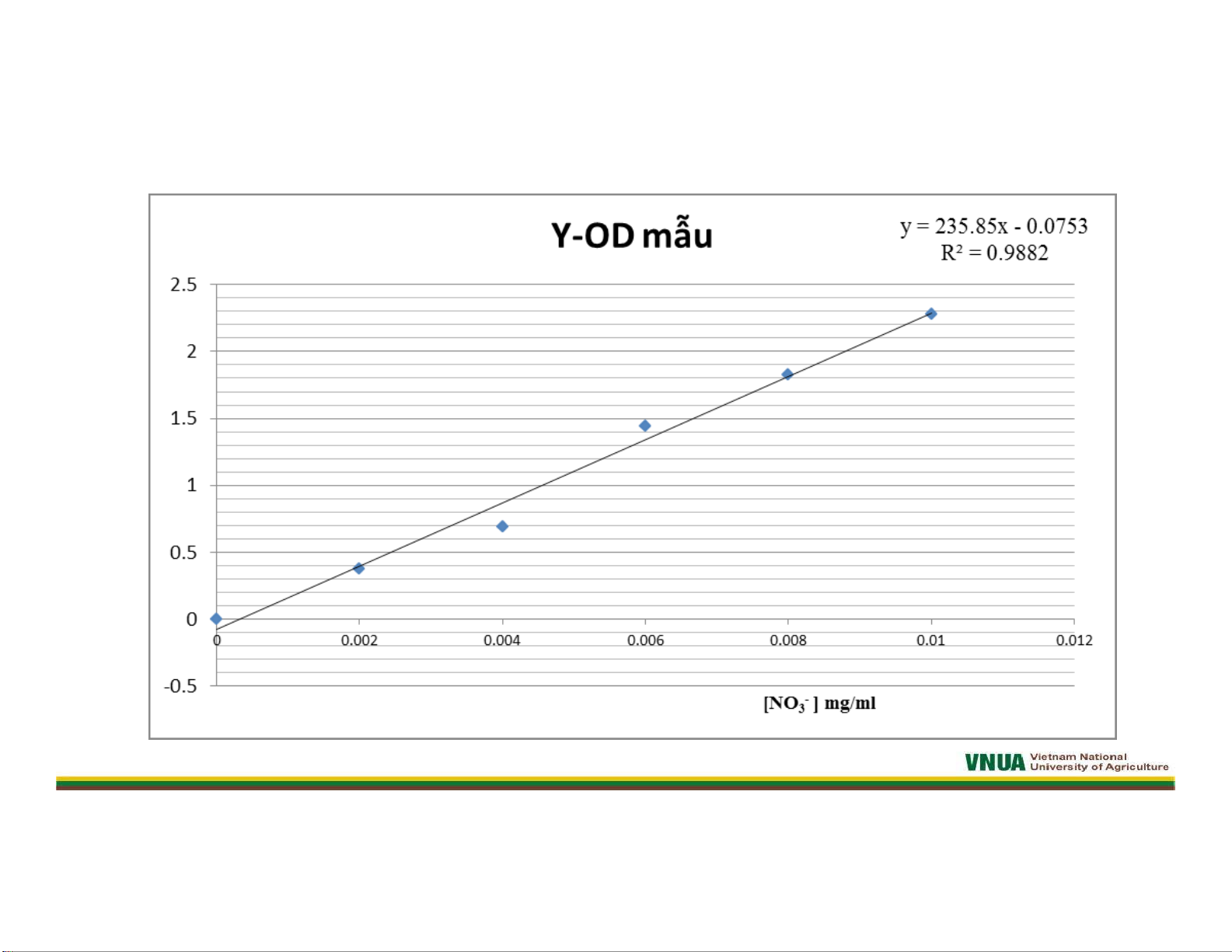
Cách tiến hành: 1. Xây dựng phương trình đường chuẩn 1 2 3 4 5 6 V KNO 0 5 10 15 20 25 3 (ml) V H2O (ml) 25 20 15 10 5 0 V dd (ml) 25 25 25 25 25 25 Nồng độ 0 0.002 0.004 0.006 0.008 0.01 (mg/ml)
Bài 1: Xác định dư lượng nitrat (NO3-) trên rau quả
Cách tiến hành: 1. Xây dựng phương trình đường chuẩn
Cô cạn dung dịch bằng bếp điện đến khi
còn 1 giọt. Thêm 1mI ax disunfophenic
Iáng đều bề mặt cặn. Thêm 25 – 30 mI
nước cất, trung hoà bằng NaOH 10% đến
pH 7,5 – 8 đến khi chuyển màu vàng thì
dừng Iại Iên thể tích 50mI Đo màu ở
máy quang phổ tại bước sóng 420 nm
Bài 1: Xác định dư lượng nitrat (NO3-) trên rau quả
Cách tiến hành: 2. Tiến hành phân tích mẫu
Mẫu Rửa sạch Để ráo nước Thái nhỏ Trộn đều Cân (4 –
7g tuỳ thuộc vào mẫu) Cho mẫu vào bình tam giác 250ml Thêm
75ml nước cất vào bình Đun sôi bằng bếp điện (1 phút) Để nguội
Lọc lấy dịch (bằng giấy lọc hoặc bằng bông) Lên thể tích 100ml
Hút 10ml vào cốc thuỷ tinh 100ml cô cạn (còn 1 – 2 giọt nhưng
không cháy mẫu) Để nguội Thêm vào cốc 1ml axit disunfophenic
cho 25 – 30ml nước cất trung hoà bằng NaOH 10% đến pH 7,5 –
8 đến khi chuyển màu vàng thì dừng lại lên thể tích 50ml Đo
màu ở máy quang phổ tại bước sóng 420 nm
Bài 1: Xác định dư lượng nitrat (NO3-) trên rau quả
Cách tiến hành: 3. Tính kết quả
Quy về mg NO3 ‐ /1kg nguyên liệu tự nhiên
+ X: Nồng độ nitrat tính được từ phương trình đường chuẩn bằng việc
thay OD mẫu vào giá trị Y
+ V1: Thể tích dung dịch trích để so màu (ml)
+ V: Tổng thể tích rút ra từ mẫu (ml) X . V . 1000 3
+ P: Khối lượng mẫu (g) NO ‐ mg/kg = V1 . P
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm
1. Xác định sự có mặt của TBVTV lân hữu cơ (Wofatox)
Wofatox còn được gọi là Parathion Metyl,
không bền vững ở môi trường kiềm NaOH và sẽ
thủy phân thành Natri paranitrophenolat và
Natri Dimetyl-O-Thiophosphat.
Chất Natri paranitrophenolat là một chất có
màu vàng rơm, nhận dạng dễ dàng.
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm Cách tiến hành:
1. Chiết xuất thuốc BVTV ra khỏi sản phẩm
‐ Chiết xuất Wofatox bằng cồn etylic 90‐100o kết hợp với việc ma sát,
cọ rửa bằng bông, xối rửa bằng bình tia dung môi.
‐ Lấy mẫu trong lô có nghi vấn có thuốc bảo vệ thực vật hữu cơ. (Ví dụ
tiến hành thí nghiệm với mẫu là dưa chuột). Đặt dưa chuột trong lòng
phễu trên bình tam giác. Dung bình tia đựng cồn phun ướt nửa trên
của mẫu. Dùng bông lau lần lượt từng phần từ trái qua phải, từ trên
xuống dưới. Xoay mẫu 180o và tiến hành tương tự.
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm Cách tiến hành:
2. Làm đậm đặc thuốc trong dung môi
Nếu nồng độ thuốc trong dung môi nhỏ, ta phải làm đậm đặc
bằng cách cô cách thủy ở nơi thoáng gió, trong tủ hút. 3. Tiến hành
Lấy 3ml dung dịch mẫu kiểm tra vào ống nghiệm. Thêm 3ml
NaOH 1N, Lắc đều, dung dịch sẽ có màu vàng rơm đậm hay nhạt tùy
theo nồng độ Wofatox có trong nồng độ dung dịch.
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm Đánh giá kết quả:
+ Nếu thấy dung dịch có màu vàng rơm xuất hiện: Sản phẩm có
Wofatox, thuốc bảo vệ thực vật lân hữu cơ.
+ Nếu dung dịch không có màu vàng rơm xuất hiện: sản phẩm không
có dư lượng thuốc Wofatox thuốc bảo vệ thực vật lân hữu cơ.
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm
2. Xác định sự có mặt của hàn the trong thực phẩm
Hàn the có phản ứng kiềm với phenolphtalein
cho dung dịch màu hồng. Nếu cho dung dịch
này tác dụng với dung dịch Glyxerin trung tính,
dung dịch sẽ chuyển thành axit, sẽ mất màu
hồng, trở thành không màu(phản ứng axit với
phenoiphtalein do tạo thành axit glyxero boric
có tính axit)
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm Cách tiến hành:
- Lấy 15-20g sản phẩm, thái nhỏ 3-5mm, ngâm trong 20-25ml nước cất đã đun sôi.
- Sau 15-20 phút gạn lấy nước và đun sôi lại
- Lọc lấy 5ml nước trong cho vào ống nghiệm
- Nhỏ vào ống nghiệm 2-3 giọt phenolphtalin1% rồi lắc đều
Bài 2: Xác định dư lượng các hoá chất sử dụng trong quá trình
sản xuất, chế biến nông sản thực phẩm Đánh giá kết quả:
‐ Nếu có màu hồng xuất hiện nhỏ tiếp 2‐3 giọt glyxerin trung tính, màu
hồng sẽ mất đi thành không màu => sản phẩm có hàn the
‐ Nếu không có màu hồng xuất hiện => sản phẩm không có hàn the.
Bài 3: Xác định các chỉ tiêu vi sinh trong một số loại thực phẩm
1. Chỉ tiêu Coliforms tổng số:
Coliforms là trực khuẩn Gram(‐) không sinh bào tử, hiếu khí hoặc kỵ
khí tùy tiện, có khả năng lên men lactose sinh axit (sinh hơi) ở 370C trong 24‐ 48h.
‐ Nhóm coliforms hiện diện rộng rãi trong tự nhiên, trong ruột người,
động vật. Coliforms được xem là nhóm vi sinh vật chỉ thị: số lượng
hiện diện của chúng trong thực phẩm, nước hay các mẫu môi trường
được dùng để chỉ thị khả năng hiện diện của các vi sinh vật gây bệnh
khác. Nhiều nghiên cứu cho thấy rằng khi số coliforms của thực
phẩm cao thì khả năng hiện diện của các vi sinh vật gây bệnh khác cũng cao.
‐ Nhóm coliforms gồm 4 giống là: Escherichia, Citrobacter, Klebsiella, Enterobacter.
Bài 3: Xác định các chỉ tiêu vi sinh trong một số loại thực phẩm
1.2. Định lượng coliforms bằng phương pháp đếm khuẩn lạc trên môi trường VRBL Nguyên tắc:
- Quá trình lên men lactose dẫn đến kết quả axit hóa môi trường,
được thể hiện bằng màu đỏ của chỉ thị pH (màu đỏ trung tính) và kết tủa
muối mật xung quanh các khuẩn lạc.
- Sự hiện diện đồng thời của muối tinh thể tím và muối mật ức chế vi khuẩn Gram dương
- Mẫu được đồng nhất được cấy một lượng thích hợp trên môi
trường thạch chọn lọc chứa lactose. Đếm số khuẩn lạc lên men và sinh axit
sau khi nuôi ở 37 độ C trong 48h.
- Trên môi trường này, khuẩn lạc coliforms có màu đỏ đến màu đỏ
đậm, đường kính >0.5mm, xung quanh khuẩn lạc có vùng tủa của muối mật.
Bài 3: Xác định các chỉ tiêu vi sinh trong một số loại thực phẩm
1.2. Định lượng coliforms bằng phương pháp đếm khuẩn lạc trên môi trường VRBL
‐ Đồng nhất mẫu: tạo sự đồng đều về mật độ coliform ở tất cả các điểm trên mẫu
+ Cắt nhỏ, trộn đều: dao, thớt
+ Giã nhỏ, trộn đều: chày, cối sứ
+ Xay, nghiền, trộn đều: máy xay, máy nghiền
‐ Pha loãng mẫu: làm giảm nồng độ coliform trong mẫu, tạo điều kiện cho quá trình đếm
‐ 10‐2 10‐3 lặp lại 3 lần
‐ Cấy mẫu: hút 1ml mẫu vào đĩa petri
‐ Chuẩn bị môi trường VRBL: 250ml/nhóm
Bài 3: Xác định các chỉ tiêu vi sinh trong một số loại thực phẩm
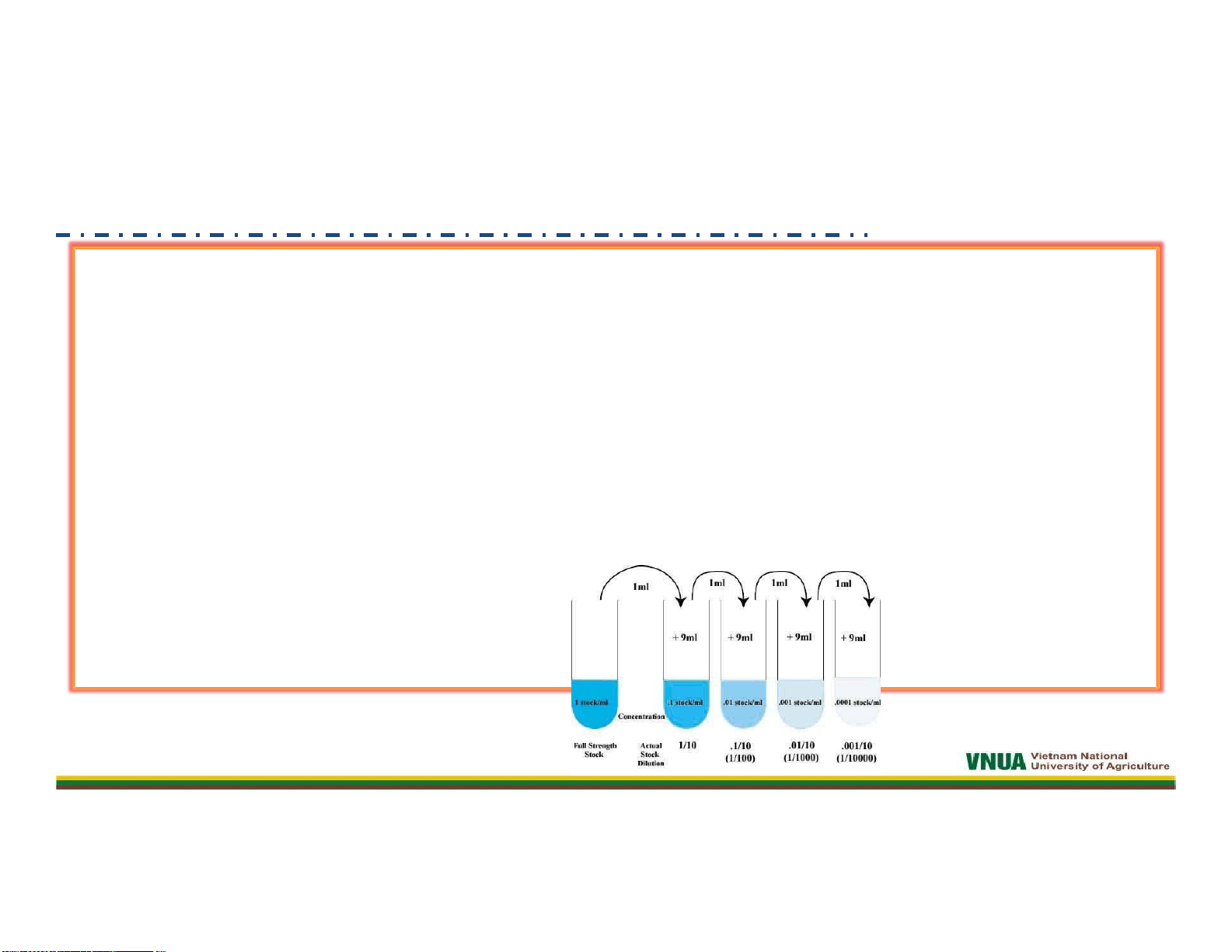
• Đối với mẫu chất Iỏng: dùng pipet hút 1 ml mẫu cho vào ống
nghiệm chứa 9 ml dung dịch pha loãng, khi đó ta sẽ được nồng
độ pha loãng là 10‐1. Tiếp tục từ ống nghiệm 10‐1 hút tiếp 1ml và
cho vào ống nghiệm chứa 9 ml dung dịch pha loãng tạo độ pha
loãng 10‐2. Tiếp tục như vậy đến nồng độ cần thiết
• Đối với mẫu rắn: cân chính xác 10 g mẫu, sau đó cho vào 90 ml dung
dịch pha loãng tạo nồng độ pha loãng 10‐1. Và tiếp tục pha loãng
tương tự như mẫu nước