








Preview text:
I.
VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN
Trongbảngtuầnhoàn,cácnguyêntốkimloạicómặtở:
-NhómIA(trừhiđro)vàIIA.Cáckimloạinàylànhữngnguyêntốs.
-NhómIIIA(trừbo),mộtphầncùacácnhómIVA,VA,VIA.Cáckimloại
nàylànhữngnguyêntốp.
-CácnhómB(từIBđếnVIIIB).CáckimloạinhómBđượcgọilà
nhữngkimloạichuyểntiếp,chúnglànhữngnguyêntốd.
-Họlantanvàactini.Cáckimloạithuộchaihọnàylànhữngnguyên
tốf.Chúngđượcxếpriêngthànhhaihàngờcuốibảng.
Xácđịnhvịtrínguyêntố:
+Nguyêntốthuộcphânnhómchính(nhómA):cóelectronxépsau
cùngrơivàophânlớpshoặcp.
-Sốthứtự=Z
-Chukỳ=sốlớpelectrron
-Nhóm=tổngsốsốelectronởlớpngoàicùng
+Nguyêntốthuộcphânnhómphụ(nhómB):cóelectronxếpsaucùng
rơivàophânlớpd.
-Sốthứtự=Z
-Chukỳ=sốlớpelectrron
-Nhóm=phụthuộctổngsốsốelectronởlớp(n-1)dx+nsy=S
+Khi1≤S≤8thìsốnhómbằngS
+Khi8<S≤10thìsổnhómlàVIIIB
+Khi10<Sthìsốnhóm=S–10
II. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
Tínhchấtvậtlíchunglàtínhdẻo,tínhdẫnđiện,tínhdẫnnhiệtvàánh kim.
-NhữngkimloạicótínhdẻocaolàAu,Ag,Al,Cu,Sn,...(dẻonhấtlà Au)
-ĐộdẫnđiệncủaAg>Cu>Au>Al>Fe
-Nhiệtđộtăngthìtínhdẫnđiệncùakimloạigiảm.
-Kimloạinàodẫnđiệntốtthìcũngdẫnnhiệttốt.Tínhdẫnnhiệtcủa
kimloạigiảmdầntheothứtựAg,Cu,Al,Fe,...
-Khốilượngriêng:Lilàkimloạicókhốilượngriêngnhỏnhất,D= 0,5g/cm3.
-Kimloạicókhốilượngriênglớnnhấtlàosimi(Os),D=22,6g/cm3.
-Kimloạicókhốilượngriêngnhỏhơn5g/cm3lànhữngkimloạinhẹ,
như:Na,K,Mg,Al,...Nhữngkimloạicókhốilượngriênglớnhơn
5g/cm3lànhữngkimloạinặng,như:Fe,Zn,Pb,Cu,Ag,Hg,...
-Kimloạicónhiệtđộnóngchảyrấtkhácnhau.ThấpnhấtlàHgnóng
chảyờ-39°c,caonhấtlàW(vonfam)nóngchảyở3410°c.
-Tínhcứng:mềmnhấtlàCs(0,2),cứngnhấtlàCr(9). Mạng tinh thể Lậpphươngtâm Lậpphươngtâm Lụcphương khối diện Độđặckhít Độđặckhít68% Độđặckhít74% 74% Li,Na,K,Rb,Cs Ba Ca,Sr Be,Mg Cr Al Fe(α) Fe(γ) V,Mo Cu Ni,Pb Au,Ag Zn II. III. HOÁ TÍNH:
TÍNH CHẤT HOÁ HỌC ĐẶC TRƯNG CỦA KIM LOẠI LÀ TÍNH KHỬ M => Mn+ + ne
1. Tác dụng với phi kim:hầuhếtcáckimloạikhửđượcphikim thànhionâm 2Na+Cl2=>2NaCl Mg+Cl2=>MgCl2
2Al+3Cl2=>2AlCl3
2Cr+3Cl2=>2CrCl3 Fe+S=>FeS
2Fe+3Cl2=>2FeCl3
2Fe+3Br2=>2FeBr3 Fe+I2=>FeI2
2. Tác dụng với oxi:Ag,Au,Ptkhôngtácdụng 4Li+O2=>2Li2O 2Na+O O 2=>Na2
2(cháytrongoxikhô) 2Mg+O2=>2MgO 4Al+3O O 2=>2Al2 3 3Fe+2O O 2=>Fe3 4 4Cr+3O O 2=>2Cr2 3
3. Tác dụng với axit:
a.Axitthôngthường:HCl,H2SO4loãng...tácdụngvớikimloạiđứng
trướcHchoH2baylên
2Li+2HCl=>2LiCl+H2↑
Zn+2HCl=>ZnCl2+H2↑
Fe+2HCl=>FeCl2+H2↑
Cr+2HCl=>CrCl2+H2↑
2Al+6HCl=>2AlCl3+3H2↑
(cáckimloạicótínhkhửmạnhnhưK,Na...sẽgâynổkhitiếpxúcvới cácdungdịchaxit)
b. Axit có tính oxi hoá mạnh: H SO4đặc,HNO 2 3
-HNO3đặc/nguội,H2SO4đặcnguội:khôngtácdụngvàđồngthờilàm
thụđộngcáckimloạiAl,Fe,Cr.
-HNO3,H2SO4đặc:khôngtácdụngAu,Pt
-Hầuhếtcáckimloạitácdụng,khửđượcN+5vàS+6xuốngsốoxihoá thấphơn
KimloạitrungbìnhhoặcyếutácdụngvớiHNO3đặcnóngtạoNO2, loãngtạoNO 3Cu+8HNO )
3=>3Cu(NO3 2+2NO+4H2O 2Fe+6H )
2SO4đặc,nóng=>Fe2(SO4 3+3SO2+6H2O
4. Tác dụng với dung dịch muối:
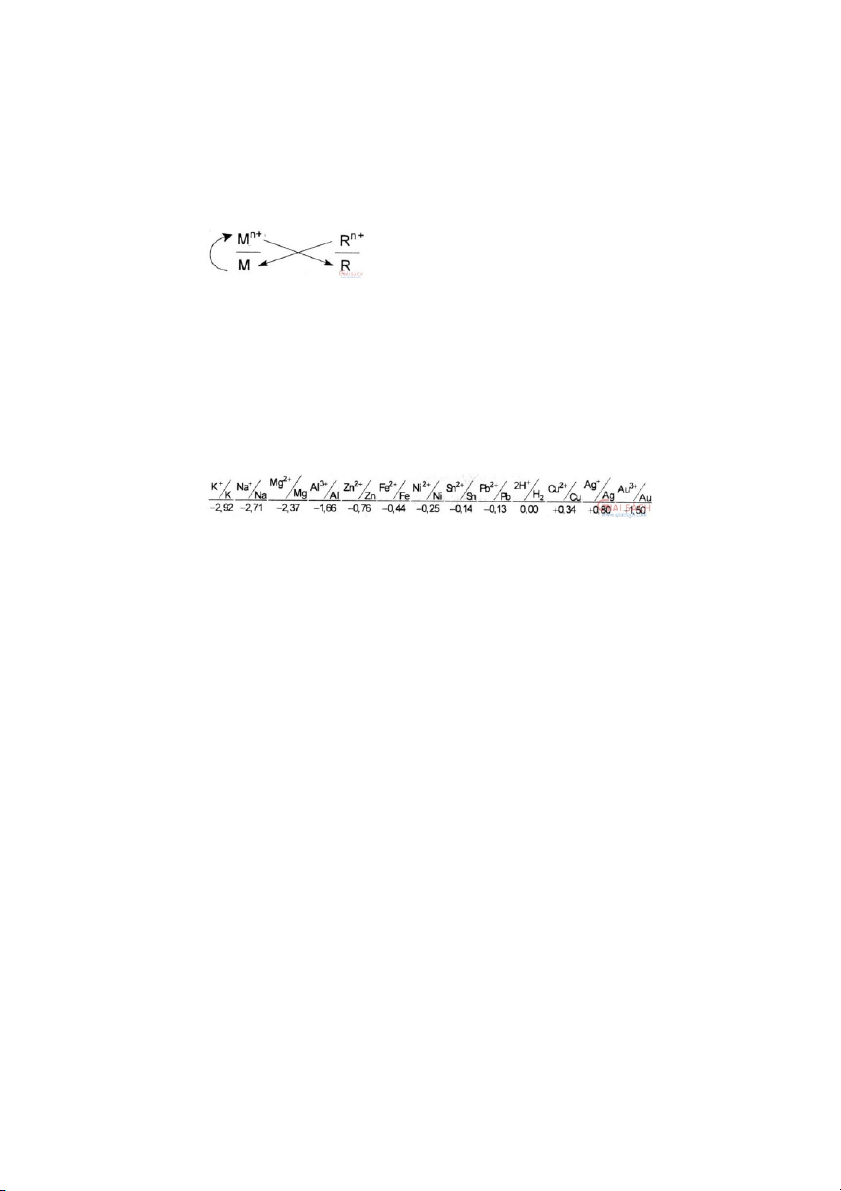
Tuântheoquytắcα:
0+2+2
Fe+CuSO4=>FeSO4+Cu↓
Cu+2FeCl3=>CuCl2+2FeCl2 Fe(NO )
3)2+AgNO3=>Fe(NO3 3+Ag↓ Fe+2Fe(NO ) ) 3 3=>3Fe(NO3 2 Cần chú ý:
Cáckimloạicókhảnăngtácdụngvớinướcởngayđiềukiệnthường
như:Na,K,Ca,Ba...khichovàodungdịchmuốisẽtácdụngvớinước
trước,tạodungdịchbazơ.Phảnứngtiếptheonếucólàcủadungdịch
bazơvớidungdịchmuối.
5. Tác dụng với dung dịch bazơ:
Dodungdịchbazơphávỡlớpbảovệ,kimloạitácdụngvớinướctạo
hiđroxytbảovệ,lớpnàytiếptụcbịdungdịchbazơphávỡ.Cáckim
loạithườnggặplàAl,Be,Zn.
2Al+2NaOH+2H2O=>2NaAlO2+3H2↑
6. Tác dụng với nước:ởđiềukiệnthường
BaogồmcáckimloạiLi,Na,K,Rb,Cs,Ca,Sr,Ba.Tạodungdịch bazơvàH2O
2Na+2H2O=>2NaOH+H2↑
Ca+2H2O=>Ca(OH)2+H2↑ ĐIỀU CHẾ KIM LOẠI
Nguyên tắc:khửiondươngkimloạithànhkimloại.
Chiathành2nhómchính:
Nhóm1:Kimloạihoạtđộngmạnh
Chỉsửdụngđượcphươngphápđiệnphânhợpchấtnóngchảy,bao gồm:
-Kimloạikiềm:điệnphânnóngchảymuốiclorua,hiđroxit
-Kimloạikiềmthổ:điệnphânnóngchảymuốiclorua
-Nhôm:điệnphânnóngchảyAl O 2
3Nhóm2:baogồmcáckimloạiđứngsau nhôm
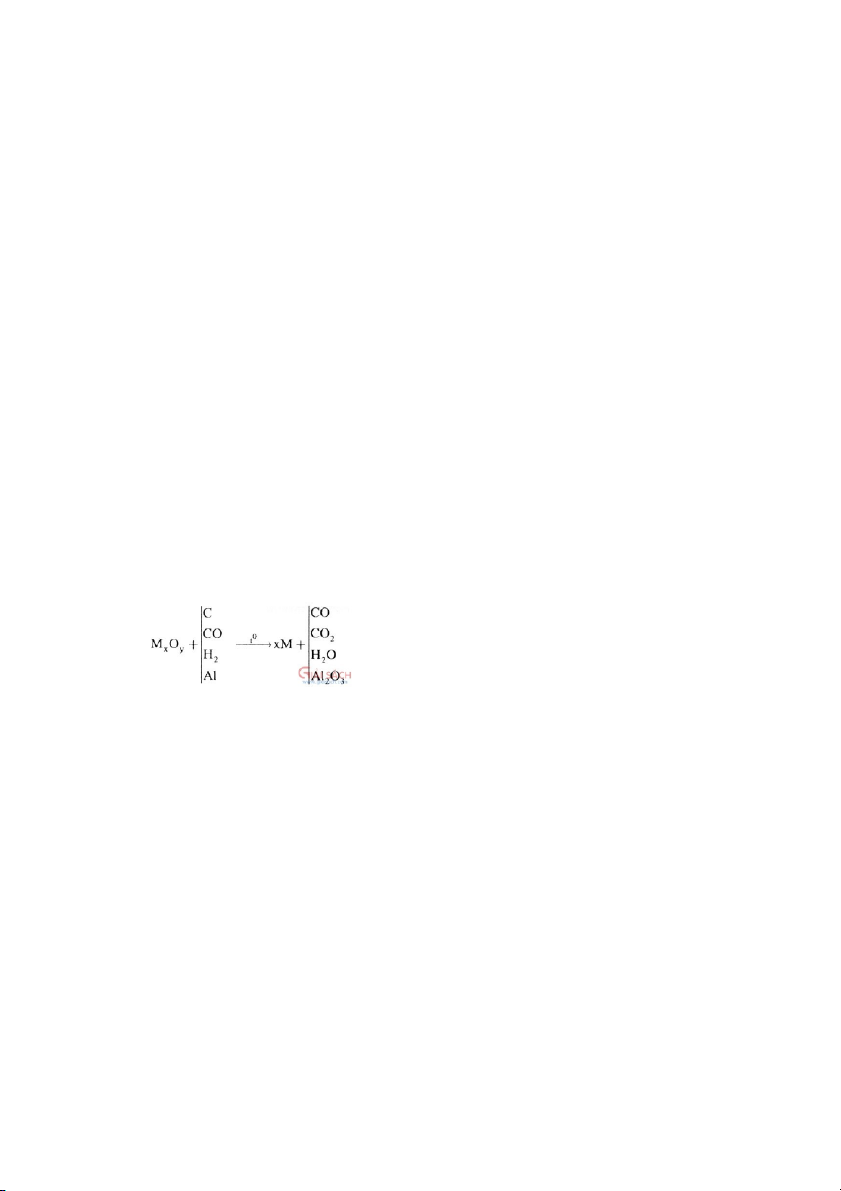
ĐIỀU CHẾ BẰNG PHƯƠNG PHÁP NHIỆT LUYỆN
to
FeO+CO=>Fe+CO2
Cầnchúý:sốmolCO=sốmolCO2;sốmolH2=sốmolH2O
ĐIỀU CHẾ BẰNG PHƯƠNG PHÁP THUỶ LUYỆN
Dùngkimloạicótínhkhửmạnhđẩykimloạicótínhkhửyếurakhỏidungdịch muốicùachúng:
Fe+CuSO4=>FeSO4+Cu
ĐIỀU CHẾ BẰNG ĐIỆN PHÂN DUNG DỊCH MUỐI Cation:
-LàioncủakimloạiđứngsauAIsẽbịkhửthànhkimloại Mn++ne=>M
-Làioncủakimloạimạnh(hoặcNH +4)sẽkhôngbịđiệnphân.Lúcnàynướcbị điệnphân 2H -
2O+2e=>H2+2OH
ĐIỀU CHẾ BẰNG ANION
-NếulàCr-,Br-sẽtạothànhCl2,Br2
-Nếulàgốcayxitcóoxi:SO 42,NO3...sẽkhôngbịđiệnphân.Lúcnàynướcbị điệnphân: 2H +
2O=>O2+4H +4e
dpdd
Vídụ:CuCl2-------->Cu+Cl2
TÊN VÀ CÔNG THỨC MỘT SỐ CHẤT
1.XinvinitNaCl.KCl
2.CacnalitKCl.MgCl2.6H2O
3.ĐolomitCaCO3.MgCO3
4.ApatitCa ) 3(PO4 2.CaF2
5.BoxitAl O 2 3.nH2O
6.ĐấtsétAl O 2 32SiO2.2H2O
7.MicaK O 2O.Al2 3.6SiO2.2H2O
8.CriolitNa3AlF6(hayAlF3.3NaF)
9.PiritđồngCuFeS2
10.MalachitCu(OH)2.CuCO3
11.ChancozitCu2S
12.ManhetitFe O 3 4
13.HemantitđỏFe O 2 3 14.HemantitnâuFe O 2 3.nH2O
15XideritFeCO3
16.PiritsắtFeS2
17.PhènchuaAl ) 2(SO4 3.K2SO4.24H2O
18.PhènnhômamonAl ) 2(SO4 3.(NH4)2SO4.24H2O
19.GalenPbS
20.SphaleritZnS.FeS(Znlàchủyếu)
21.FluoritCaF2
22.CrômitFeO.Cr O 2 3hayFe(CrO2)2
23.ThạchcaosốngCaSO4.2H2O
24.VôisốngCaO
25.VôitôiCa(OH)2
TÍNH CHẤT LƯỠNG TÍNH
Chấtlưỡngtínhlàchấtvừathểhiệntínhchấtaxitvừathểhiệntínhchấtbazơ,
dođóvừatácdụngvớiaxitvừatácdụngđượcvớibazơtheophảnứngaxitbazơ
(phảnứngtraođổi). Oxit Al O ,BeO,ZnO,Cr O 2 3 2 3 Hiđroxit
Al(OH) ,Be(OH)2,Zn(OH)2,Cr(OH) 3 3
Muốiaxitcủaaxityếu
NaHCO ,Ca(HCO )32,NaHS,Ba(HCO3) 3 2
Muốicủaaxityếuvàbazơ
(NH ) CO ,CH COONH ,NH HCO yếu 4 2 3 3 4 4 3
MỘT SỐ TRƯỜNG HỢP CẦN CHÚ Ý THÊM
1. CO2 tác dụng với chất khác
Thínghiệm:ChoCO2từtừđếndưvàodungdịchCa(OH)2hoặc
Ba(OH)2.Hiệntượng:Xuấthiệnkếttủa,sauđókếttủatan.
CO2+Ca(OH)2=>CaCO3↓+H2O
CaCO3+CO2+H2O=>Ca(HCO3)2
Thínghiệm:ChoCO2từtừđếndưvàodungdịchNaOH. Phảnứngxảyra:
CO2+2NaOH=>Na2CO3+H2O
Na2CO3+CO2+H2O=>2NaHCO3 2. Muối nhôm
Thínghiêm:DẫnCO2đếndưvàodungdịchNaAlO2.
Hiệntượng:XuấthiệnkếttủakeotrắngkhôngtankhiCO2dư.
CO2+H2O+NaAlO2=>Al(OH)3↓+NaHCO3
Thínghiệm:ChodungdịchHCltừtừđếndưvàodungdịchNaAlO2.
Hiệntượng:Xuấthiệnkếttủakeotrắng,sauđótankhiHCldư.
HCl+H2O+NaAlO2=>Al(OH)3↓+NaCl
Al(OH)3+3HCl=>AlCl3+3H2O
Thínghiệm:ChotừtừdungdịchNaOHchođếndưvàodungdịch AlCl3.
Hiệntượng:Xuấthiệnkếttủakeotrắngđếncựcđại,sauđókếttủatan
dầntạodungdịchtrongsuốt.
AlCl3+3NaOH=>Al(OH)3↓+3NaCl
Al(OH)3+NaOH=>NaAlO2+2H2O
HiệntượngnàytươngtựvớiZnCl2,CrCl3.
Thínghiệm:ChotừtừdungdịchAlCl3đếndưvàodungdịchNaOH.
Hiệntượng:Xuấthiệnkếttủakeotrắngsauđótanngay(vìnằmtrong
môitrườngNaOH),mộtthờigiansaulạixuấthiệnkếttủakeotrắng khôngtan.
AlCl3+3NaOH=>Al(OH)3↓+3NaCl
Al(OH)3+NaOH=>NaAlO2+2H2O
Thínghiệm:ChotừtừdungdịchNH3vàodungdịchAlCl3.
Hiệntượng:TạokếttủakeotrắngkhôngtantrongdungdịchNH3dư.
AlCl3+3NH3+3H2O=>Al(OH)3↓+3NH4Cl
Thínghiệm:ChoNavàodungdịchAlCl3
Hiệntượng:Cókhíbaylên,tạokếttủatrắng.Đôikhikếttủacóthể tan:
2Na+2H2O=>2NaOH+H2↑
AlCl3+3NaOH=>Al(OH)3↓+3NaCl
NếudungdịchcòndưNaOHthì:
Al(OH)3+NaOH=>NaAlO2+2H2O 3. Liên quan Na CO 2 3
Thínghiệm:ChotừtừđếndưdungdịchHC1vàodungdịchNa2CO3
Hiệntượng:LúcđầukhôngcóCO2baylên,mộtlúcsaubắtđầucó CO2↑
HCl+Na2CO3=>NaHCO3+NaCl
HCl+NaHCO3=>NaCl+H2O+CO2↑
Thínghiệm:ChotừtừđếndưdungdịchNa2CO3vàodungdịchHCl
Hiệntượng:XuấthiệnCO2ngaylậptức(vìNa2CO3nằmtrongmôi trườngaxit)
2HCI+Na2CO3=>2NaCl+H2O+CO2
Thínghiệm:ChodungdịchFeCl3tácdụngvớidungdịchNa2CO3
Hiệntượng:Cókếttủanâuđỏvàkhíbaylên:
2FeCl3+3Na2CO3=>Fe2(CO3)3+6NaCl Fe )
2(CO3 3+3H2O=>2Fe(OH)3↓+3CO2↑
Thínghiệm:ChodungdịchAlCl3tácdụngvớidungdịchNa2CO3
Hiệntượng:Cókếttủakeotrắngvàkhíbaylên: 2AlCl )
3+3Na2CO3=>Al2(CO3 3+6NaCl Al )
2(CO3 3+3H2O=>2Al(OH)3↓+3CO2↑
4. Liên quan đến kim loại Oxit kim loại tác dụng với H2O ở nhiệt độ thường
Thínghiệm:ChoKvàodungdịchCuSO4
Hiệntượng:Cókhíbayravàxuấthiệnkếttủamàuxanh:
2K+2H2O=>2KOH+H2↑
2KOH+CuSO4=>Cu(OH)2↓+K2SO4
Thínghiệm:ChoNa2OvàodungdịchCuSO4
Hiệntượng:Xuấthiệnkếttủamàuxanh Na2O+H2O=>2NaOH
2NaOH+CuSO4=>Cu(OH)2↓+Na2SO4
5. Liên quan dãy điện hóa
Thínghiệm:ChoFedưtácdụngvớidungdịchHNO3loãng
Kếtquả:Thuđượcmuốisắt(II) Fe+4HNO )
3=>Fe(NO3 3+NO+2H2O Fe+2Fe(NO ) ) 3 3=>3Fe(NO3 2
Thínghiệm:ChoFetácdụngdungdịchAgNO3dư
Kếtquả:Thuđượcmuốisắt(III)màuvàngvàcóAgkếttủa
Fe+2AgNO3=>Fe(NO3)2+2Ag↓ Fe(NO )
3)2+AgNO3=>Fe(NO3 3+Ag↓
Thínghiêm:ChoCudưvàodungdịchmuốisắt(III)
Hiệntượng:Mấtdầnmàuvàng,xuấthiệnmàuxanh
Cu+2FeCl3=>CuCl2+2FeCl2
Thínghiệm:HoàtanhỗnhợpFe O 3
4vàCutrongdungdịchHCldư
Kếtquả:ThuđượcFeCl2vàCuCl2,nếusaucònđồngdưthìkhôngcòn FeCl3 Fe O 3
4+8HCl=>FeCl2+2FeCl3+4H2O
Cu+2FeCl3=>CuCl2+2FeCl2
6. Liên quan dung dịch NH3
Thínghiệm:ChotừtừđếndưdungdịchNH3vàodungdịch
CuCl2Hiệntượng:Xuấthiệnkếttủaxanhsauđótan,tạodungdịch xanhlam
CuCl2+2NH3+2H2O=>Cu(OH)2↓+2NH4CI Cu(OH) )
2+4NH3=>[Cu(NH3 4](OH)2




