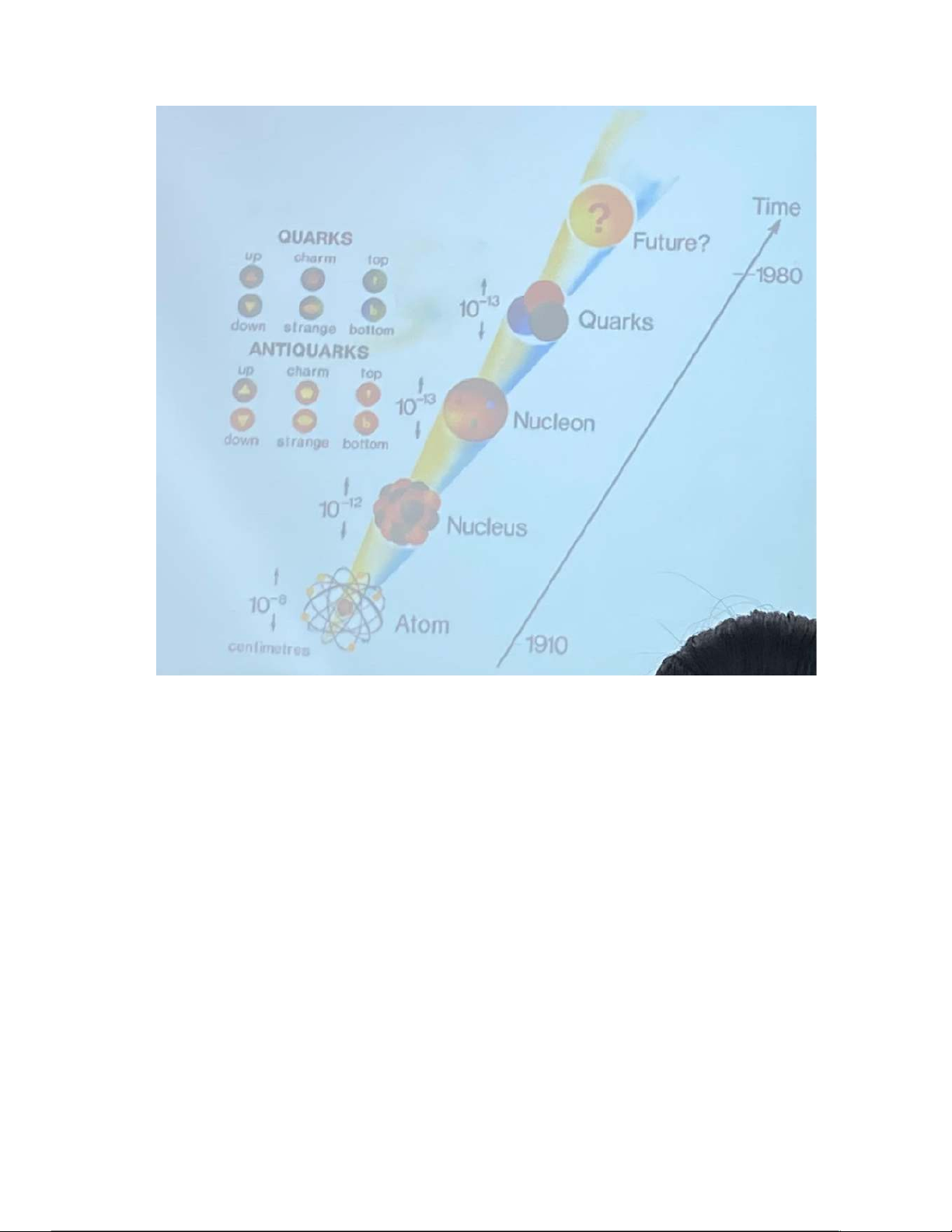




Preview text:
HÓA HỌC ĐẠI CƯƠNG 1 Buổi 1: Ý nghĩa của hóa học:
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về
thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất. Hóa học
nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng
hóa học xảy ra giữa những thành phần đó
Hóa học đôi khi được gọi là “khoa học trung tâm” vì nó là cầu nối các
ngành khoa học tự nhiên khác như vật lý học, sinh học, địa chất học và vũ trụ học
Lịch sử phát triển của hóa học
1. Thời kì cổ đại: từ thượng cổ đến hết thế kỉ thứ 3 sau công nguyên
Giải thích hiện tượng tự nhiên thông qua các vị thần
Năm 3000 trước công nguyên:
Người Ai Cập xây dựng thuyết Ogdoad (thuyết “Các lực lượng
nguyên thủy) hình thành nên vạn vật. Đó làm 8 nguyên tố của sự
hỗn loạn và tồn tại trước sự có mặt của Mặt trời
Năm 1200 trước công nguyên:
Tapputi – Belatikallim được nhắc đến trong một bảng kí tự hình nêm
tại Lưỡng Hà – được coi là nhà hóa học đầu tiên khi là người làm ra nước hoa
Năm 450 trước công nguyên:
Empedocles khẳng định vạn vật được tạo thành từ 4 yếu tố nguyên
thủy: Đất, nước, lửa, không khí
Thuyết nguyên tử luận (phát triển thuyết của Leucippus):
Vật chất được cấu tạo từ nguyên tử nhỏ bé (gọi là “atoma”), không phân chia
Vũ trụ là vô tận và vĩnh cửu. Có vô số thế giới phát sinh, phát triển và triệt tiêu
Vận động không tách rời vật chất. Vận động của nguyên tử là
vĩnh viễn, không có điểm kết thúc
Là người đầu tiên đưa ra khái niệm không gian: là khoảng chân
không rộng lớn, trong đó những nguyên tử vận động vĩnh viễn.
Không gian là những khoảng trống giữa các vật thể, nhờ đó các
vật thể có thể tu lại hoặc giãn ra. Xuất phát từ học thuyết
nguyên tử, Đêmmocrit cho rằng không gian là giai đoạn và có thể phân chia vô tận
Luận điểm của Đêmmocrit bị chối bỏ
Đa dạng của vật chất:
Cố gắng nhận thức bản chất các mảnh (hạt) “nguyên tố”. Ông cho
rằng tương tác của chúng giống như sự thay đổi hình dạng
Platon cho rằng, thành phần của các nguyên tố đầu tiên là tam giác
xuất hiện khi “phân hủy” các hình đa diện tam giác và tứ giác đều.
Khi có sự khác biệt về kích thước, các tam giác của nguyên tố đầu
tiên không ngừng tương tác với nhau và tạo ra sự đa dạng của vật chất
Sự chuyển hóa giữa các nguyên tố:
Thuyết của Aristot ảnh hưởng tới tư tưởng của các nhà giả kim thuật sau này.
Đã trình bày hệ thống hóa học các nguyên tố dựa trên nguyên lý cặp
đôi: khô - ẩm, nóng – lạnh. Đối với 4 nguyên tố cơ bản của “vật chất
nguyên thủy” – đất, không khí, nước và lửa – ông đã nghiên cứu
nghiên cứu nguyên lý cặp đôi và nhận được 4 tổ hợp cặp đôi: Nóng + Khô = Lửa
Nóng + Ẩm = Không khí Lạnh + Khô = Đất Lạnh + Ẩm = Nước
Khi đun nóng nước thiên nhiên, nước được biến thành không khí và
để lại trong đĩa một bã là đất. Hiện tượng này được giải thích
như sau: Nước đã trả ấm cho lửa, thu nóng của lửa tạo thành không
khí, đồng thời nước trả lạnh cho lửa, thu nóng của lửa tạo thành
không khí, đồng thời nước trả lạnh cho lửa, thu khô của lửa, tạo thành đất!
Sự đa dạng trong thế giới sự vật, hiện tượng, theo Aristot, chứng tỏ
rằng một nguyên tố có thể chuyển hóa thành nguyên tố khác
Xuất hiện khái niệm “Nguyên tử” (atoma)
Dựa vào khái niệm nguyên tố để giải thích thế giới tự nhiên bằng các luận điểm khác nhau: -
Thuyết lượng tử luận của Đêmocrit -
Thuyết của Platon về sự đa dạng vật chất -
Thuyết của Aristot về sự chuyển hóa qua lại giữa các nguyên tố
2. Thời kì giả kim thuật: từ thế kỉ thứ 4 đến đầu thế kỉ 16
Ý tưởng “giả kim”, xuất hiện vào thế kỉ thứ III – IV tại Ai Cập, trở
thành đề tài chính trong suốt 1500 năm. Thời kì này là thời kì của
“nghệ thuật biến đổi các kim loại thành vàng”. Sau đó người ta
còn thêm yêu cầu tìm ra thuốc thần bí truyền cho con người sức
khỏe, sự trẻ trung, tính bất tử.
3. Thời kì hóa y học và hóa kĩ thuật: từ đầu thế kỉ 16 đến thế kỉ 17
4. Thời kì hóa học độc lập trở thành một môn khoa học: từ
giữa thế kỉ 17 đến cuối thế kỉ 18
5. Thời kì hóa học hiện đại: Từ đầu thế kỉ 19 đến ngày nay
Những định hướng chính nghiên cứu chính: Hóa học lượng tử
Cơ chế phản ứng hóa học hữu cơ Hóa học cao phân tử
Ứng dụng các phương pháp vật lý vào nghiên cứu các quá trình hóa học
Hóa sinh học và phân tử hóa sinh học Hóa học vũ trụ Địa hóa học Công nghệ nano
CÁC KHÁI NIỆM VỀ NGUYÊN TỬ Định luật Boyle: P1V1 = P2V2 = const
Mô tả mối quan hệ tỉ lệ nghịch giữa áp suất và thể tích của một khối
khí, nếu nhiệt độ được giữ không đổi trong một hệ kín
Các nguyên tố là những phần không thể chia cắt được của vật chất.
Ông đã nhận ra được sự khác biệt giữa hỗn hợp và hợp chất, tiến
hành nhiều thí nghiệm phân tích thành phần các chất, vì thế ông
được coi là Cha đẻ của chuyên ngành hóa phân tích
Năm 1740, Lô – mô – nô – xốp xây dựng thành công thuyết hạt về
cấu tạo các chất, nhiều luận điểm đã đi trước cả học thuyết nguyên
tử - phân tử. Ông gọi các nguyên tử là “nguyên tố” (element) và “phân tử” là hạt
Năm 1760, ông đưa ra một nhận định tổng quát về “Định luật bảo
toàn chất và chuyển động”: “Tất cả những sự biến đổi xảy ra trong
thiên nhiên đều có bản chất là vật thể này mất đi một lượng bao
nhiêu thì vật thể kia được thêm một lượng bấy nhiêu...”. Định luật
tổng quát này của tự nhiên áp dụng được ngay vào các quy tắc của chuyển động. Buổi 2: Buổi 3:
1.2. Hệ thống khối lượng nguyên tử, phân tử. Số
Avogradro. Đơn vị khối lượng nguyên tử, nguyên tử
khối. mol, khối lượng mol nguyên tử và phân tử
a) Đơn vị khối lượng nguyên tử:
Được tính bằng 1/12 khối lượng nguyên tử 12 , được kí hiệu là u (unit) 6C
hay còn gọi là đơn vị cacbon (đvC) − 1 19,9260. 10 24 −24 −27 1 u= m = g=1,6605.10 g=1,6605.10 kg 12 12C 12
b) Nguyên tử khối, phân tử khối:
Nguyên tử khối (khối lượng nguyên tử tương đối) là số đo của khối
lượng nguyên tử tính ra đơn vị u (đvC)
He=4,0026 u O=15,9994 u
Phân tử khối (khối lượng phân tử tương đối) bằng tổng khối lượng
nguyên tử tương đối của các nguyên tử tạo thành phân tử
O =2. 15,9994=31,9988 ≈32 u 2 c) Số Avogadro:
Số nguyên tử có trong 12g chất của 1 C 2
được gọi là số Avogadro: 6 N=6,022.1023 d) Mol:
Mol là lượng chất chứa 6,022. 1023 hạt vi mô
e) Khối lượng mol nguyên tử, khối lượng mol phân tử
Khối lượng mol nguyên tử của một nguyên tố là khối lượng của 1
mol nguyên tử nguyên tố đó
Khối lượng mol phân tử của một chất là khối lượng của 1 mol phân tử chất đó
b) Nguyên tố hóa học. Đồng vị
A X với X – kí hiệu nguyên tố Z
Nguyên tố hóa học là tập hợp các dạng nguyên tử có cùng điện tích hạt nhân
Mỗi nguyên tố hóa học có thể có một số dạng nguyên tử có cùng điện tích
Những dạng nguyên tử khác nhau của một nguyên tố hóa học có
cùng điện tích hạt nhân Z nhưng số khối A khác nhau được gọi là
những đồng vị của nguyên tố đó
ĐỊNH LUẬT LIÊN HỆ GIỮA KHỐI LƯỢNG VÀ NĂNG LƯỢNG:
Thuyết tương đối (năm 1903)
Khối lượng là thước đo quán tính, năng lượng là thước đo vận động của vật chất E=m c2
Trong đó: m: khối lượng, c=2,9979.108: vận tốc ánh sáng trong chân không
Sự biến thiên về khối lượng ∆ m của một hệ nào đó luôn kèm theo sự
biến thiên về năng lượng của hệ và ngược lại ∆ E=∆ m . c2
ĐỊNH LUẬT LIÊN HỆ GIỮA KHỐI LƯỢNG VÀ VẬN TỐC CHUYỂN ĐỘNG: m m = 0 v √1−v2c2
c−¿ tốc độ ánh sáng trong chân không
m −¿ khối lượng nghỉ hay khối lượng của vật thể đứng yên o
m −¿khối lượng của vật thể di chuyển với vận tốc v
v (khối lượng tương
đối tính của vật thể)
Vì c quá lớn, nên sự hiệu chỉnh chỉ có ý nghĩa trong các trường
hợp vật thể chuyển động với tốc độ lớn, ví dụ electron trong
chuyển động xung quanh hạt nhân
Đối với vật thể vĩ mô, v ≪ c , nên khối lượng không phụ thuộc
vào tốc độ chuyển động