






























































Preview text:
ĐẠI CƯƠNG SẮC KÝ
Ths. DS. VÕ SỸ NHẬT MỤC TIÊU
1. Trình bày được định nghĩa và diễn tiến quá trình sắc ký
2. Phân loại được các phương pháp sắc ký
3. Giải thích được vai trò, ý nghĩa của các thông số sắc ký
4. Giải thích được hiện tượng giãn pic và cách khắc phục
5. Trình bày được nguyên lý và ứng dụng của các phương pháp sắc ký lỏng LỊCH SỬ RA ĐỜI
• 1903 tại Warsaw, nhà thực vật học M. Tswett đã phát minh ra
sắc ký hấp phụ để tách các sắc tố thực vật
– Pha động: ether dầu hỏa (hydrocarbon)
– Pha tĩnh: bột inulin (carbohydrate), CaCO hoặc sucrose 3
• Trong tiếng Hy Lạp: chromatos (“màu”) và graphein (“ghi”) ➔
chromatography (“ghi màu”): sắc ký
Progress of a column chromatographic LỊCH SỬ RA ĐỜI
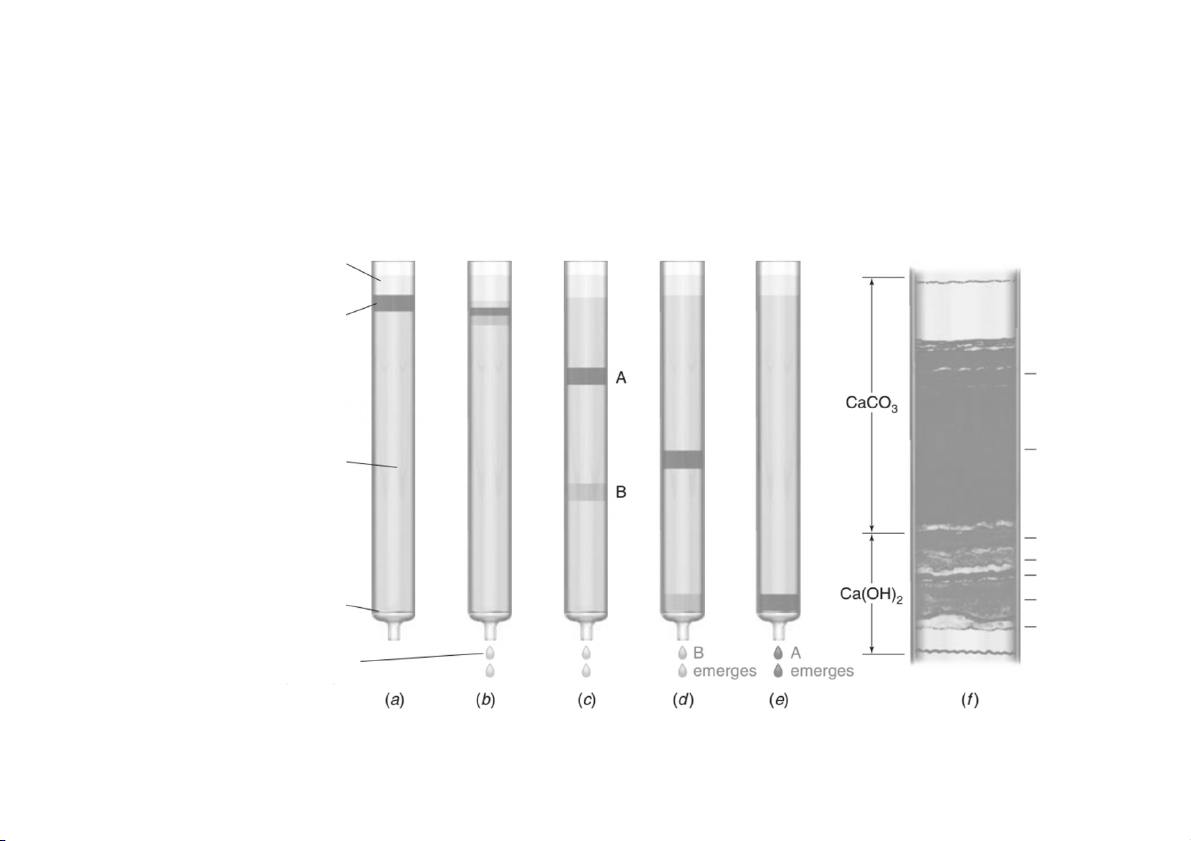
• 1930 tại Hungary, L. Zechmeister tách các sắc tố từ vỏ ớt đỏ
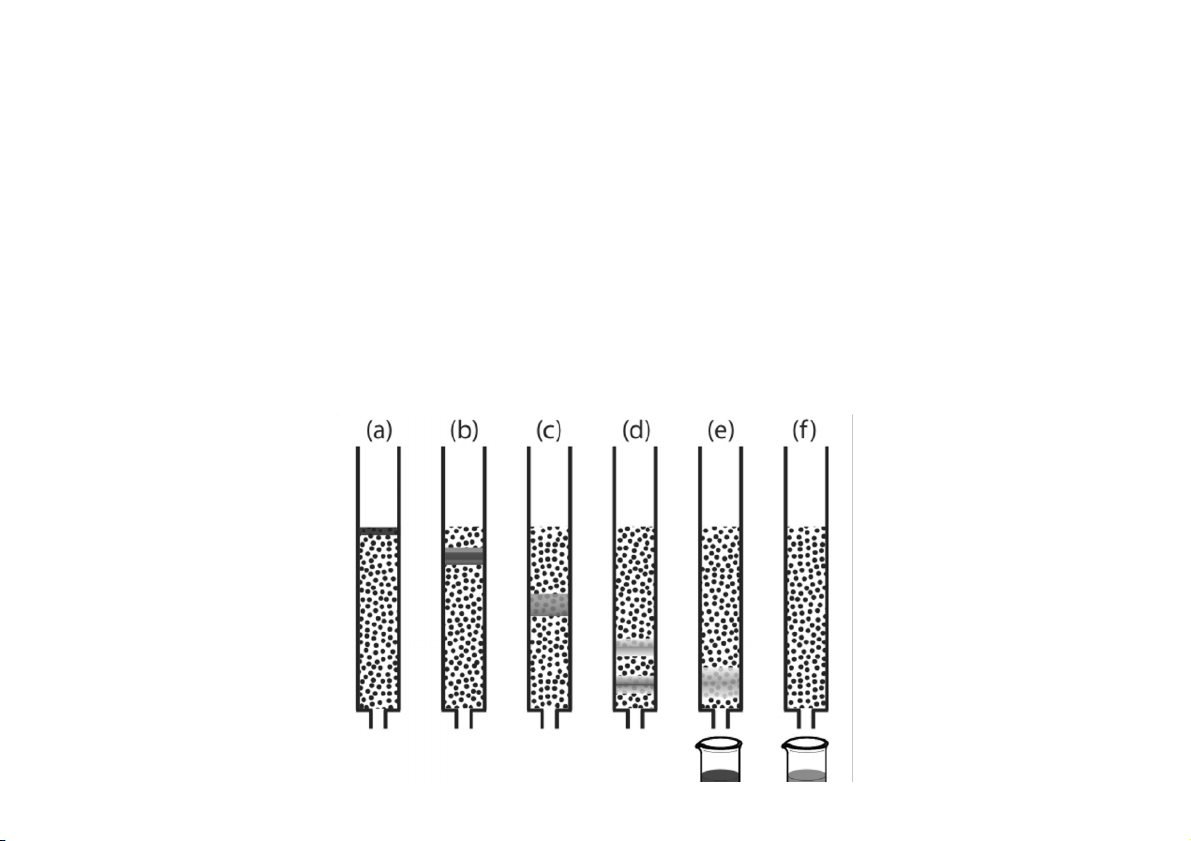
Pha tĩnh dưới là Ca(OH) và pha tĩnh trên là CaCO 2 3 Dung môi Hỗn hợp ban đầu với chất tan A và B Cột (pha tĩnh) được phân tán trong dung môi (pha động) Đĩa thủy tinh xốp Dung dịch rửa giải
The idea behind chromatography: solute A, with a greater affinity than solute B
for the stationary phase, remains on the column longer LỊCH SỬ RA ĐỜI
• 1935, B. A. Adams và E. L. Holmes đã chế tạo nhựa trao đổi ion tổng hợp đầu tiên
• 1941, A. J. P. Martin và R. L. M. Synge đặt nền móng cho sắc
ký phân bố lỏng – lỏng, sau đó đã nhận giải Nobel năm 1952
• 1960: sắc ký lỏng cao áp ra đời (HPLC)
• 1937 – 1972: 12 giải Nobel về sắc ký
• 2005: sắc ký lỏng siêu hiệu năng (UPLC, UHPLC, UFLC) ĐỊNH NGHĨA
Sắc ký là những phương pháp tách trong đó các thành phần của
mẫu được phân bố vào 2 pha: pha tĩnh và pha động
• Pha tĩnh: chất rắn, chất lỏng được giữ trên một chất rắn hay
một gel. Pha tĩnh có thể được nhồi vào cột, hoặc trải thành một
lớp, hay phân tán thành một lớp phim...
• Pha động: chất khí, chất lỏng hay chất lỏng siêu tới hạn
• Cơ chế tách sắc ký: hấp phụ, phân bố, trao đổi ion, rây phân tử, ái lực... QUÁ TRÌNH SẮC KÝ
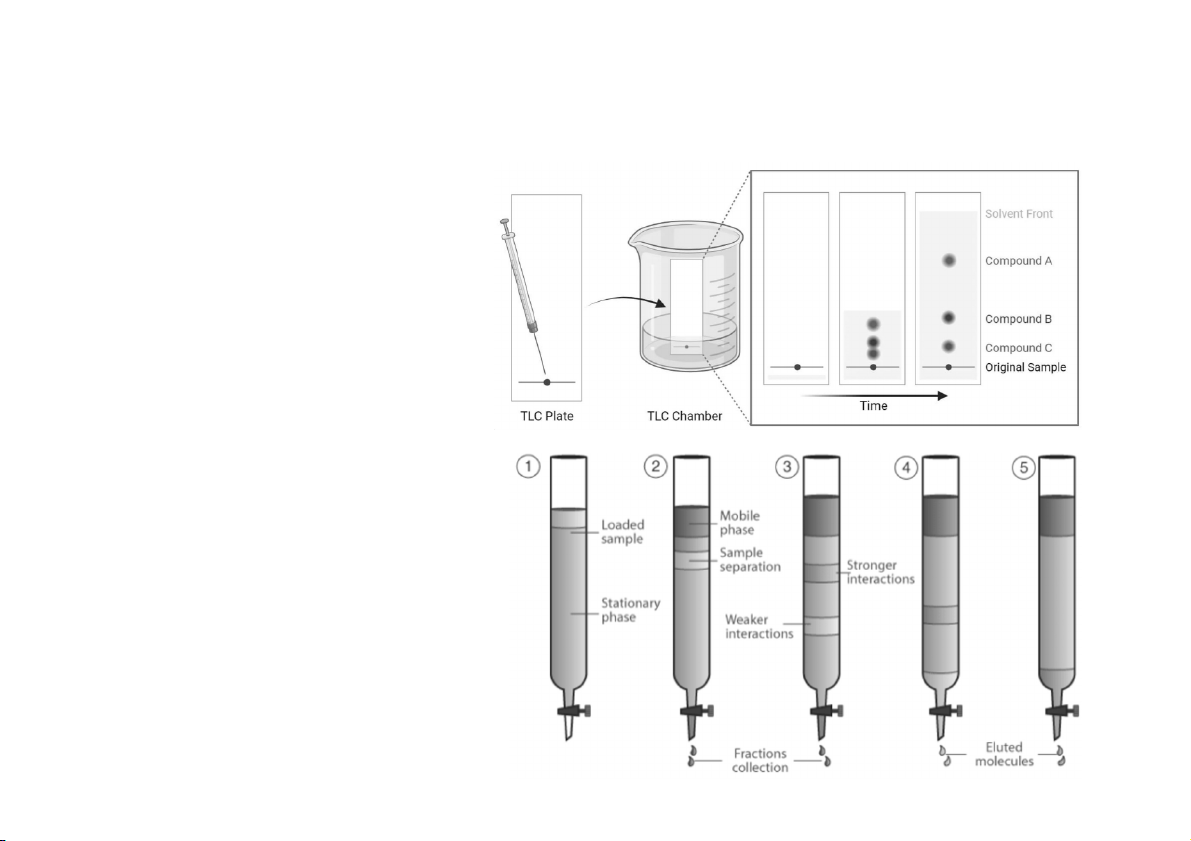
1. Đưa hỗn hợp lên pha tĩnh 2. Triển khai sắc ký – Sắc ký khai triển – Sắc ký rửa giải • Quá trình rửa giải • Dung môi rửa giải • Dung dịch rửa giải
3. Phát hiện các chất – Màu của chất – Đèn tử ngoại
– Thuốc thử đặc hiệu – Detector (đầu dò)
PHÂN LOẠI CÁC PHƯƠNG PHÁP SẮC KÝ
v THEO PHƯƠNG CÁCH LƯU GIỮ CỦA PHA TĨNH 1) Sắc ký cột 2) Sắc ký lớp mỏng 3) Sắc ký giấy
v THEO BẢN CHẤT VẬT LÝ CỦA PHA ĐỘNG 1) Sắc ký lỏng 2) Sắc ký khí
3) Sắc ký lỏng siêu tới hạn
PHÂN LOẠI CÁC PHƯƠNG PHÁP SẮC KÝ
v THEO BẢN CHẤT CỦA QUÁ TRÌNH SẮC KÝ 1) Sắc ký hấp phụ
• Pha tĩnh: rắn. Pha động: lỏng hoặc khí Chất tan được hấp phụ trên bề mặt pha tĩnh rắn
Chất tan bị hấp phụ càng mạnh thì di chuyển qua cột càng chậm
PHÂN LOẠI CÁC PHƯƠNG PHÁP SẮC KÝ
v THEO BẢN CHẤT CỦA QUÁ TRÌNH SẮC KÝ 2) Sắc ký phân bố
• Pha tĩnh lỏng được liên kết với một bề mặt rắn, thường là bên
trong cột sắc ký silica (SiO ) trong sắc ký khí 2
Mặt cắt ngang của cột hình ống
Chất tan trong pha lỏng liên kết với bề mặt cột
Chất tan phân bố càng nhiều trong pha động
thì di chuyển qua cột càng nhanh
PHÂN LOẠI CÁC PHƯƠNG PHÁP SẮC KÝ
v THEO BẢN CHẤT CỦA QUÁ TRÌNH SẮC KÝ 3) Sắc ký trao đổi ion
• Pha động lỏng. Các ion như SO — hoặc N(CH ) + liên kết 3 3 3
cộng hóa trị với pha tĩnh rắn, thường là nhựa
• Các ion chất tan mang điện tích trái dấu bị hút vào pha tĩnh
Các anion bị giữ lại, gần các cation liên kết
cộng hóa trị với pha tĩnh
Nhựa trao đổi anion: chỉ các
anion bị giữ lại trên pha tĩnh
PHÂN LOẠI CÁC PHƯƠNG PHÁP SẮC KÝ
v THEO BẢN CHẤT CỦA QUÁ TRÌNH SẮC KÝ
3) Sắc ký trao đổi ion
Sử dụng nhựa trao đổi ion để khử khoáng nước
TỐC ĐỘ DI CHUYỂN CỦA CÁC CHẤT
SẮC KÝ KHÍ (GC) VÀ SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC) 5. Diện tích pic (S)
6. Hệ số lưu giữ (k), hệ số dung lượng (k’) 2 < k < 10 (có thể
chấp nhận 1 < k < 20)
TỐC ĐỘ DI CHUYỂN CỦA CÁC CHẤT
SẮC KÝ KHÍ (GC) VÀ SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC)
7. Độ lưu giữ tỷ đối hay hệ số chọn lọc (α): là tỷ số hệ số lưu giữ giữa hai chất Trong đó: t’ > t’ > 1 r,B r,A ➔ α Nếu α = 1 ➔ t’ = t’ r,B
r,A ➔ hai chất rửa giải đồng thời, không tách được khỏi nhau
α càng lớn thì sự phân tách giữa 2 chất càng nhiều
HÌNH DẠNG PIC – SỰ ĐỐI XỨNG CỦA PIC
8. Hệ số đối xứng (A ) s 𝐴 + 𝐵 𝐴 = 𝑠 2𝐵
• A: nửa chiều rộng phía sau của pic được đo ở 1/10 chiều cao pic
• B: nửa chiều rộng phía trước của pic được đo ở 1/10 chiều cao pic
HÌNH DẠNG PIC – SỰ ĐỐI XỨNG CỦA PIC
8. Hệ số đối xứng (A ) s
• A = 1,0: pic hoàn toàn đối xứng s
• A > 1,0: pic bị kéo đuôi s
• A < 1,0: pic bị doãng về phía trước s 0,8 ≤ *𝐴𝑠 ≤ 1,5
HIỆU LỰC CỘT – SỐ ĐĨA LÝ THUYẾT BIỂU KIẾN
Tại điểm tiêm mẫu, mẫu là một dải hẹp. Khi đi qua cột, độ rộng
của dải này liên tục tăng ➔ hiện tượng mở rộng dải (giãn pic)
9. Số đĩa lý thuyết (N): dùng để đánh giá hiệu lực cột
L: chiều dài cột; H: chiều cao đĩa
w: chiều rộng pic; d : đường kính hạt pha tĩnh p
Hiệu năng của cột càng cao khi pic càng hẹp (w nhỏ) ➔
• số đĩa lý thuyết N lớn • chiều cao đĩa H nhỏ
• đường kính hạt pha tĩnh d nhỏ p
Chromatographic bands (peaks) are broadened
during the transport through the column
ĐỘ PHÂN GIẢI – MỨC ĐỘ PHÂN TÁCH HAI PIC
10. Độ phân giải (R ): mô tả mức độ phân tách của hai pic trên S sắc ký đồ
R càng lớn, khả năng phân tách của 2 pic càng cao s 𝑅 ≥ 1,5 𝑠
HIỆN TƯỢNG MỞ RỘNG DẢI – SỰ GIÃN PIC
• Là hiện tượng đặc biệt trong sắc ký, được nghiên cứu qua
thuyết động học về đĩa sắc ký
• Sự giãn pic là kết quả di chuyển nhanh chậm khác nhau của
các phân tử của cùng một chất khi qua cột
• Pic ra muộn bị giãn rộng hơn pic ra sớm
• Cột sắc ký tốt (hiệu lực cao) sẽ cho pic nhọn (ít bị giãn)
THUYẾT ĐỘNG HỌC TRONG SẮC KÝ
Khuếch tán xoáy (A): là hiện tượng xảy ra khi cùng một loại
phân tử chất tan đi qua cột, nhưng di chuyển theo các quãng
đường khác nhau (còn gọi là khuếch tán Eddy)
• Như vậy, các phân tử chất tan đi vào cột cùng một lúc sẽ thoát
ra khỏi cột vào những thời điểm khác nhau ➔ giãn pic
λ: hằng số thể hiện độ đồng nhất của pha tĩnh
d : đường kính của hạt pha tĩnh p
Đường kính hạt càng nhỏ, khuếch tán xoáy càng ít xảy ra
THUYẾT ĐỘNG HỌC TRONG SẮC KÝ
Khuếch tán dọc (B): các phân tử chất tan khi qua cột sẽ khuếch
tán từ nơi có nồng độ cao đến nơi có nồng độ thấp (dọc theo thành cột sắc ký)
γ: hằng số thể hiện hiệu quả nhồi cột
u: tốc độ dòng pha động
D : hệ số khuếch tán của chất tan trong pha động m
Hệ số khuếch tán của chất tan trong pha khí lớn hơn trong pha
lỏng ➔ khuếch tán dọc là vấn đề nghiêm trọng hơn trong GC
Tốc độ dòng càng cao, khuếch tán dọc càng ít xảy ra
THUYẾT ĐỘNG HỌC TRONG SẮC KÝ
Sự chuyển khối (C): là sự di chuyển qua lại của khối chất tan
giữa pha tĩnh và pha động
q: hằng số liên quan đến vật liệu nhồi cột
d : độ dày của pha tĩnh; d : đường kính cột f c
D , D : hệ số khuếch tán của chất tan trong pha tĩnh và pha động s m
Sự chuyển khối ít xảy ra khi: » Tốc độ dòng nhỏ » Hạt pha tĩnh nhỏ
THUYẾT ĐỘNG HỌC TRONG SẮC KÝ
Phương trình van Deemter:
Hạn chế sự giãn pic bằng cách:
» Giảm kích thước hạt pha tĩnh
» Đồng nhất hạt pha tĩnh
» Giảm đường kính cột (cột mao quản trong GC)
Plot showing the relationship between the height of a theoretical plate H, and the mobile
phase’s velocity u, based on the van Deemter equation SẮC KÝ PHA ĐẢO
Sắc ký pha đảo (RP): phổ biến nhất trong sắc ký lỏng
1. Pha tĩnh: không phân cực (silica biến đổi bề mặt)
2. Pha động: dung môi phân cực
– Nước hoặc dung dịch đệm (kiểm soát pH pha động)
– Dung môi hữu cơ: methanol, acetonitril hoặc tetrahydrofuran
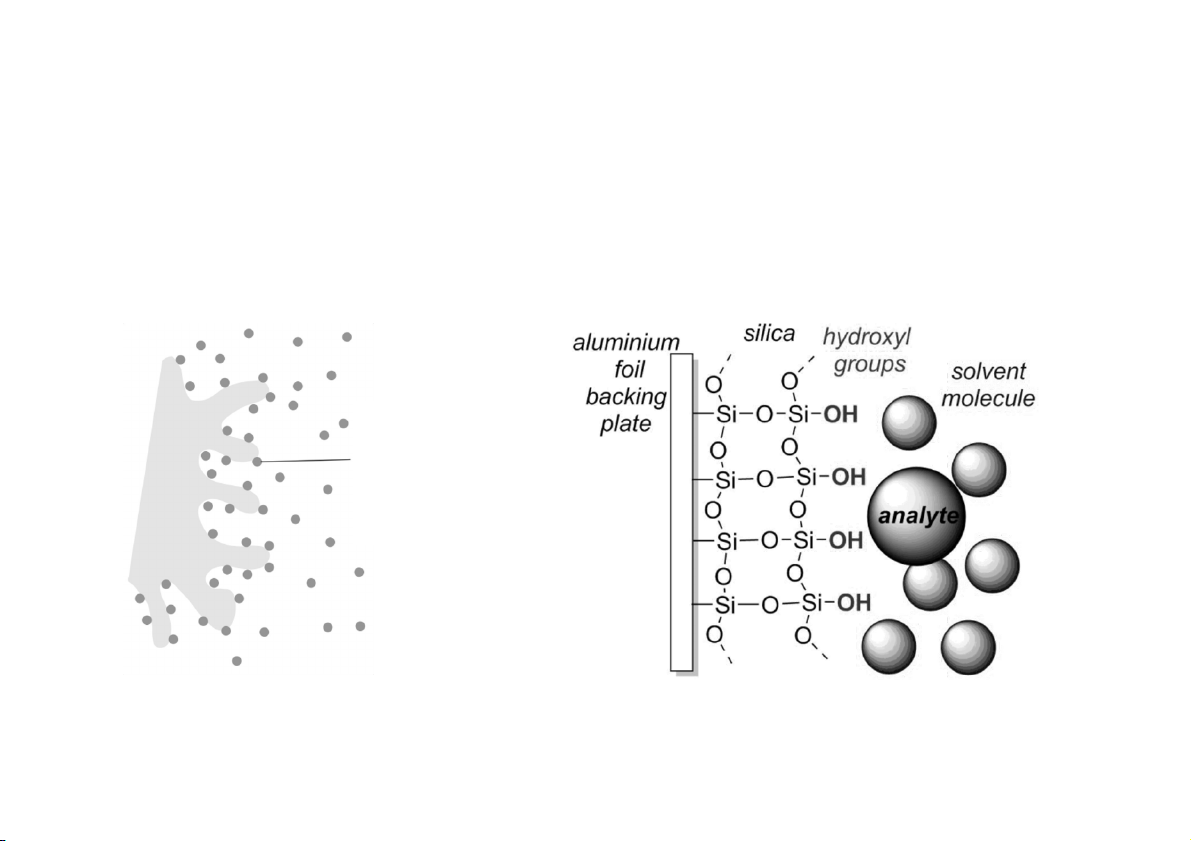
3. Cơ chế lưu giữ: sắc ký phân bố SẮC KÝ PHA ĐẢO
PHA TĨNH: dựa trên các hạt silica mà bề mặt đã được biến đổi
hóa học để tạo thành bề mặt không phân cực
Silica (silica gel) là dạng khử nước một phần của keo acid silicic được polyme hóa
Silica gel – the basis of stationary phase particles SẮC KÝ PHA ĐẢO PHA TĨNH
• Phản ứng hóa học giữa các nhóm silanol trên bề mặt silica và
thuốc thử silan hữu cơ: cloro(dimethyl)octadecylsilan ➔ bề
mặt kỵ nước (không phân cực). Octadecyl silan (—C H ) là 18 37
pha tĩnh kỵ nước nhất, gọi là cột C hoặc cột ODS 18 SẮC KÝ PHA ĐẢO PHA TĨNH
• Thuốc thử silan có 3 nhóm alkyl (R, 2R’) nối với Si: rất cồng
kềnh và che chắn không gian ➔ không thể phản ứng với tất cả
các nhóm silanol ➔ còn nhiều nhóm silanol tự do
• End-capping (dùng trimethyl clorosilan): giảm thiểu các nhóm
silanol tự do ➔ giảm các tương tác phân cực (amin, acid…) SẮC KÝ PHA ĐẢO PHA TĨNH SẮC KÝ PHA ĐẢO PHA TĨNH
• Pha tĩnh dựa trên silica thường sử dụng với pha động có pH
trong khoảng 2 – 8. Nếu pha động có tính acid / base mạnh ➔ silica dễ bị phân hủy
• Pha tĩnh dựa trên các hạt polyme hữu cơ như polystyren –
divinylbenzen (PS-DVB), ổn định trong pha động có pH
khoảng 1 – 13. Pha tĩnh này thường lưu giữ chất phân tích
mạnh hơn so với silica thông thường SẮC KÝ PHA ĐẢO CƠ CHẾ LƯU GIỮ:
• Sự lưu giữ: tương tác không phân cực
– chất tan không phân cực lưu giữ mạnh trên pha tĩnh
– chất tan phân cực lưu giữ yếu hơn và rửa giải sớm hơn
Hydrophobic interactions between C18 (stationary phase) and naproxen
Kích thước phân tử càng lớn thì tương tác càng mạnh
Pha tĩnh C là pha tĩnh kỵ nước nhất ➔ lưu giữ mạnh nhất 18 SẮC KÝ PHA ĐẢO CƠ CHẾ LƯU GIỮ
Sự phân tách dựa trên cơ chế phân bố
• Chất tan phân cực (thân nước) phân bố nhiều trong pha động
(phân cực) và rửa giải khỏi cột với thời gian lưu ngắn
• Chất tan không phân cực (kỵ nước) phân bố nhiều trong pha
tĩnh (không phân cực) và lưu giữ mạnh hơn, thời gian lưu dài
Separation in order of increasing hydrophobicity by RP chromatography SẮC KÝ PHA ĐẢO CƠ CHẾ LƯU GIỮ
• Sự lưu giữ cũng bị ảnh hưởng bởi tính chất không phân cực và
kích thước phân tử của pha tĩnh (C và C ) 18 8
Reversed-phase chromatography with the C
18 and the C8 stationary phase. The
mobile phase is 80% methanol/20% 25 mM KH PO 2 4 (pH 6.0) SẮC KÝ PHA ĐẢO PHA ĐỘNG
• Khả năng hòa tan của dung môi pha động phụ thuộc vào độ
phân cực P′. P’ càng cao, khả năng hòa tan các hợp chất phân cực càng tốt
• Sự rửa giải của dung môi pha động phụ thuộc vào cường độ
rửa giải 𝜀o. 𝜀o càng cao, sự rửa giải càng mạnh Độ phân cực Cường độ rửa giải Cường độ rửa giải Dung môi (P’) Pha đảo (𝜀o (C Pha thuận (𝜀o (SiO )) 1 )) 8 2 SẮC KÝ PHA ĐẢO
PHA ĐỘNG: nước (hoặc dung dịch đệm) + dung môi hữu cơ
phân cực: methanol, acetonitrile hoặc tetrahydrofuran
• Khi tăng tỷ lệ % của dung môi hữu cơ ➔ tăng cường độ rửa
giải của pha động ➔ sự rửa giải càng mạnh (t ngắn) R
Effect of percentage of acetonitrile in the mobile phase SẮC KÝ PHA ĐẢO PHA ĐỘNG
• Cường độ rửa giải của dung môi hữu cơ tăng dần theo thứ tự:
methanol, acetonitrile, tetrahydrofuran
Mobile phases with similar eluting strengths • Pha động: – 62% methanol / H O 2
isoeluotropic: có cường độ rửa – 53% acetonitril / H O
giải bằng nhau, sự lưu giữ trung 2
– 40% tetrahydrofuran / H O bình của các chất là như nhau 2 SẮC KÝ PHA ĐẢO PHA ĐỘNG
• Tuy nhiên, khi thay đổi hệ pha động, thứ tự rửa giải giữa các
chất có thể thay đổi vì hệ số chọn lọc của 3 hệ là khác nhau
Illustration of solvent selectivity in RP chromatography SẮC KÝ PHA ĐẢO PHA ĐỘNG
• Methanol rẻ hơn và ít độc hơn acetonitril ➔ ưu tiên sử dụng
• Tuy nhiên, hỗn hợp methanol - nước có độ nhớt cao hơn hỗn
hợp acetonitrile - nước ➔ áp suất hệ thống cao hơn ➔ thay thế
methanol bằng acetonitrile sẽ làm giảm áp suất của hệ thống Độ nhớt (mPas) % Dung môi hữu cơ SẮC KÝ PHA ĐẢO PHA ĐỘNG
• Đối với detector UV – Vis, ưu tiên đệm phosphat vì hấp thụ UV
thấp. Tuy nhiên, đệm phosphat hòa tan kém trong dung môi
hữu cơ ➔ kết tủa ở nồng độ cao
• Đối với detector MS, ưu tiên dùng đệm dễ bay hơi của các acid
hữu cơ như acid acetic, acid formic và muối amoni của chúng.
Các hệ đệm này cũng có khả năng hòa tan tốt hơn trong dung môi hữu cơ
• Đối với các chất có tính acid / base, sự lưu giữ còn phụ thuộc
pH của pha động ➔ sử dụng hệ đệm SẮC KÝ PHA ĐẢO PHA ĐỘNG Ví dụ:
Separation of acidic drugs (fenoprofen and diclofenac) and basic drugs SẮC KÝ PHA ĐẢO PHA ĐỘNG Ví dụ:
• Imipramine và amitriptyline có tính base và với pha động pH 3,
chủ yếu ở dạng BH+, phân bố chủ yếu trong pha động và thời
gian lưu ngắn, khoảng 2 phút. Khi pH = 10, imipramine và
amitriptyline chủ yếu ở dạng tự do (B), phân bố chủ yếu trong
pha tĩnh và bị lưu giữ mạnh hơn, thời gian lưu dài ~ 4 phút
➔ Dược chất có tính base: khi pH tăng, thời gian lưu tăng
• Fenoprofen và diclofenac có tính acid và với pha động pH 3,
chủ yếu ở dạng acid (HA), phân bố chủ yếu trong pha tĩnh và bị
lưu giữ mạnh, thời gian lưu dài ~ 3,5 phút. Khi pH = 10, chủ
yếu ở dạng A–, phân bố chủ yếu trong pha động, thời gian lưu ngắn ~ 1,5 phút
➔ Dược chất có tính acid: khi pH tăng, thời gian lưu giảm SẮC KÝ CẶP ION
Trong sắc ký pha đảo, các chất rất phân cực rửa giải trong phần
đầu tiên của sắc ký đồ, gần với thời gian chết (t ) M ➔ độ tin cậy
của phương pháp không cao
Sắc ký cặp ion: dùng để phân tích các chất rất phân cực
• Pha tĩnh và pha động: tương tự sắc ký pha đảo
• Thêm thuốc thử cặp ion: phần ion tương tác với ion chất phân
tích và phần kỵ nước tương tác với pha tĩnh kỵ nước
Chất phân tích và thuốc thử cặp ion tích điện trái dấu, dẫn đến
tương tác ion (trung hòa về điện) ➔ tăng sự lưu giữ
Yêu cầu: điều chỉnh pH pha động cho phù hợp ➔ ion hóa chất phân tích SẮC KÝ CẶP ION
Các thuốc thử cặp ion điển hình gồm: natri octanesulfonat, acid
heptafluorobutyric và tetrabutylamoni hydro sulfat
• Octanesulfonat và acid heptafluorobutyric tích điện âm ➔ tạo
cặp ion với các thuốc base (BH+)
• Tetrabutylammoni hydro sulfat (amoni bậc bốn) tích điện
dương và tạo cặp ion với các thuốc acid tích điện âm (A–)
Structures of (sodium) octanesulfonate, heptafluorobutyrate
(heptafluorobutyric acid), and tetrabutylammonium (hydrogen sulfate) SẮC KÝ CẶP ION Comparison of RP Không có thuốc thử chromatography and ion- cặp ion trong pha pair chromatography. động (Sắc ký pha đảo)
The stationary phase is C in 18 both experiments. The
mobile phase in the upper chromatogram is 30%
methanol mixed with 70% acetate buffer pH 3.5.
The mobile phase in the
lower chromatogram is 45% Octanesulfonate 65
methanol mixed with 55% mM trong pha động acetate buffer pH 3.5 (Sắc ký cặp ion) containing 65 mM octanesulfonate SẮC KÝ CẶP ION
Sự lưu giữ các chất tăng lên khi thay đổi hệ pha động:
• Giảm nồng độ dung môi hữu cơ (tương tự sắc ký pha đảo)
• Tăng kích thước phân tử của thuốc thử cặp ion. Ví dụ:
– octanesulfonat (C ) lưu giữ base mạnh hơn pentanesulfonat 8 (C ) 5
– tetrabutylamoni hydro sulfat (C ) lưu giữ acid mạnh hơn 16
tetramethylamoni hydro sulfat (C ) 4
• Tăng nồng độ của thuốc thử cặp ion (khuyến cáo 1–5 mM) SẮC KÝ CẶP ION
Một số lưu ý trong thực nghiệm:
• Methanol được ưu tiên làm dung môi hữu cơ trong pha động vì
hòa tan tốt thuốc thử cặp ion
• Pha động có thuốc thử cặp ion có khuynh hướng sủi bọt (lọc
chân không để loại bọt khí)
• Cân bằng cột với pha động tốn nhiều thời gian hơn so với sắc ký pha đảo
• Duy trì tốc độ dòng trong hệ thống (ví dụ 0,1 mL / phút) thay vì
tắt bơm khi chạy qua đêm (tránh kết tủa thuốc thử cặp ion)
• Kiểm soát nhiệt độ cột (sắc ký cặp ion nhạy cảm với sự thay đổi nhiệt độ) SẮC KÝ PHA THUẬN Sắc ký pha thuận (NP)
• Pha tĩnh rắn: rất phân cực
• Pha động lỏng: không phân cực hoặc ít phân cực hơn pha tĩnh
• Cơ chế lưu giữ: sắc ký hấp phụ
• Áp dụng: chất phân tích rất kỵ nước hoặc rất thân nước
• Sắc ký pha thuận sử dụng nhiều dung môi hữu cơ độc hại ➔
hạn chế sử dụng trong thực nghiệm Silica và pha tĩnh
• Pha tĩnh điển hình: silica tinh khiết
• Các chất kém phân cực không có ái lực với silica thì không bị
lưu giữ ➔ đi qua cột với tốc độ tương đương pha động
• Các chất có nhóm phân cực có ái lực cao hơn với silica, bị lưu
giữ trong hệ thống do cơ chế hấp phụ SẮC KÝ PHA THUẬN Silica và pha tĩnh
• Bề mặt silica được bao phủ bởi các nhóm silanol (—Si—OH),
tạo nên đặc tính hấp phụ mạnh của silica
• Một số silanol tương tác liên kết hydro với các silanol gần đó
(bắc cầu) trong khi các silanol khác bị cô lập (tính acid đơn lẻ)
• Trong một số trường hợp, hai silanol được gắn vào cùng một
nguyên tử Si (silanol ghép đôi) Bắc cầu Ngậm nước Tính acid đơn lẻ Ion kim loại bề mặt Kim loại hoạt động Ghép đôi SẮC KÝ PHA THUẬN Silica và pha tĩnh
• Các nhóm silanol khác nhau có các đặc tính hấp phụ khác
nhau. Để khử hoạt tính của các nhóm silanol hoạt động mạnh, ta có thể:
èdùng một lượng nhỏ H O hoặc dung môi phân cực khác 2
èhoặc thêm một lượng nhỏ amin hoặc acid vào pha động
• Để thay đổi độ chọn lọc (thay đổi thứ tự rửa giải), các silanol
trên silica có thể được tạo dẫn xuất với các phối tử có chứa
các nhóm phân cực khác như diol, —CN và —NH2
Ví dụ: nhôm silicat và magnesi silicat SẮC KÝ PHA THUẬN
Tương tác phân tử và sự lưu giữ
Chủ yếu là tương tác phân cực bao gồm: tương tác lưỡng cực,
tương tác liên kết hydro và tương tác ion
• Tương tác lưỡng cực: là tương tác của các chất có các nhóm
chức với mômen lưỡng cực cố định, nhóm nitril hoặc nitro tham
gia vào tương tác lưỡng cực mạnh nhất
Ví dụ: CN > NO > C = O, CHO > COOR > halogen > OH > 2 COOH > —O— > NH2
• Tương tác liên kết hydro: là tương tác giữa nguyên tử cho và
nguyên tử nhận liên kết hydro. Chất cho liên kết hydro là acid
và chất nhận liên kết hydro là base thì tương tác càng mạnh
Ví dụ: acid carboxylic và phenol là chất cho liên kết hydro
mạnh và amin là chất nhận liên kết hydro mạnh
Silanol có cả thuộc tính cho và nhận liên kết hydro SẮC KÝ PHA THUẬN
Tương tác phân tử và sự lưu giữ
• Tương tác ion: xảy ra giữa các chất có tính base và các nhóm
silanol có tính acid, tương tác này là không mong muốn vì làm
tăng khả năng lưu giữ rất mạnh ➔ khử các silanol hoạt động mạnh
• Các chất có nhiều nhóm phân cực sẽ dễ bị lưu giữ mạnh, trong
khi các chất ít phân cực hơn sẽ ít bị lưu giữ hơn
NP chromatography of vitamin E variants. The stationary phase is silica. The mobile phase is n- SẮC KÝ PHA THUẬN
Tương tác phân tử và sự lưu giữ
Sự tương tác / lưu giữ tăng lên theo sự phân cực của nhóm chức
• Các hydrocarbon bão hòa không tương tác với silica ➔ không bị lưu giữ
• Các hydrocarbon thơm tương tác yếu ➔ bị lưu giữ một chút
• Alcol và phenol có độ phân cực cao hơn ceton, đều có tương
tác liên kết hydro với silica ➔ lưu giữ mạnh hơn
• Amin bậc một (tính base) nhận liên kết hydro mạnh và acid
carboxylic cho liên kết hydro mạnh ➔ silica lưu giữ rất mạnh
Khả năng lưu giữ tăng lên theo số lượng các nhóm chức. Chất có
2 nhóm hydroxyl lưu giữ mạnh hơn chất chỉ có 1 nhóm hydroxyl SẮC KÝ PHA THUẬN
Tương tác phân tử và sự lưu giữ Tương tác với silica Sự lưu giữ
Contribution of different functional groups to interaction and retention with silica SẮC KÝ PHA THUẬN
Pha động: hỗn hợp của n-heptan và ethyl acetat hoặc propanol.
Thành phần phân cực (ethyl acetat hoặc propanol) tăng sự cạnh
tranh các vị trí hấp phụ trên bề mặt silica ➔ giảm sự tương tác
của các chất với silica ➔ giảm khả năng lưu giữ của pha tĩnh
• Cường độ của pha động là do độ phân cực P’ của dung môi, có
thể được xếp hạng theo cường độ rửa giải 𝜀∘ (SiO ) 2 Độ phân cực Cường độ rửa giải Cường độ rửa giải Dung môi (P’) Pha đảo (𝜀o (C Pha thuận (𝜀o (SiO )) 1 )) 8 2 SẮC KÝ RÂY PHÂN TỬ
Sắc ký rây phân tử (SEC): là kỹ thuật sắc ký dùng để tách các
chất hữu cơ có độ phân cực thấp, theo kích thước phân tử của chúng
Pha tĩnh: là các hạt polyme cực nhỏ (hạt gel) được thiết kế có
các lỗ xốp với kích thước khác nhau
• Hạt gel mềm được làm từ polysaccharid như dextran,
polyacrylamid hoặc polystyren. Gel mềm được sử dụng với
dòng trọng lực (pha động chảy qua cột do trọng lực)
• Hạt gel cứng chịu được áp suất cao và làm bằng silica (nước
làm pha động) hoặc polyme hữu cơ có nhiều liên kết chéo như
polystyren – divinylbenzen (dung môi hữu cơ làm pha động) Pha động:
• Nước ➔ Sắc ký lọc trên gel
• Dung môi hữu cơ ➔ Sắc ký thấm qua gel (GPC) SẮC KÝ RÂY PHÂN TỬ
Các phân tử khác nhau thâm nhập theo cách khác nhau vào các lỗ xốp của gel
• Các phân tử lớn không đi vào các lỗ xốp của gel và di chuyển cùng vận tốc pha động
Thể tích pha động mang các phân tử lớn đi qua cột gọi là thể
tích loại trừ V = thể tích pha động giữa các hạt gel trong cột 0
• Các phân tử nhỏ nhất được pha động dẫn vào các lỗ xốp nhỏ nhất của hạt gel
Thể tích pha động để rửa giải các chất nhỏ nhất gọi là thể tích thấm tổng VM
• Do đó, các chất có trong mẫu được tách ra theo thứ tự giảm
dần kích thước phân tử
SẮC KÝ RÂY PHÂN TỬ Phân tử nhỏ Phân tử lớn
Principle of size exclusion chromatography SẮC KÝ RÂY PHÂN TỬ
Kích thước lỗ xốp trên các hạt pha tĩnh (hạt gel) phải được lựa
chọn phù hợp với các phân tử nghiên cứu
Ví dụ: Tách các protein từ 30 – 200 kDa
Các protein > 200 kDa được rửa giải với thể tích loại trừ V0
Các chất < 30 kDa rửa giải cùng nhau với thể tích thấm tổng VM
SEC separation of thyroglobulin (660 kDa), IgG (150 kDa), BSA (66.5 kDa), myoglobin (17 kDa),
and uracil (0.1 kDa). The stationary phase is termed Sepax Unix SEC-300. The mobile phase is
0.2 M dibasic sodium phosphate, pH 7 with phosphoric acid SẮC KÝ ĐỐI QUANG
Các đồng phân đối quang có tính chất hóa lý giống hệt nhau
➔ không thể phân tách bằng các kỹ thuật sắc ký thông thường Sắc ký đối quang:
• Cách tiếp cận gián tiếp: dùng tác nhân đối quang để tạo dẫn
xuất không đối quang, được thực hiện trước quá trình sắc ký
• Cách tiếp cận trực tiếp: dùng pha tĩnh hoặc pha động không đối quang
Pha tĩnh gồm các hạt polyme (silica, cellulose hoặc
methacrylat) có bề mặt được tạo dẫn xuất với các nhóm chức
không đối quang (protein, polysaccharid, cyclodextrin, kháng
sinh và methacrylat dạng xoắn) SẮC KÝ ĐỐI QUANG
Separation of L- and D-epinephrine using a chiral stationary phase. The stationary phase is
termed Shodex ORpak CDBS-453. The mobile phase is acetonitrile with 0.05% (w/v) acetic
acid/0.2 M sodium chloride in water 5 : 95 (v/v)
SẮC KÝ LỎNG SIÊU TỚI HẠN
Sắc ký lỏng siêu tới hạn (SFC)
• Pha động: là chất lỏng siêu tới hạn. Phổ biến là CO siêu tới 2
hạn (ở nhiệt độ ≥ 31,3 oC và áp suất ≥ 73,9 atm) Chất lỏng siêu tới hạn ) Điểm tới Rắn Lỏng tm hạn t (a ấ su p Á Khí Điểm ba Nhiệt độ (oC)
SẮC KÝ LỎNG SIÊU TỚI HẠN
• Nhiệt độ cột: được kiểm soát bằng lò cột như GC (đảm bảo
nhiệt độ cột > nhiệt độ tới hạn)
• Áp suất: đạt được bằng cách đặt một ống mao dẫn hẹp ở cuối
cột sắc ký (bộ hạn chế). Khi chất lỏng siêu tới hạn rời khỏi bộ
hạn chế, chuyển thành khí chứa chất tan và dễ dàng phát hiện bằng detector Ưu điểm của SFC:
• Tách các chất phân tích không bay hơi như LC (vì khả năng
hòa tan tốt của chất lỏng siêu tới hạn)
• Tốc độ rửa giải và độ phân giải cao hơn so với LC (vì hệ số
khuếch tán trong chất lỏng siêu tới hạn cao hơn)
• Tăng cường độ rửa giải bằng cách:
➔tăng tỷ trọng của chất lỏng siêu tới hạn (tăng dần áp suất)
➔hoặc thêm dung môi hữu cơ vào pha động như methanol
SẮC KÝ LỎNG SIÊU TỚI HẠN
Cấu tạo của máy SFC bao gồm:
• Hệ thống bơm CO vào cột ở áp suất cao hơn áp suất tới hạn 2
• Bộ tiêm mẫu thường được thực hiện bởi một vòng lặp tương tự như trong LC
• Cột sắc ký có thể là cột mao quản giống như GC hoặc cột nhồi giống như LC
• Detector: thường là detector ion hóa ngọn lửa (FID), detector UV hoặc khối phổ
SFC là một phương pháp chính thức trong EP, nhưng không được sử dụng nhiều