



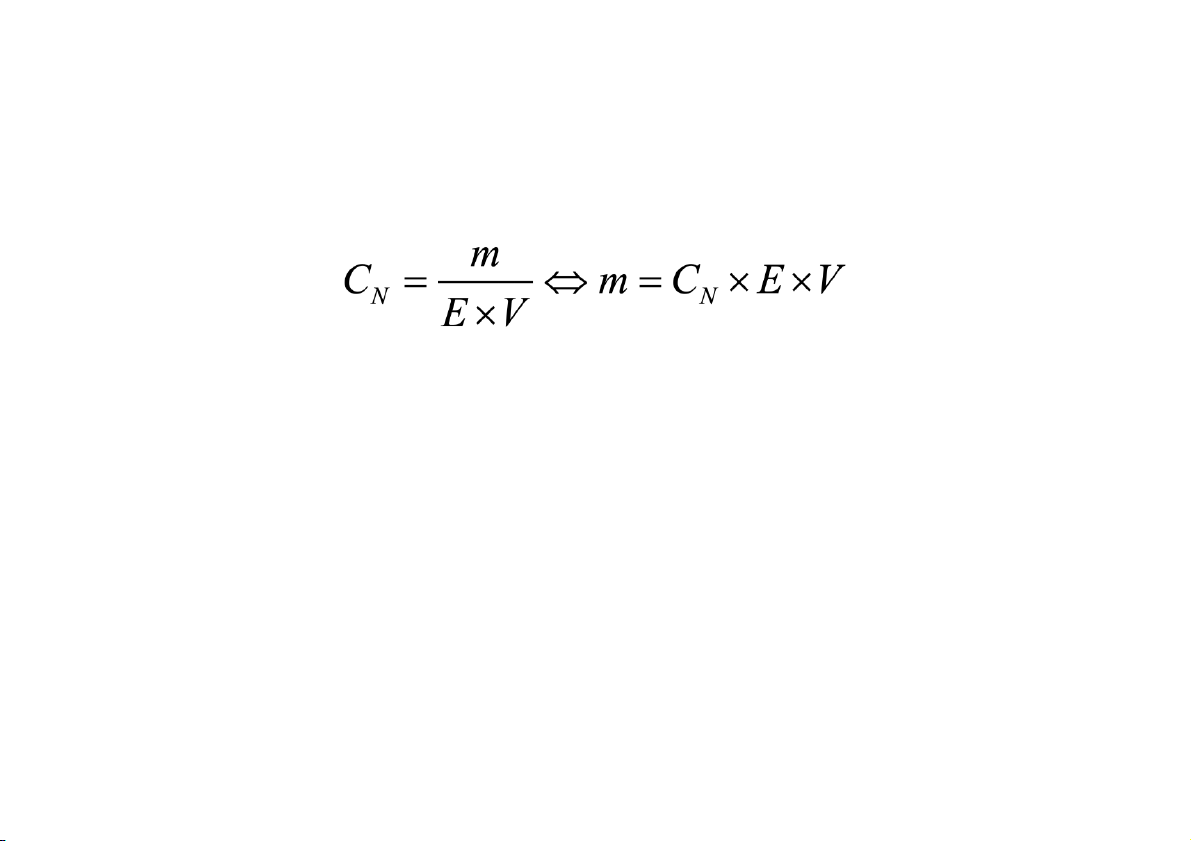
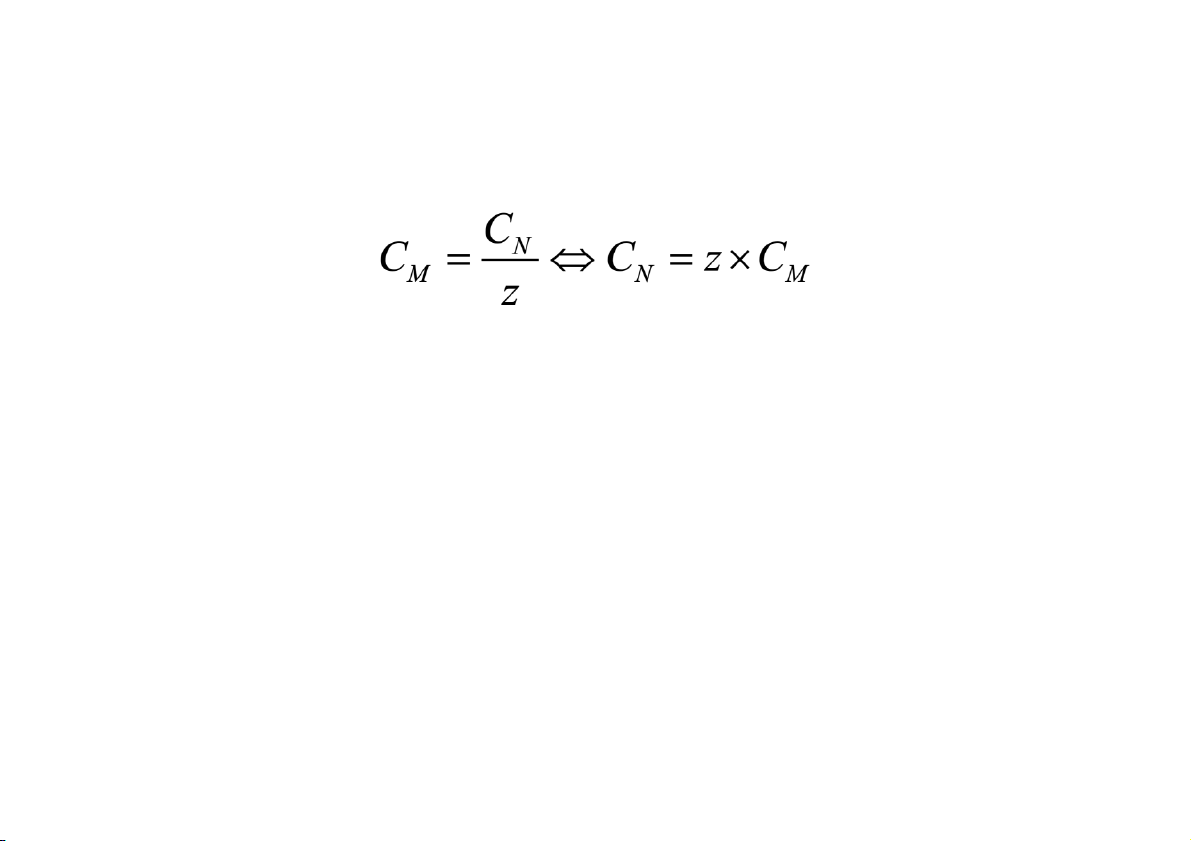





















Preview text:
NỒNG ĐỘ DUNG DỊCH
Ths. DS. VÕ SỸ NHẬT MỤC TIÊU BÀI HỌC
1. Trình bày được các cách biểu thị nồng độ và giải các bài
toán về nồng độ dung dịch
– Nồng độ phân tử
– Nồng độ phần trăm
– Nồng độ đương lượng
– Nồng độ phần triệu
– Nồng độ phần tỷ
2. Trình bày được các đặc điểm và biết cách sử dụng các
dụng cụ, thiết bị dùng để pha chế dung dịch NỒNG ĐỘ DUNG DỊCH
Dung dịch là hỗn hợp đồng nhất của hai hay nhiều chất, gồm có:
• Chất tan: là các chất hòa tan trong dung dịch (chất phân tích)
• Dung môi: là chất lỏng trong dung dịch (phổ biến là nước)
Nồng độ: là một đơn vị đo lường chung, biểu thị lượng chất tan
có trong một lượng dung dịch xác định NỒNG ĐỘ DUNG DỊCH
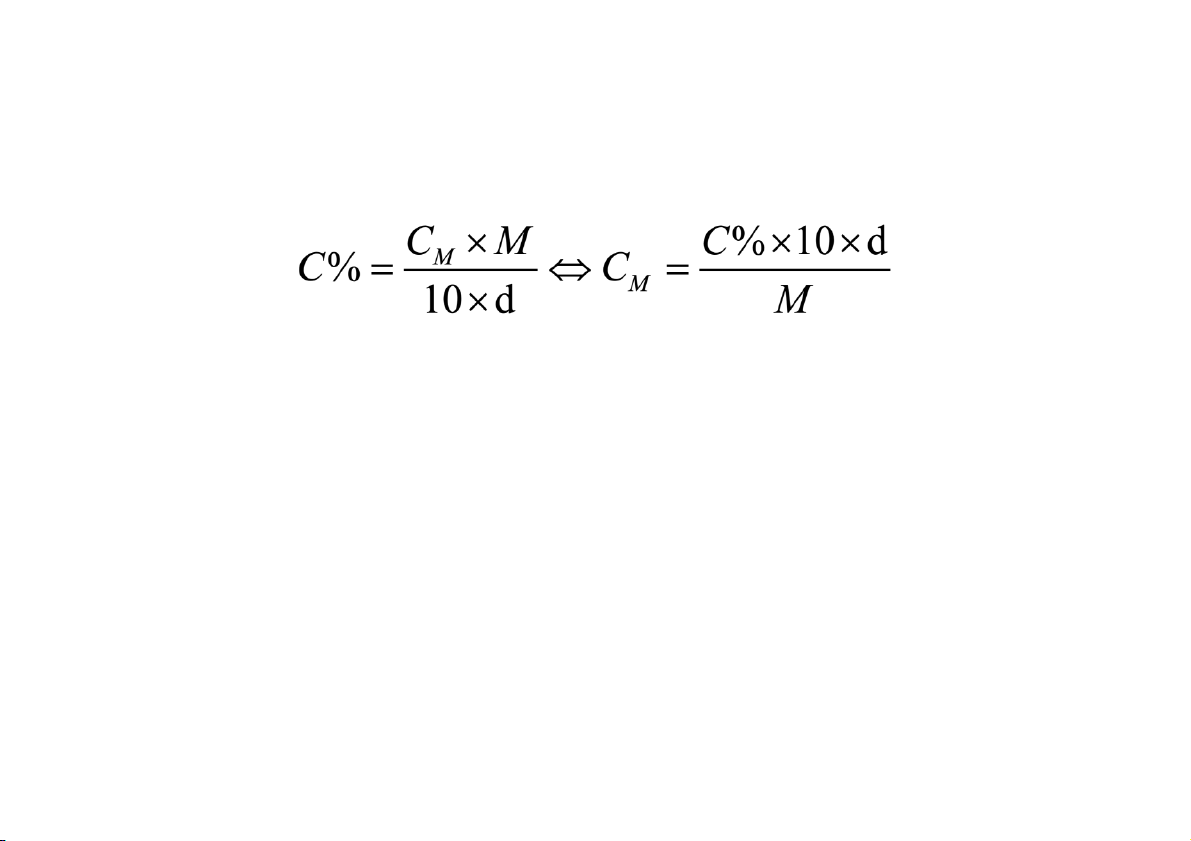
Nồng độ phân tử (nồng độ mol): biểu thị số mol chất tan có trong 1 lít dung dịch
CM: nồng độ phân tử (mol/L) V: thể tích dung dịch (L)
Ứng dụng: biểu thị nồng độ của thuốc thử trong dung dịch, ví dụ
dung dịch NaOH, HCl, KHP... dùng trong chuẩn độ thể tích
Ví dụ: 0,4 g NaOH (KLPT = 40) được hòa tan trong nước và điều
chỉnh thể tích đến 100,0 mL. Nồng độ mol của NaOH là: NỒNG ĐỘ DUNG DỊCH
Nồng độ phân tử (nồng độ mol)
Khi nồng độ mol quá nhỏ ➔ nồng độ mol được tính theo milimol
(mM), micromol (μM) hoặc nanomol (nM)
Ví dụ: Chuyển đổi nồng độ mol từ M sang mM
Nồng độ của paracetamol trong dung dịch là 1,6 × 10−2 M tương ứng với: mM
Chuyển đổi nồng độ từ mg / mL sang M
Ví dụ: Nồng độ của paracetamol trong dung dịch là 0,0125 mg /
mL (KLPT = 151,2 g / mol). Nồng độ mol được tính như sau: NỒNG ĐỘ DUNG DỊCH
Nồng độ phần trăm theo khối lượng: biểu thị số gam chất tan có trong 100 g dung dịch
Ứng dụng: biểu thị hàm lượng của API trong dược phẩm rắn
hoặc bán rắn (ví dụ như thuốc mỡ, kem bôi da)
Ví dụ: Tính hàm lượng hoạt chất có trong thuốc mỡ tra mắt tetracyclin 1 % (tuýp 5g) NỒNG ĐỘ DUNG DỊCH
Nồng độ phần trăm theo thể tích:
Ứng dụng: trộn lẫn các dung môi với nhau Ví dụ:
• methanol - nước (tỷ lệ 70:30) làm pha động cho HPLC
• cồn 70% để sát khuẩn NỒNG ĐỘ DUNG DỊCH
Nồng độ phần trăm khối lượng theo thể tích: biểu thị số gam
chất tan có trong 100 ml dung dịch
Dung dịch có nồng độ 1% (kl / tt) chứa 1 g / 100 mL
Ứng dụng: biểu thị hàm lượng của API trong dược phẩm lỏng (ví
dụ như thuốc tiêm, thuốc nhỏ mắt) Ví dụ:
Tính hàm lượng hoạt chất trong chai TNM NaCl 0,9 % (V = 10 ml)
Tính hàm lượng hoạt chất trong chai glucose 5 % (V = 500 ml) NỒNG ĐỘ DUNG DỊCH
Mối liên hệ giữa nồng độ % và nồng độ mol
Ví dụ: Tính nồng độ phần trăm của dung dịch NaOH 2 M (d=1,02) biết MNaOH = 40
Ví dụ: Tính nồng độ mol của dung dịch HCl 3,65% (kl/tt), biết MHCl = 36,5 (d = 1) NỒNG ĐỘ DUNG DỊCH Đương lượng gam Ký hiệu E (g) M: khối lượng phân tử
z: được tính tùy vào bản chất của phản ứng hóa học NỒNG ĐỘ DUNG DỊCH Đương lượng gam Phản ứng acid - base
• Đối với acid: z là số proton hoạt tính của acid
• Đối với base: z là số proton cần thiết để trung hòa nó
Ví dụ: HCl + NaOH = NaCl + H2O EHCl = ; ENaOH = H2SO4 + 2NaOH = Na2SO4 + 2H2O EH2SO4 = ; ENaOH = NỒNG ĐỘ DUNG DỊCH Đương lượng gam Phản ứng oxy hóa - khử
• z là số electron cho hay nhận trong phản ứng Ví dụ: MnO - 2+ + 4 + 5Fe + 8H → 5Fe3+ + Mn2+ + 4H2O NỒNG ĐỘ DUNG DỊCH Đương lượng gam
Phản ứng tạo tủa và phức chất
• Đối với cation: z là điện tích của cation đó
• Đối với anion: số đương lượng của ion kim loại tương ứng để
tạo tủa hoặc phức chất Ví dụ: 3Ag+ + PO 3- 4 → Ag3PO4↓ Ag+ + 2CN- → Ag(CN) - 2 NỒNG ĐỘ DUNG DỊCH
Nồng độ đương lượng (CN): biểu thị số đương lượng gam của
chất tan có trong 1 lít dung dịch
Ví dụ: Xác định nồng độ đương lượng của dung dịch H2SO4 9,8%
(kl/tt) biết đương lượng gam E của H2SO4 = 49
Ví dụ: Tính lượng muối Na2CO3 có độ tinh khiết 86% cần dùng để
pha 500 ml dung dịch Na2CO3 có nồng độ 0,1 N, biết đương
lượng gam E𝑁𝑎2𝐶𝑂3 = 53 NỒNG ĐỘ DUNG DỊCH
Mối quan hệ giữa nồng độ đương lượng và nồng độ mol
Ví dụ: 2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH (có một nhóm OH– được trung hòa bằng 1 proton)
➔ nồng độ đương lượng của dung dịch NaOH là: CN =
H2SO4 (có số proton hoạt tính là 2)
➔ nồng độ đương lượng của dung dịch H2SO4 là: CN = NỒNG ĐỘ DUNG DỊCH
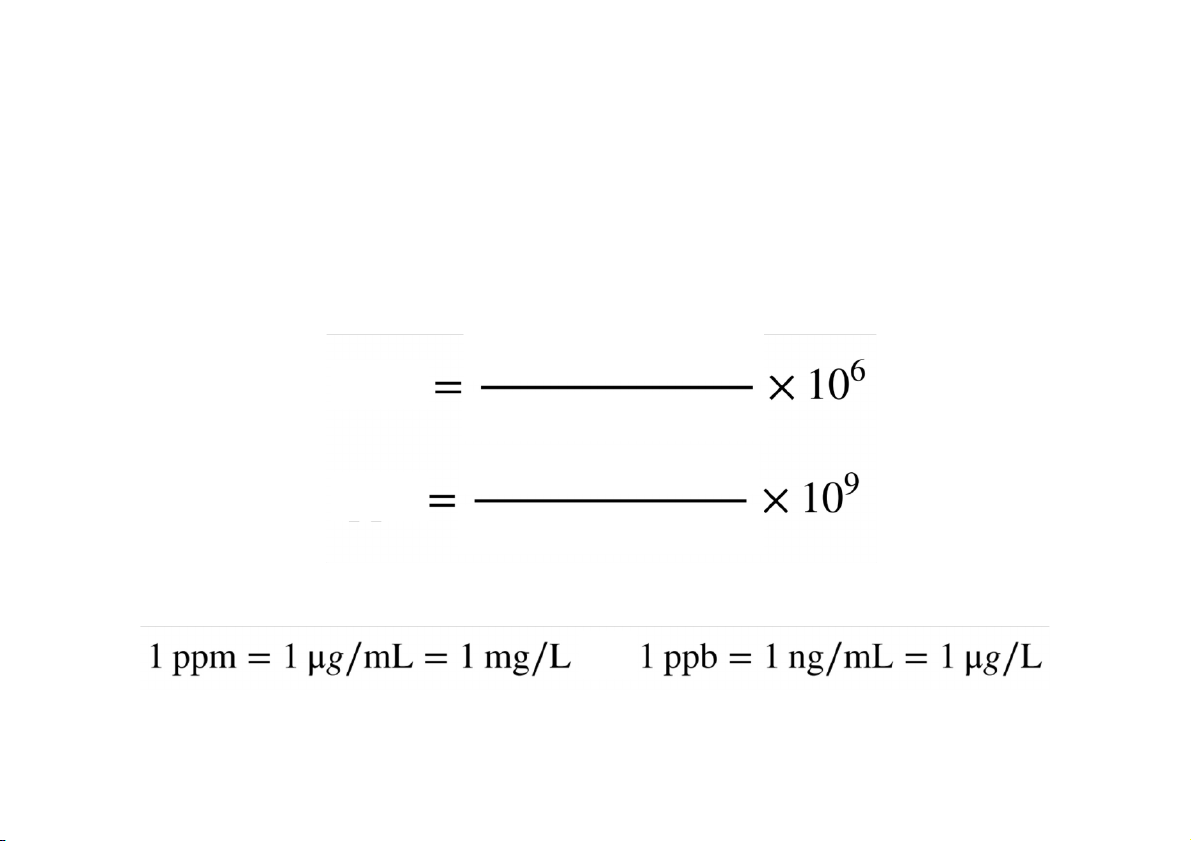
Nồng độ phần triệu (ppm) và nồng độ phần tỷ (ppb): thường
sử dụng khi nồng độ của chất tan cực nhỏ
• tạp chất kim loại nặng trong nguyên liệu và dược liệu
• dược chất trong dịch sinh học khối lượng chất tan ppm khối lượng mẫu thử khối lượng chất tan ppb khối lượng mẫu thử
Vì lượng chất tan cực nhỏ so với nước ➔ ddd = dH2O = 1 g / mL và NỒNG ĐỘ DUNG DỊCH
Nồng độ phần triệu và nồng độ phần tỷ
Ví dụ: Hòa tan 0,4001 g Pb(NO3)2 trong dd HNO3 loãng, điều
chỉnh thể tích đến 250,0 mL. Dung dịch này sau đó được pha
loãng 100 lần bằng dd HNO3 loãng. Tính nồng độ của Pb (ppm)
trong dung dịch cuối cùng?
Cho biết MPb(NO3)2 = 331,2; MPb = 207,2 g / mol và ddd = 1 g / mL 0,4001 g Pb(NO3)2 có: g Pb
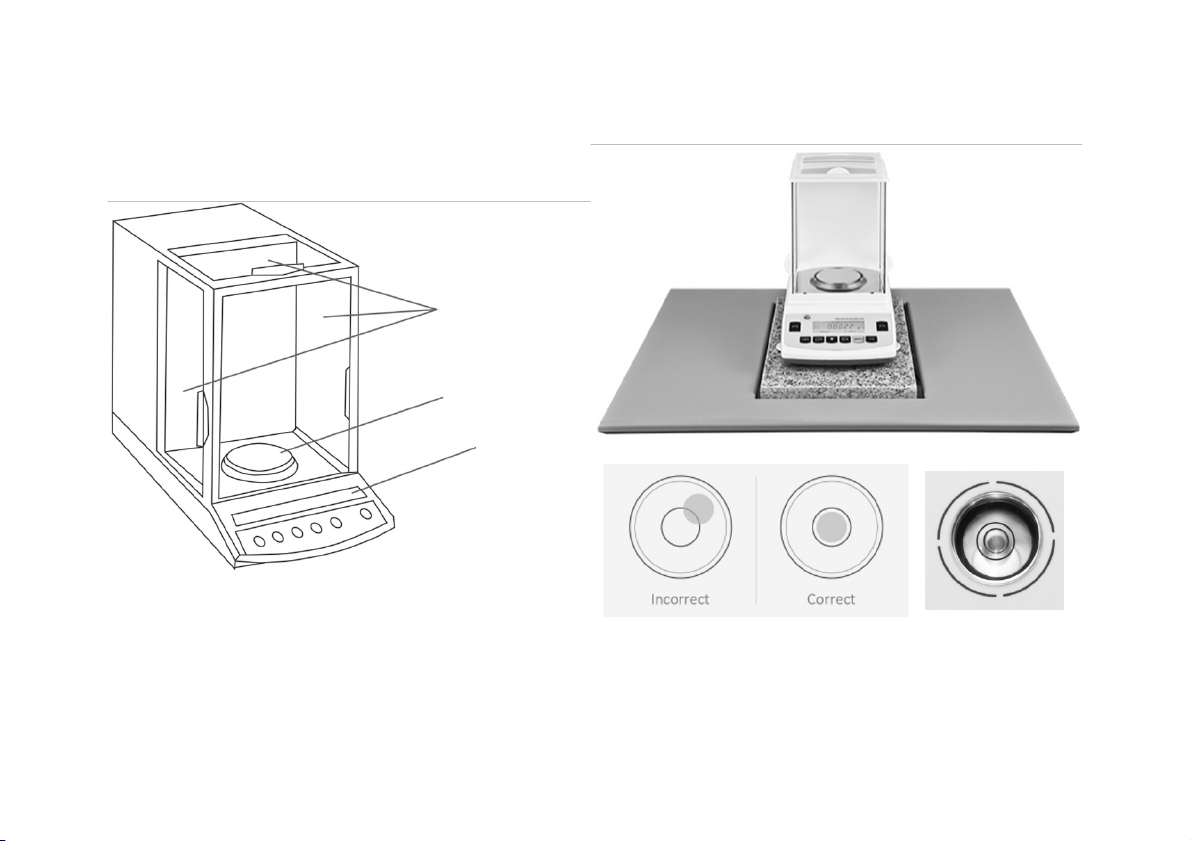
Hàm lượng Pb trong dung dịch pha loãng cuối cùng là: CÂN PHÂN TÍCH Cân phân tích Cửa kính Đĩa cân Màn hình điện tử Analytical balance
• Giảm rung động và đảm bảo số đọc ổn định bằng cách đặt cân
trên bàn cứng (đá cẩm thạch)
• Đảm bảo cân thăng bằng bằng cách điều chỉnh các chân đế để
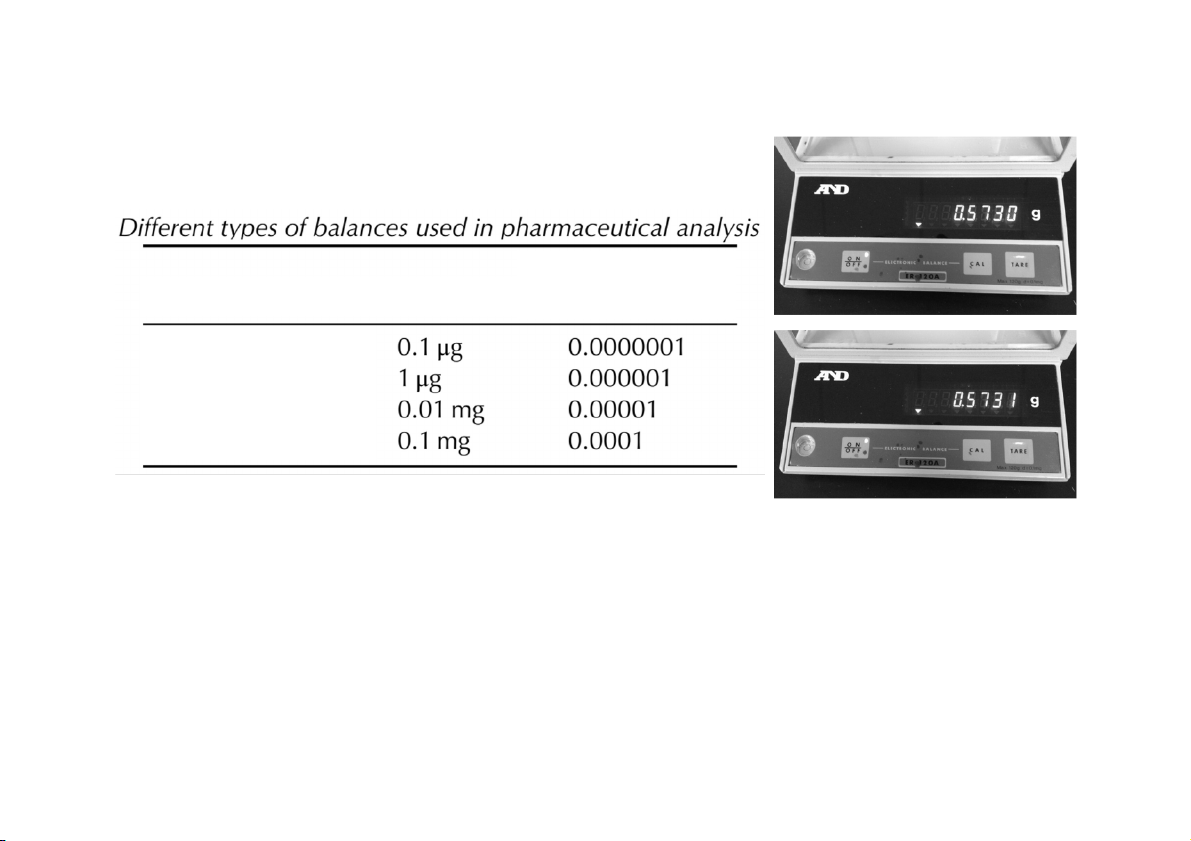
bọt khí ở giữa tâm vòng tròn CÂN PHÂN TÍCH Số lượng chữ số Tên cân Khả năng đọc thập phân (g) Cân siêu vi lượng Cân vi lượng Cân bán vi lượng Cân phân tích
• Khả năng đọc là khối lượng gia tăng nhỏ nhất có thể đo được,
cân phân tích 4 số lẻ có khả năng đọc là 0,1 mg
• Giới hạn trọng tải: là trọng tải tối đa của cân, cân phân tích có
khả năng cân khoảng 100 – 200 g
CÂN PHÂN TÍCH – QUY TRÌNH CÂN
• Đặt bì có kích thước phù hợp lên đĩa cân
• Đổ chất hoặc mẫu cần cân lên bì
• Ghi lại khối lượng trên màn hình điện tử (m1)
• Đổ hết mẫu vào bình chứa
• Đặt bì lên cân một lần nữa, đọc số cân (m2)
• Khối lượng mẫu = m1 – m2
• Làm sạch cân sau khi sử dụng
CÂN PHÂN TÍCH – HƯỚNG DẪN SỬ DỤNG
CÂN PHÂN TÍCH – MỘT SỐ LƯU Ý
• Không đặt trực tiếp mẫu lên đĩa cân
• Đảm bảo bì được đặt chính giữa đĩa cân
• Nhiệt độ mẫu ~ nhiệt độ phòng
• Trước khi đọc khối lượng: đóng các cửa kính bảo vệ và đợi cân ổn định vài giây
• Cân phải được kiểm tra hàng ngày và hiệu chuẩn định kỳ PIPET – PHÂN LOẠI
Pipet: dùng để cung cấp thể tích chính xác của một chất lỏng
• Pipet chính xác có bầu được sử dụng để cung cấp một thể
tích cụ thể, ví dụ như 5,00 mL hoặc 10,00 mL
• Pipet chia độ được sử dụng để cung cấp các thể tích thay đổi
trong một phạm vi xác định, ví dụ như 8,4 mL PIPET Dung tích Sai số cho Sai số tương (mL) phép (mL) đối (%)
Pipet chính xác loại A là loại tốt nhất
và được khuyến nghị cho các phép thử định lượng PIPET – CÁCH SỬ DỤNG
• Đặt đầu pipet vào dung dịch
• Dùng quả bóp cao su để hút chất lỏng đến cao hơn vạch của
thể tích mong muốn (không dùng miệng để hút chất lỏng)
• Lấy pipet ra khỏi dung dịch và dùng khăn giấy loại bỏ dung dịch
thừa bám trên mặt ngoài của pipet PIPET – CÁCH SỬ DỤNG
• Giữ pipet thẳng đứng và đầu pipet chạm vào thành cốc thải
• Xả chất lỏng đến khi mặt khum vừa chạm đến vạch chuẩn Vị trí đúng c a ủ m t ặ lõm là ngay t i ạ vạch chu n ẩ
Correct position of the meniscus at the calibration mark PIPET – CÁCH SỬ DỤNG
• Giữ pipet thẳng đứng và đặt đầu pipet chạm vào thành của
bình nhận, cho chất lỏng chảy chậm và dọc theo thành bình
• Khi thấy toàn bộ chất lỏng đã chảy ra, giữ pipet trong vài giây
Lưu ý: đầu pipet sẽ vẫn còn một giọt chất lỏng nhưng không được thổi ra
PIPET – HƯỚNG DẪN SỬ DỤNG BÌNH ĐỊNH MỨC Bình định mức
• dùng để pha dung dịch có nồng độ chính xác
• có cổ hẹp và vạch chuẩn cho biết dung môi cần được đổ đầy đến mức nào
• được chế tạo cho một thể tích cụ thể ở một nhiệt độ cụ thể (thường là 20 oC) vạch chuẩn Volumetric flask BÌNH ĐỊNH MỨC
Các bước pha dung dịch với bình định mức:
• Chuyển chất tan vào bình định mức
– chất rắn được cân bằng cân phân tích
– hoặc chất lỏng được phân phối bằng pipet
• Thêm dung môi khoảng 2/3 thể tích bình
• Lắc cơ học hoặc siêu âm để hòa tan hoàn toàn
• Thêm dung môi đến vạch chuẩn và lắc đều
BÌNH ĐỊNH MỨC – HƯỚNG DẪN SỬ DỤNG BURET
• là ống thủy tinh dài có khóa ở đầu dưới
• dọc theo thành ống có vạch chia độ (thang đo ml)
• dùng trong phương pháp chuẩn độ thể tích
Lưu ý: khi đọc thể tích, mắt phải ở cùng độ cao với đỉnh chất lỏng Buret Dung dịch chuẩn độ Khóa
BURET – QUY TRÌNH CHUẨN ĐỘ
• Nạp dung dịch chuẩn độ lên buret, chỉnh thể tích về 0,00 mL
• Mở khóa buret cho dung dịch chuẩn độ chảy từng giọt vào mẫu
• Gần đến điểm kết thúc, giảm tốc độ bằng cách chỉnh khóa
• Tại điểm kết thúc, đọc thể tích của dung dịch chuẩn độ
Lưu ý: bọt khí có thể nằm ngay dưới khóa ➔ loại bỏ bọt khí này
trước khi chuẩn độ bằng cách mở khóa hoàn toàn
Khi dùng buret 25 mL với sai số cho phép 0,03 mL, thể tích đọc
được là 15,08 mL thì giá trị thực từ 15,05 – 15,11 mL
BURET – HƯỚNG DẪN SỬ DỤNG
PHA DUNG DỊCH VÀ PHA LOÃNG DUNG DỊCH
Các bước pha dung dịch có nồng độ chính xác:
• Cân chính xác chất tan trên cân phân tích rồi chuyển chất tan sang bình định mức
• Rửa bì bằng dung môi và xả trực tiếp vào bình định mức
• Thêm dung môi đến khoảng 2/3 bình định mức
• Lắc cơ học hoặc siêu âm để hòa tan hoàn toàn
• Để dung môi không đổ tràn lên trên vạch chuẩn, khi gần về
cuối, thêm dung môi cẩn thận bằng pipet pasteur (ống nhỏ giọt)
PHA DUNG DỊCH VÀ PHA LOÃNG DUNG DỊCH
Mục đích của pha loãng: thu được dung dịch có nồng độ rất nhỏ với độ chính xác cao
Ví dụ: Pha dung dịch có nồng độ 1 mg / L
• 1 mg rất nhỏ: rất khó cân và không chính xác
• 1 L dung môi khá lớn: pha chế không thuận tiện và chi phí cao
• Thực tế: pha dung dịch gốc (dung dịch nồng độ cao), sau đó
pha loãng dung dịch này đến nồng độ thấp hơn
Cân 50,0 mg chất tan và hòa tan trong dung môi đến 100,0 mL
➔ dung dịch gốc có nồng độ mg / L
Hút 5,0 mL dung dịch gốc và pha loãng đến thể tích 100,0 mL
(pha loãng 20 lần) ➔ nồng độ là mg / L
Hút 2,0 mL dung dịch này và pha loãng đến thể tích 50,0 mL
(pha loãng 25 lần) ➔ nồng độ là mg / L
PHA DUNG DỊCH VÀ PHA LOÃNG DUNG DỊCH
Phương trình pha loãng:
Cchưa pha loãng × Vchưa pha loãng = Cpha loãng × Vpha loãng
Ví dụ: Cần pha loãng dung dịch acid hydroclorid 1,05 M để thu
được 500,0 mL dung dịch HCl có nồng độ 0,01 M Như vậy, hút
mL dung dịch HCl 1,05 M và pha loãng thành
500,0 mL thu được dung dịch có nồng độ là 0,01 M
PHA DUNG DỊCH VÀ PHA LOÃNG DUNG DỊCH
Ví dụ: Hòa tan 50,0 mg paracetamol bằng methanol trong bình
định mức và điều chỉnh thể tích đến 100,0 mL. Hút 1,0 mL dung
dịch này và pha loãng thành 100,0 mL bằng methanol. Tính nồng
độ (μg/mL) của paracetamol trong dung dịch cuối cùng?
Dung dịch gốc paracetamol có nồng độ:
Nồng độ dung dịch paracetamol cuối cùng được tính theo phương trình pha loãng: