





























Preview text:
lOMoAR cPSD| 18638480
ĐÁNH GIÁ: ĐẶC ĐIỂM VÀ ỨNG DỤNG CỦA AMYLASE
Kumari Sweta1, Swati Tyagi2, Anchal Bamal3
Khoa học Đời sống, Viện Nghiên cứu và Thuốc Ứng dụng, Ghaziabab, Uttar Pradesh, Ấn Độ Tóm tắt
Amylase là các enzym thủy phân tinh bột trong thực vật như một nguồn
dự trữ carbohydrate và glycogen ở động vật như một nguồn dự trữ
carbohydrate để giảm lượng đường có thể lên men, chủ yếu là maltose và
hạn chế dextrin. Amylase được phân loại là đường hóa (𝛽- amylase) và
dextrization (𝛼-amylase). Alpha-amylase là các enzym xúc tác quá trình
thủy phân tinh bột thành các oligosaccharid, maltose và glucose. Chúng
phân bố rộng rãi trong các môi trường sống vi sinh vật, thực vật và động
vật. 𝛼-amylase là một trong những enzym thiết yếu nhất và được sử dụng
phổ biến trong nhiều ngành công nghiệp, bao gồm sản xuất si-rô ngô
Fructose cao (HFCS). Mục đích của nghiên cứu này là xem xét các tài liệu
liên quan về sự phân chia và phát triển amylase từ vi khuẩn. Các tài liệu
được xem xét trong bài báo này bao gồm những tài liệu liên quan đến việc
phân lập vi khuẩn sản xuất amylase, quy trình sản xuất và tối ưu hóa, và
các tài liệu khác liên quan chặt chẽ đến chúng và những tài liệu gần đây. 1. GIỚI THIỆU 1.1 Vi sinh vật
Vi sinh vật là nguồn sản xuất enzyme quan trọng nhất. Chọn đúng loài
đóng vai trò quan trọng trong việc tạo ra sản lượng cao của các enzyme
thích hợp cho sử dụng trong công nghiệp. Vi khuẩn, xạ khuẩn, nấm, tảo lOMoAR cPSD| 18638480
và động vật nguyên sinh có thể được xếp vào nhóm vi sinh vật đất. Mỗi
nhóm có những đặc điểm cho đặc trưng và nơi làm việc của chúng. Các
vi sinh vật phổ biến trong đất là vi khuẩn Archea. Enzyme là xúc tác
sinh học có bản chất là đại phân tử. Khi bắt đầu chu trình, các phân tử
gọi là cơ chất, và enzyme biến đổi chúng thành các phân tử khác nhau
gọi là sản phẩm[9]. Định nghĩa về vi sinh vật đã cho phép hiểu biết thực
sự về môi trường vi sinh vật như một môi trường có thể phân tích bằng
cách sử dụng các phương pháp và chiến lược tương tự, mặc dù nó phản
ánh các dạng đơn vị sinh sản và tổ chức khác nhau. Các nhà sinh vật học
bắt đầu hiểu được điểm chung của tất cả các loài vào cuối thế kỷ 20 sau
công trình nghiên cứu của Carl Woese và các nhà tiến hóa phân tử khác,
tất cả đều bao gồm các tế bào có sự tương đồng đáng kể với nhau và có
di sản tiến hóa chung, và do đó có đặc điểm chính của mã di truyền và
sinh học phân tử được chia sẻ rộng rãi. Vi sinh vật học và sinh học nói
chung được thống nhất trong bối cảnh này, như chúng chưa từng có trước đây[86,11]. 1.2 Enzyme
Đối với nhiều người, thuật ngữ enzyme là một cụm từ phổ biến.
Enzyme như được mô tả là các hợp chất sinh học có tác dụng đẩy nhanh
các sinh hóa và phản ứng sinh học. Chức năng của chúng là hoạt động
như những chất hóa học xúc tác giúp đẩy nhanh thời gian của những
phản ứng bên trong và bên ngoài đối với tế bào của một sinh vật[75].
Chất xúc tác sinh học là các enzyme điều chỉnh các phản ứng sinh hóa
khác nhau. Trong những năm gần đây khả năng sử dụng vi sinh vật như
nguồn công nghệ sinh học của các enzym quan trọng trong công nghiệp
đã dấy lên sự quan tâm của nhiều nhà vi sinh vật khám phá enzyme
ngoại bào. Proteases và amylase được coi là các enzyme nổi bật nhất
trong số các enzyme quan trọng trong công nghiệp vì chúng thường lOMoAR cPSD| 18638480
được sử dụng phổ biến trong ngành sản xuất bia, chất tẩy rửa và thực
phẩm[16]. Việc sử dụng enzyme tăng dần lên sau Thế chiến thứ hai do
những tiến bộ trong vi sinh vật học công nghiệp và kỹ thuật sinh
hóa.[26] Đối với một số lĩnh vực khác nhau, chẳng hạn như thịt bò, thức
ăn chăn nuôi, chất tẩy rửa, dệt may, quần áo, thuộc da, cũng như các
ngành công nghiệp dược phẩm, mỹ phẩm và hóa chất, các enzyme hiện
đang được sử dụng trong nhiều ngày. Các ứng dụng công nghiệp chiếm
80% thị trường enzyme toàn cầu[80], Ít nhất 50% các enzyme được bán
ngày nay có nguồn gốc từ GMO, sử dụng thao tác di truyền và thao tác
protein. Enzyme thức ăn được sử dụng phổ biến nhất và vẫn là loại
enzyme chiếm thị phần lớn nhất. Chúng bao gồm các chuỗi axit amin
được kết nối với các liên kết peptit[50]. Tính đặc hiệu có được là do mỗi
loại enzyme đều có vị trí liên kết chọn lọc cho lớp nền tương ứng của
chúng. Lớp nên liên kết với vị trí liên kết của enzyme, được gọi là ‘vị trí
hoạt động’. Ở đó, các liên kết hóa học khác nhau bị phá vỡ và hình
thành trong lớp nền, được chuyển hóa thành các sản phẩm.
Các enzyme khác nhau cần các thành phần bổ sung để hoạt động, được
gọi là ‘đồng yếu tố’. Chúng rất quan trọng trong quá trình hình thành ở
nhiều bước xúc tác hoặc trong những thay đổi với chất nền. Những thành
phần bổ sung này bao gồm các ion kim loại khác nhau, nhóm chân giả và
các nhóm hóa học gọi là co-enzyme liên kết rất giống với enzyme. [Hình 1] lOMoAR cPSD| 18638480
1.3. Các lớp và chức năng của enzyme
Các enzyme thực hiện khá nhiều chức năng khác nhau. Phần lớn,
chúng là nguyên nhân gây ra sự chuyển đổi lẫn nhau về mặt hóa học mà
một sinh vật muốn sống [75]. Trong tự nhiên, các loại enzym khác nhau
đã được tìm thấy. Mỗi enzyme có một chế độ chức năng khác nhau trên
lớp nền cụ thể của nó. Một số enzyme phá vỡ các hợp chất cao phân tử
thành các monomer cấu thành của chúng trong khi các enzym khác thì
làm ngược lại. Trên hết, một số enzyme biến cấu trúc định dạng của
phân tử thành một hình dạng khác. Chúng được đặt những cái tên cụ thể
dựa trên loại vai trò của một enzyme. Các enzyme được phân loại thành
6 nhóm khác nhau tùy theo Hội đồng về Enzym [75] [Bảng 1].
Enzym từ lâu đã được lấy từ các nguồn tự nhiên để sử dụng trong công
nghiệp. Các enzyme cụ thể đã được chiết xuất và tạo ra cho quá trình sản
xuất, phân hủy và chuyển đổi của các hợp chất khác nhau với số lượng
lớn trong các nhà máy lên men công nghiệp. Enzym amylase là một loại
rất phổ biến trong số nhiều dạng enzyme được sử dụng [75]. 1.4. Amylases
Các amylases có chức năng quan trọng trong tinh bột [63, 49, and 13]
do đó là các enzyme ổn định nhiệt được sử dụng phổ biến nhất. Amylase
là các enzyme thủy phân các phân tử tinh bột thành một loạt các cấu tử,
bao gồm giới hạn maltose, dextrin và các polymer cấu tạo từ glucose
ngày càng nhỏ hơn [85]. Thông thường, amylase được gọi là “glycoside hydrolases” [30].
Amylase là các enzyme xúc tác quá trình thủy phân tinh bột thành
đường. Những chất này có trong nước bọt của con người và một số loài
khác, nơi bắt đầu quá trình tiêu hóa hóa học. Thực phẩm có chứa một
lượng lớn tinh bột nhưng ít đường, chẳng hạn như gạo và khoai tây, có lOMoAR cPSD| 18638480
vị ngọt khi nhai, vì amylase chuyển hóa một số tinh bột của chúng thành
đường trong miệng. Tuyến tụy và tuyến nước bọt tạo amylase ( alpha
amylase) thành disaccharid và trisaccharid để thủy phân tinh bột, các
enzyme khác chuyển thành glucose để cung cấp năng lượng cho cơ thể.
Ngoài ra, amylase được tạo ra bởi thực vật và một số vi khuẩn. Amylase
là enzyme đầu tiên được phát hiện và phân lập ( năm 1833, bởi
AnselmePayen ) [59]. Ủy ban Quốc tế về Enzym đã phân loại sáu nhóm
enzyme riêng biệt theo phản ứng xúc tác của chúng : EC1
Oxidoreductases; EC2 Transferases; EC3 Hydrolases; EC4 Lyases; EC5 Isomerases; EC6 Ligases [44].
Các enzyme hoạt tính sinh học thường có thể thu được từ thực vật,
động vật và vi sinh vật. Để phát triển các hydrolase ngoại bào, amylase
đã được phân lập từ nhiều nguồn khác nhau [4,5,19].
Lịch sử của amylase bắt đầu vào năm 1811 khi enzyme phân hủy tinh
bột đầu tiên được Kirchhoff phát hiện, sau đó là một số báo cáo về amylase
tiêu hóa và amylase mạch nha. Năm 1930 Ohlsson đề nghị phân loại các
enzyme tiêu hóa tinh bột trong mạch nha như α và β amylase theo dạng
anome của đường được hình thành bởi phản ứng enzyme, muộn hơn
nhiều. Amylase, enzyme thủy phân, xúc tác quá trình thủy phân tinh bột
thành các đường phân tử lượng thấp. Trong tự nhiên, tinh bột là nguồn
thực phẩm dồi dào nhất cho polysaccarid sau xenlulose và là nguồn cung
cấp năng lượng và cacbon có thể tiếp cận chính của Trái Đất [12, 29]. lOMoAR cPSD| 18638480
Nó được thực vật tổng hợp và sử dụng trong các ngành công nghiệp
sữa, sợi, giấy, rượu, dược phẩm [69]. Amylase có mặt khắp nơi và lan
rộng khắp thực vật, động vật và vi sinh vật. Tuy nhiên, vi sinh vật sản
xuất amylase đã thay thế thành công phương pháp xử lí hóa học trong
các ngành công nghiệp khác nhau vì hiệu quả chi phí và lợi thế công
nghiệp [46, 81]. Tinh bột, một loại polymer thô, bền vững và có thể phân
hủy sinh học, được cung cấp bởi nhiều loài thực vật như một nguồn
năng lượng dự trữ và có thể được tìm thấy trong rễ cây, thân cây, hạt
giống cây trồng và các loại cây chủ lực như gạo, ngô, lúa mì, bột sắn,
khoai tây và vi sinh vật amylase có nguồn gốc[12, 73, and 38]. Tinh bột
bao gồm hai nguyên tố, một là polymer glucose mạch thẳng - amylose
có chứa các liên kết α-1,4 và một là polymer phân nhánh - amylopectin
với các mạch thẳng của các gốc α-1,4 được liên kết với nhau bằng liên kết α-1,6 [26].
Quá trình khử trùng hợp của tinh bột bằng amylase là cơ sở của nhiều
quy trình công nghiệp [60]. Nghiên cứu hoạt động nhiệt động học của α-
amylase trong quá trình thủy phân tinh bột ở các điều kiện nhiệt độ, pH
và ion kim loại khác nhau bằng cách sử dụng nguyên lý nhiệt động học
và phương pháp giảm mức độ [28]. Báo cáo nghiên cứu về tin sinh học và
sinh hóa trong khảo cổ ưa nhiệt Thermococcus spp của một α-amylase
hình thành maltose mới lạ thuộc họ GH57. CL1-CL1. Maltose hình thành
α-amylase là một loại của họ glycoside hydrolase 57
(GH57) và khác thường ở chỗ nó thể hiện hoạt động thủy phân kép
chống lại các liên kết α-1,4 và α-1,6-glycosidic và chỉ nhận ra maltose.
Enzym này trước đây chỉ được công nhận ở Pyrococcups sp. IS 04. [39]. [47]. lOMoAR cPSD| 18638480
Amylase (EC:3.2.1.0), một thuật ngữ đề cập đến α-amylase, β-amylase
và π-amylase, là một trong những enzyme phổ biến và quan trọng nhất
do có nhiều ứng dụng và cũng là nhóm lớn thứ hai trên thị trường
protease [47]. Chúng là một trong những enzyme công nghiệp quan
trọng nhất, chiếm khoảng 30% tổng thị trường enzyme thế giới [2,21].
Amylase có nhiều ứng dụng trong quá trình hóa lỏng và đường hóa tinh
bột [71] và cũng trong các ngành công nghiệp khác nhau bao gồm thực
phẩm, đồ uống, nhiên liệu sinh học, giấy, dược phẩm, chất tạo ngọt, chất
tẩy rửa, dệt may, lên men và chế biến tinh bột
[21,46,82,29,20,16,43,68,23]. Hoạt tính xúc tác khác nhau của α-
amylase được báo cáo là phản ứng với chất nito được sử dụng trong giai
đoạn sản xuất [23]. Đã báo cáo về nhân bản phân tử và đặc điểm sinh
hóa trong Escherichiacoli của một α-amylase hữu cơ, ưa nhiệt, chịu
dung môi từ một chủng Bacillus; [6]. [18]. Ở thực vật, thuật ngữ α-
amylase hình thành trong quá trình bắt đầu nảy mầm và phát triển của
hạt và được thúc đẩy bởi axit abscisic và axit salicylic để phản ứng với
gibberellin và bị kìm hãm [87]. Vai trò chính của β-amylase là tham gia
vào quá trình phân hủy tinh bột ở thực vật [32], đã chứng minh chức
năng của β-amylase trong quá trình phân hủy tinh bột tạm thời [66]. 2 PHÂN LOẠI AMYLASE
Tùy thuộc vào phương thức hoạt động của chúng, amylase có thể được
chia thành 2 loại ,endo – amylase và exo – amylase. Các endo-amylase
xúc tác thủy phân tự phát của α -1,4 glicosidic có trong chuỗi tinh bột
của các thành phần cấu trúc, tức là amylose hoặc amylopectin. Hoạt lOMoAR cPSD| 18638480
động xúc tác này góp phần hình thành các oligosaccharide mạch thẳng
và phân nhánh có độ dài khác nhau của chuỗi. Các exo-amylase thủy
phân từ đầu không khử, dẫn đến sự hình thành các sản phẩm cuối ngắn
liên tiếp. Exo-amylase như β- amylase thủy phân quan hệ glycosidic α-
1,4 và glucoamylase xúc tác liên kết α-1,4 và α-1,6 glycosidic [ 1,3,7].
Endo và exo –amylase chủ yếu hoạt động trên các liên kết α-1,4, các
enzym phân nhánh chủ yếu vào các liên kết α-1,6 và cyclodextrin
glycosyltransferase phá hủy tinh bột bằng cách chủ yếu xúc tác chu trình
và phản ứng quá mức. [ Bảng2] 2.1 ENDOAMYLASE
Endoamylase chỉ đơn thuần phân cắt các liên kết α-1,4 trong tinh bột ở
bên trong của phân tử tinh bột bằng cách đi qua các điểm phân nhánh α-
1,6 của amylopectin. Endoamylase được công nhận rộng rãi nhất là α-
amylase (EC 3.2.1.1). Điều này cho phép dung dịch tinh bột nhanh
chóng mất độ nhớt. Các enzym này hầu hết được phân thành 2 nhóm
theo mức độ thủy phân cơ chất: thủy phân (30-40%) và đường hóa (50-
60%). Sự phân chia này thường được sử dụng để mô tả các α -amylase
đặc tính [ 83]. Do đó, các sản phẩm endoamylase là các oligosaccharide
có độ dài khác nhau. Endoamylase xúc tác quá trình thủy phân tự phát
trong phân tử tinh bột, tạo ra các oligosaccharide mạch thẳng và phân
nhánh có độ dài khác nhau của chuỗi glucose.[21] [22] 2.2.EXOAMYLASES
Exoamylase cũng phân cắt các liên kết α -1,4 ví dụ: β-amylase (EC
3.2.1.2), nhưng một số trong số chúng có thể tấn công các liên kết α-
1,6, ví dụ: glucoamylase (EC 3.2.1.3). Các enzym này hoạt động bên
ngoài trên các liên kết cơ chất từ đầu không khử của tinh bột và do đó
chỉ tạo ra các sản phẩm có trọng lượng phân tử thấp từ tinh bột, ví dụ: lOMoAR cPSD| 18638480
maltose và glucose, tương ứng [ 84]. Các exoamylase thủy phân chất
nền từ đầu không khử, dẫn đến các sản phẩm cuối cùng liên tiếp ngắn hơn [ 21].[Hình 2]
2.3 α-Amylase (EC 3.2.1.1)
Họ α-amylase bao gồm một nhóm amylase với các đặc tính cơ chất và
ion kim loại khác nhau có chức năng như gốc glucose được kết nối bằng
các liên kết glycosidic α-1-1, α-1-4, α-1-6[79]
α-Amylase (EC 3.2.1.1), Canxi metalloenzyme, còn được gọi là
glycogenase hoặc 1,4- α-D-glucanglucanohydrolase [7,14]. Chúng tự
thủy phân liên kết α-1,4 và phân cắt các chuỗi dài để tạo ra amylose và
maltose, maltotry và maltose, glucose và hạn chế amylopectin
dextrin[52]. α -Amylase đến từ thực vật, động vật, vi khuẩn (Baxillus)
và nấm (ascomyest và basidomycetes) [7].
(EC 3.2.1.1) (1,4- α-D-glucanohydrolase; glycogenase) amylase là
enzyme canxi metallo hoạt động ở các vị trí ngẫu nhiên trong chuỗi tinh
bột dẫn đến sự phân hủy carbohydrate chuỗi dài thành maltotriosis mà
amylose maltose, hoặc amylopectin maltose, glucose và dextrin tối
thiểu, α-amylase dường như hoạt động nhanh hơn β-amylase và là 1 loại
enzyme tiêu hóa chính gây mù do amylopectin ở động vật.
2.4. β-amylase (EC 3.2.1.2) β-amylase (EC 3.2.1.2) thủy phân các kết
nối α-1,4 glycosidic từ các
đầu không khử và không thể phá vỡ các kết nối α-1,6 so với α-amylase.
Nó được tạo ra bởi thực khuẩn , vi khuẩn, và nấm [29]. Trong khi β- lOMoAR cPSD| 18638480
amylase trong mô động vật không có, nó có thể có trong các vi sinh vật
cư trú trong đường tiêu hóa. Tinh bột β-amylase thủy phân maltose trong
trái cây chín tạo ra hương vị đặc trưng [7,20]. Trong hạt cả hai dạng α-
và β-amylase đều xảy ra. β-amylase xảy ra ở trạng thái không hoạt động
trước khi nảy mầm trong khi α-amylase xảy ra khi nảy mầm.
(EC 3.2.1.2) (Tên thay thế: 1,4-α-D- glucanmaltohydrolase;
glycogenase; saccharogen amylase) β-amylase cũng được tổng hợp bởi
vi khuẩn, nấm, xung hạt và thực vật, xúc tác quá trình thủy phân liên kết
thứ hai α-1,4 glycosidic bond, phân cắt hai đơn vị glucose (maltose) tại
một thời điểm. β-amylase phân giải tinh bột thành đường trong quá trình
chín của trái cây, dẫn đến làm ngợt trái cây chín. Trước khi nảy mầm có
β-amylase, trong khi α-amylase và protease xuất hiện khi bắt đầu nảy
mầm. Mô động vật không chứa β-amylase mặc dù chỉ có [53,56 và 54]
có thể được tìm thấy ở vi sinh vật nằm trong đường tiêu hóa.
2.5. γ-Amylase (EC 3.2.1.3) γ-Amylase (EC 3.2.1.3) xúc tác quá trình
thủy phân glycosidic của α-
1,4 và α-1,6. Ngoài ra nó còn được gọi là glucoamylase, exo-1,4- α-
glucosidase, amyloglucosidase, glucan1,4- α-glucosidase,
amyloseglucosidase, glucan1,4- α-glucosidase, 1,4- α-D-
glucanglucohydrolase hoặc α-glucosidaselysosomal. Nó là amylase hoạt
động tối ưu trong điều kiện axit, so với α- và β-amylase [76,36]. (EC
3.2.1.3) (tên thay thế: glucan 1,4-α-glucosidase; amyloglucosidase; exo-
1,4-α-glucosidase; glucoamylase; lysosome α-glucosidase; 1,4-α-D-
glucanglucohydrolase), cuối cùng tương tác α(1,4) glycosidic ở đầu
không khử của amyloza và amylase khác, γ-amylase hoạt động hiệu quả
nhất trong môi trường axit và có độ pH tối ưu 3 [54]. lOMoAR cPSD| 18638480
3. CƠ CHẾ CỦA SỰ HẤP THỤ AMYLASE
𝛼-Amylodextrin bị amylase mạch nha phân hủy đến nhiệt độ thường
theo hai hai giai đoạn khá rõ ràng. (a) Một phản ứng tương đối nhanh
trong đó maltose là đường chính được tạo ra nhưng hiệu ứng 𝛼 chiếm ưu
thế một chút trong quá trình biến đổi được thể hiện. α –dextrins và f-
maltose thường được sản xuất theo tỷ lệ giảm dần (và biến đổi) tương đối.
(b) Một phản ứng tương đối chậm, rõ ràng là tuyến tính, trong đó, nếu
không phải là đường khử duy nhất được tạo thành, thì glucose là nguyên
tố chính, do đó tính tuyến tính được quan sát thấy; Tại thời điểm này,
không có sự thay đổi nào có thể phát hiện được giữa các sản phẩm phân hạch.
Ở đây không xác định rõ ràng giữa giai đoạn nhất định của phản ứng
trừ khi nồng độ thấy của các enzyme được sử dụng. Nó mô tả một kỹ
thuật mới để đánh giá của sự đột biến trong hỗn hợp enzyme – cơ chất dạng keo mảnh [17].
4. AMYLASE ENZYME SẢN XUẤT VI KHUẨN
Amylase là kinh tế vì có thể dễ dàng điều khiển vi sinh vật để thu
nhận các enzym có các đặc tính khác nhau. Bacillus sp. Trong số các vi
khuẩn, nó thường được sử dụng trong sản xuất amylase bền nhiệt để đáp
ứng nhu cầu công nghiệp, và được coi là những nhà sản xuất α-amylase
mạnh [40]. Bacillus sp, được ước tính là enzyme chiếm khoảng 50% thị
trường enzyme toàn cầu [65]. Các loài Bacillus khác nhau đã được công lOMoAR cPSD| 18638480
bố là sản xuất α-amylase bằng cách lên men. Trực khuẩn spp. KR-8104
tạo ra α-amylase, là chất độc lập và hoạt động ở pH thấp [62], được sử
dụng để phát triển α-amylase quy mô lớn. Một lựa chọn để sản xuất
thương mại các α-amylase có thể điều nhiệt là vi khuẩn ưa nhiệt Bacillus
Stearothermophilus. Bacillus spp tạo ra amylase kiềm và chất làm mát.
Chẳng hạn như Bacillus licheniformis [64, 67] và Bacillus halodurans.
Sản xuất -amylase ngoại bào hoạt động lạnh từ vi khuẩn mới
Microbacterium foliorum GA2 và Bacillus cereus GA6 đã được báo cáo [34].
5. XÁC ĐỊNH HOẠT ĐỘNG CỦA AMYLASE
Tất cả các phân lập của Bacillus subtilis được thử nghiệm với thạch
tinh bột để sản xuất amylase. Môi trường thạch tinh bột cấy vi sinh vật
và sau đó đổ đầy dung dịch iốt. Đĩa tinh bột ngập dung dịch iot ở trên
sau 72 giờ sinh trưởng. Dưới phông nền màu xanh lam, vùng rõ ràng
được nhìn thấy xung quanh amylase /các khuẩn lạc tạo ra [48].
6. TÍNH TOÁN HOẠT ĐỘNG ENZYME
Hoạt động của Enzyme được tính bằng Nồng độ của sản phẩm được
tạo ra / trọng lượng phân tử của sản phẩm = 1/thời gian ủ. Hoạt tính của
enzyme được biểu thị bằng μ mol/ml/phút [48].
7. SÀNG LỌC VI KHUẨN SẢN XUẤT AMYLASE
Mẫu lọc đối với phân lập được xác định được sàng lọc hoạt tính
amylolytic bằng cách kéo dài từng mẫu phân lập đến kích thước thạch
dinh dưỡng 1% tinh bột và 1% tinh bột dextrose. Trong 2448 giờ, đĩa
thạch được ủ ở 37℃, và đĩa của nấm được ủ trong 3-5 ngày ở nhiệt độ
phòng. Đĩa nuôi cấy được đổ đầy iốt lugol để phân loại khu vực xung lOMoAR cPSD| 18638480
quanh việc làm sạch môi trường nuôi cấy. Đường kính của vùng làm
sạch được hình thành đại diện cho hoạt động amylolytic của chủng cô
lập như được xác định trong [9].
8. PHÁT SINH VI KHUẨN
Thạch tinh bột là một môi trường chọn lọc được sử dụng để phân lập
Bacillus subtilis xung quanh mẫu đất 1,0gmof được pha loãng hàng loạt
trong nước muối sinh lý vô trùng và độ pha loãng đạt được bằng cách
trộn toàn diện đến 10-5. 0,1ml mẫu pha loãng 10-3 được phết với sự trợ
giúp của que L trên các đĩa thạch vô trùng có chứa thạch tinh bột, và các
đĩa này được ủ ở 37℃ trong 24-48 giờ. Các đĩa được quan sát thấy sự
phát triển của vi khuẩn sau khi ủ [48].
9. ỨNG DỤNG CỦA AMYLASE
Amylases là một trong những loại enzyme được sử dụng phổ biến nhất
cần thiết để chế biến thực phẩm lên men và thị trường amylase ngày càng
phát triển với phạm vi sử dụng ngày càng mở rộng. 𝛼-amylase là enzym
đầu tiên được sản xuất thương mại và bán trong số tất cả các enzym khác.
Để hỗ trợ tiêu hóa, sự phát triển công nghiệp đầu tiên của
-amylase từ A. Oryzae, được gọi là "Taka diastase," do Tiến sĩ J.
Takamine [71] phát triển đã được sử dụng. Thị trường toàn cầu về
enzym rất quan trọng đối với nhiều ứng dụng khác nhau. Amylase được
sử dụng rộng rãi trong các ngành công nghiệp sản xuất tinh bột thực
phẩm và phi thực phẩm. [Bàng số 3] lOMoAR cPSD| 18638480
9.1 Công nghệ chế biến tinh bột
Tinh bột, kho thực phẩm dự trữ lớn thứ hai trong tự nhiên cho
polysaccharides, là thành phần chính của đa số thực phẩm thiết yếu và
được sử dụng trong các ngành công nghiệp thực phẩm và các ngành
công nghiệp phi thực phẩm. Tinh bột được tạo ra bởi quá trình quang
hợp của thực vật và là nguồn cacbon dễ dàng tiếp cận trên Trái Đất. Tinh
bột được sử dụng trong các ngành công nghiệp khác nhau bao gồm thực
phẩm, rượu, giấy, dệt may, v.v... Chế biến tinh bột được cho là cần thiết
cho hầu hết các ứng dụng trong các ngành công nghiệp khác nhau. Chế
biến tinh bột hóa học có những hạn chế cao như yêu cầu nhiệt độ, pH
thấp, năng suất glucose thấp hơn, mùi vị hợp chất không mong muốn và
tổng hợp màu không mong muốn trong khi thủy phân qua trung gian
enzyme có khả năng giải quyết các đặc điểm bất lợi này[69,27]. -
amylase qua trung gian tinh bột thủy phân đươc sử dụng trong sản xuất
si-rô glucose và fructose [45].
9.2. Ngành công nghiệp thực phẩm
Sự ra đời của công nghệ sinh học hiện đại đã mang lại nhiều cải tiến
cho ngành công nghiệp thực phẩm. Việc sử dụng các enzyme trong công
nghiệp thực phẩm rất đa dạng và chúng thường được sử dụng làm chất
chế biến. Trong công nghiệp thực phẩm chế biến, amylase thường được
sử dụng để làm bánh, đồ uống, siro tinh bột,… Sản xuất bánh mì là một
trong những kỹ thuật phổ biến nhất trong chế biến thực phẩm trên toàn
cầu[22]. Việc sử dụng các enzyme trong sản xuất bánh mì cho thấy sự
quan trọng của chúng trong việc kiểm soát chất lượng và hiệu quả sản
xuất. Để kéo dài độ tươi và thời gian sử dụng các sản phẩm nướng,
amylase được thêm vào bột hoặc kết hợp với enzyme [70], được lên men
bởi nấm men [74]. Trong quá trình lọc nước trái cây, amylase được sử
dụng để tối ưu hóa việc sản xuất nước ép trái cây trong suốt[78,71]. lOMoAR cPSD| 18638480
Amylase được tạo ra từ vi sinh vật có thể được sử dụng trong đồ uống có
cồn bằng cách thủy phân tinh bột trước khi lên men để làm giảm hoặc
loại bỏ độ đục. Cùng với xenlulaza và pectinaza, amylaza được sử dụng
để thẩm thấu, hóa lỏng và làm trong trong quá trình chế biến nước trái
cây để tăng năng suất và hiệu quả chi phí[37,18]
9.3. Ngành công nghiệp chất tẩy rửa
Gần đây, việc sử dụng enzyme làm chất phụ gia trong các công thức
chất tẩy rửa đã trở nên khó tránh khỏi do các điều kiện nhẹ hơn so với
các hóa chất bao gồm chất tẩy rửa[61]. Công ty này chiếm hàng đầu
trong việc sử dụng enzyme công nghiệp. Các công thức của chất tẩy rửa
enzyme tăng cường hiệu quả của chất tẩy rửa trong việc loại bỏ vết bẩn
theo cách thân thiện với môi trường[72]. Amylase xúc tác glycosidic quá
trình kết nối thủy phân trong vết bẩn và loại bỏ keo tinh bột kết hợp với
các vết bẩn và vết bẩn khác. -Amylase, một endo-amylase, chủ yếu
được sử dụng cho chất bột giặt, vì hoạt động exo-amylase không hiệu
quả để loại bỏ vết bẩn. Trên thực tế, -amylase được sử dụng trong các
công thức chất tẩy rửa dạng lỏng chiếm khoảng 90%[21,72,24 và 42]
9.4. Ngành công nghiệp giấy
Nhờ nhận thức ngày càng cao về các mối quan tâm tính bền vững và
giảm thiểu tác động bất lợi đến môi trường, việc sử dụng các enzyme có
nguồn gốc từ vi sinh vật đã ngày càng phát triển trong ngành công
nghiệp giấy và bột giấy. Enzyme được sử dụng trong ngành công nghiệp
này năng lượng tiêu thụ, thời gian xử lý và số lượng hóa chất cần thiết
để xử lý. Amylase được sử dụng trong ngành công nghiệp này bao gồm
lớp phủ tinh bột, khử mực, tăng cường thoát nước, và làm sạch giấy lOMoAR cPSD| 18638480
[35,70]. Ứng dụng chính của -amylase trong công nghiệp giấy là sản
xuất tinh bột cao phân tử với độ nhớt thấp bằng cách điều chỉnh lượng
tinh bột giấy được phủ[22]. Quá trình này làm cho giấy mịn và rắn chắc,
cải thiện chất lượng viết. -amylase được sử dụng để thủy phân một
phần polyme trong một đợt hoặc chu kỳ liên tục để định cỡ giấy nhằm
bảo toàn độ nhớt của tinh bột. Định cỡ giấy làm tăng tính nhất quán của
sản phẩm cuối cùng và tăng độ bền và độ cứng của giấy. Các -amylase
hoạt động ở nhiệt độ thấp rất hữu ích để giảm độ nhớt của tinh bột cho
lớp phủ giấy thích hợp [11,33,43]
9.5. Công nghiệp dệt may
Amylase được sử dụng trong ngành công nghiệp này để khử cặn thực
vật, tức là loại bỏ tinh bột để tăng cường sản xuất đồng đều, ướt đồng
đều. Tinh bột được áp dụng cho sợi, một chất định cỡ giá rẻ và dễ dàng
có sẵn để vận hành dệt nhanh chóng và an toàn. Hồ tinh bột được sử
dụng để uốn cong trong dệt vải để cung cấp độ bền và ngăn ngừa đứt dây [2].
Sau khi dệt, amylose được thêm vào để xúc tác đặc biệt cho quá trình
thủy phân tinh bột thành dextrin hòa tan trong nước. Một cách hiệu quả,
amylase chiết tinh bột mà không làm hỏng vải [31].
Quá trình khử cặn bằng enzyme bông với -amylase là một công nghệ
tiên tiến trong nhiều thập kỷ qua [41] việc khử cặn bằng enzyme của
bông bằng -amylase đã là một công nghệ tiên tiến. Các amylase của
chủng Bacillus được sử dụng trong định cỡ dạng sợi dọc tổng hợp [72]. 10.KẾT LUẬN
Do các đặc tính có thể khai thác của chúng,amylase được cố định
thành các chất nền hữu cơ,vô cơ và không độc hại và phân hủy sinh học lOMoAR cPSD| 18638480
phù hợp để làm cho chúng khả thi hơn trong các ứng dụng công nghệ
khác nhau để tăng cường độ ổn định nhiệt và lưu trữ so với các emzym
tự do. Do đó amylase đã mở rộng các ứng dụng công nghiệp đặc biệt là
trong các ngành công nghiệp tẩy rửa, da, giấy, hóa chất và dược phẩm
TÀI LIỆU THAM KHẢO
1. Agrawal M, Pradeep S, Chandraraj K, Sathyanarayana NG.Thuỷ
phân tinh bột bằng amylase từ Bacillus Sp.KCA102: Một cách tiếp
cận thống kê.Qúa trình hóa sinh 2005;40:2499-2507
2. Aiyer PA. Amylase và ứng dụng của chúng.Tạp chí công nghệ sinh
học Châu Phi,2005; 4 (13): 1525- 1529
3. Akkaya B, Yenidunya AF, Akkaya R. Sản xuất và cố định amylase
ngoại bào ưu nhiệt mới từ phân lập trực khuẩn . Tạp chí Quốc tế Đại
phân tử Sinh học, 2012; 50:991- 995
4. Anbu P, Hilda A. và Gopinath S. C.B., “ Nấm keratinophilic của
trang trại gia cầm và đất dổ lông vũ ở Tamil Nadu, Ân Độ”,
Mycopathologia, 2004; 158 (3) : 303-309
5. Anbu P và Hur BK.Phân lập vi khuẩn chịu dung môi hữu cơ
Baccillus licheniformis PAL05 có khả năng tiết lipase bền với
dungmooi ,Công nghệ sinh học và hóa sinh ứng dụng , 2014 ; 61 (5): 528-534
6. Asoodeh A, Emtenani S, Emtenani S,Jalal R, Mohammad Reza HMR. lOMoAR cPSD| 18638480
Nhân bản phân tử và mô tả đặc điểm sinh hóa của α –amylase hữ cơ, ưa
nhiệt chịu dung môi từ chủng Bacillus ở Escherichia coli.J. Mol. Catal. Enzym, 2014;99B: 114 - 120
7. Benjamin S, Smitha RB, Jisha VN, Pradeep S, Sajith S, Sreedevi S,
Priji P ,Unni KN, Sarath Josh MK. Một chuyên khảo về amylase từ
Bacillus ssp .Những tiến bộ trong khoa học sinh học và công nghệ sinh học ,2013; 4: 227 – 241
8. Berg J, Tymoczko J, Stryer L. Hóa sinh xuất bản VI. W. H. Freeman. 2006
9. Bertrand TF, Frederic T, Robert N. Sản xuất và mô tả một phần đặc
tính của amylase bền nhiệt từ chủng nấm men ascomycetes được
phân lập từ đất giàu tinh bột. McGraw Hill Inc, New York 2004; 53- 55
10. Boyer M, Madoui MA, Gimenez G, La Scola, B, Raoult D.Các
nghiên cứu về phát sinh loài và kiểu gen của các gen thông tin trong
bộ gen cho thấy sự tồn tại của 4 miền sự sống bao gồm cả các virus
khổng lồ .PloS One 2010, 5, e15530
11. Bruinenberg P, Hulst A, Faber A, Voogd R. Một quy trình định cỡ bề
mặt hoặc lớp phủ của giấy. Đơn xin cấp bằng sáng chế Châu Âu. EP0690170A1.Năm 1996
12. Buleon A, Colonna P, Planchot V,Ball S .Hạt tinh bột : cấu trúc và
sinh tổng hợp . NS. J.Biol.Macromal, 1988;23: 85- 112
13. Crab W và Mitchinson C. Các enzym tham gia vào quá trình chế biến
tinh bột thành đường. Xu hướng Biotechnol 1997; 15:349-352. lOMoAR cPSD| 18638480
14. Demirkan ES, Mikami B, Adachi M, Higasa Tet al. Alpha amylase từ
B amyloliquefaciens: Làm sạch, xác định đặc điểm ,phân hủy tinh bột
thô và biểu hiện ở E. coli . Qúa trình hóa sinh ,2005; 40: 2629-2646
15. Doss A và Anand SP. Thanh lọc và xác định đặc tính của enzyme
amylolytic ngoại bào tử các loài Aspergillus. Aft. J. Biotechnol 2012; 11(83): 14941-14945
16. El- Fallal A, Dobrara MA, El- Sayed A, OmarN. Tinh bột và các α –
amylase vi sinh vật : từ khái niệm đến các ứng dụng sinh học
.Chương 21 . INTECH .459488. Năm 2012
17. Freeman và Hopkins. Hóa sinh. Năm 1939; 30: 442
18. Garg G, Singh A, Kaur A. Pectinnases vi sinh vật: nột công cụ thân
thiện với môi trường của tự nhiên cho các ngành công nghiệp .3
công nghệ sinh học, 2016; 6 (1): 47-59
19. Gopinath SCB, Anbu P, Hilda A. Hoạt động enzym ngoại bào ở nấm
được phân lập từ môi trường giàu dầu, Mycoscience ,2005: 46(2): 119- 126
20. Goyal N, Gupta JK, Soni SK, Một loại tinh bột thô mới tiêu hóa α –
amylase có thể điều nhiệt từ Bacillus sp. I-3 và sử dụng nó trong quá
trình thủy phân trực tiếp tinh bột khoai tây sống. Enzyme Microb, kĩ
thuật viên, 2005; 37: 723-734 lOMoAR cPSD| 18638480
21. Gupta R, Gigras P, Mohapatra H, Goswami VK, Chauhan B. Các α –
amylase của vi sinh vật: quan điểm công nghệ sinh học. Quy trình
sinh hóa 2003; 38:1599 – 1616
22. Gurung N, Ray S, Bose S, Rai V. Một cái nhìn rộng hơn: các enzym
vi sinh vật và sự liên quan của chúng trong các ngành công nghiệp, y
học và hơn thế nữa. Giới thiệu sinh học Res 2013; 2013: 329121.
23. Hashemi M., Shojaosadati SA, Razavi SH, Mousav SM. Hành vi xúc
tác khác nhau của α-amylase để phản ứng với chất nitơ được sử dụng
trong giai đoạn sản xuất. J. Ấn Độ Eng. Chem., 2014; 21: 772-778.
24. Hmidet N, El-Hadj Ali N, Haddar A, Kanoun S, Alya S, Nasri M.
Protease kiềm và amylase bền nhiệt được đồng sản xuất bởi Bacillus
licheniformis NH1: Đặc tính và ứng dụng tiềm năng làm phụ gia tẩy rửa.
Tạp chí Kỹ thuật Hóa sinh, 2009; 47: 71– 79.
25. Illanes A. Giới thiệu. Trong; Illanes A. (biên tập). 2008. Enzyme
Biocatallysis. Nguyên tắc và Ứng dụng. Springer. : 19-56.
26. Janecek, S. Họ alpha-amylase: sinh học phân tử và sự tiến hóa. Ăn
xin. Lý sinh. Mol Biol., 1997; 67: 67-97.
27. Jansen B. và Olsen J. Amylases và tiềm năng công nghiệp của họ.
Vật liệu ưa nhiệt trong Công nghệ sinh học. Hà Lan: Nhà xuất bản Học
thuật Kluwer, 1999; 115-37. 26.
28. Jeon E, Jung JH, Seo DH, Jung DH, Holden JF, Park CS. (). Phân
tích sinh hóa và định dạng sinh học của một loại maltose-amylase
mới thuộc họ GH57 trong loài siêu ưa nhiệt Thermococcus sp.CL1.
Enzyme Microb. Tech., 2014; 60: 9-15. lOMoAR cPSD| 18638480
29. Kandra L. α-Amylases có tầm quan trọng trong y tế và công nghiệp.
J. Mol. Struct., 2003; 667: 487- 498.
30. Kaur A, Kaur M, Samyal ML, Ahmed Z. Phân lập, xác định đặc tính
và xác định chủng vi khuẩn. Tạp chí Nghiên cứu Vi sinh vật và Công
nghệ Sinh học, 2012; 573-579.
31. Kirk O, Borchert TV, Fuglsang CC. Ứng dụng enzyme trong công
nghiệp. Curr. Opin. Công nghệ sinh học. Năm 2002; 13, 345-351.
32. Kossmann J và Lloyd J. Hiểu biết và ảnh hưởng đến hóa sinh tinh
bột. Crit. Rev. Biochem. Mol. Biol., 2000; 35: 141196.
33. Kuddus M và Roohi. Các αamylase hoạt động lạnh của vi sinh vật:
Từ những nguyên tắc cơ bản đến những phát triển gần đây. Các Chủ đề
Nghiên cứu, Công nghệ và Giáo dục Hiện tại trong Vi sinh Ứng dụng và
Công nghệ Sinh học Vi sinh vật. 2010; 1265-76.
34. Kuddus M, Saima R, Ahmad IZ. Sản xuất α-amylase ngoại bào hoạt
động lạnh từ vi khuẩn mới Microbacterium foliorum GA2 và
Bacillus cereus GA6 được phân lập từ sông băng Gangotri, Tây Himalaya. J.
Gen. Eng. Technol., 2012; 10: 151-159.
35. Kuhad RC, Gupta R, Singh A. Xenlulozơ vi sinh vật và các ứng
dụng công nghiệp của chúng. Enzyme Res. 2011; 2011: 280696. doi:
10.4061 / 2011/280696Glucoamylase lOMoAR cPSD| 18638480
36. Kumar P và Satyanarayana T.vi sinh vật: Đặc điểm và ứng dụng.
Đánh giá quan trọng trong Công nghệ sinh học. Năm 2009; 29, 225- 255.
37. Kumar S. Vai trò của enzym trong chế biến nước quả và nâng cao
chất lượng của nó. Tiến lên Appl. Khoa học. Res., 2015; 6 (6): 114– 124
38. Le Corre D, Bras J, Dufresne A. Các hạt nano tinh bột: đánh giá.
Biomacromol. 2010; 11: 1139-1153.
39. Li XY, Wang J, Donga HZ, Zhang HL. Nghiên cứu động học của α-
amylase trong quá trình thủy phân tinh bột bằng phương pháp đo vi
lượng. ThermochimicaActa, 2014; 579: 70-73.
40. Mahmood AU, Greenman J, Scragg AH. Chất chiết xuất từ vỏ cam
và khoai tây: Phân tích và sử dụng làm chất nền Bacillus để sản xuất
ngoại bào trong nuôi cấy liên tục. Enzyme Microb. Công nghệ., 1998; 22: 130-137.
41. Enzyme Marcher D, Hagen HA, Castelli S. Entschlichtenmit. ITB Veredlung, 1993; 39: 20-32.
42. Mitidieri S, Souza Martinelli AH, Schrank A, Vainstein MH. Công
thức chất tẩy rửa có chứa enzym chứa amylase từ Aspergillusniger:
Một nghiên cứu so sánh với các công thức chất tẩy rửa thương mại.
Bioresour, Technol., 2006; 97: 1217-1224.
43. Mobini-Dehkordi M. và Javan FA. Ứng dụng của alpha-amylase
trong công nghệ sinh học. J. Biol. Thế giới ngày nay, 2012; 1 (1): 15- 20. lOMoAR cPSD| 18638480
44. Mojsov K. Các alpha-amylase của vi sinh vật và các ứng dụng công
nghiệp của chúng: một đánh giá. NS. J. Quản lý. NÓ. Bản in, 2012; 2 (10): 583–609.
45. Nielsen JE và Borchert TV. Kỹ thuật protein của alpha-amylases vi
khuẩn. Biochim. Sinh lý. Acta. 2000;1543:253-274.
46. Pandey A, Nigam P, Soccol. CR, Socool VT, Singh D, Mohan R.
Tiến bộ trong amylases vi khuẩn. Biotechnol. Appl. Biochem., 2000;31:135-152.
47. Pandey A, Webb C, Soccol CR, Larroche, C. Công nghệ Enzyme.
Công nghệ châu Á. Nhà xuất bản, New Delhi. 2005;197.
48. Panneerselvam T và Elavarasi S. Cô lập - Amylase Sản xuất Bacillus
subtilis từ đất. Int.J.Curr.Microbiol.App.Sci 2015;4(2): 543-552.
49. Poonam N, Dalel S. Enzyme và các hệ vi khuẩn tham gia vào chế
biến tinh bột. Enzyme Microbiol. Technol. 1995;17:770-778.
50. Publication, W. Hướng dẫn đo enzyme lâm sàng. Freehold, NJ:
Worthington Biochemical Corporation. 1972.
51. Qian M, Haser R, Payan F. Corbohydrate Các vị trí liên kết trong
một phức hợp chất nền α-amylase tuyến tụy, có nguồn gốc từ phân
tích cấu trúc X-quang ở độ phân giải 2,1 A. Protein Sci. 1995;4: 747. lOMoAR cPSD| 18638480
52. Rajagopalan G và Krishnan C. sản xuất α-amylase từ catabolite chán
nản Bacillus subtilis KCC103 sử dụng mía thủy phân. Công nghệ
Bioresource. 2008;99:3044-3050.
53. Rani K. Rít hai pahse thanh lọc amylases nảy mầm và nghiên cứu
ứng dụng của nó trong việc khử hóa vải. J. Biochem châu Á. Pharm. Res. 2012;2 (3):215- 221.
54. Rani K. Khai thác và nghiên cứu các thông số động học của nhiều
xung nảy mầm β-amylases. Int J Pharm and Life Sci. 2012;3(8): 1895- 1898.
55. Rani K. Nghiên cứu so sánh các thông số động học của amylases vi
khuẩn và nấm. J BioInnovation. 2012;3:48-57.
56. Rani K. Sản xuất amylase và kiềm phosphatase, Verlag: Lambert
Academic Publishing Gmbh&Co. KG, Đức, 2012;1- 56. 12.
57. Rani K, Rana R và Datt S. Đánh giá về đặc điểm và ứng dụng của
Amylase. Int. J. Vi sinh học và Tin sinh học. 2015;5:1-5.
58. Ray R, Jana SC, Nanda G. Phương pháp sinh hóa tiếp cận tăng khả
năng ổn định nhiệt của β-Amylase từ trực khuẩn megaterium B6
Folia microbiologica, 1994;39:367-570.
59. Richard B. Hóa học hữa cơ phản ứng lại lần 2 của enzyme-câtlyzed.
London, Anh: Báo chí học thuật.2002
60. Richardson TH, Tan X, Frey G, Callen W, Cabell M, Lam D,
Macomber J, Short JM, Robertson DE, Miller C. Một loại enzyme
mới hiệu suất cao để hóa lỏng tinh bột. Khám phá và tối ưu hóa có lOMoAR cPSD| 18638480
độ pH thấp, ổn định nhiệt α-amylase.J.Biol.Chem., 2002;227:265- 126507.
61. Rodriguez Sanoja R, Morlon- Guyot J, Pintado J, Juge N, Guyot JP.
So sánh các chẩcterization đầy đủ và cắt ngắn hình thức của
lactobacillus amylovorus.-amylase và vai trò lặp đii lặp lại trực tiếp của
Cterminal trong tình trạng thô ràng buộc tinh bột.Appl. Môi trường.Vi sinh vật.2002;66:3350-6.
62. Sạedi RH và cộng sự. Cách tiếp cận bio-statistical để tối ưu hóa của
hoạt động đông lạnh 𝛼-amylase sản xuất bới psychrotolerant mới lạ,
M.Folirum GA2 trong quá trình lên men trạng thái rắn.
Biocatal.Agrix.Biotechnol., 2014;3:175-181.
63. Sarikaya E, Higassa T, Adachi M, Mikami B. So sánh khả nagw
phân hủy của α − và β-amylase trên hạt tinh bột thô. Quy trình sinh hóa. Năm 2000;35:711-715.
64. Saxena RK, Dutt K, Agarwal L, Nayyar, P. Một amylase kiềm và bền
nhiệt cao từ Bacillus sp. Bioresour. Teachnol., 2007;98:260-265.
65. Shallmey M, singh A, Ward OP. Sự phát triển trong việc sử dụng các
bài bacillus cho sản xuất công nghiệp. Cần J.microbiol. 2004;50:1- 17. lOMoAR cPSD| 18638480
66. Schidig A, Frohlich A, Schulze S, lloyd JR, Kosmann J. Ức chế
tuyến yên của một lục nạp, mục tiêu dẫn beta amylase tinh bột thừa
kiểu hình trong lá. Plant J.,2002;30:581-591.
67. Setyorini E, Takenaka S, Murakami S, Aoki K. Thanh lọc và xác
định đặc tính của protease ngoại bài hấp thụ mới từ chủng Bacillus
subtilis FP-133.J.Basic Microbiol., 2006;46:294-304.
68. Shah IJ, Gami PN, Shukla RM, Acharya DK. Tối ưu hóa sản xuất α-
amylase bằng công nghệ lên men Aspergillusoryzae. Cơ bản
Res.J.Microbiol.,2014;1(4):1-10.
69. Sharma A và Satynarayana T. Acidstable-amylase của vi sinh vật:
đặc điểm, kĩ thuật, di truyền hóa sinh và ứng dụng quá trình., 2013;48:201-211.
70. Singh R, Kumar M, Mital A, Mehta PK. Enzyme vi sinh vật: tiến bộ
công nghiệp trong thế kỉ 21. Công nghệ sinh học., 2016;6:174.
71. Sivaramakrishnan S, Gangadharan D, Nampoothiri Km, Soccol CR.
Tổng quang về sự phát triển 𝛼-amylase từ các nguồn vi sinh vật.
Technol thực phẩm. Biotechnol ., 2006;44:173-184.
72. Souza PM và Magalhaes PO. ứng dụng của vi sinh vật -Amylase
trong công nghiệp- một tạp trí Braz đánh giá về vi sinh vật học tại Ilian,2010;41:850-861.
73. Sumitani JI, Nagae H, Kawaguchi T, Arai M.Bacillus loại động vật
-Amylase: nhân bản và xác định trình tự gen, và so sánh trình tự axit
amin suy ra với trình tự các amylase khác. J.
Ferment,Bioeng.,1998;85:428-432. lOMoAR cPSD| 18638480
74. Sundarram A và Murthy TPK. Sản xuất và ứng dụng , đánh giá: -
Amylase. Tạp chí ứng dụng về môi trường vi sinh, 2014;2(4):166- 175.
75. Tamura K, Stecher G, Peterson D, Filipski A, Kumar S.mega6: Phân
tích di truyền tiến hóa phân tử phiên bản 6.0. Sinh học và sự tiến hóa, 2013;30:2725-2729.
76. Tateno T, Fukuda H và Kondo A. Sản xuất L-Lysine từ tinh bột bởi
vi khuẩn cỏynebacteriumglutamicum hiển thị -amylase. Vi sinh
công nghệ sinh học trên bề mặt tế bào. 2007;74:1213-1220.
77. Tester RF và Karkalas J. Tinh bột trong : Biopolyme,
Polysaccharodes II: Polusaccharides đến Eukaryote. (A.Steinbuchel; Ẹ
Vandamme. S. De Baets và A.Steinbuchel), Winheim: Wiley-VCH., 2002;6:381-438.
78. Vailant F, Millan A, Dornier M và cộng sự. Chiến lược tối ưu hóa
kinh tế trong việc lọc nước ép trái cây dạng bột bằng cách sử dụng vi
lọc dòng chảy.J.Food. Bản tiếng anh., 2001;48:83-90.
79 . Van der Maarel MJEC , Van der Veen B , Uitdehaag JCM ,
Leemhuis H ,Dijkhuizen L .Tính chất và ứng dụng của enzym chuyển
hóa tinh bột thuộc họ α amylase . J . Biotechnol . 2002 ; 94: 137-155. 80
. Van Oort , M. Các enzym trong công nghệ thực phẩm – sản xuất .
Trong : Whitehurst RJ, van Oort M . ( eds) enzyme trong công nghệ thực
phẩm , xuất bản lần thứ 2. Chichester : Wiley – Blackwell .2010 ; 1-17 lOMoAR cPSD| 18638480 81
. Vengadaramana A. α – amylase của vi sinh vật quan trọng trong
công nghiệp trong quá trình chuyển đổi tinh bột . Sch . Acad .J . Pharm ,2013, 2(3) : 209-221. 82
. Vieille C và Zeikus GJ . Enzym ưa nhiệt : nguồn, công dụng và
cơ chế phân tử để điều nhiệt .Vi sinh Mol Biol .Rev 2001 ; 65: 1-43 83
. Vihinen M và Mantsala P . Amylolyyicenymes vi sinh vật
.Đánh giá quan trọng trong Hóa sinh và Sinh học phân tử , 1989 ; 24: 329- 4178 84
. Vishwanathan P , Surlikar NR . Sản xuất α – amylase với
Aspergillusflavus trên hạt dền bằng cách lên men ở trạng thái rắn, J.
Basic Microbiol, 2001; 41: 57-64 85
. Wind R .Ph .D. Luận văn Rijksuniversiteit Groningen ,Hà Lan . Năm 1997 86
. Windish WW và Mhatre NS. Các amylase của vi sinh vật
.Những tiến bộ trong ứng dụng vi sinh vật . Năm 1965 ; 7: 273-304 87
. Woyke T , Rubin EM. Sự phát triển .Tìm kiếm các nhánh mới
trên cây sự sống .Khoa học 2014 ; 346 : 698-699 88
. Xie , Z, Zhang ,Z . L , Hanzlik , S, Cook , E & Shen , Q.J.
(2007) . Axit salicylic ức chế sự biểu hiện α – amylase do gibberellin
gây ra và sự nảy mầm của hạt thông qua con đường liên quan đến gen
WRKY cảm ứng axit abscisic . Mol thực vật . Biol, 64 : 293-303 89
. Ye Z , Miyake H, Tatsumi M, Nishimura S và cộng sự . Hai vị
trí liên kết carbohydrate bổ sung của α - amylase từ bacillus cereus var
mycoides liên quan đến quá trình thủy phân và liên kết tinh bột thô . Tạp
chí hóa sinh , 2004 ; 135 :355- 363 lOMoAR cPSD| 18638480
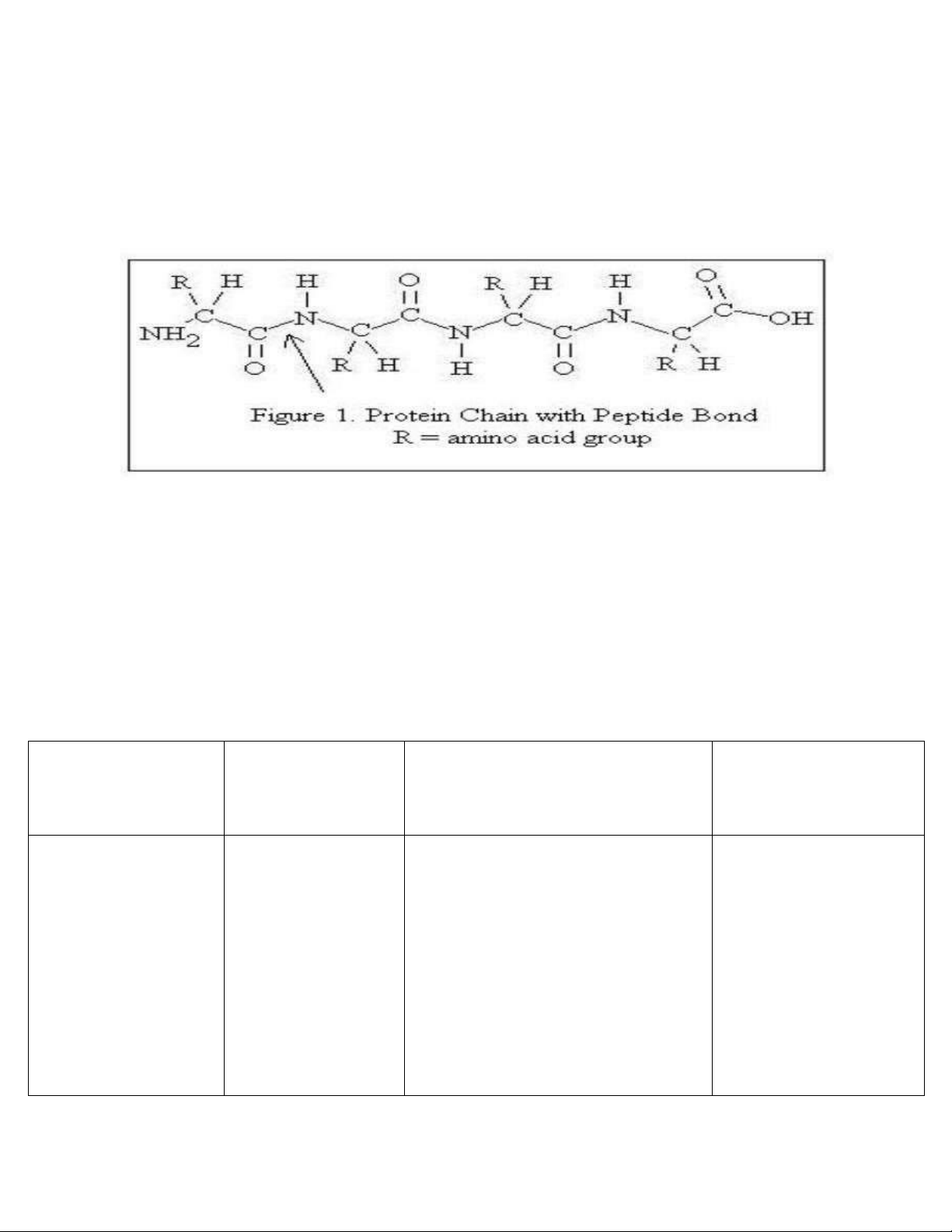
Hình 1: Cấu trúc protein điển hình: hai axid amin nối với nhau bằng liên kết peptit[50].
Bảng 1: Các loại enzym và chức năng của chúng Tính ẩn của Loại enzim Chức năng Ví dụ enzim Số lượng EC1 Các sản phẩm
Các enzim như vậy xúc tác Alcohol oxy hóa
việc chuyển các điện tử giữa dehydrogenase các phân tử. Quá trình
chuyển đổi của các phân tử
hydro diễn ra trong các hệ
thống sinh học. Các enzym
thực hiện điều này thường
được gọi là dehydrogenase. lOMoAR cPSD| 18638480 EC2 Transferase Các enzym như vậy di Aminotransferase
chuyển các dạng nguyên tử
khác nhau giữa các phân tử khác nhau. EC3 Hydrolases
Lớp enzym này phá vỡ các Amylase
phân tử với sự trợ giúp của nước. EC4 Lyases
Lyases loại bỏ các nhóm để Pectatelyase
tạo liên kết đôi, hoặc thêm các nhóm trong cơ chất thành liên kết đôi. EC5 Isomerase Các enzym này cho phép Mutase
cùng một phân tử thay đổi cấu trúc, bằng cách di
chuyển các nhóm từ vị trí này sang vị trí khác EC6 Ligases
Các enzym như vậy liên kết Sợi DNA
các phân tử với nhau thông
qua liên kết cộng hóa trị.
Những phản ứng như vậy
đòi hỏi năng lượng đầu vào
dưới dạng đồng yếu tố ATP.
Bảng 2: Phân loại Amylase Enzyme Tính đặc Phương thức Sản phẩm
hiệu của liên hành động kết glucosis lOMoAR cPSD| 18638480 𝛼-amylase (1,4-𝛼-D- 𝛼-(1-4) - Endo- Tuyến tính glucan glucosyl oligosaccharides và phân glucanhydrolase) nhánh 𝛽-amylase (1,4-𝛼-D- 𝛼-(1-4)- Exo Maltose và
glucanmaltohydrolase) glucosyl Dextrins giới hạn Amyloglucodidase 𝛼-(1-4)- Exo hoặc Endo Glucose (Exo-1,4-𝛼- glucosyl và glucosidase; Glucose glucoamylase) 𝛼(1-6)- glucosyl
Hình 2: Các loại Amylase khác nhau lOMoAR cPSD| 18638480
Bảng 3: Ứng dụng Amylase trong các ngành công nghiệp khác nhau Ngành công nghiệp Các ứng dụng Thực phẩm
Tinh bột hóa lỏng và đường hóa; sản xuất siro
ngô; chống đóng váng trong nướng. Nâng cao
thời hạn sử dụng của bánh mỳ; giảm sự hình
thành sương mù lạnh trong đồ uống. Chất tẩy rửa
Loại bỏ vết bẩn từ tinh bột Giấy
Giảm độ nhớt, khử dính, cải thiện hệ thống thoát nước Dệt may
Kích cỡ, sợi dọc của vật liệu Nhiên liệu sinh học Sản xuất ethanol Dược phẩm Hỗ trợ tiêu hóa Xử lý sinh học
Xử lý sinh học chất thải rau Da thú Tách sợi HẾT




