
Preview text:
Bài tập chương 5: Cân bằng lỏng – lỏng
Câu 1: Một dung dịch chứa 0,5 mol propanol và 0,5 mol etanol được chưng cho đến khi nhiệt độ sôi của
dung dịch là 90oC. Áp suất hơi của phần ngưng tụ thu được là 1066 mmHg (cũng đo ở 90oC). Xem dung
dịch là lý tưởng và biết rằng ở 90oC áp suất hơi bão hòa của propanol và etanol lần lượt là 574 và 1190 mmHg. Hãy tính:
a) Thành phần mol của phần (hơi) ngưng tụ
b) Thành phần mol của dung dịch trong bình chưng
c) số mol etanol đã hóa hơi
ĐS: xE = 0,8; xE = 0,3; 0,32 mol
Câu 2: Chưng cuốn brombenzen bằng hơi nước ở áp suất 760 mmHg thì hệ bắt đầu sôi ở 368,3 K. Biết
rằng brombenzen không tan trong nước, áp suất hơi của nước và brombenzen ở nhiệt độ trên lần lượt là
639 và 121 mmHg. Tính lượng brombenzen tối đa chưng cuốn được cùng với 0,5 kg nước. ĐS: 825,81 g
Câu 3: Dưới áp suất 760 mmHg, hệ benzene-H2O sôi ở 66 oC; biết P*benzene = 540 mmHg. Tính lượng
hơi nước tối thiểu để chưng cuốn 1 kg benzene ở nhiệt độ này. ĐS: 94 g
Câu 4: Nước và cacbontetraclorua CCl4 là hai chất lỏng không tan lẫn. Ở 25oC dung dịch chứa I2 trong
nước có nồng độ 0,0612 g/l nằm cân bằng với dung dịch chứa I2 trong CCl4 có nồng độ 5,202 g/l. Lắc
đều 10 ml dung dịch I2/CCl4 nồng độ 3,2 g/l với 150 ml nước cất đến cân bằng. Tính nồng độ của I2 trong
CCl4 và trong nước lúc cân bằng.
ĐS: [I2/H2O]=0,032 g/l; [I2/CCl4] = 2,72 g/l
Câu 5: Hệ số phân bố iot I2 giữa nước và sulphua carbon CS2 bằng k = CH2O /CCS2 = 0,00167. Tính lượng
iot có thể rút ra từ 2.10-3 m3 nước chứa 2.10-5 kg iot, nếu biết: (MI2 = 254 g/mol)
a) Dùng 0,05.10-3 m3 CS2 chiết một lần,
b) Dùng lượng CS2 đó chiết 5 lần.
ĐS: 1,875.10-5 kg và 1,998.10-5 kg
Câu 6: a) Ở 25 oC, hệ số phân bố I2 trong H2O và CCl4 tính theo phần mol: KN = 0,0022. Nếu hệ ban đầu
gồm 0,01 mol I2, 1 mol H2O và 1mol CCl4 thì phần mol của I2 trong mỗi pha tại cân bằng sẽ là bao nhiêu.
(ĐS: trong H2O: 2,17.10-5; trong CCl4: 9,98.10-3)
b) Từ kết quả trên, tính hệ số phân bố I2 trong H2O và CCl4 theo nồng độ mol/l. Biết ở 25oC, khối lượng
riêng của CCl4 là 1,59 g/ml; khối lượng riêng của nước là: 0,997 g/ml. (ĐS: 0,012)
c) Nồng độ I2 trong CCl4 tại cân bằng là 0,0734mol/l. Xác định thể tích Na2S2O3 0,0100 mol/l để chuẩn
độ I2 trong 25 ml dung dịch nước. Biết:
2Na2S2O3 + I2 → Na2S4O6 + 2NaI (ĐS: 4,4 ml)
d) Xác định hệ số phân bố I2 trong H2O và CCl4 theo nồng độ molan. (ĐS: 0,019)
Câu 7: Hệ 2 chất lỏng phenol và nước có bảng nhiệt độ chuyển trạng thái (từ trong sang đục) – thành
phần khối lượng như sau:
%phenol 10 20 30 35 40 45 50 55 60 70
t (oC) 42 52 60 67 66 65 63 60 50 28
a) Lấy 10 g phenol và 20 g nước cho vào ống nghiệm và giữ ở 60oC. Xác định số pha, thành phần và
khối lượng mỗi pha trong hệ ở trạng thái cân bằng.
b) Nếu thêm vào hệ (a) 20 g nước, giữ nguyên nhiệt độ thì quan sát thấy hiện tượng gì?
ĐS: a) 2 pha; 4g; 26 g;
Bài tập chương 6: Cân bằng lỏng – rắn
Câu 1: nêu một số đặc điểm của điểm eutecti trên giản đồ pha của hệ hai cấu tử A và B Câu 2:
a. Vẽ giản đồ thành phần – nhiệt độ nóng chảy của hỗn hợp đồng – niken dựa vào bảng số liệu sau: Ni (%) 0 20 40 60 80 100 Nhiệt độ bắt đầu 1373 1467 1554 1627 1683 1728 kết tinh (K) Nhiệt độ kết thúc 1373 1406 1467 1543 1629 1728 kết tinh (K)
b. Ghi trên giản đồ các điểm:
- cân bằng giữa đồng nguyên chất lỏng và rắn
- hỗn hợp nóng chảy chứa 45% Ni cân bằng với dung dịch rắn
- Hỗn hợp nóng chảy cân bằng với dung dịch rắn chứa 65% Ni
- Hỗn hợp nóng chảy có 50% Ni ở 1670 K
Câu 3: Phân tích các miền, các đường cân bằng và các điểm cân bằng của giản đồ pha sau:
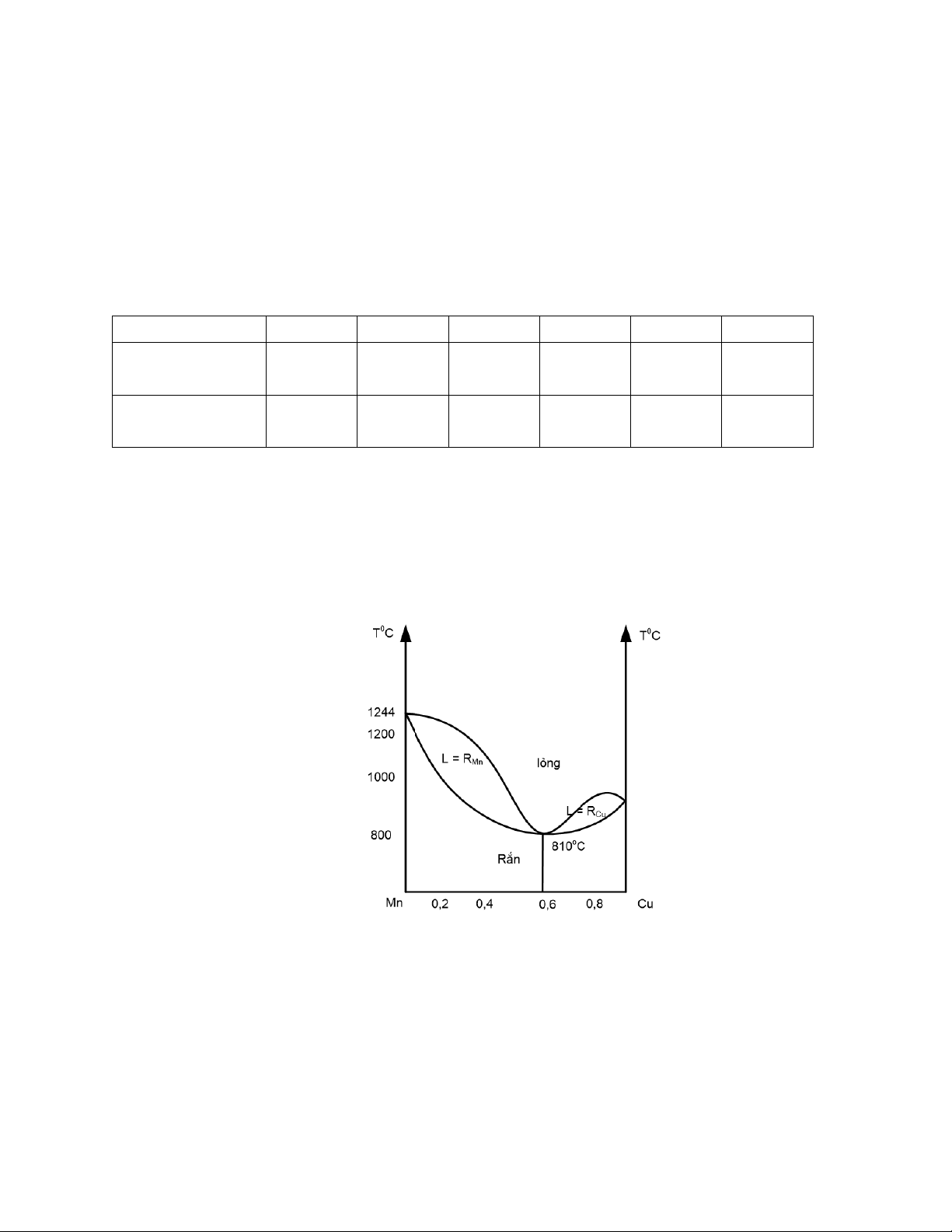
Bài 4: Cho giản đồ pha "Nhiệt độ - Thành phần (% mol)" của hệ AgCl - KCl như hình vẽ:
a. Từ giản đồ, hãy xác định điểm nóng chảy của AgCl và KCl.
b. Xác định nhiệt độ, số pha và thành phần của hệ M.
c. Nếu có 10 mol hệ M, xác định thành phần pha rắn và pha lỏng
d. Cần thêm bao nhiêu AgCl ở 500oC vào hệ M để hệ thành đồng thể. (ĐS: 4 mol)
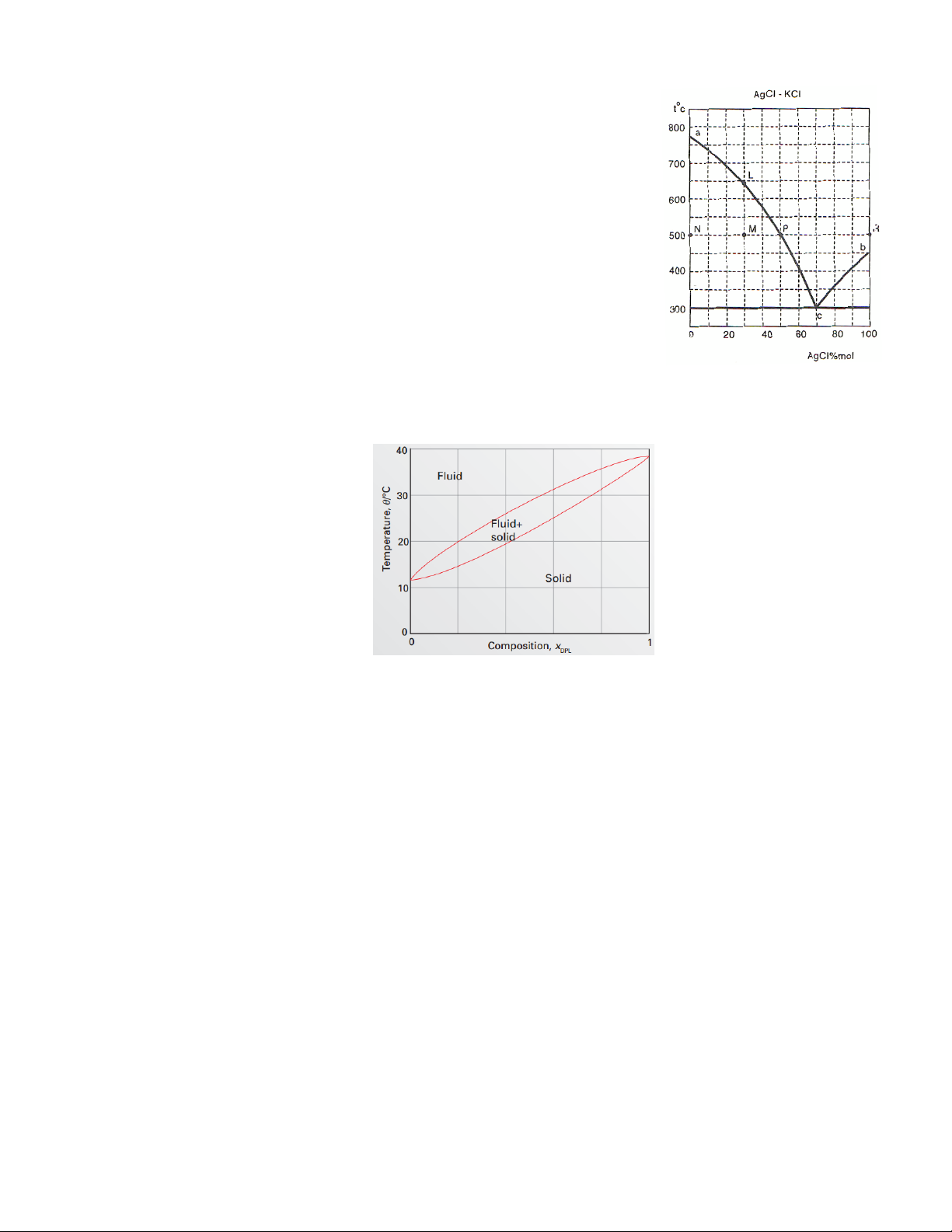
Bài 5: Giải thích quá trình làm lạnh từ 45°C của hỗn hợp lỏng gồm Dielaidoylphosphatidylcholine (DEL)
và Dipalmitoylphosphatidylcholine (DPL) có thành phần xDEL=0,5
Giản đồ nóng chảy của Dielaidoylphosphatidylcholine (DEL) và Dipalmitoylphosphatidylcholine (DPL).




