
Preview text:
Bài tập chương 6: Cân bằng lỏng – rắn
Câu 1: Dung dịch chứa 2,433 gam lưu huỳnh trong 100 gam naphtalen nóng chảy ở 79,599 oC.
Biết rằng nhiệt nóng chảy của naphtalen là 35,5 cal/gam, nhiệt độ nóng chảy của naptalen là 80,2
oC. Xác định độ liên hợp của lưu huỳnh trong dung dịch trên (số nguyên tử trong 1 phân tử liên
kết của lưu huỳnh). (ĐS: 9)
Câu 2: Ở 20oC áp suất hơi bão hòa của nước là 17,54 mmHg, một dung dịch ure có áp suất hơi
là 17,22 mmHg. Xác định áp suất thẩm thấu của dung dịch trên ở 40oC, biết khối lượng riêng của
dung dịch là 1,01 g/ml. M(ure) = 60,06 g/mol. (ĐS: = 25,2 atm)
Câu 3: Trong 100ml dung dịch (dung môi nước) có 1 gam myoglobin. Áp suất thẩm thấu của
dung dịch đó ở 25oC là 11 mmHg. Xác định khối lượng của phân tử myoglobin.
ĐS: M = 16852,4 g/mol
Câu 4: Cho dung dịch chứa 1 gam một chất tan trong 15 ml benzen ở 20oC. Khối lượng riêng
của benzen ở nhiệt độ này là 0,8765g/ml. Độ hạ điểm kết tinh của dung dịch T = 3,04oC. Kl
(benzen) = 5,1 (K.Kg/mol). Tìm khối lượng phân tử của chất tan.
ĐS: M= 127,6 g/mol
Câu 5: Khối lượng riêng của etylen glycol ở 25 oC là 1,1088g/cm3. Tính nhiệt độ kết tinh của
hỗn hợp chứa 0,5 lit etylen glycol và 9,5 lit nước. Coi dung dịch là loãng và etylen glycol là chất
tan không bay hơi. M(EG) = 62,07 g/mol; Kl (H2O) = 1,86 (độ.Kg/mol).
ĐS: 371,251 K
Câu 6: Để xác định phân tử lượng M của một chất hữu cơ khó bay hơi X, ta làm thí nghiệm sau:
Hai cốc thủy tinh A và B được đặt trong một chuông thủy tinh kín; cốc A chứa 0,1 mol naphtalen
trong 100 g benzen; cốc B chứa 10 g chất X trong 100 g benzen. Hai cốc được đặt cạnh nhau cho
đến khi đạt trạng thái cân bằng. Sau đó lấy cốc A ra cân lại thấy khối lượng cốc A giảm 8 g. Hãy
tính M và nêu những điều kiện gần đúng trong thí nghiệm. M(benzen) = 78,11 g/mol
(ĐS: M = 85,2 g/mol)
Câu 7: nêu một số đặc điểm của điểm eutecti trên giản đồ pha của hệ hai cấu tử A và B Câu 8:
a. Vẽ giản đồ thành phần – nhiệt độ nóng chảy của hỗn hợp đồng – niken dựa vào bảng số liệu sau: Ni (%) 0 20 40 60 80 100 Nhiệt độ bắt đầu 1373 1467 1554 1627 1683 1728 kết tinh (K) Nhiệt độ kết thúc 1373 1406 1467 1543 1629 1728 kết tinh (K)
b. Ghi trên giản đồ các điểm:
- cân bằng giữa đồng nguyên chất lỏng và rắn
- hỗn hợp nóng chảy chứa 45% Ni cân bằng với dung dịch rắn
- Hỗn hợp nóng chảy cân bằng với dung dịch rắn chứa 65% Ni
- Hỗn hợp nóng chảy có 50% Ni ở 1670 K
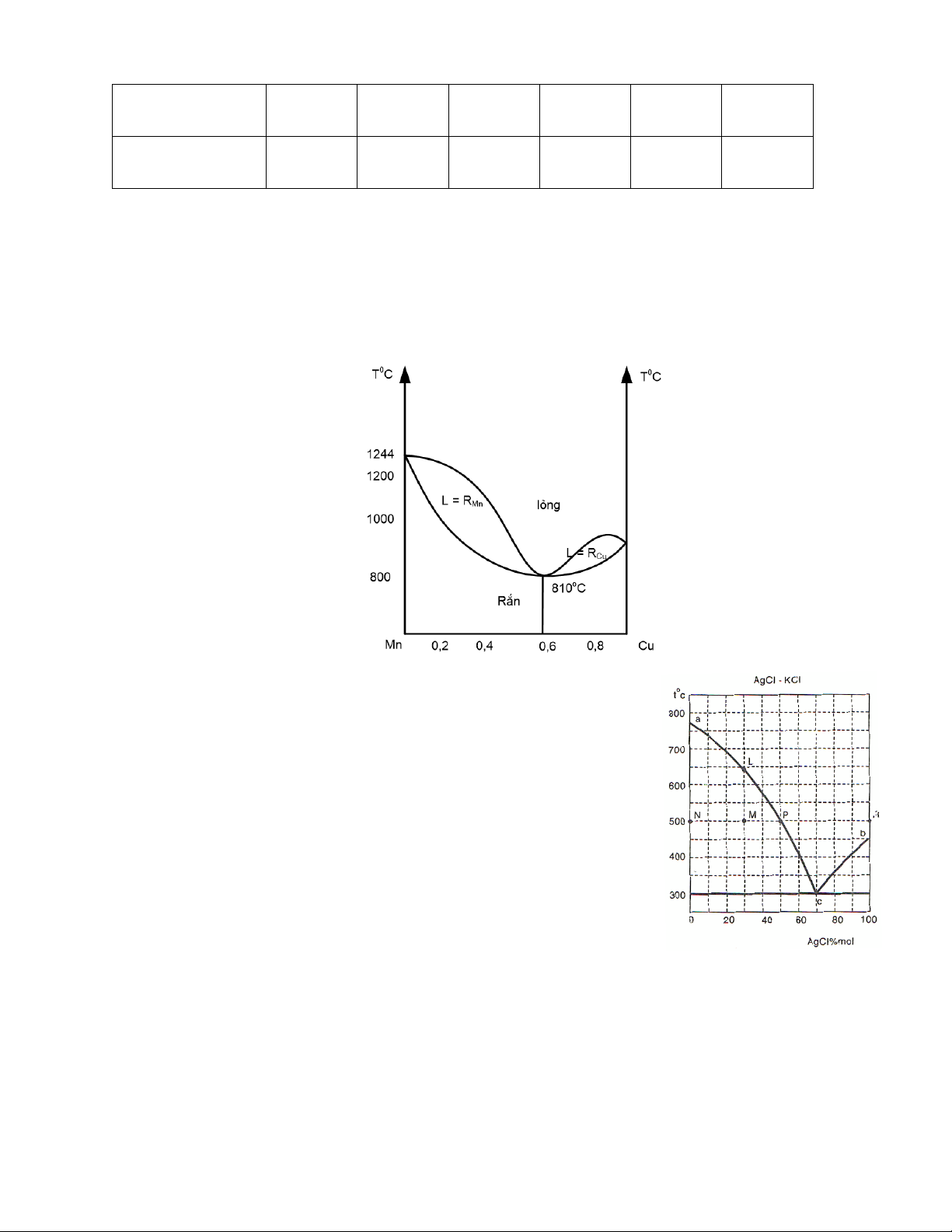
Câu 9: Phân tích các miền, các đường cân bằng và các điểm cân bằng của giản đồ pha sau:
Bài 10: Cho giản đồ pha "Nhiệt độ - Thành phần (% mol)" của hệ AgCl - KCl như hình vẽ:
a. Từ giản đồ, hãy xác định điểm nóng chảy của AgCl và KCl.
b. Xác định nhiệt độ, số pha và thành phần của hệ M.
c. Nếu có 10 mol hệ M, xác định thành phần pha rắn và pha lỏng
d. Cần thêm bao nhiêu AgCl ở 500oC vào hệ M để hệ thành đồng thể. (ĐS: 4 mol)
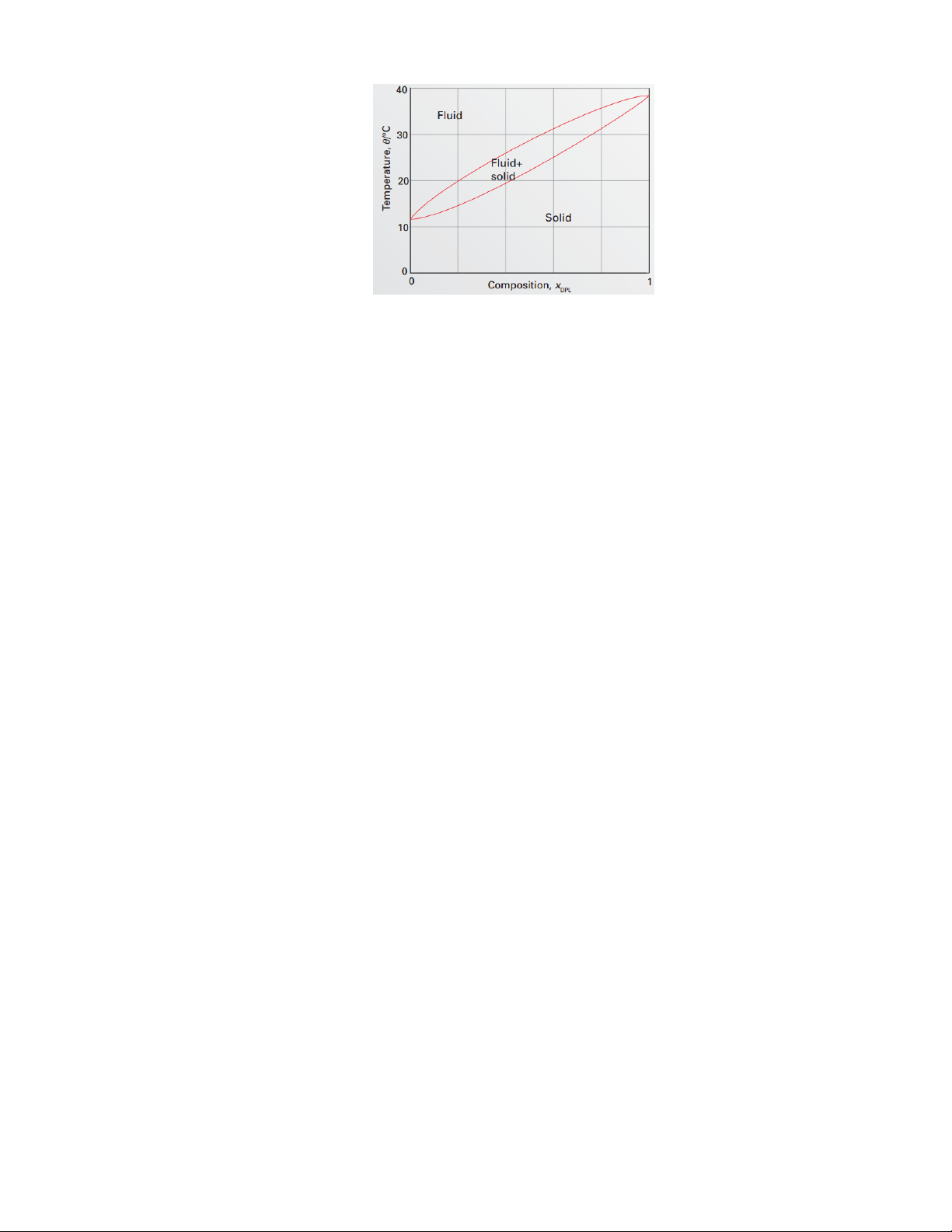
Bài 11: Giải thích quá trình làm lạnh từ 45°C của hỗn hợp lỏng gồm Dielaidoylphosphatidylcholine
(DEL) và Dipalmitoylphosphatidylcholine (DPL) có thành phần xDEL=0,5
Giản đồ nóng chảy của Dielaidoylphosphatidylcholine (DEL) và Dipalmitoylphosphatidylcholine (DPL).




