

Preview text:
BÀI TẬP CHUNG HÓA LÝ 1
Bài tập chương Cân bằng hóa học
Câu 1: Xác định hằng số cân bằng Kp của phản ứng: SO2(k) + 1/2O2(k) = SO3(k) ở 700K.
Biết rằng ở 500K, hằng số cân bằng Kp = 2,138.105 atm-1/2 và hiệu ứng nhiệt của phản ứng
trong khoảng nhiệt độ từ 500 đến 700K là ∆H = -23400 cal.
ĐS: Kp (700) = 255,491 atm-1/2
Câu 2: Hằng số cân bằng ở 1000K của phản ứng: 2H2O(h) = 2H2(k) + O2(k) là KP =
7,76.10-21 atm. Áp suất phân ly của FeO ở nhiệt độ đó là 3,1.10-18 atm. Hãy xác định KP ở
1000K của phản ứng: FeO(r) + H2(k) = Fe(r) + H2O(h) ĐS: KP (1000K) = 20.
Câu 3: Đun nóng tới 445oC một bình kín chứa 8 mol I2 và 5,3 mol H2 thì tạo ra 9,5 mol HI
lúc cân bằng. Xác định lượng HI thu được khi xuất phát từ 8 mol I2 và 3 mol H2. ĐS: 734,72 g
Câu 4: Hằng số cân bằng của phản ứng: CO(k) + H2O(h)
CO2(k) + H2(k) ở 800K là KP = 4,12.
Đun hỗn hợp chứa 20% CO và 80% H2O (% khối lượng) đến 800K. Xác định lượng hydro
sinh ra nếu dùng 1 kg nước. ĐS: 17,1 g
Câu 5: ở 750oC đối với phản ứng: 1 1 SnO2(r) + H2(k) = Sn(r) + H2O(h) 2 2
Phệ = 32,0 mmHg, PH2O = 23,7mmHg (ở cân bằng) a) Tính Kp
b) Đối với phản ứng: H2(k) + CO2(k) = CO(k) + H2O(k) thì ở 750oC, Kp = 0,771. Tính Kp của phản ứng: 1 1 SnO2(r) + CO(k) = Sn(r) + CO2(k) 2 2 §S: a) 2,85; b) 3,71
Câu 6: ở T = 1273K, Phệ = 30,4 atm, cân bằng trong phản ứng: CO2(k) + C(r) = 2CO(k) đạt
được với % số mol CO2 = 17%.
a) Tính % số mol CO2 nếu Phệ = 20,3atm.
b) Nếu thêm N2 vào hỗn hợp phản ứng (Vhệ = const) cho đến khi PN2 = 10atm thì cân bằng
sẽ thay đổi như thế nào?
c) Tại áp suất nào thì % số mol khí CO2 = 25%?
ĐS: a) %CO2 = 12,59%; c) P = 54,75atm 1
Câu 7: Khi nung NH4Cl ở 427oC (tạo thành NH3(k) và HCl(k)), áp suất hơi của hệ đo được
bằng 4650 mm Hg. Ở 459oC áp suất hơi của hệ tăng đến 8360 mm Hg. Giả sử hơi tuân theo
định luật của khí lý tưởng.
a) Xác định các hằng số cân bằng Kp ở hai nhiệt độ trên.
b) Tính các biến thiên năng lượng Gibbs ở 1 atm (Go).
c) Giả sử trong khoảng nhiệt độ từ 427oC đến 459oC, biến thiên enthalpy ở 1 atm (Ho)
không phụ thuộc vào nhiệt độ, hãy tính Ho.
d) Biến thiên entropy chuẩn (So) của phản ứng nhiệt phân NH4Cl ở 427oC từ các điều kiện nêu trong mục b) và c).
ĐS: a) 9 atm2 và 30,25 atm2; b) Tính cho 1 mol NH4Cl :-12,7874 kJ/mol và -2,75
kJ/mol; c) 161,389 kJ/mol; d) 248,82 J/(mol.K)
Câu 8: Hằng số cân bằng của phản ứng: 2H (nguyên tử khí) = H2 (khí)
có thể biểu diễn bằng phương trình: lgKp = 22570/T – 1,504lgT – 0,767. Trong đó, hằng số
cân bằng Kp và nhiệt độ T có đơn vị atm-1 và K, tương ứng. Xác định hiệu ứng nhiệt của
phản ứng đã cho ở 800K. ĐS: - 441,9 kJ
Câu 9: Có thể điều chế clo bằng phản ứng: 4HCl(k) + O2 → 2H2O(h) + 2Cl2
Xác định hằng số cân bằng Kp của phản ứng ở 386oC, biết rằng ở nhiệt độ đó và áp suất hệ
1atm, khi cho 1 mol HCl tác dụng với 0,48 mol O2 thì khi cân bằng sẽ thu được 0,402 mol Cl2. (ĐS: 9,773 atm-1)
Câu 10: ở 500oK, hằng số cân bằng của phản ứng:
PCl3 (k) + Cl2 → PCl5 (k) là Kp = 3 atm-1
a) Tính độ phân ly α của PCl5 ở 1 atm và ở 8 atm.
b) Tính áp suất mà ở đó có độ phân ly α = 10% .
c) Phải thêm bao nhiêu mol Cl2 vào 1 mol PCl5 để độ phân ly của PCl5 ở 8 atm là α = 10%.
(ĐS: a) 0,5; 0,2; b) 33 atm; c) 0,5 mol)
Câu 11: Hằng số cân bằng Kp ở 25oC và 50oC của phản ứng
CuSO4.3H2O(r) → CuSO4(r) + 3H2O(h) lần lượt là 10-6 và 10-4 atm3;
a) Tính hiệu ứng nhiệt trung bình của phản ứng trong khoảng nhiệt độ trên
b) Tính lượng hơi nước tối thiểu phải thêm vào một bình có thể tích 2 lít ở 25oC để chuyển
hoàn toàn 0,01 mol CuSO4 trong bình thành CuSO4.3H2O.
Câu 12*: a) Phản ứng C(gr) + CO2(k) = 2CO(k) ở 900oC có Kp = 39 (atm). Cho dư C(gr)
(thể tích không đáng kể) vào một bình kín (thể tích không đổi), chứa khí CO2, áp suất ban
đầu 1 atm, ở 800oC khi phản ứng đạt cân bằng, áp suất tổng cộng bằng bao nhiêu? Biết rằng
trong khoảng từ 800 – 900oC, hiệu ứng nhiệt trung bình của phản ứng là 172,52kJ 2
b) Phản ứng CO(k) + Cl2(k) = COCl2(k) có phương trình lg Kp = 5020/T – 1,75lg T – 1,171.
Xác định thành phần % thể tích của hỗn hợp cân bằng khi cho 1,16 mol COCl2 vào 1 bình
kín dung tích 8,8 lít ở 800oC.
c) Phản ứng CaCO3 = CaO + CO2 (k) có ΔH = 154,8 kJ; áp suất phân ly ở 880oC bằng 1atm.
Cho dư bột CaCO3, C(gr) vào một bình kín có dung tích 8,8 lít, chứa 0,2048 mol Cl2. Giữ
bình ở nhiệt độ 800oC đến khi các phản ứng đạt cân bằng. Áp suất riêng phần của mỗi khí bằng bao nhiêu?
Câu 13: Cho phản ứng: N2O4(k) 2NO2(k)
a) Biết độ chuyển hóa của phản ứng ở 100 oC; 1 atm đạt 89%. Tính giá trị của KP và Go của phản ứng ở 100oC
b) Biết Ho298 = 57,01 kJ (giả thiết Ho không phụ thuộc vào nhiệt độ). Tính giá trị của KP
và thành phần các chất của phản ứng tại trạng thái cân bằng ở 25oC. Nhận xét và giải thích
ảnh hưởng của nhiệt độ tới chiều chuyển dịch cân bằng.
c) Áp suất của phản ứng là bao nhiêu để hiệu suất phản ứng đạt 99% ở 100oC. Nhận xét và
giải thích ảnh hưởng của áp suất tới chiều chuyển dịch cân bằng phản ứng.
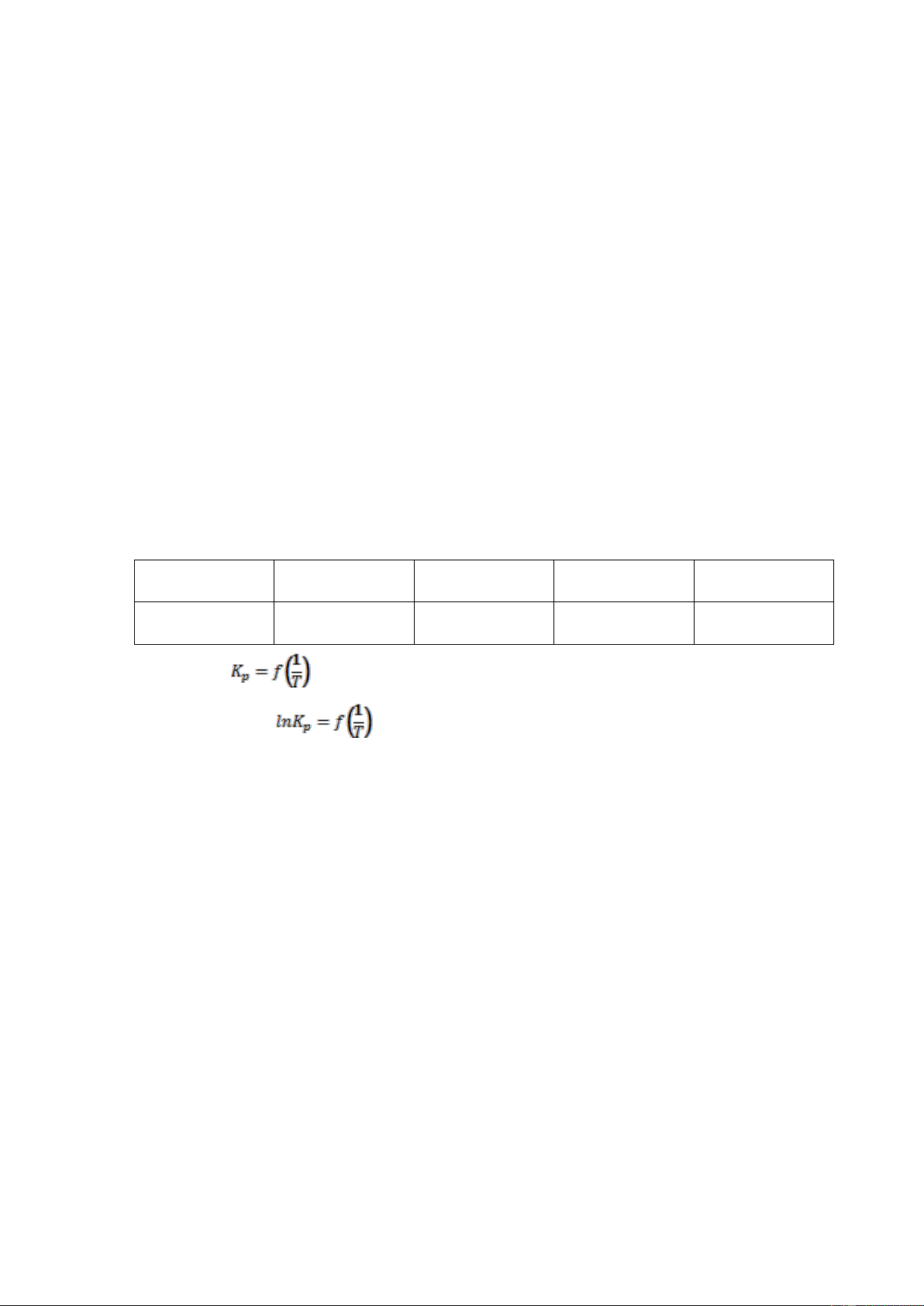
Câu 14: Cho cân bằng trong pha khí: I2 2I
Coi khí là lý tưởng. Hằng số cân bằng của phản ứng Kp ở một số nhiệt độ như sau: T (K) 950 1050 1150 1250 Kp (Pa) 1,134.10-3 7,316.10-3 33,83.10-3 127.10-3 a. Dựng đồ thị
trong khoảng nhiệt độ 950 – 1250K b. Lập phương trình
trong khoảng nhiệt độ 950 – 1250K
c. Xác định hiệu ứng nhiệt trong khoảng nhiệt độ nghiên cứu 3




