






Preview text:
Bài 1 d [O ] Đối với phản ứng 2N 2
2O5 (k) à 4NO2 + O2 tốc độ được biểu thị bằng công thức v= . Hãy viết biểu dt
thức tốc độ với các chất khác trong phương trình phản ứng Bài 2
Một phản ứng hóa học cân bằng được viết theo 2 cách khác nhau Cách 1: 2NO + Cl2 - à 2NOCl Cách 2: NO + ½ Cl - 2 à NOCl
a. Nếu tốc độ phản ứng tương ứng với cách viết 1 là 7.1x10-5 mol.L-1.s-1 thì tốc độ
phản ứng tương ứng với cách viết 2 là như thế nào ?
b. Viết phương trình diễn tả sự thay đổi tốc độ phản ứng theo các chất. Bài 3:
Một phản ứng hóa học cân bằng được viết theo 2 cách khác nhau Cách 1: 2O3 à 3O2 Cách 2: O3 à 3/2 O2
a. Nếu tốc độ phản ứng tương ứng với cách viết 1 là 5.0x10-4 mol.L-1.s-1 thì tốc độ
phản ứng tương ứng với cách viết 2 là như thế nào ?
b. Viết phương trình diễn tả sự thay đổi tốc độ phản ứng theo các chất. Bài 4
Trộn 1 lít dung dịch CH3COOH 2M với 1 lít dung dịch C2H5OH 3M. Xác định tốc độ hình thành
ethylacetate. Cho biết phản ứng là bậc 1 đối với các chất tham gia phản ứng.
Tốc độ phản ứng sẽ thay đổi như thế nào nếu trước khi phản ứng, mỗi dung dịch được pha loãng 2 lần ? Bài 5
Sự phân hủy N2O5 xảy ra theo phương trình sau: 2N2O5 à 2N2O4 + O2
Phản ứng tuân theo quy luật động học bậc nhất với hằng số tốc độ phản ứng k = 0,0015 phut-1. Hỏi sau 1,5
giờ có bao nhiêu phần trăm N2O5 bị phân hủy. Bài 6
Sự đào thải một kim loại nặng ra khỏi cơ thể tuân theo động học phản ứng là bậc 1 và có thời gian bán
đào thải là 60 ngày. Một người cân nặng 60 kg bị ngộ độc 6.4x10-3 gram kim loại nặng. Hỏi phải mất bao
nhiều ngày để mức kim loại nặng của người này về mức bình thường (mức bình thường là 23 ppb/gram khối lượng cơ thể) Bài 7
Sự thủy phân một ester trong môi trường kiềm xảy ra như sau
RCOOR’ + NaOH à RCOONa + R’OH
Khi tăng nồng độ kiềm lên 2 lần thì tốc độ của phản ứng cũng tăng lên 2 lần. Kết quả tương tư, khi tăng
nồng độ ester lên 2 lần thì vận tốc cũng tăng 2 lần
a) Xác định bậc của phản ứng và dạng phương trình dộng học
b) Hòa tan 0,01 mol NaOH và 0,01 mol ester vào 1 lít nước (thể tích không thay đổi trong quá trình
phản ứng). Sau 200 phút ester bị thủy phân 60%. Tính
+ Hằng số tốc độ phản ứng
\’+ Thời gian bán phản ứng
+ Thời gian để 99% ester bị phân hủy
Đáp số: k 0,75 mol-1.l.phut-1 T1/2 = 133,33 phút T = 13200 phút Bài 8
Người ta đo tốc độ đầu hình thành chất C đối với phản ứng A + B à C và thu được kết quả như sau: Số thí nghiệm a (M) b (M) V -1 0.103 (M.phút ) I 0,1 0,1 2,0 II 0,2 0,2 8,0 III 0,1 0,2 8,0 Tính:
a) Bậc đối với chất A và B
b) Hằng số tốc độ phản ứng c) Tính v0 khi a = b = 0,5 M Bài 9
Carbon (C) 14 là chất đồng vị của Carbon 12. 14C là chất phóng xạ vì vậy nó bị mất dần khối lượng theo
thời gian, trong khi 12C vẫn bền vững. Tỷ lệ 14C và 12C trong cơ thể sống là không đổi. Đồng vị phóng xạ
14C có chu kỳ bán rã là 5730 năm, sự phân rã phóng xạ này là quá trình bậc nhất. Một bộ xương người
được phát hiện có hàm lượng 14C giảm chỉ còn 1% so với thời điểm ban đầu của nó. Hỏi người này sống cách đây bao nhiêu năm ? Đáp số: 38057 năm Bài 10
Một sinh viên năm I bắt đầu học môn học mà không có điều kiện để ôn tập. Giả sử rằng sinh viên sẽ quên
một nửa những gì đã được học sau 6 tháng nếu không ôn tập. Hỏi sau khi tốt nghiệp đại học (4 năm) bao
nhiêu kiến thức đã được học mà sinh viên này còn nhớ. Coi sự quên như là quá trình bậc I Bài 11
Khi nghiên cứu phản ứng phân hủy ở pha khí của N2O3 ta có các số liệu sau: Thời gian (s) 0 1109 2218 Nồng độ (M) 0,5 0,25 0,125
a) Xác định bậc của phản ứng
b) Xác định hằng số tốc độ phản ứng Bài 12
Nghiên cứu phản ứng chậm giữa NO và H2 2NO + 2H2 à 2H2O + N2
Cho thấy bậc đối với NO bằng 2 khi H2 dư và bậc đối với H2 bằng 1 khi NO dư
a) Viết phương trình tốc độ của phản ứng và xác định bậc toàn phần
b) Phản ứng trên là đơn giản hay phức tạp ? Tại sao ? Bài 13
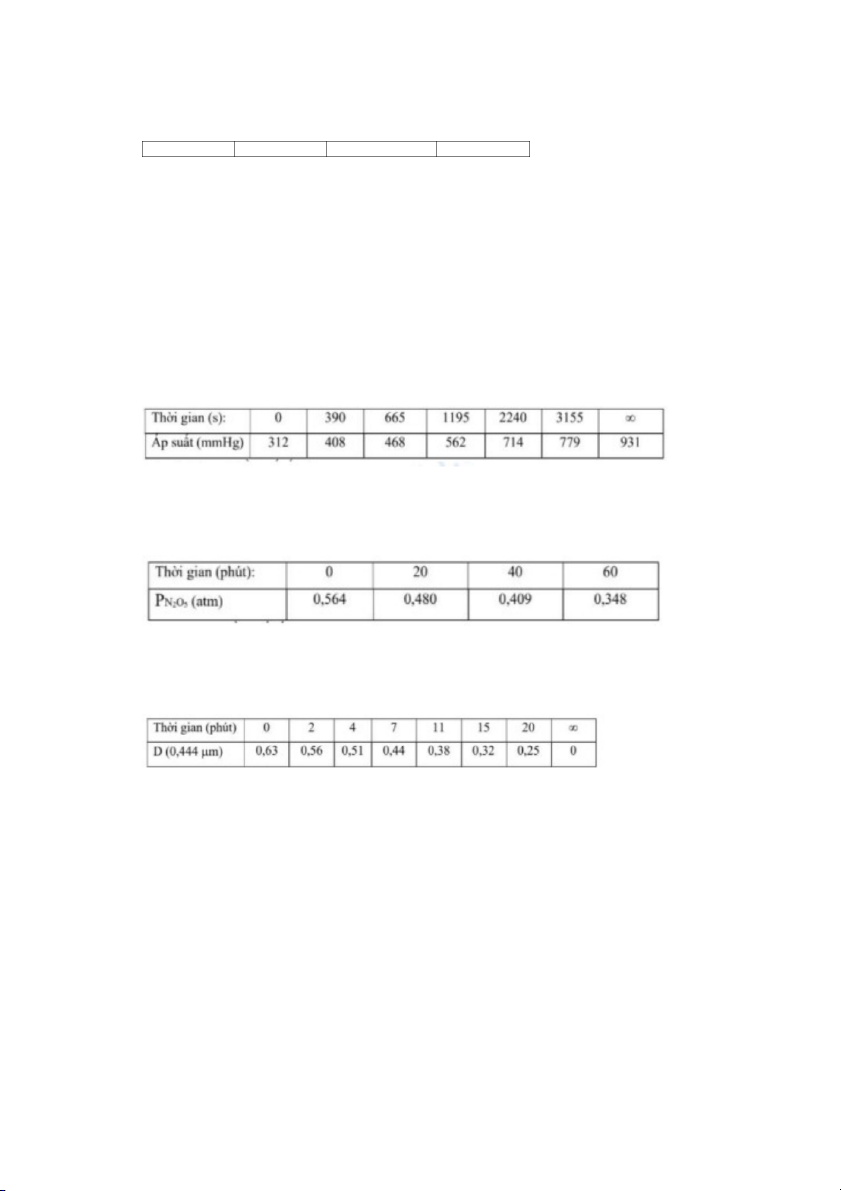
Hơi dimetyleter ở 504 C phân hủy theo phương trình: CH o 3OCH → CH 3 + H 4 + CO 2
Sự phụ thuộc của áp suất chung vào thời gian như sau:
Hãy xác định bậc và hằng số tốc độ. Bài 14
Trong phản ứng phân hủy N2O thành N 5 2O và O 4 . Biết P 2
N2O5 phụ thuộc vào thời gian như sau:
Hãy xác định bậc và hằng số tốc độ. Bài 15
Phản ứng làm mất màu của một chất dưới tác động của tia tử ngoại được theo dõi bằng
phương pháp trắc quang. Mật độ quang D phụ thuộc vào thời gian như sau:
Hãy xác định bậc và hằng số tốc độ. Bài 16
Sự thủy phân của acid monocloroacetic ở 25oC như sau:
ClCH2COOH + H2O à HOCH2COOH + HCl
Kết quả chuẩn độ cùng một thể tích mẫu hỗn hợp phản ứng với dd NaOH được cho trong bảng sau T (phút) 0 600 700 2070 NaOH 12.9 15.8 16.4 20.5
Hãy xác định hằng số tốc độ phản ứng. Sau bao lâu ba acid có hàm lượng bằng nhau ? Bài 17
Cho phản ứng: CH3COCH3 = C2H4 + CO + H2
Áp suất tổng biến đổi như sau: Thời gian (phút) 0 6,5 13 19,9 Ptổng (PT)(N/m2) 41589,6 54386,6 65050,4 74914,6
Chứng minh đây là phản ứng bậc 1 và tính giá trị hằng số tốc độ phản ứng.
Hướng dẫn: Viết phản ứng như sau: CH3COCH3 = C2H4 + CO + H2 Khi t =0 P0 0 0 0 Ở t/g t (P0 – x) x x x
Chứng minh ở thời điểm t, áp suất của Aceto
Phương trình động học cho phản ứng b Bài 18
Thời gian bán phản ứng (Chu kỳ bán hủy) t1/2 của N2O5 là 5,7 giờ và đây
là phản ứng bậc 1. Tính hằng số tốc độ phản ứng và thời gian cần thiết
để phản ứng hết 75% và 87% lượng chất ban đầu. Bài 19
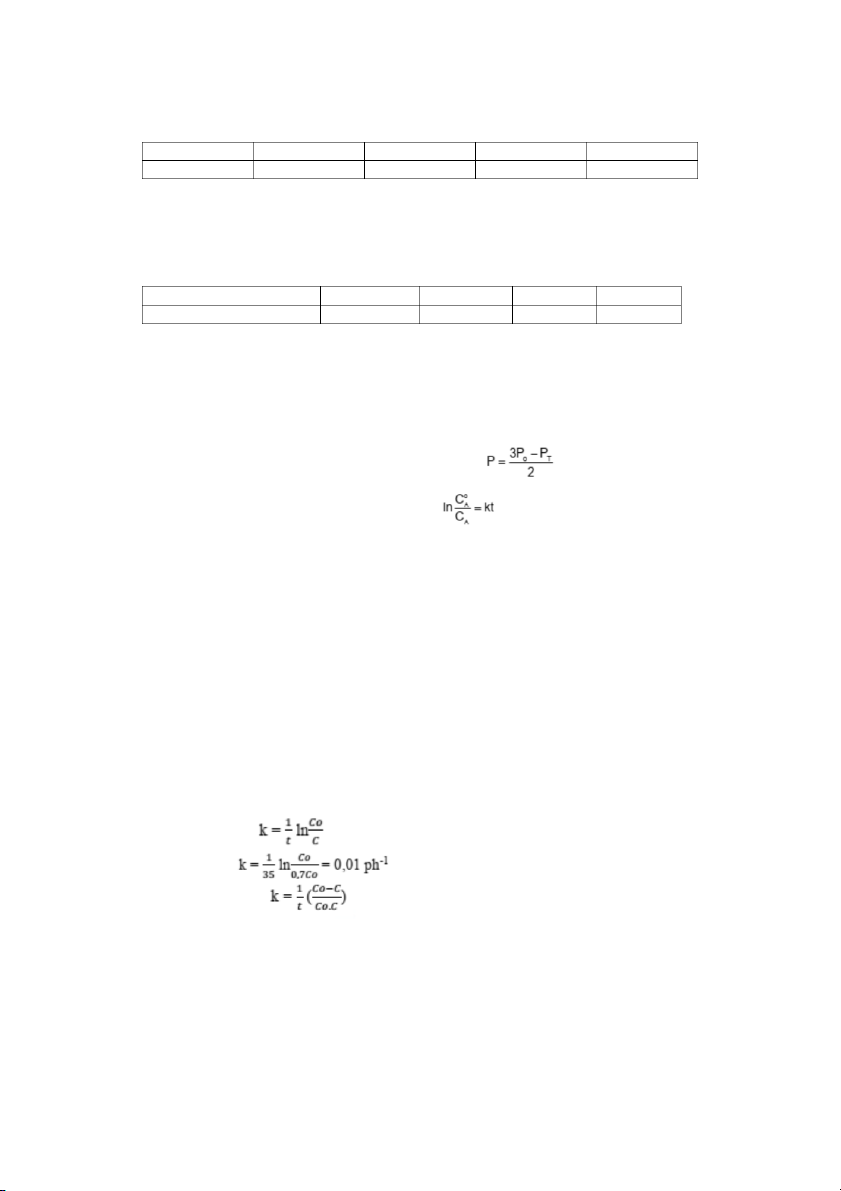
Một phản ứng bậc 1 đơn giản xảy ra được 30% trong 35 phút. Hãy tính hằng số tốc độ k.
Hỏi sau 5 giờ còn lại bao nhiêu % chất phản ứng.
Tương tự: Một phản ứng bậc 2 đơn giản xảy ra được 30% trong 30 phút. Hãy tính hằng
số tốc độ và sau 1 giờ còn lại bao nhiêu % chất phản ứng. Giải Phản ứng bậc 1 : Sau 35 phút :
⟹Sau 5 giờ lượng chất phản ứng còn lại : 5% Phản ứng bậc 2: Sau 30 phút :
⟹Sau 1 giờ lượng chất phản ứng còn lại : 53,85% Bài 20
Một phản ứng bậc 1 đã phản ứng được 25% trong 50 phút. Hỏi sau 50 phút nữa nồng độ
của tác chất là bao nhiêu. Biết nồng độ đầu là 5.103 mol.dm-3 Đáp án
Phản ứng bậc 1 đã phản ứng được 25% trong 50 phút ⟹ Sau 50ph nữa thì lương chất
còn lại là 1 nửa so với ban đầu ⟹ C = 2,5.103 -3 100ph mol.dm Bài 21
Trộn 2 chất A và B có cùng thể tích và nồng độ. Phản ứng xảy ra theo phương trình:
A + B → C. Sau 1 giờ A phản ứng hết 75%. Hỏi sau 2 giờ A còn lại bao nhiêu, nếu phản ứng là:
a. Bậc 1 theo A và bậc 0 theo B
b. Bậc 1 theo mỗi cấu tử.
c. Bậc 0 theo mỗi cấu tử. Đáp án:
a. K=1,386 h-1, A còn lại 6,25%
b. K = 3/Co M-1h-1, A còn 14,285%
c. K = 0,75 M.h-1, A à B kết thúc sau 1 giờ 19 phút ⟹ Sau 2 giờ không còn tác chất A Cho phản ứng đơn giản
N2 (k) + 3 H2 (k) ßà 2NH3 (k)
Tốc độ phản ứng thuận thay đổi như thế nào khi tăng thể tích bình phản ứng lên 2 lần a) Tăng lên 4 lần b) Tăng lên 16 lần c) Giảm xuống 4 lần
d) Giảm xuống 16 lần
Trong một bình kín chứa 1 mol N2 và 3 mol. Khi có mặt của xúc tác và được đun nóng, phản ứng xảy ra theo cơ chế đơn giản
N2 (k) + 3 H2 (k) ßà 2NH3 (k)
Tốc độ phản ứng thuận thay đổi như thế nào khi N2 đã phản ứng hết 0,65 mol a) Tăng lên 22,2 lần b) Tăng lên 33,3 lần c) Tăng lên 66,6 lần d) Không thay đổi
Cho phản ứng 2NO + O2 à 2NO2 là phản ứng đơn giản một chiều. Tốc độ phản ứng thay đổi như thế nào
nếu nồng độ oxi tăng lên 4 lần a) Tăng lên 4 lần b) Tăng lên 6 lần c) Không thay đổi d) Giảm 4 lần
Cho phản ứng 2NO + O2 à 2NO2 là phản ứng đơn giản một chiều. Tốc độ phản ứng thay đổi như thế nào
nếu nồng độ oxi và NO đều tăng 2 lần a) Tăng lên 4 lần b) Tăng lên 6 lần c) Tăng lên 8 lần d) Không thay đổi
Một phản ứng kết thúc sau 3h ở 20oC. Ở nhiệt độ nào phản ứng sẽ kết thúc sau 20 phút, biết hệ số nhiệt độ của phản ứng là 3 a) 30oC b) 40oC c) 50oC d) 60oC
Thời gian bán hủy của 235U là 7,1x108 năm. Hằng số tốc độ của phản ứng phân hủy bậc 1 là: a) k = 8,9x10-10 năm-1 b) k = 9,8x10-10 năm-1 c) k = 9,8x10-10 năm d) k = 3,55x10-10 năm-1+
Phản ứng N2 + 3H2 ßà 2NH3 xảy ra theo cơ chế đơn giản. Tốc độ phản ứng thuận thay đổi như thế nào
khi tăng áp suất của hệ phản ứng lên 3 lần
a) Tốc độ phản ứng tăng lên 3 lần
b) Tốc độ phản ứng giảm đi 3 lần
c) Tốc độ phản ứng tăng lên 81 lần
d) Tốc độ phản ứng tăng lên 12 lần
Khi thực hiện một phản ứng ở 20oC thì hằng số tốc độ của phản ứng là k. Khi tăng nhiệt độ phản ứng lên
30oC thì tốc độ phản ứng tăng lên 2 lần. Tính năng lượng hoạt hóa của phản ứng Phản ứng bậc 2 Bài 1 Cho phản ứng:
CH3COOC2H5 + NaOH à CH3COONa + C2H5OH
Hằng số tốc độ của phản ứng ở 283 K là 2,83 mol-1.l.phút-1. Tính thời gian cần thiết để nồng độ của
CH3COOC2H5 còn lại 50% nếu ta trộn 1 lít dung dịch ethyl acetate nồng độ 0,05 M với:
a) 1 lít dung dịch NaOH nồng độ 0,05 M
b) 1 lít dung dịch NaOH nồng độ 0,1 M Bài 2
Trong 10 phút, phản ứng giữa hai chất xảy ra hết 25% lượng ban đầu. Tính chu kỳ bán hủy của phản ứng
nếu nồng độ ban đầu hai chất trong phản ứng bậc hai là như nhau Đáp số t1/2 = 30 phút Bài 3
Phản ứng NO3 à NO2 + ½ O2
tuân theo động học bậc 2. Ở nhiệt độ 20oC, nồng ban đầu của NO3 là 0,05 M, sau 60 phút nồng độ NO3 còn lại là 0,0358 M.
a) Tính hằng số tốc độ phản ứng.
b) Tính thời gian bán hủy
c) Tính nồng độ NO3 sau 145 phút phản ứng
Đáp sô: 2,2x10-3 L.mol-1.s-1 t1/2 = 150 phút Bài 4
Một vài mối nguy hiểm cho tầng ozone của khí quyển có liên quan đến phản ứng NO + O3 à NO2 + O2
Phản ứng là bậc 1 đối với mỗi chất tham gia phản ứng và có hằng số tốc độ phản ứng là 1,3x106 L.mol-1.s-
1 ở 298 K. Nếu nồng độ ban đầu của các chất tham gia phản ứng bằng nhau và bằng 1.10-6 M.
a) Hãy tính nồng độ của NO và O3 sau 2 giây phản ứng.
b) Hãy tính thời gian bản phản ứng c) Nếu [NO] -6 -7
0 = 1x10 M và [O3]0 = 5x10 M. Tính nồng độ O3 sau 3,5s
Đáp số: a) [NO] = [O -7 -7
3] =2,8x10 mol/L c) [O3] = 0,27x10 mol/L Bài 5
Phản ứng giữa oxalic acid và thủy ngân clorua xảy ra theo phương trình phản ứng
C2H2O4 + HgCl2 à 2CO2 + Hg2Cl2 + 2HCl
Tốc độ của phản ứng đo theo Hg2Cl2 kết tủa ở các nồng độ đầu khác nhau của H2C2O4 và HgCl2 tại thời điểm 1 phút như sau: Thí nghiệm [HgCl 4 -1 2]0 (M) [H2C2O4]0 (M) V.10 (M.phút ) 1 0,0836 0,202 0,26 2 0,0836 0,404 1,04 3 0,0418 0,404 0,53
Hãy xác định bậc của phản ứng và tính hằng số tốc độ của phản ứng
Đáp số: bậc 3 (bậc 2 đối với H -3 -1
2C2O4, bậc 1 với HgCl2), k = 7,62x10 M phút-1
Phản ứng phức tạp Bài 1 Phản ứng song song:
được đặc trưng bằng các dữ liệu sau: -
Hiệu suất hình thành sản phẩm B là 63% -
Thời gian biến đổi một nửa chất A là 19 phút. Tính k1 và k2 Đáp số: k -2 -1 -2 -1
1= 2,3.10 phút , k2 = 1,35.10 phút Bài 2
Phản ứng song song tiến hành theo phương trình
Xác định các hằng số tốc độ k1 và k2, biết rằng trong hỗn hợp các sản phẩm phản ứng có 35% chất B, còn
nồng độ chất A giảm đi một nửa sau 410 giây Đáp số: k -3 -1 -3 -1 1 =0,59.10 s , k2 = 1,09.10 s Bài 3
Đối với phản ứng song song hai hướng bậc nhất: A à B; A à C
Sự phụ thuộc nồng độ các chất A và B vào thời gian được biểu thị bằng các phương trình sau: C -0,08t -0,06t A = a.e và CB = a(1-e )
Hãy cho biết trong ba phương trình dưới đây, phương trình nào biểu thị đúng sự phụ thuộc nồng độ chất C vào thời gian a) Cc -0,02t = a(1 - e ) b) Cc 0,02t = a(1 - e )
c) Cc = a(e-0,06t - e-0,08t) d) Cc -0,06t = a(e-0,08t - e ) Bài 4
Acid g-oxibutyric chuyển thành g-lacton trong môi trường nước là phản ứng thuận nghịch bậc 1 theo phương trình sau:
Nồng độ đầu của acid là 18,23 M. Lượng acid đã phản ứng (x) ở các thời điểm t xác định được cho dưới đây: t( phút) 21 50 100 160 220 ∞ x (M) 2,41 4,96 8,11 10,35 11,25 13,28
Hãy xác định hằng số tốc độ phản ứng thuận kf và phản ứng nghịch kr và hằng số cân bằng K Đáp số: Bài 5
Cho phản ứng thuận nghịch A ßà B với nồng độ đầu của A bằng a, của B bằng không. Cho hằng số tốc độ phản ứng thuận k -6 -1
f = 1,6.10 s và hằng số cân bằng K = 1,12
a) Tính thời gian để phản ứng đạt cân bằng
b) Tính thời gian để chất A còn lại 70% Đáp số: Bài 6:
Phản ứng A ßà B được đặc trưng bằng các dữ kiện sau: nồng độ đầu của chất A bằng 0,05 M, của chất B
bằng 0; nồng độ chất A ở trạng thái cân bằng là 0,01 M. Tỷ sô kf/kr là: a) kf/kr = 0,25 b) kf/kr = 4 c) kf/kr = 5 d) kf/kr = 1/5 Bài 7
Đối với phản ứng A ßà B người ta xác định được k -1 -1
f =0,02 s và kr= 0,1 s . Nồng độ đầu của A và B
tương ứng là 0,8 M và 0,3 M. Xác định nồng độ chất A và B tại thời điểm cân bằng
Đáp số: [A]eq = 0,916 M và [B]eq = 0,183 M Bài 8 Cho phản ứng nối tiếp
. Thời gian để chất B đạt giá trị cực đại là 126,5s, khi đó
tỷ số giữa nồng độ của B và A bằng 4,53. Thời gian để 25% chất A chuyển hóa là 85s. Xác định k1 và k2
Đáp số: 3,38.10-3 s-1; 15,3.10-3 s-1
Phương trình Arrhenius Bài 1
Hệ số nhiệt độ (g) của tốc độ phản ứng bằng 3,5. Ở 15oC hằng số tốc độ phản ứng này bằng 0,2 s-1. Hằng
số tốc độ phản ứng ở 40oC là a) k313 = 0,7 s-1 b) k313 = 0,5 s-1 c) k313 = 4,6 s-1 d) k313 = 0,2 s-1 Bài 2
Hệ số nhiệt độ (g) của tốc độ phản ứn nghiên cứu bằng 3. Tính nhiệt độ của hệ phản ứng cần phải tăng lên
để tốc độ phản ứng tăng 80 lần a) T o 2 – T1 = 19,9 b) T o 2 – T1 = 29,9 c) T o 2 – T1 = 39,9 d) T o 2 – T1 = 49,9 Bài 3
Phản ứng trong pha khí giwuax NH3 và NO2 ở giai đoạn đầu là phản ứng bậc 2. Tính năng lượng hoạt hóa
và thừa số A của phương trình Arrhenius, biết ở nhiệt độ 600 K và 716 K, hằng số tốc độ có giá trị tương ứng bằng 0,385 M-1 -1 -1 S và 16 M s-1. Đáp số: E -1 -1
a =114,759 J.mol , A=3,58.109 M s-1 Bài 4
Hằng số tốc độ phản ứng phân hủy HI ở 280oC bằng 7,96.10-7 phút-1; ở 300oC bằng 3,26.10-6 phút-1. Xác
định năng lượng hoạt hóa, hằng số tốc độ ở 290oC và hệ số nhiệt độ của tốc độ phản ứng. Đáp số: Bài 5
Biết rằng thời gian để 50% N2O phân hủy ở nhiệt độ không đổi tỷ lệ nghịch với áp suất đầu.Hãy xác định bậc của phản ứng
Thời gian nửa phản ứng của phản ứng trên thay đổi theo nhiệt độ và áp suất đầu của N2O như sau: t(oC) 694 757 Po (mmHg) 294 360 t1/2 1520 212 Xác định:
a) Hằng số tốc độ phản ứng ở 2 nhiệt độ trên
b) Năng lượng hoạt hóa của phản ứng c) Thừa số Arrhenius A
Đáp số: 1) Phản ứng bậc 2 2) a) k -1 -5 -1
694 =2,24.10-6 (mmHg s-1), k757 = 1,31.10 (mmHg s-1) b) E -1 a = 223 kJ.mol c) A=2,49.106 Bài 6
Một phản ứng bậc nhất tiến hành ở 27 oC, nồng độ chất đầu giảm đi
một nữa sau 5000s. Ở 37 oC nồng độ giảm đi một nữa sau 1000s. Xác
định năng lượng hoạt hóa của phản ứng.
Hướng dẫn: Áp dụng phương trình Arrhenius: Bài 7
Nghiên cứu phản ứng 2I(k) + H2(k) = 2HI(k). Cho thấy hằng số tốc độ
phản ứng ở 418K là 1,12.10-5 M-2.s-1 và ở 737K là 18,54.10-5 M-2.s-1. Xác
định năng lượng hoạt hóa và hằng số tốc độ phản ứng ở 633,2K