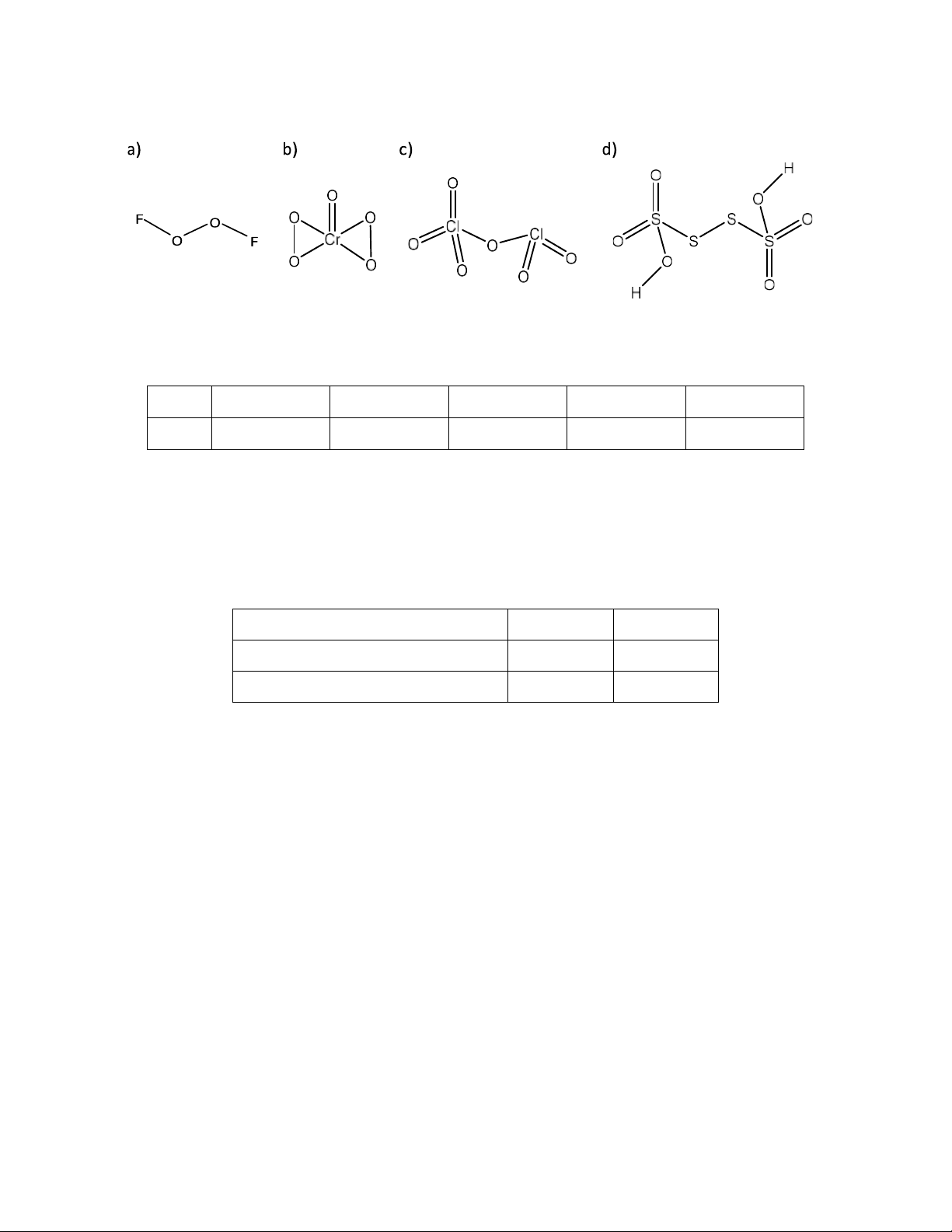

Preview text:
1. Xác ịnh số oxi hóa của từng nguyên tử trong các phân tử sau:
2. Bảng dưới ây cho biết thế khử tiêu chuẩn của một số cặp oxi hóa khử trong dung dịch nước tại pH = 0. MnO /Mn BiO /Bi CrO /Cr S O /SO Fe3+/Fe2+ Eo (V) 1,51 1,60 1,33 2,01 0,77
Từ bảng trên hãy cho biết trong dung dịch nước, ở iều kiện chuẩn, tác nhân nào có thể oxi hóa
Mn2+ thành MnO tại pH = 0. Viết và cân bằng phương trình hóa học cho những phản ứng oxi hóa ó.
3. Giải thích sự khác biệt về năng lượng liên kết và ộ dài liên kết H–H trong phân tử H2 và ion H + 2 trong bảng sau. H2 H2+
Năng lượng liên kết EH–H (kJ/mol) 436 255
Độ dài liên kết H–H (pm) 74.2 106
4. Đề xuất giải thích cho xu hướng biến ổi của một số tính chất sau:
a. Trong các phân tử CH4, NH3 và H2O ở thể khí, giá trị góc liên kết lần lượt là H–C–H = 109,5o H–N–H = 106,7o H–O–H = 104,5o
b. Độ nhớt của các axit lỏng tinh khiết giảm dần theo thứ tự H3PO4 > H2SO4 > HClO4.
5. Phân loại các hi rua sau vào nhóm hi rua ion, hi rua cộng hóa trị hoặc hi rua kiểu kim loại: a) BaH2 b) SiH4 c) UH3 d) AsH3 e) HI f) KH
6. Hoàn thành và cân bằng các phương trình hóa học sau. Trong từng phản ứng hãy cho biết vai
trò các chất chứa hi ro. , , a) Ca + H2 ⎯⎯⎯
b) N2 + H2 ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯ c) CuO + H2 ⎯⎯⎯ d) CaH2 + H2O → e) NaH + C2H5OH → f) KH + NH3 → g) NaH + BH3 →
h) LiH + SiCl4 → SiH4 + ....




