

Preview text:
BÀI TẬP TỔNG HỢP ĐỘNG HÓA HỌC
Bài 1: Trong dung dịch nước, chất T bị phân hủy phương trình: T + 2H2O → 2X+ + Y2- (1)
Trong dung dịch loãng, hằng số tốc độ của phản ứng tại 350 K là k1 = 4,00.10-5 s-1.
a. Cho biết bậc của phản ứng (1).
b. Tính thời gian cần thiết t1 để 80% lượng chất T bị phân hủy ở 350K.
c. Tính hằng số tốc độ của phản ứng k2 tại 300K và thời gian cần thiết t2 để 80% lượng T
bị phân hủy ở nhiệt độ này. Biết năng lượng hoạt hóa Ea của phản ứng là 166,00 kJ.mol-1
và Ea không phụ thuộc vào nhiệt độ.
d. Khi có mặt chất xúc tác hằng số tốc độ của phản ứng phân hủy tại 300 K là k ’ 2 = 3,00.104
s-1. Giả sử thừa số tần số phản ứng không thay đổi, tính năng lượng hoạt hóa E ’ a của phản
ứng khi có mặt xúc tác.
Bài 2: Cho phản ứng bậc một sau:
CCl3COOH (k)→ CHCl3(k) + CO2 (k)
Thực hiện phản ứng ở 30oC, nồng độ chất phản ứng giảm đi một nửa sau 1 giờ 23 phút 20
giây. Ở 70oC, nồng độ chất phản ứng giảm đi một nửa sau 16 phút 40 giây.
1. Tính thời gian cần để nồng độ giảm xuống còn 1/4 ở 30oC và hệ số nhiệt độ của tốc độ phản ứng.
2. Tính năng lượng hoạt hóa của phản ứng. Bài 3:
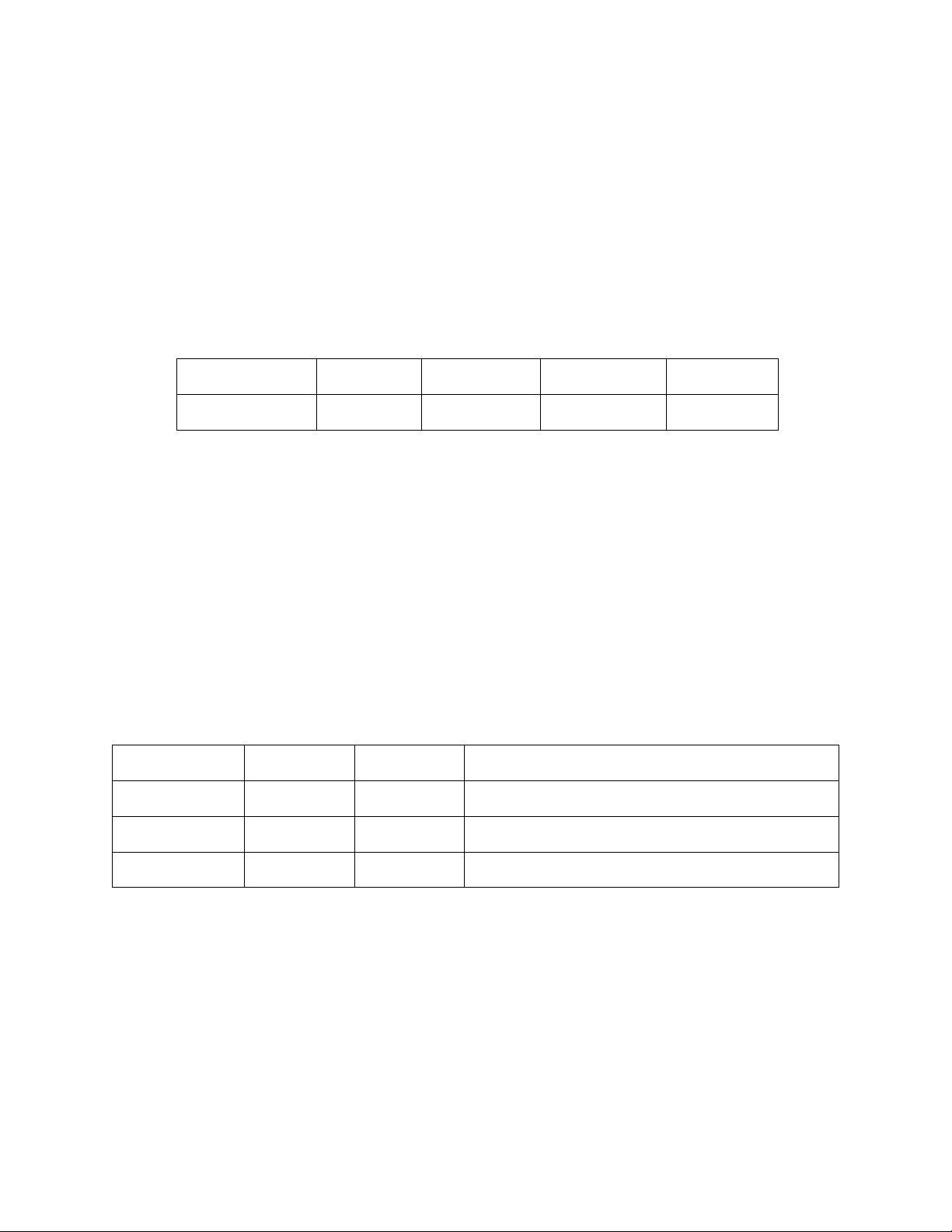
Cho phản ứng xảy ra ở T(K): 2N2O5(k) ⇄ 4NO2(k) + O2(k) lần lượt có các thí nghiệm: Thí nghiệm
Nồng độ đầu của N2O5 (mol/l)
Tốc độ phân hủy (mol/l.s) TN 1 0,17 1.39.10-3 TN 2 0,34 2,78.10-3 TN 3 0,68 5,56.10-3
a) Viết biểu thức tốc độ phản ứng. Tính hằng số tốc độ ở T(K).
b) Năng lượng hoạt hóa Ea của phản ứng là 24,74 kcal/mol, hằng số tốc độ phản ứng ở
298K bằng 2,03.10-3 s-1. Tính nhiệt độ T(K) của thí nghiệm đã tiến hành. Bài 4:
4.1 Ở 3100C sự phân hủy XY3 (khí) xảy ra theo phản ứng : 2XY3 (khí) ⎯⎯
→ 2X (rắn) + 3Y2 (khí) (1)
Theo thời gian phản ứng, áp suất chung của hệ đo được là: t (giờ) 0 5,5 6,5 8 P (mmHg) 733,32 805,78 818,11 835,34
Hãy chứng minh phản ứng trên là bậc 1. Tính hằng số tốc độ của phản ứng và thời gian nửa phản ứng.
4.2 Khi tiến hành phản ứng trên ở nhiệt độ T, sau 1 giờ, áp suất tổng cộng trong bình tăng
10% so với lúc bắt đầu (giả sử bậc phản ứng không đổi)
a. Tính hằng số tốc độ của phản ứng ở nhiệt độ T.
b. Tính hệ số nhiệt độ của phản ứng, biết năng lượng hoạt hóa của phản ứng là 249,72 kJ/mol.
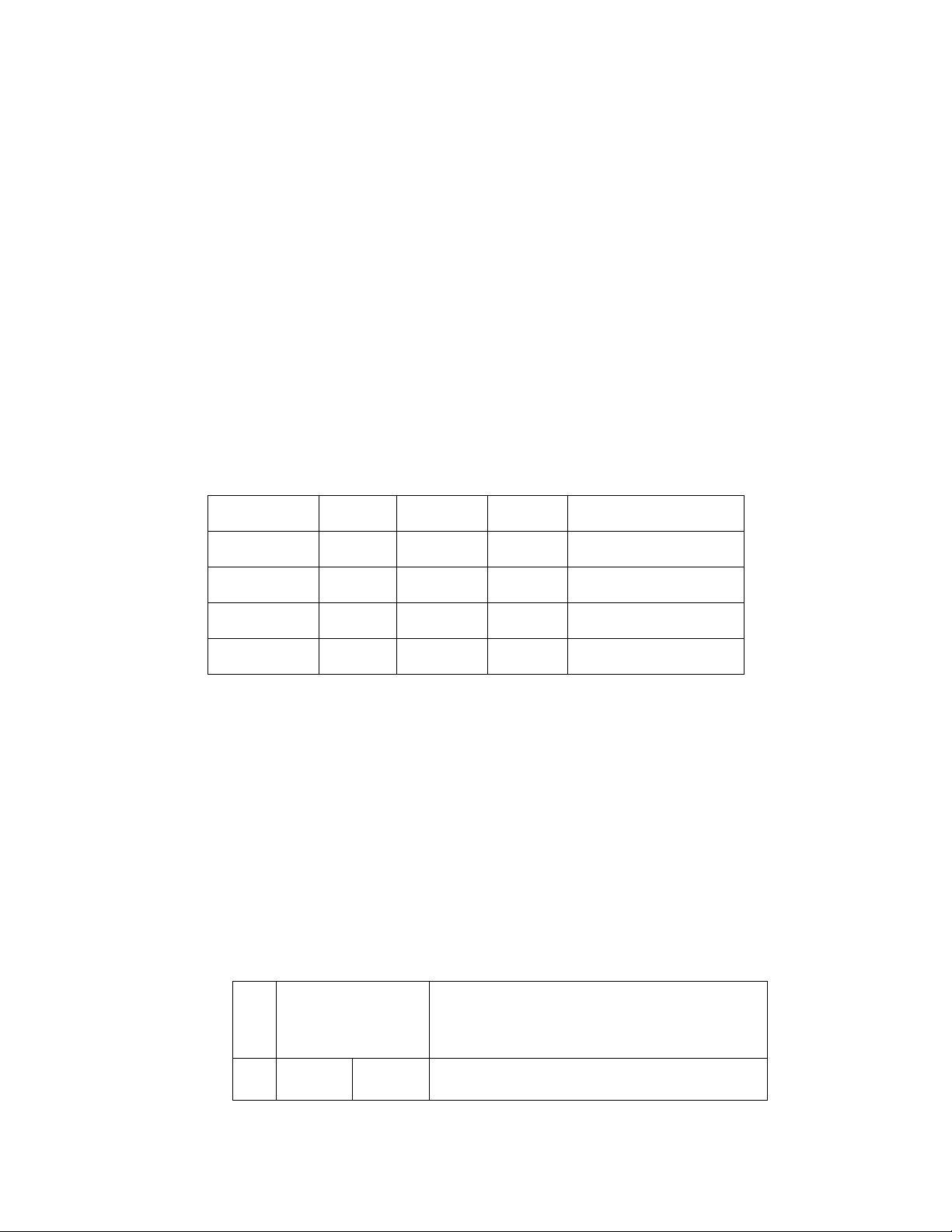
Bài 5: Xét phản ứng xảy ra trong pha khí sau: 2NO (khí) + O2 (khí) → 2NO2 (khí)
Nồng độ riêng phần của các chất tại nhiệt độ T xác định được cho trong bảng dưới đây: Thí nghiệm [NO], M [O2], M
Tốc độ riêng phần tạo thành NO2, M.s–1 1 0,020 0,020 0,057 2 0,040 0,040 0,455 3 0,040 0,020 0,228
a. Xác định bậc phản ứng riêng đối với NO, O2.
b. Viết biểu thức tốc độ và tính hằng số tốc độ của phản ứng tại nhiệt độ T. Bài 13:
Hai đồng phân A và B của cùng một chất thực hiện các quá trình đime hóa sau: 2A 1 k ⎯⎯→ A2 2B k2 ⎯⎯→ B2
Biết cả hai quá trình là bậc hai theo chất tham gia và k1 = 0,250 L.mol-1.s-1 tại 25oC. Trong
một thực nghiệm, A và B được đặt trong hai bình riêng tại 25oC, với [A]0 = 1,0010-2 M
và [B]0 = 2,5010-2 M. Sau khi phản ứng tiến hành được 3 phút thì [A] = 3,00[B].
a, Tính nồng độ A2 sau 3 phút.
b, Tính chu kỳ bán hủy của thực nghiệm liên quan đến A. c, Tính giá trị k2.
Bài 6: Xét phản ứng IO− + I 5 − + H 6 + ⎯ ⎯ → I 3 + H 3 O 3 2 2
Vận tốc của phản ứng đo ở 250C có giá trị theo bảng sau: Thí nghiệm [I-] (M) [IO - 3 ], M [H+], M Vận tốc (mol.l-1.s-1) 1 0,010 0,10 0,010 0,60 2 0,040 0,10 0,010 2,40 3 0,010 0,30 0,010 5,40 5 0,010 0,10 0,020 2,40
a. Lập biểu thức tính vận tốc của phản ứng.
b. Tính hằng số vận tốc của phản ứng và xác định đơn vị của hằng số tốc độ đó.
c. Năng lượng hoạt hóa của phản ứng E = 84 kJ.mol-1 ở 250C. Tốc độ phản ứng thay đối
như thế nào nếu năng lượng hoạt hóa giảm đi 10 kJ.mol-1.
Bài 7: Xét phản ứng: 2NO (k) + H2(k) → N2O (k) + H2O (k)
Để nghiên cứu động học của phản ứng trên ở 8200C, người ta đo tốc độ đầu của phản ứng
ở những áp suất ban đầu khác nhau của NO và H2. Áp suất đầu, torr TN
Tốc độ đầu của sự tạo thành N2O, torr/s PNO P H2 1 120,0 60,0 8,66.10-2 2 60,0 60,0 2,17.10-2 3 60,0 180,0 6,62.10-2
1. Hãy xác định biểu thức của định luật tốc độ thực nghiệm và tính hằng số tốc độ.
2. Tính tốc độ của sự tiêu thụ NO ở nhiệt độ 8200C, khi hỗn hợp ban đầu có áp suất riêng
phần của NO bằng 2,0.102 torr và của H2 bằng 1,0.102 torr.
3. Tính thời gian cần thiết để áp suất riêng phần của H2 giảm đi một nửa, nếu áp suất ban
đầu của NO là 8,00.102 torr và của H2 bằng 1,00 torr ở nhiệt độ 8200C.




