



Preview text:
BÀI 3: XÁC ĐỊNH HÀM LƯỢNG SO2 TRONG KHÔNG KHÍ
III. Nguyên tắc
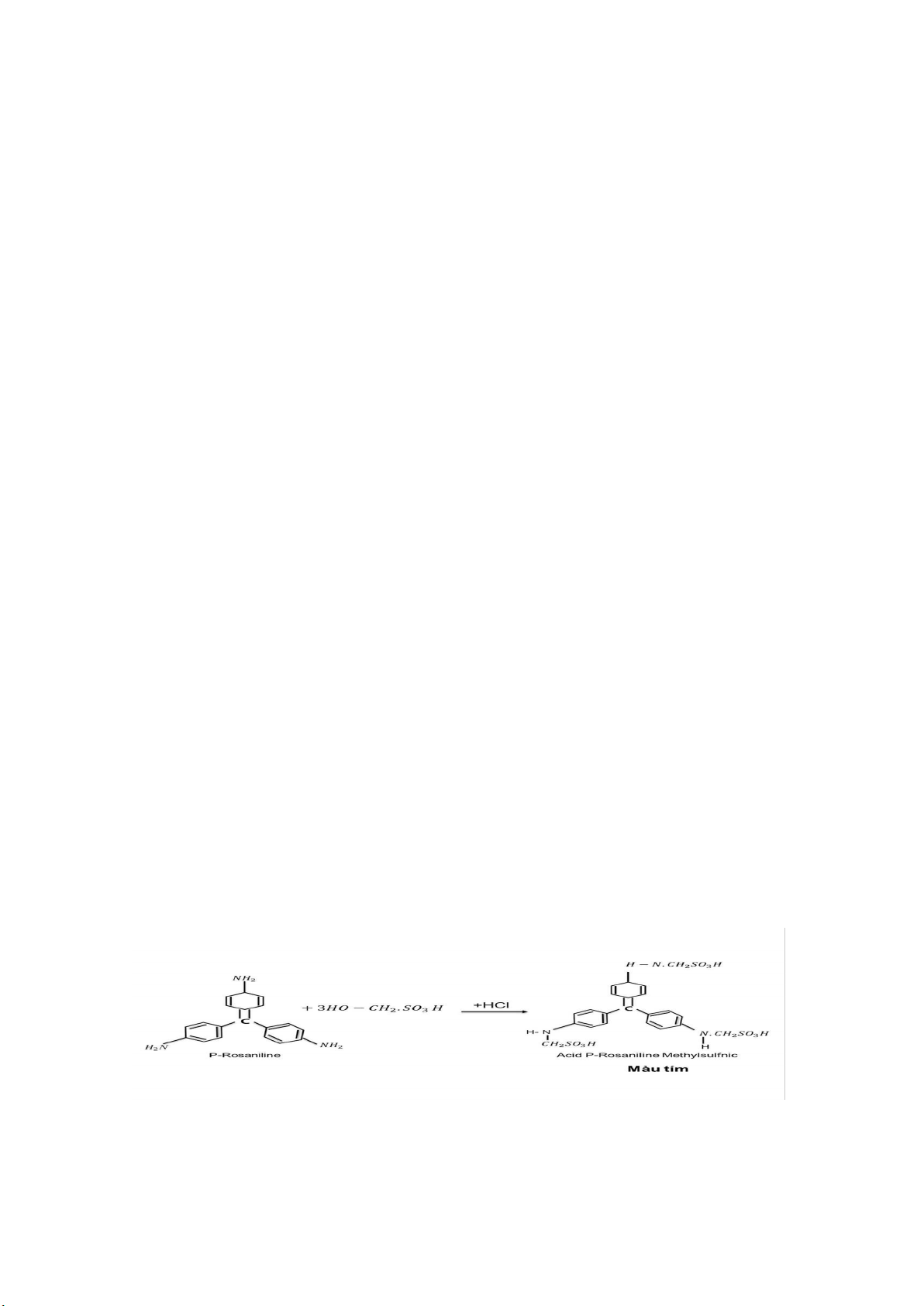
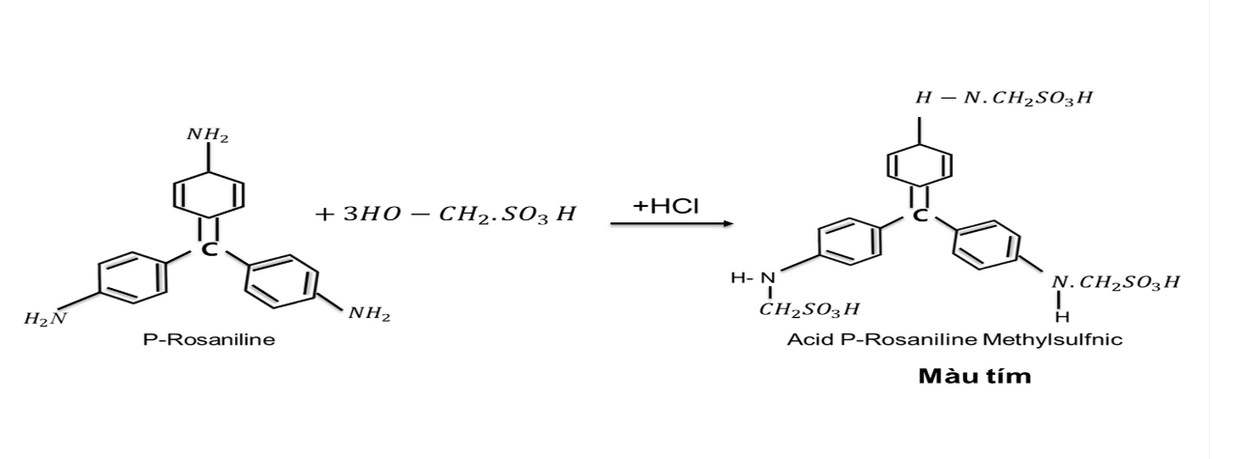
Phương pháp West - Gaeke dựa trên sự hấp thu và ổn định SO2 trong không khí bằng dung dịch Na (hoặc K) Tetrachlomercurat II để tạo thành phức chất
Dichlosunficmercurat II.
- Phức chất sunfit chống lại sự oxyt hóa của oxy trong khí quyển và ổn định ngay cả sựcó mặt của các chất oxy hóa mạnh như ozon và các oxyt của Nitơ. Định lượng SO2 thu được bằng Pararosanilin Methylsunfonic.
- Sau đó cho acid Metylsunfomic tác dụng với Pararosanilin trong HCl để tạo thànhphức chất màu đỏ tím acid Pararosanilin Metylsunfonic.
- Độ nhạy : 0,015 - 0,6 mg/m3 lấy mẫu 38,2 lít không khí. Hệ thống tuân theo địnhluật Beer - Lamber với nồng độ khoảng 0,25 mg/ 10 mL dung dịch hấp thu.
- Phương trình phản ứng:
+ Trong dung dịch hấp thụ
2KCl + HgCl2 →2K+ + [HgCl4]2-
+ SO2 hấp thụ [HgCl4]2- + SO2 + H2O → [HgCl2(SO3)]2- + 2HCl
+ Phức chất này tác dụng với Formalaldehyde tạo thành acid Methylsulfonic
[HgCl2(SO3)]2- + HCHO + 2H+ → HO - CH2 - SO3H + HgCl2
+ Sau đó tác dụng với Pararosaniline/HCl tạo phức mày tím
IV. Hóa chất, dụng cụ, thiết bị
1
4.1. Hóa chất
3
Hóa chất
Cách Pha
Vai trò
Dung dịch hấp thu
K
2
HgCl
4
(0.04M)
Hòa tan 10.86g HgCl
2
+ 5.96g KCl
+
0.066g EDTA vào nước, định
mức đến gần 1 lít, chỉnh pH
khoảng 5, dung dịch giữ được
trong 6 tháng, nếu có kết tủa thì
không dùng được (có thể thay KCl
bằng 4.68g NaCl)
Tác dụng với SO
2
tạo phức chất
Axit Sulfamic 0.6%
Hòa tan 0.3g H
2
NSO
3
H trong
50
mL nước cất
Phản ứng
pararosaniline và
dd hấp thu hợp
chất màu
HCHO 0.2%
Hòa tan 0.5mL HCHO 40% định
mức 100 mL với nước cất.
Phản ứng
pararosaniline và
dd hấp thu hợp
chất màu
Thuốc thử Pararosanilin
làm việc
Lấy 20mL Pararosanilin gốc cho
vào bình định mức 250mL, thêm
25
mL H
3
PO
4
3M định mức đến
250
mL.
Thuốc thử tạo
phức màu
tím
Na
2
S
2
O
3
0,01N
m
¿
CN×V ×D Na
2
S
2
O
3
10
×p
Dung dịch chất
chuẩn dùng để
chuẩn độ I
2
I
2
0,1N
Cho 12,7g I
2
và 40g KI (trộn khô)
sau đó hòa tan trong bình định mức
ml
1000
Na
2
S
2
O
5
0,01N
m
¿
CN×V ×D Na
2
S
2
O
5
10
×p
Xác định lại nồng
độ
Na
2
S
2
O
3
I
2
0
bằng nước cất
Xác định lại nồng
ộ dung dịch
Na
2
S
2
O
5
0,01N
IV. Quy trình thí nghiệm
4.1. Xác định lại nồng độ Na2S2O3
► Thực hiện 3 lần thí nghiệm. Tính thể tích Na
2
S
2
O
3
trung bình, suy ra nồng độ đương
lượng Na
2
S
2
O
3
:
Phản ứng thế
-
3
+
¿
+
3
I
2
+
7
H
2
¿









ml K
5
2
Cr
2
O
7
0.01N
5
mL KI 10%
5
mL H
2
SO
4
6N
mL nước cất
10
Đậy kín để trong tối 10 phút
Na
2
S
2
O
3
0.01N
Chuẩn độ Na
2
S
2
O
3
0.01N đến khi
dung dịch có màu vàng rơm
Cho 3 giọt chỉ thị hồ
tinh bột (dung dịch
xuất hiện màu xanh
tím)
Cho 3 giọt chỉ thị
hồ tinh bột (dung
dịch xuất hiện
màu xanh tím)
Tiếp tục chuẩn
độ đến khi mất
màu xanh tím
Ghi nhận
V
Na
2
S
2
O
3
(
mL
)
Cr O2−¿+6I−dư¿+14 H+¿→Cr ¿¿¿O
2 7
- Phản ứng chuẩn độ:
2−¿¿
I−¿+2S2O23−¿↔2I−¿+S4O6 ¿¿¿
3
4.2. Xác định lại nồng độ I2 bằng dung dịch chuẩn Na2S2O3









ml I
10
2
mL CH
5
3
COOH 1:1
mL nước cất
10
Đậy kín để trong tối 10 phút
)
Dung dịch có màu vàng nâu
(
Na
2
S
2
O
3
Chuẩn độ dung dịch này bằng
dung dịch Na
2
S
2
O
3
Khi dung dịch có
màu vàn rơm, cho
hồ tinh bột vào
Dung dịch có màu
(
xanh tím)
Tiếp tục chuẩn độ
đến khi mất màu
xanh tím
Ghi nhận
V
Na
2
S
2
O
3
mL
)
(
► Thực hiện 3 lần thí nghiệm. Tính thể tích Na2S2O3 trung bình, suy ra nồng độ đương lượng I2
Phản ứng chuẩn độ :
I2 + 2S2O32- 2I- + S4O62-
4.3. Xác định lại nồng độ Na2S2O5
- Mẫu trắng : Erlen A: 50mL I2 0.01N + 25mL nước cất
- Mẫu thử : Erlen B: 50mL I2 0.01N + 25mL dd Na2S2O5
Để yên 5 phút cho phản ứng, sau đó chuẩn độ bằng Na2S2O3 0.01N với chỉ thị hồ tinh bột.
Điểm dừng chuẩn độ: Dung dịch mất màu xanh tím
Phương trình chuẩn độ
2S2O25−¿+2I2→4SO2+4 I−¿+O2¿¿
2S O2−¿+I2→S4O26−¿+2I−¿¿¿¿
2 3
4.4. Xây dựng đường chuẩn
Bình 25ml | 0 | 1 | 2 | 3 | 4 | 5 | ||
Dung dịch disulfit 4ppm (mL) | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 3 | ||
Dung dịch hấp thu (mL) | 10.0 | 9.5 | 9.0 | 8.5 | 8.0 | 7.0 | ||
Acid sulfamic 0.6% | 1 | 1 | 1 | 1 | 1 | 1 | ||
Để yên 10 phút | ||||||||
Formaldehyde 0.2% | 1 | 1 | 1 | 1 | 1 | 1 | ||
Pararosanilin | 5 | 5 | 5 | 5 | 5 | 5 | ||
Hàm lượng SO2 (µg) | 0 | 2 | 4 | 6 | 8 | 12 | ||
Định mức 25ml, lắc đều, để yên 30 phút tiến hành đo màu ở bước sóng 548nm | ||||||||
4.5. Phân tích mẫu
Bình mẫu | |
Lấy 10ml dung dịch cho vào impinger. Hút khí với tốc độ 1lít/phút, thời gian hút 30 phút | |
Tránh để mẫu dưới ánh nắng mặt trời trong và sau khi lấy mẫu, cần phải phân tích ngay hoặc giữ mẫu ở 5 0C | |
Mẫu sau khi thu truyền qua bình định mức 25ml, tráng nước cất | |
Acid sulfamic 0.6% | 1 ml |
Để yên 10 phút | |
Formaldehyde 0.2% | 1 ml |
Pararosanilin | 5 ml |
Định mức 25ml, để yên 30 phút tiến hành đo màu ở bước sóng 548n | m |
5.3. Xác định lại nồng độ Na2S2O5
Mẫu | Mẫu trắng | Mẫu thật | |
V Na2S2O3 (ml) | 54,50 | 37.05 | |
SO2(µg/ml)¿¿¿×CNa2S2O3 ×ĐSO2 ×103 V Na¿2 S2O5 (54,50−37,05) ×0,01×32000 μg ¿ =223.36( ) 25 ml | |||
5.5. Phân tích mẫu
Nồng độ SO2 trong không khí (C) tính bằng mg/m3 theo công thức:
C (mg/m
3)¿ Va0
Trong đó: a: Hàm lượng SO2 trong mẫu tương ứng với ống than mẫu (μg)
V0: thể tích mẫu không khí đã được đưa về điều kiện tiêu chuẩn (250C, 1 atm), (L)
V0 (L) = V (L/p hút)×t phút
mg a 9.616 mg
CSO2(m3 )=V0= 30 =0.321( m3 )
VI. Trả lời câu hỏi
6.1. Nêu các ảnh hưởng trở ngại chính đến phương pháp lấy mẫu và phân tích SO2 trong không khí
- Tránh để mẫu phân tích dưới ánh nắng mặt trời dưới ánh nắng mặt trời trong và saukhi lấy mẫu, cần phân tích ngay hoặc bảo quản mẫu ở 50C.
- Khi phân tích mẫu khí hiện trường phải tập trung vào bình impinger.
- Bình impinger có sự hấp thu SO2 và [HgCl4]2- trong bình impinger giữ SO2, những chất không hấp thụ bị đẩy ra theo đường ống.
NaCl+HgCl2→¿¿
SO2+¿¿
- Vì [HgCl2SO3]- dễ bị phân hủy dưới ánh nắng mặt trời nên cần phải bảo quản.
- Chú ý đến tốc độ hút khí và thời gian bật máy đến lúc tắt máy.
6.2. Tại sao phải chuẩn lại SO2?
- Định lượng SO2 chuẩn bằng Na2S2O5 vì Na2S2O5 phân hủy sinh ra SO2 thì lượng SO2 chuẩn tiếp tục vào phản ứng tiếp theo.
- Sau khi tính được SO2 chuẩn cần phải pha loãng dung dịch disunfit 1ml bằng 4 μg để xây dựng đường chuẩn.




