




Preview text:
lOMoARcPSD|40651217
BÁO CÁO THỰC HÀNH
Bài: XÁC ĐỊNH HÀM LƯỢNG VITAMIN C TRONG RAU QUẢ
(Metrohm – Application Bulletin, No.98/3 e ; AOAC 967.21)
 Ưu nhược điểm của phương pháp Ưu điểm:
Ưu nhược điểm của phương pháp Ưu điểm:
- Chuẩn độ được các dung dịch có màu, và độ chính xác cao.
- So với phương pháp điện thế kế trực tiếp, phương pháp này không bị cản trở bởi điện thếnối và hệ số hoạt độ.
- So với phương pháp chuẩn độ thể tích cổ điển (sử dụng chất chỉ thị), phương pháp nàykhông mắc sai số chỉ thị, có thể sử dụng khi dung dịch có màu, nồng độ chất phân tích thấp. Ứng dụng rộng rãi trong trong kiểm tra chất lượn nước cũng như thực phẩm.
Nhược điểm:
- Mất nhiều thời gian do cần nhiều điểm để vẽ đường cong chuẩn độ, có thể khắc phụcđược bằng thiết bị chuẩn độ tự động.
 Giới thiệu phương pháp chuẩn độ điện thế
Giới thiệu phương pháp chuẩn độ điện thế
- Là một phương pháp phân tích mà việc xác định điểm tương đương của quá trình chuẩnđộ được thực hiện bằng cách đo điện thế của dung dịch phân tích. Tại gần điểm tương đương xảy ra sư thay đổi đột ngột của thế điện cực chỉ thị, nhờ đó xác định được điểm tương đương.
- Việc xác định điểm tương đương theo phương pháp chuẩn độ điện thế chỉ được thựchiện khi có ít nhất một cấu tử tham gia phản ứng chuẩn độ quá trình điện cực.
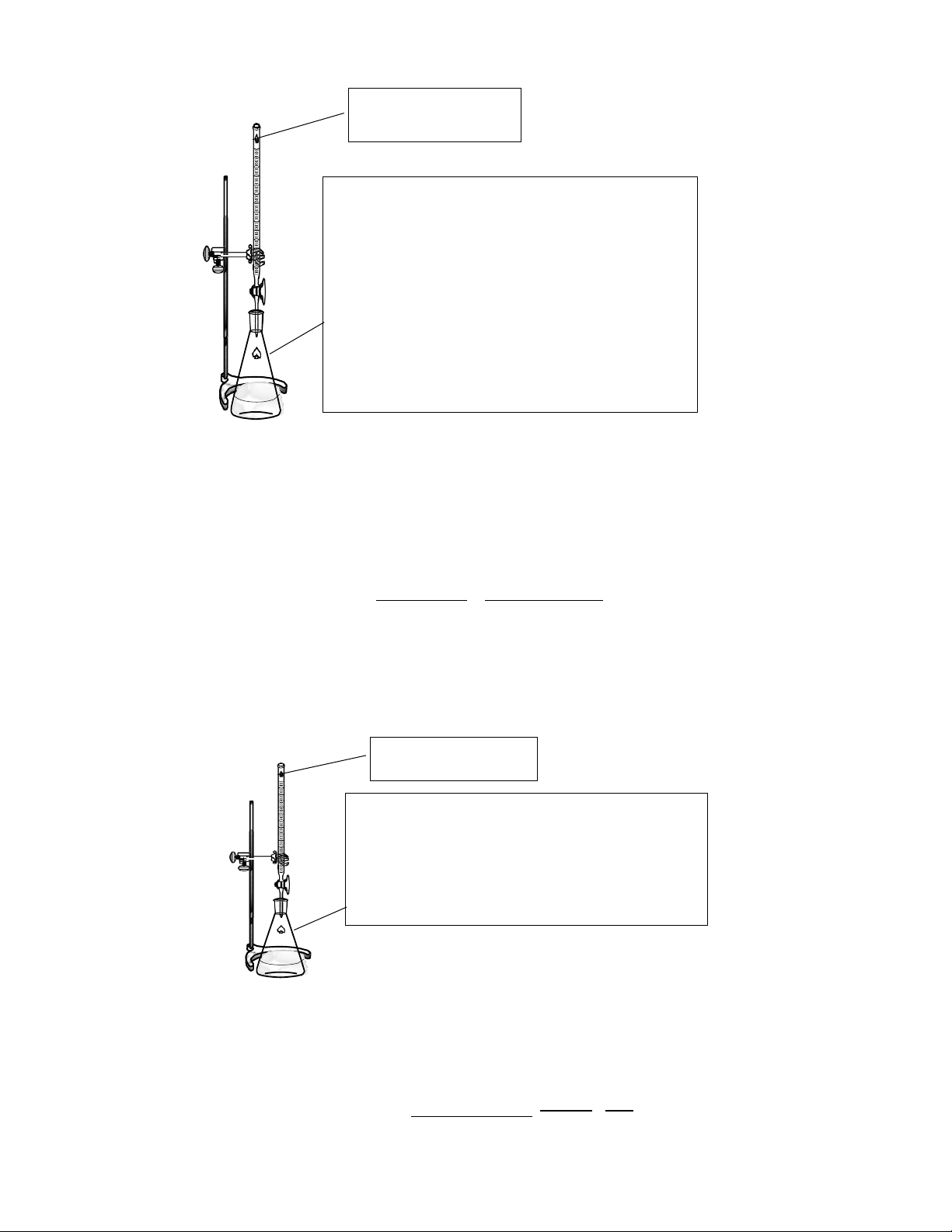
Để tiến hành phương pháp chuẩn độ điện thế, người ta lắp một mạch đo gồm điện cực vào becher chứa dung dịch phân tích.
II. Nguyên tắc
Có 2 cách:
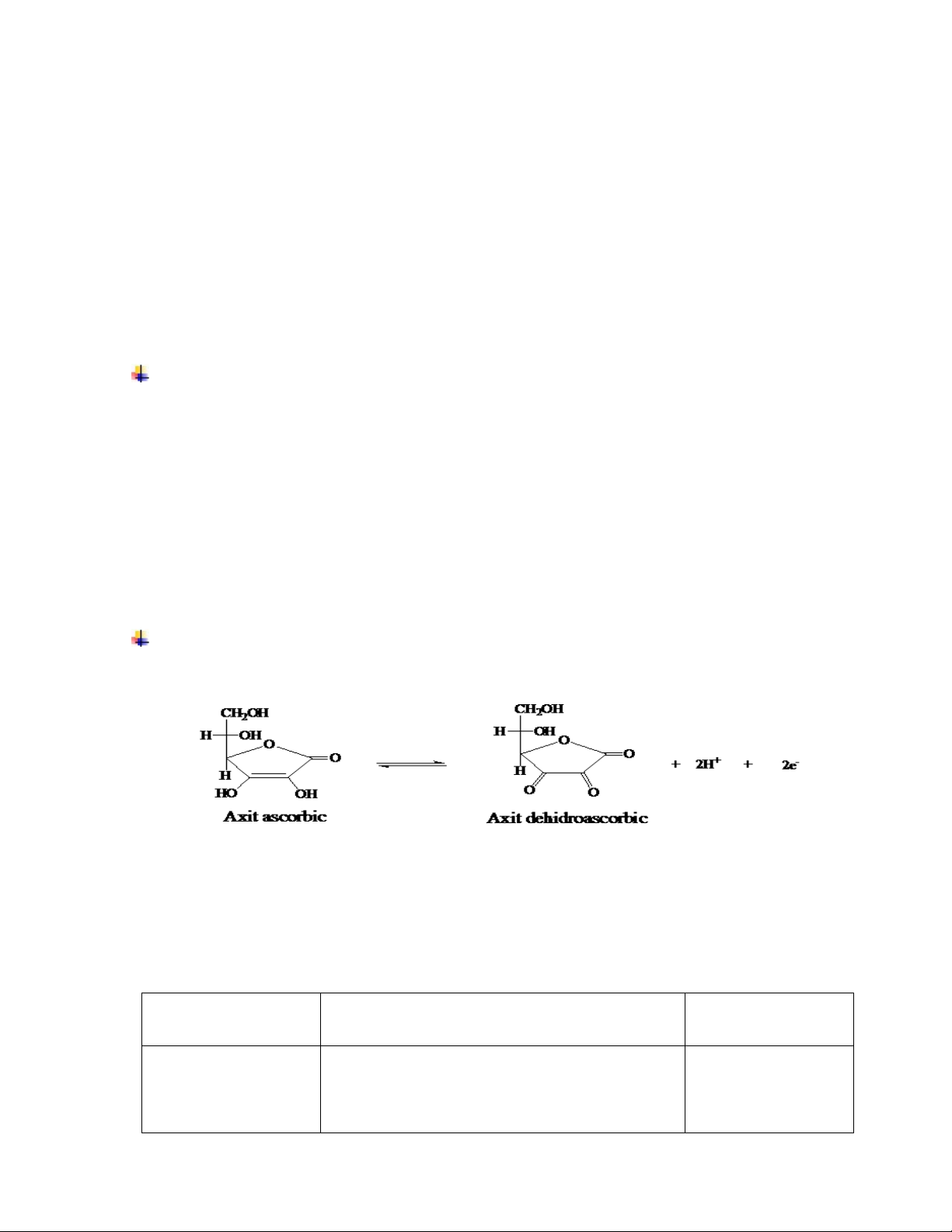
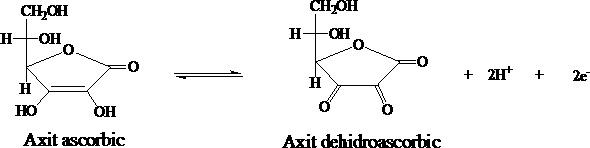
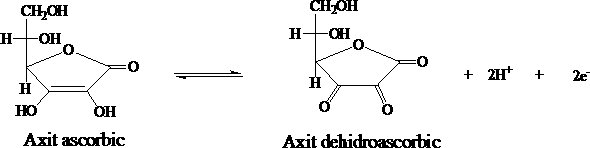
- Cách 1: Vitamin C (acid ascorbic) và các dạng muối hay este của acid ascorbic trong các mẫu rau quả sẽ được chiết với acid oxalic, sau đó tiến hành chuẩn độ bằng phương pháp chuẩn độ điện thế với chất chuẩn là 2,6 – dicholophenol indophenol (DPIP). Nguyên tắc của phương pháp là dựa vào phản ứng oxi hoá acid ascorbic thành acid dehydroascorbic bởi 2,6 – dicholophenol indophenol trong môi trường acid .
 Phương trình phản ứng:
Phương trình phản ứng:
H2C6 H6O6+HC12 H6C12O2N →C6 H6O6+HC12H8C12O2 N
- Cách 2: Acid ascobic được chuẩn độ bằng chất chuẩn là iod. Nguyên tắc của phương pháp là dựa vào phản ứng oxi hóa acid ascobic thành acid dehydroascobic bởi iod trong môi trường acid.
 Phương trình phản ứng:
Phương trình phản ứng:
I2+ I- I3-
cC6H8O6 I3- C6H6O6 3I 2H
- Hóa chất, dụng cụ và thiết bị
3.1. Hóa chất
Tên hóa chất | Cách pha hóa chất | Vai trò |
Dung dịch acid oxalic | Hòa tan 1g oxalic trong 1L nước | Chiết Vitamin C từ rau quả |
Dung dịch acid ascorbic tiêu chuẩn 500mg/L | 50 mg acid ascorbic trong dung dịch acid oxalic và định mức 100mL | Là chất chuẩn gốc hiệu chuẩn lại chất chuẩn |
Dung dịch 2,6dicholophenol indophenol | Hòa tan 330 mg 2,6-dicholophenol indophenol trong nước cất và thêm 100mg NaHCO3 hòa tan và định mức 1L | Chất chuẩn |
Dd CH3COONa 10% | C %×V mcân( g )= P | Dung dịch đệm ốn định môi trường, bảo vệ điện cực |
Dung dịch I2 0,01N | C ×V × M mcân( g )= 10N × p×z I2 | Dùng chuẩn độ lượng Vitamin C trong mẫu |
Dung dịch Na2S2O3 0,01N | C ×V mL×Đ×100 C ×V mL mcân= N 1000× p = N10× p×z×M =0.01 | Dung dịch chuẩn xác định nồng độ chính xác của I2 |
Dung dịch K2Cr2O7 0.01N | C ×V mL×Đ×100 C ×V mL mcân= N 1000× p = N10× p×z×M =0.01 | Dung dịch chuẩn gốc xác định 1 nồng độ chính xác của Na2S2O3 |
- Tiến hành thí nghiệm
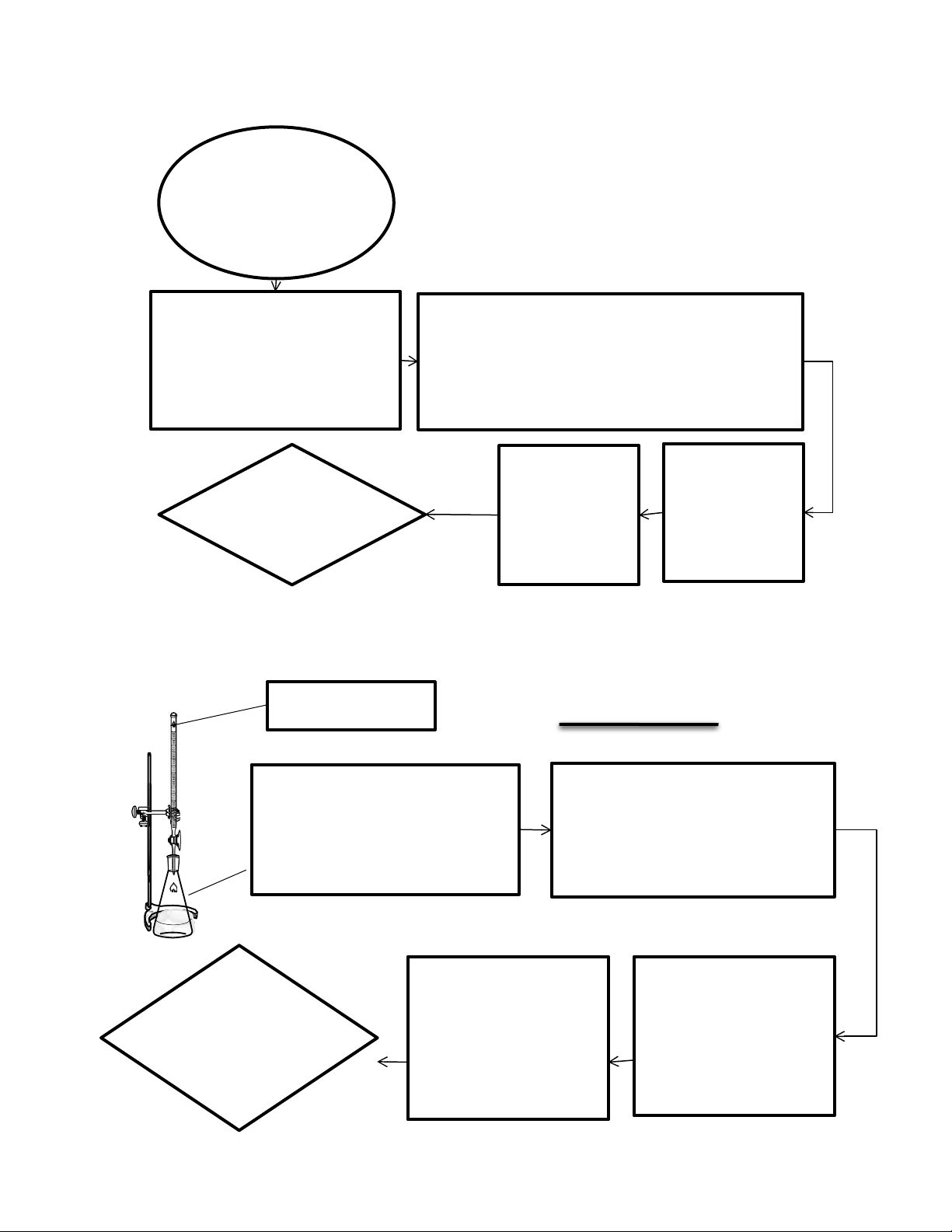
. Chuẩn bị mẫu
4.1
Cân 9.8374g mẫu
đã cắt nhỏ với dao
không gỉ
Cho vào cối sứ 10mL dung
dịch acid oxalic, nghiền nhỏ
và cho vào becher 100mL
Thực hiện 3 lần sau đó gộp tất cả vào bình định
mức 100ml, tráng cốc và cối chày sứ bằng
ml dung dịch acid oxalic và định mức đến
10
vạch.
Để yên 10 phút
cho acid oxalic
trong mẫu hòa
tan hết
Lọc bằng giấy
lọc băng vàng
(
Bỏ nước lọc
đầu)
Dung dịch lọc
4.2. Phân tích mẫu bằng phương pháp chuẩn độ với Iod
4.2.1. Xác định nồng độ chính xác của Na2S2O3 bằng K2Cr2O7 0,1N





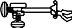






10
ml K
2
Cr
2
O
7
0.1
N
5
mL KI 10%
2
mL H
2
SO
4
4N
10
mL nước cất
Đậy kín để trong tối 10 phút
Na
2
S
2
O
3
0.1N
Chuẩn độ Na
2
S
2
O
3
0.1N đến khi
dung dịch có màu vàng rơm
Cho 3 giọt chỉ thị hồ
tinh bột (dung dịch
xuất hiện màu xanh
tím)
Tiếp tục chuẩn độ đến
khi mất màu xanh tím
Ghi nhận
V
Na
2
S
2
O
3
)
(
mL
► Thực hiện 3 lần thí nghiệm. Tính thể tích Na2S2O3 trung bình, suy ra nồng độ đương lượng Na2S2O3
- Phản ứng thế:
3+¿+3 I +7 H ¿ 2 2 Cr2O27−¿+6I−dư¿+14H+¿→Cr ¿¿¿O
- Phản ứng chuẩn độ:
2−¿¿
−¿+2S2O23−¿↔2I−¿+S4O6 ¿¿¿
I3
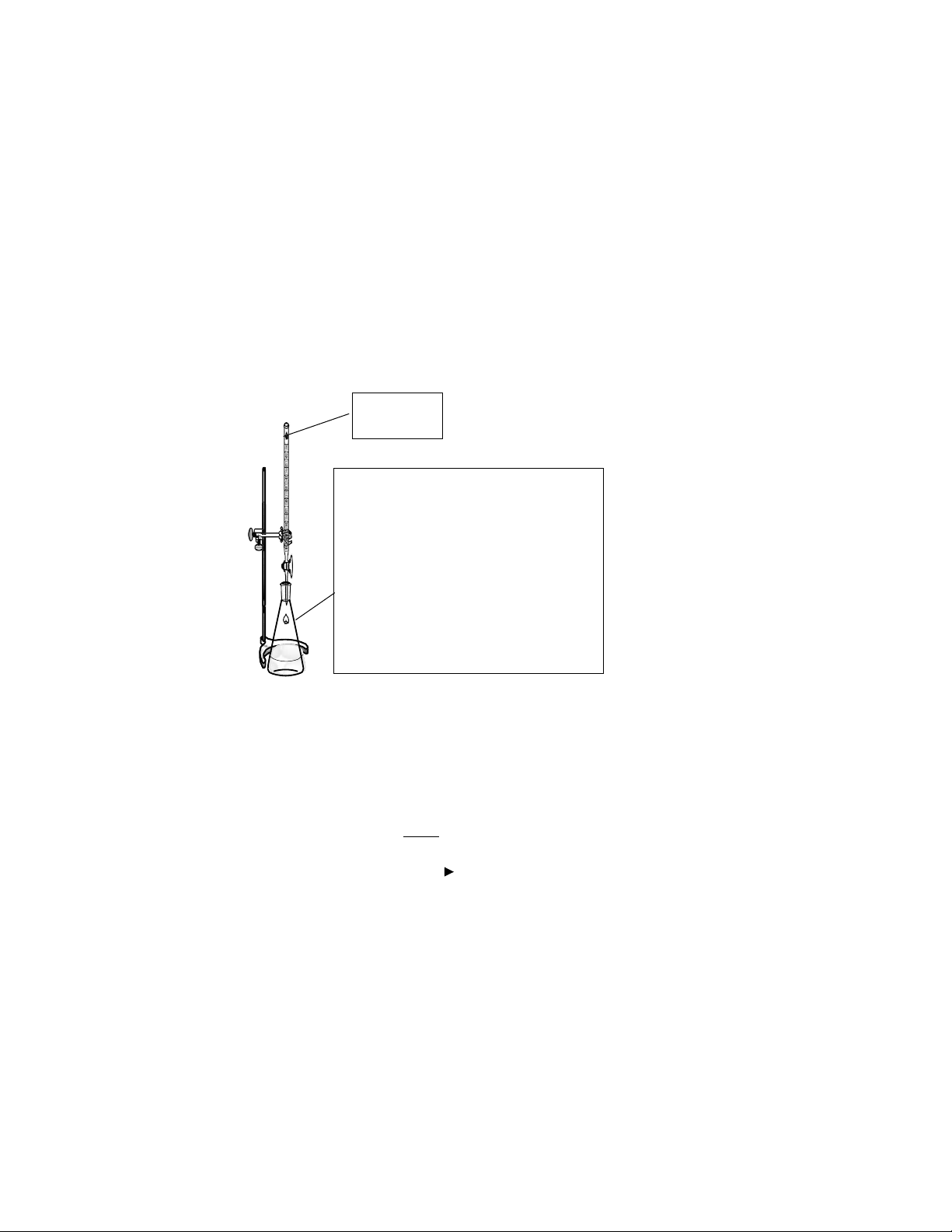
4.2.2. Xác định nồng độ chính xác của dung dịch Iod bằng dung dịch chuẩn Na2S2O3




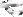
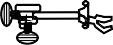






-
5mL dung dịch iod
-
10mL nước cất
-
5mL đệm acetat
-
5 giọt chỉ thị hồ tinh bột, lắc đều-
Chuẩn bằng Na
2
S
2
O3 đến khi dung dịch
mất màu xanh
Na
2
S
2
O
3
► Thực hiện 3 lần thí nghiệm. Tính thể tích Na2S2O3 trung bình, suy ra nồng độ đương lượng I2
Phản ứng chuẩn độ : I + 2S O 2- 2I- + S O 2-
2 2 34 6
4.2.3. Xác định hàm lượng Vitamin C (C6H8O6) trong mẫu bằng dung dịch Iod

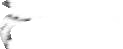








-
10mL mẫu
-
10mL nước cất
-
15mL acid oxalic, 1mL dung dịch CH
3
COONa 10%
-
Chuẩn độ bằng dung dịch iod đến khi dung dịch có màu
xanh tím.
Dung dịch Iod
Nồng độ Vitamin C trong mẫu được xác định như sau:
6 8 6 CN ×V mL)I2 0.0954×V mLiod
CNC H O =( V mLC6H8O6 = 10
4.3. Xác định hàm lượng Vitamin C trong mẫu bằng DPIP
4.3.1. Hiệu chuẩn dung dịch 2,6-Dicholophenol Indophenol bằng dung dịch Vitamin C










-
10mL dung dịch chuẩn Vitamin C
-
10mL nước cất
-
15mL dung dịch acid oxalic
-
1mL dung dịch CH3COONa 10%
Dung dịch DPIP
Điểm dừng chuẩn độ: Dung dịch chuyển từ màu xanh sang màu hồng.
Ta có:
(C
CDPIPN = N ×VmLmL)C6 H8O6 =0,0864mL×10
V DPIP V DPIP
4.3.2 Xác định vitamin C trong mẫu
- Lấy 10mL dung dịch lọc cho vào erlen 250mL
- Thêm 10mL nước, 15mL acid oxalic, 1mL dung dịch CH3COONa 10%
- Cho cá từ vào và khuấy đều dung dịch, nhúng hệ điện cực, hiệu chỉnh thông số máy
- Nhấn start, theo dõi kết quả chuẩn độ- Cài đặt các thông số:
Mode | Ipol | Stop condition | ||
Titration parameter | Abs | |||
V Step | 0.1ml | Stop V | 10ml | |
Dos.Rate | Max ml/min | Stop U | OFF | |
Signal. Drift | OFF Mv/min | Stop EP | 9 | |
Equilibr. Time | 8s | Filling rate | Max.ml/min | |
Start V | OFF | Evaluation | ||
Pause | 0s | EPC | 5 mV | |
I(pol) | 1uA | EP recognition | greatest | |
Temperature | 25oC | Fix ESP pH | OFF | |
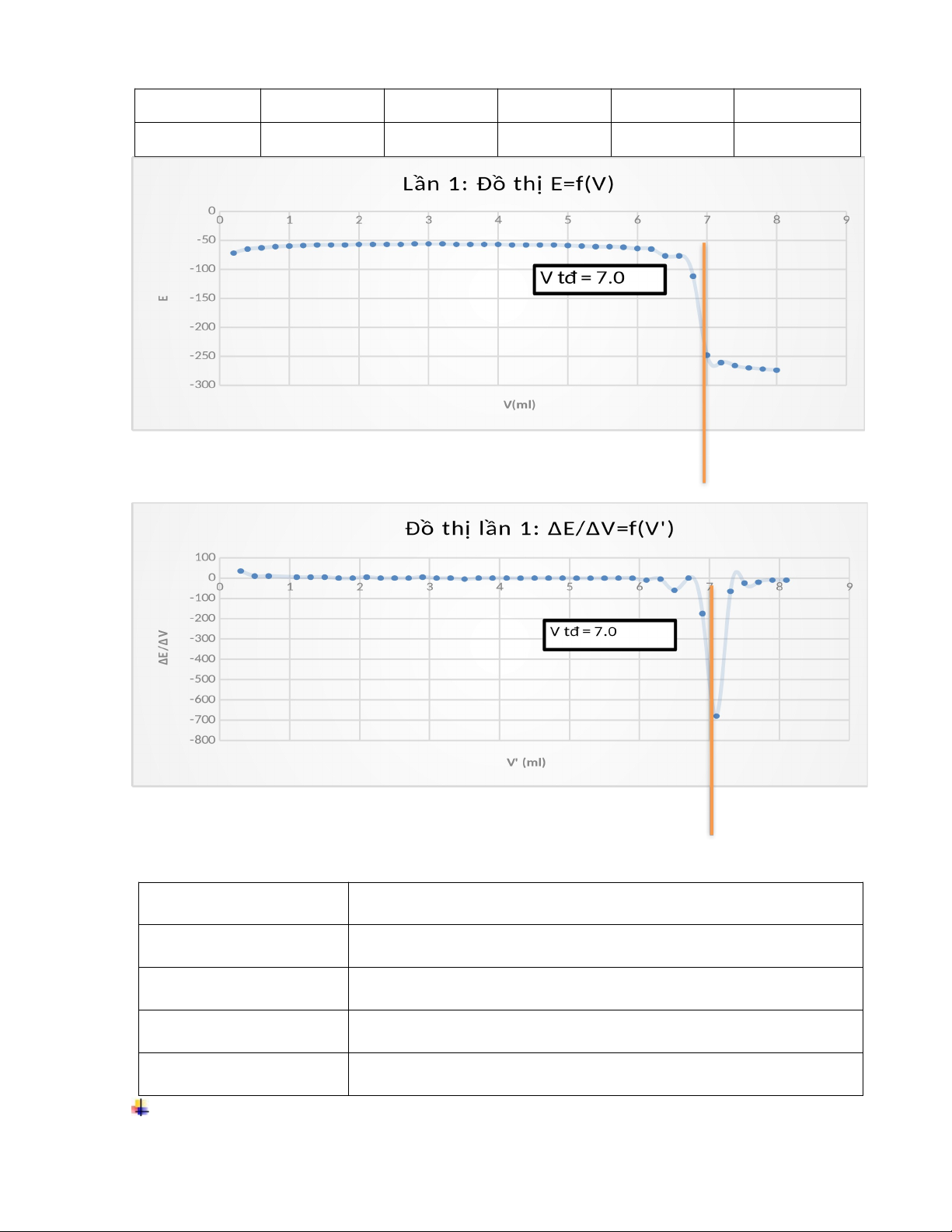
 Kết quả v Lần 1:
Kết quả v Lần 1:
V (mL) | E | rV | rE | V' | rE/rV |
0.2 | -72 |
|
|
|
|
0.4 | -65 | 0.2 | 7 | 0.3 | 35 |
0.6 | -63 | 0.2 | 2 | 0.5 | 10 |
0.8 | -61 | 0.2 | 2 | 0.7 | 10 |
1.0 | -60 | 0.2 | 1 | 1.1 | 5.0 |
1.2 | -59 | 0.2 | 1 | 1.3 | 5.0 |
1.4 | -58 | 0.2 | 1 | 1.5 | 5.0 |
1.6 | -58 | 0.2 | 0 | 1.7 | 0.0 |
1.8 | -58 | 0.2 | 0 | 1.9 | 0.0 |
2.0 | -57 | 0.2 | 1 | 2.1 | 5.0 |
2.2 | -57 | 0.2 | 0 | 2.3 | 0.0 |
2.4 | -57 | 0.2 | 0 | 2.5 | 0.0 |
2.6 | -57 | 0.2 | 0 | 2.7 | 0.0 |
2.8 | -56 | 0.2 | 1 | 2.9 | 5.0 |
3.0 | -56 | 0.2 | 0 | 3.1 | 0.0 |
3.2 | -56 | 0.2 | 0 | 3.3 | 0.0 |
3.4 | -57 | 0.2 | -1 | 3.5 | -5.0 |
3.6 | -57 | 0.2 | 0 | 3.7 | 0.0 |
3.8 | -57 | 0.2 | 0 | 3.9 | 0.0 |
4.0 | -57 | 0.2 | 0 | 4.1 | 0.0 |
4.2 | -58 | 0.2 | -1 | 4.3 | -0.5 |
4.4 | -58 | 0.2 | 0 | 4.5 | 0.0 |
4.6 | -58 | 0.2 | 0 | 4.7 | 0.0 |
4.8 | -58 | 0.2 | 0 | 4.9 | 0.0 |
5.0 | -59 | 0.2 | -1 | 5.1 | -0.5 |
5.2 | -60 | 0.2 | -1 | 5.3 | -0.5 |
5.4 | -61 | 0.2 | -1 | 5.5 | -0.5 |
5.6 | -61 | 0.2 | 0 | 5.7 | 0.0 |
5.8 | -62 | 0.2 | -1 | 5.9 | -0.5 |
6.0 | -64 | 0.2 | -2 | 6.1 | -10 |
6.2 | -65 | 0.2 | -1 | 6.3 | -5.0 |
6.4 | -77 | 0.2 | -12 | 6.5 | -60 |
6.6 | -77 | 0.2 | 0 | 6.7 | 0.0 |
6.8 | -112 | 0.2 | -35 | 6.9 | -175 |
7.0 | -248 | 0.2 | -136 | 7.1 | -680 |
7.2 | -261 | 0.2 | -13 | 7.3 | -65 |
7.4 | -266 | 0.2 | -5 | 7.5 | -25 |
7.6 | -270 | 0.2 | -4 | 7.7 | -20 |
7.8 | -272 | 0.2 | -2 | 7.9 | -10 |
8.0 | -274 | 0.2 | -2 | 8.1 | -10 |
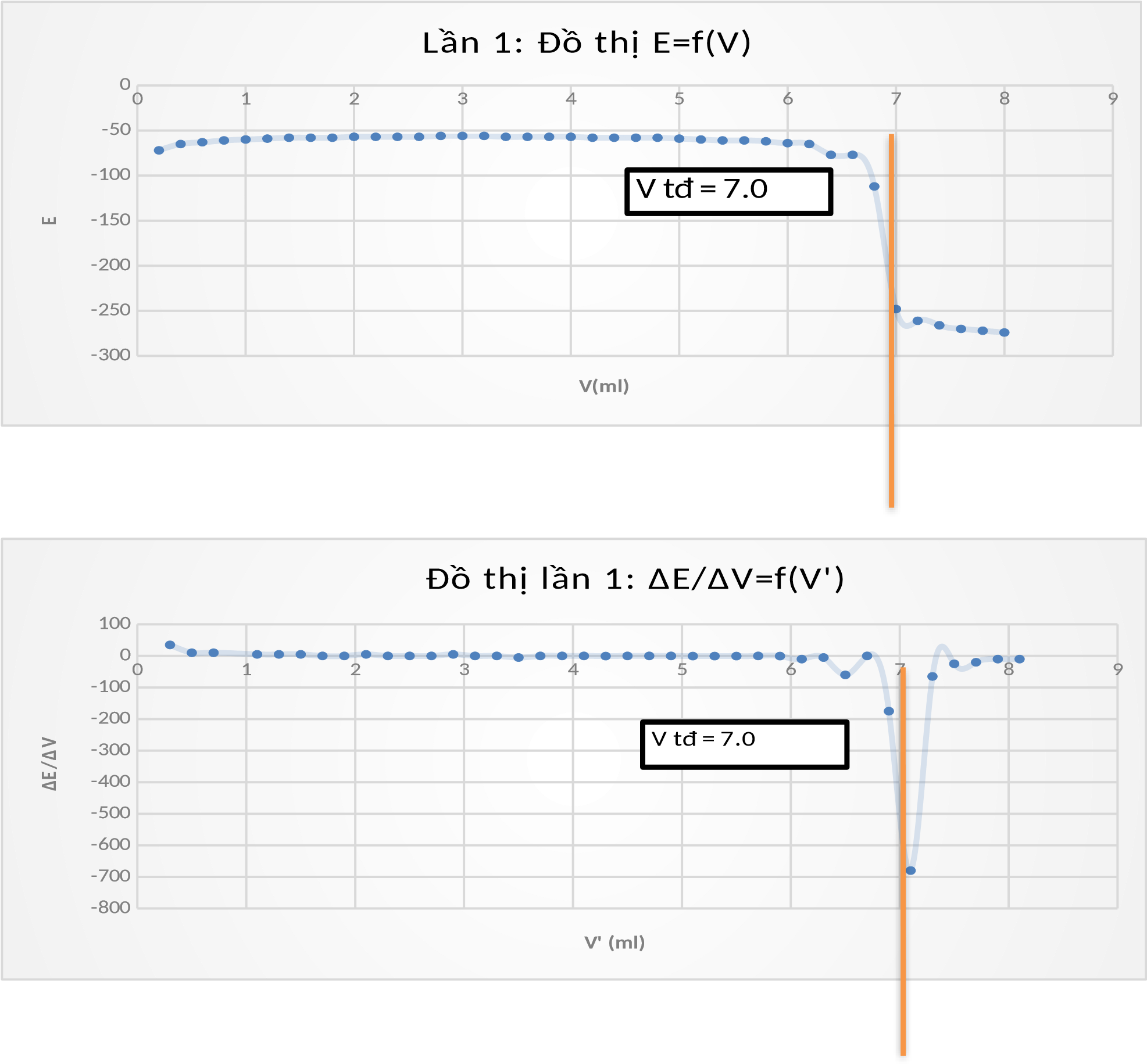
Lần thí nghiệm | Vtđ (DPIP) |
1 | 7.00 ml |
2 | 7.00 ml |
3 | 7.00 ml |
Trung bình | 7.00 ml |
 Ta có:
Ta có:
1.00mL (DPIP) là 0.0010M
Vậy 7.00 mL (DPIP) là 0.0070M  Và:
Và:
1.00mL (DPIP) = 0.001 mol/L tương ứng 0.1760 mg Vitamin C
Suy ra 0.0070M tương ứng 1.2320 mg vitamin C  Hàm lượng vitamin C trong mẫu (mgVitamin C /100g mẫu )
Hàm lượng vitamin C trong mẫu (mgVitamin C /100g mẫu )
mgVitaminC V bđm 100
( 100gmẫu )=C1× V hút × mmẫu
Trong đó : C1 là hàm lượng Vitamin C (mg)
 mgVitaminC 100mg
mgVitaminC 100mg
()=1.2320× × =125.2360( ) 100gmẫu 10 9.8374 100g
VI. Trả lời câu hỏi
6.1. Nêu vai trò các hóa chất đã sử dụng trong quy trình. Ngoài chất oxi hóa là DPIP ta còn có thể sử dụng chất oxi hóa nào khác để xác định acid ascobic không? Nêu nguyên tắc xác định acid ascobic bằng chất oxi hóa này.
 Ngoài chất oxi hóa là DPIP ta có thể dung dung dịch I2
Ngoài chất oxi hóa là DPIP ta có thể dung dung dịch I2
 Phương pháp Iod : Acid ascorbic được chuẩn độ bằng chất chuẩn là iod, nguyên tắc phương pháp là dựa vào phản ứng oxi hóa acid ascorbic thành acid dehydroascorbic bởi iod trong môi trường acid - Phương trình phản ứng :
Phương pháp Iod : Acid ascorbic được chuẩn độ bằng chất chuẩn là iod, nguyên tắc phương pháp là dựa vào phản ứng oxi hóa acid ascorbic thành acid dehydroascorbic bởi iod trong môi trường acid - Phương trình phản ứng :
I2+ I- I3C6H8O6 I3- C6H6O6 3I 2H
6.2. Nếu trong mẫu có chứa acid dehydro ascorbic thì phải xử lý như thế nào? - Ta cần xử lý ngay bằng cách thêm vài giọt axit oxalic và dung dịch iod đã pha trong KI để chuyển về acid ascorbic rồi đem đi xác định acid ascorbic trong mẫu như bình thường.




