




Preview text:
BÀI 2: XÁC ĐỊNH NHU CẦU OXY HÓA HỌC (COD) TRONG MẪU NƯỚC
II. Nguyên tắc
- Tổng hàm lượng hợp chất hữu cơ có trong nước thải sẽ bị oxi hóa bởi tác nhân oxihóa mạnh K2Cr2O7 và được tính tương đương với một lượng oxi tiêu tốn trong quá trình này. Lượng oxi đó chính là COD. Thông thường các hợp chất hữu cơ sẽ bị oxi hóa hoàn toàn bởi K2Cr2O7 trong môi trường axit H2SO4 đậm đặc ở điều kiện đun nóng khoảng 3 giờ.
+¿→ nCO2+(a+8 c)H2O+2 cCr3+¿¿¿
2−¿+8cH ¿ Cnab+cCr2 O7
H
O
(Chất hữu cơ) Với c = 2/3n + a/6 −¿ b/3
- Bằng cách cho một lượng Bicromat kali dư chính xác để oxi hóa hoàn toàn tổng hàm lượng hợp chất hữu cơ, sau đó chuẩn lượng Bicromat kali còn lại bằng dung dịch chuẩn Fe 2+ với chỉ thị Ferroin. Điểm tương đương nhận được khi dung dịch chuyển từ màu xanh lam sang màu nâu đỏ.
3+¿+7 H2O¿ 3
2−¿+6Fe2+¿+14 H+¿→6 Fe +¿+2Cr ¿¿¿ ¿
Cr O
2 7
FAS + 1,10 - Phenanthrolein → [Fe(Phen) ]2+
3
III. Trở ngại của các chất vô cơ
- Một số ion vô cơ có thể bị oxy hóa dưới điều kiện thí nghiệm COD làm gây sai số.
Cl- là một trong những ion gây sai số lớn nhất.
3+¿+7 H2O¿
6Cl−¿+Cr2O27−¿+14 H+¿→3Cl2+2 Cr ¿¿ ¿
- Khắc phục: Dùng HgSO4.
Hg+¿+2Cl−¿→ HgCl2¿¿
+ Để oxy hóa hoàn toàn khi trong nước có mặt nhiều chất hữu cơ mạch thẳng, các hydrocacbua thơm, các pyridin, pyrimidin khó bị oxy hóa, cần phải có chất xúc tác tham gia. Nitrit bị oxy hóa thành Nitrate cũng gây sai số COD. Khắc phục bằng cách thêm Sulphamic acid vào dung dịch dichnmate. IV. Ưu nhược điểm trong phân tích COD þ Ưu điểm:
- Cho biết kết quả trong một khoảng thời gian ngắn hơn nhiều (3 giờ) so với BOD (5 ngày).
→ COD được dùng để đánh giá mức độ ô nhiễm của chất hữu cơ thay cho BOD. þ Nhược điểm:
- Không thể xác định phần chất hữu cơ có khả năng phân hủy sinh học.
- Không cho biết tốc độ phân hủy sinh học của các chất hữu cơ có trong nước thải dướiđiều kiện tự nhiên. 5.1. Hóa chất
Tên hóa chất | Cách pha | Vai trò |
Dung dịch chuẩn K2Cr2O70.025 N | Cân chính xác 12.2623 g K2Cr2O7 (đã sấy khô ở 1050C trong 2 giờ, để yên trong bình hút ẩm 30 phút) hòa tan trong 500 mL nước cất. Thêm 167 mL H2SO4 đậm đặc, 33.3g HgSO4, khuấy cho tan, chờ nguội. Chuyển vào bình định mức 1 Lít, tráng rửa cốc pha, nhập chung nước rửa, tráng vào bình 1 Lít, cuối cùng dùng nước cất định mức đến vạch, lắc đều. | Dung dịch chuẩn để xác định nồng độ FAS |
CN ×V mL mcân= K2Cr210O7 × p ×Đ=29410××100099.9××0.256 =12 | ||
Dung dịch H2SO4 tác nhân | 5,5 g Ag2SO4 hòa tan trong 1 lit H2SO4 đậm đặc, sau 2 ngày mới sử dụng. | Tác nhân |
Dung dịch Fe2+ 0.25N (FAS) | Hòa tan 98g Fe(NH4)2(SO4)2.6H2O trong 250ml nước cất, thêm 20ml H2SO4 đậm đặc. Chờ nguội, định mức 1 lít CFe(NH4)2(SO4)2.6 H 2O ×V mL×Đ 392×1000 mcân= 10× p = 10×1 | Dung dịch chuẩn 0 |
Chỉ thị Ferroin | Hòa tan 1,485g 1,10-phenoltrolin, 0,695g FeSO4.7H2O, hòa tan và định mức bằng nước cất thành 100ml. | Chất chỉ thị |
VI. Tiến hành thí nghiệm
6.1. Xác định chính xác nồng độ dung dịch FAS










10
ml K
2
Cr
2
O
7
0
,25N
5
ml H
2
SO
4
6
N
20
ml nước cất
2
giọt chỉ thị Ferroin
Dung dịch Fe
2+
Thực hiện 3
lần. Lấy giá
trị trung
bình
Điểm tương đương nhận được: Dung dịch chuyển từ màu xanh nhạt sang nâu đỏ.
6.2. Xác định nhu cầu oxy hóa học (COD)
|
|
 |
|  |
Đậy nút vặn ngay, lắc kỹ

nhiều lần. Đặt ống nghiệm
vào rổ inox
Cho vào lò sấy 150
0
C trong 2
giờ. Để nguội đến nhiệt độ
phòng











+
Cho dung dịch trên vào erlen
+
1 vài giọt chỉ thị Ferroin
Dung dịch FAS 0.25N
Thực hiện
mẫu trắng
với nước cất
Điểm tương đương: Dung dịch chuyển từ màu xanh nhạt sang nâu đỏ
Bảng (*)
Thể tích mẫu (mL) | Dung dịch K2Cr2O7 | H2SO4 tác chất (mL) | Tổng thể tích (mL) |
2.5 | 1.5 | 3.5 | 7.5 |
5.0 | 3.0 | 7.0 | 15.0 |
10.0 | 6.0 | 14.0 | 30.0 |
7.2. Xác định nhu cầu oxy hóa học (COD)
Mà hàm lượng COD được tính theo công thức sau:
COD(mgO2/L)=(V ¿¿0−V m)×CV mFAS× ĐO ×1000 ¿
Trong đó:
V0: thể tích FAS dùng định phân mẫu trắng (mL)
V: thể tích FAS dùng định phân mẫu cần xác định (mL)
CFAS: nồng độ đương lượng dung dịch chuẩn FAS (N)
Vm: thể tích mẫu lấy đi xác định (mL) Nên ta được:
COD(mgO2/L)=(V ¿¿0−V m)×CV mFAS× ĐO ×1000 ¿
¿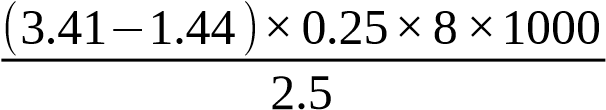 =1576mgO2/L
=1576mgO2/L
Vậy hàm lượng của COD là 157.60mgO2/L
VIII. Trả lời câu hỏi
Thuyết lập công thức tính hàm lượng COD mgO2/L
Cn Ha Ob+cCr2 O27−¿+8cH+¿→ nCO2+(a+8 c)H2O+2 cCr3+¿¿¿¿
3+¿+7H2O¿
Cr2O27−¿(dư)+6Fe2+¿+14 H+¿→6Fe3+¿+2Cr ¿¿¿ ¿
FAS + 1,10 - Phenanthrolein → [Fe(Phen)3]2+
Do Cr2O27−¿(dư)¿ nên: ¿¿
¿¿ + ¿¿
mCOD
gCOD/L= =¿¿¿
V Lit
¿¿¿¿
CN(V nềnFAS−V FASmẫu)×10−3 MO2
¿ V mL×10−3 × 4 (mg/L)




