




Preview text:
lOMoAR cPSD| 58797173
BÁO CÁO THÍ NGHIỆM BÀI 4
PHA DUNG DỊCH CHUẨN Na2CO3, XÁC ĐỊNH ĐỘ CHUẨN DUNG
DỊCH HCl, XÁC ĐỊNH NaOH VÀ Na2CO3 TRONG HỖN HỢP HO TÊN:
1. Nguyễn Bùi Anh Duy - 19130014
2. Nguyễn Thanh Huy - 19130023
3. Trần Trung Kiên - 19130029 NHÓM: 01 LỚP: 191300A
THỜI GIAN: 7h50 – 12h20 - BUỔI SÁNG THỨ NĂM
I. NGUYÊN TẮC VÀ CÁCH TIẾN HÀNH
* Xác định độ chuẩn dung dịch HCl Nguyên tắc
Cơ sở của phương pháp là phản ứng giữa acid - base của acid mạnh (HCl) và đa base (Na2CO3)
Phản ứng chuẩn độ Na2CO3 bằng HCl xảy ra qua hai giai đoạn:
Na2CO3 + HCl → NaCl + NaHCO3
NaHCO3 + HCl → NaCl + CO2 + H2O
Ta quan sát được hai điểm tương đương trên đường chuẩn độ. Cụ thể,
+ Tại điểm tương đương thứ nhất, pH ~ 8,34. Do đó, có thể dùng phenphatalein làm
chất chỉ thị. Tuy nhiên, cũng có thể chuẩn độ thẳng đến điểm tương đương thứ hai dùng
bromerezol lục hoặc metyl ca cam làm chỉ thị.
+ Điểm tương đương thứ hai được lựa chọn bởi vì bước nhảy pH lớn hơn nhiều so
với điểm tương đương thứ nhất. Kết luận, để thu được kết quả chính xác người ta đổi màu
metyl da cam (từ màu vàng sang màu da cam). Cách tiến hành
- Pha dung dịch chuẩn Na2CO3 0,1000N từ muối rắn Na2CO3 Cân 0,5303 gram Na2CO3 lOMoAR cPSD| 58797173 H ò a tan 100 mL n ướ c c ấ t.
100 mL dung d ị ch Na 2 CO 3 ,1000N 0 + T í nh h ệ s ố K cor. ( n ế u c ó )
- Pha dung dịch HCl ~ 0,1000N từ HCl đặc
Pipet: 2 mL HCl đặc + 248 mL n ướ c c ấ t
250 mL dung d ị ch HCl ~ 0 ,1000N
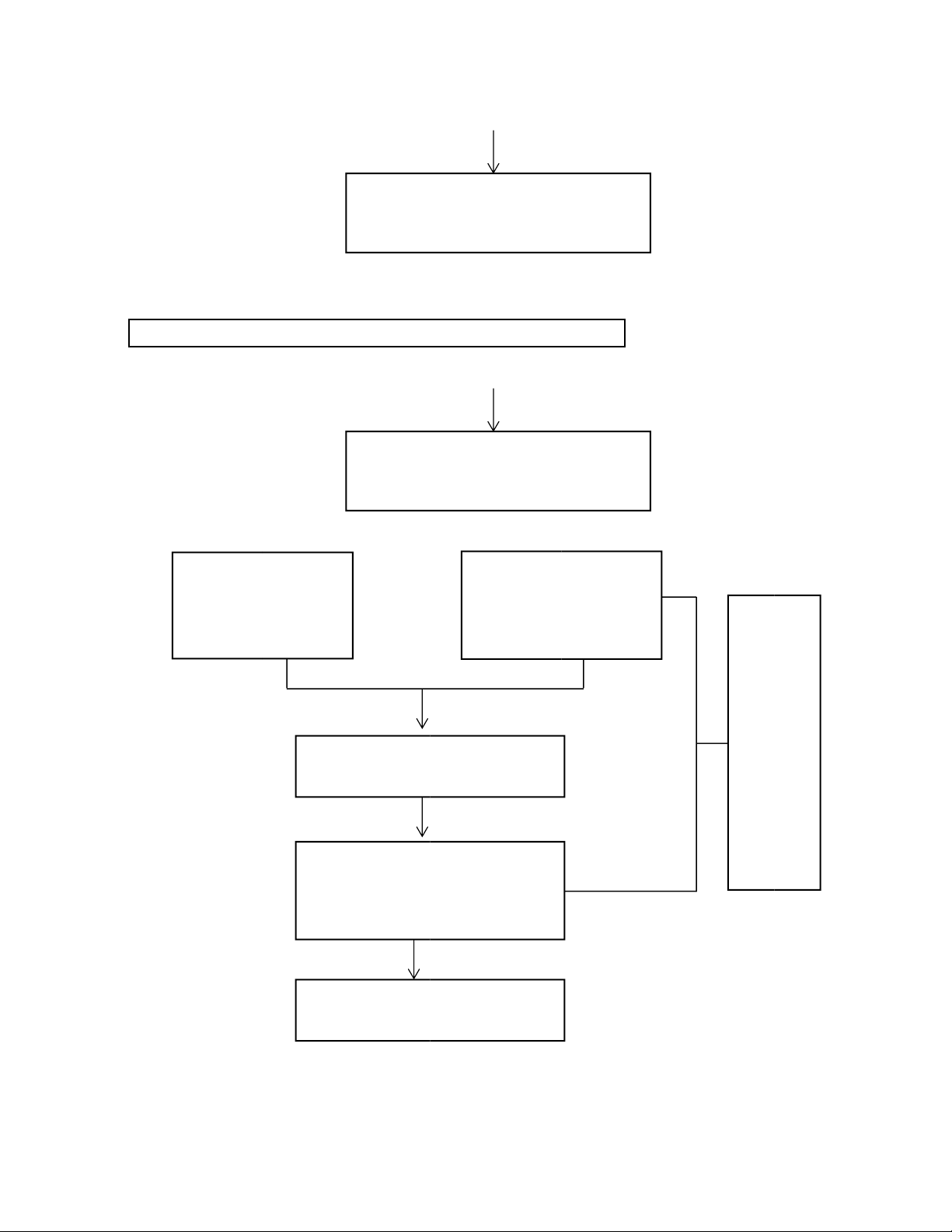
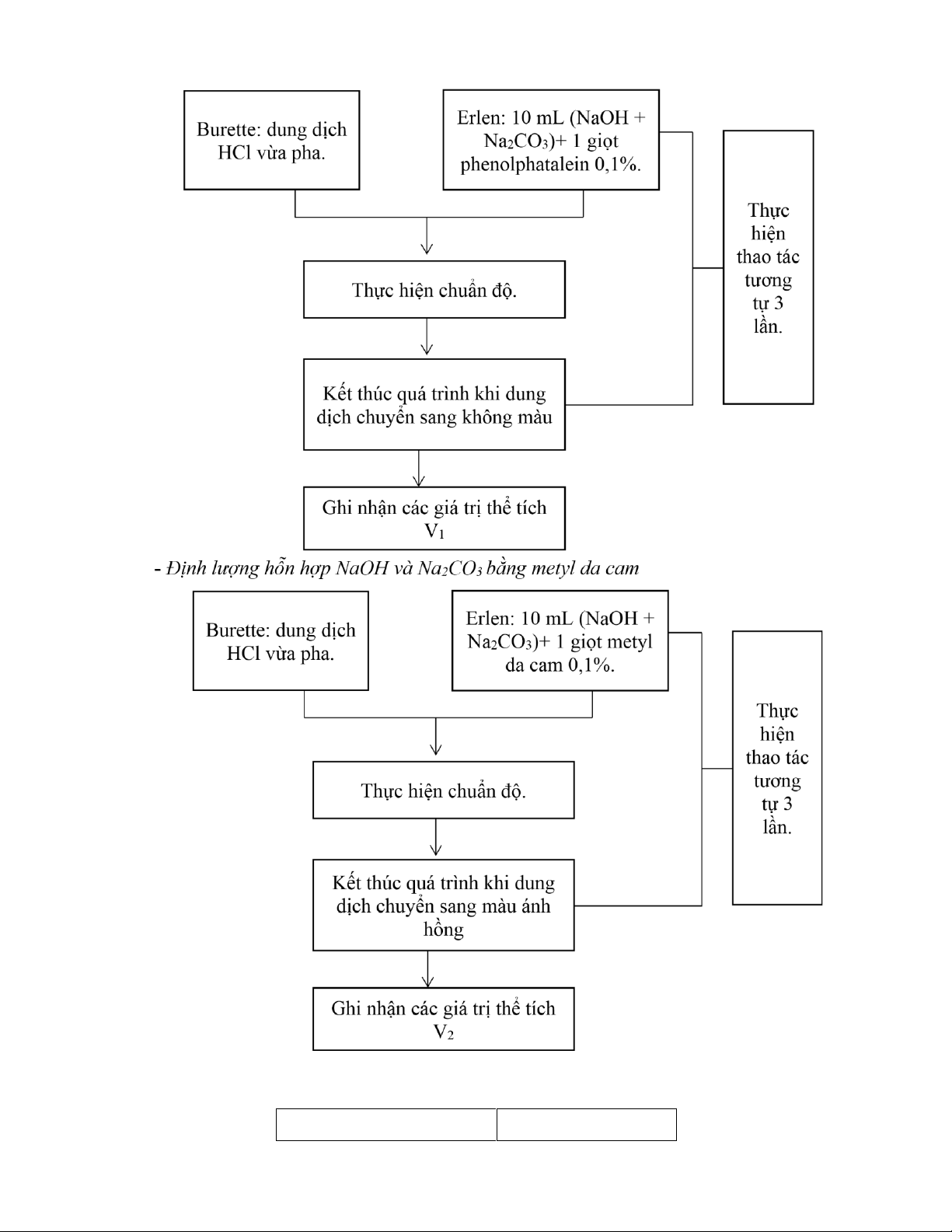
- Xác định lại nồng độ HCl với chỉ thị phenolphtalein: Erlen: 10 mL Burette: dung d ị ch Na 2 CO 3 0 ,1000N HCl v ừ a pha. + 1-2 gi ọ t phenolphtalein 0 ,1%. Th ự c hi ệ n thao t á c
Th ự c hi ệ n chu ẩ n độ . t ươ ng t ự 3 l ầ n.
K ế t th ú c qu á tr ì nh khi m ấ t
m à u h ồ ng c ủ a dung d ị ch
Ghi nh ậ n c á c gi á tr ị th ể t í ch V 1
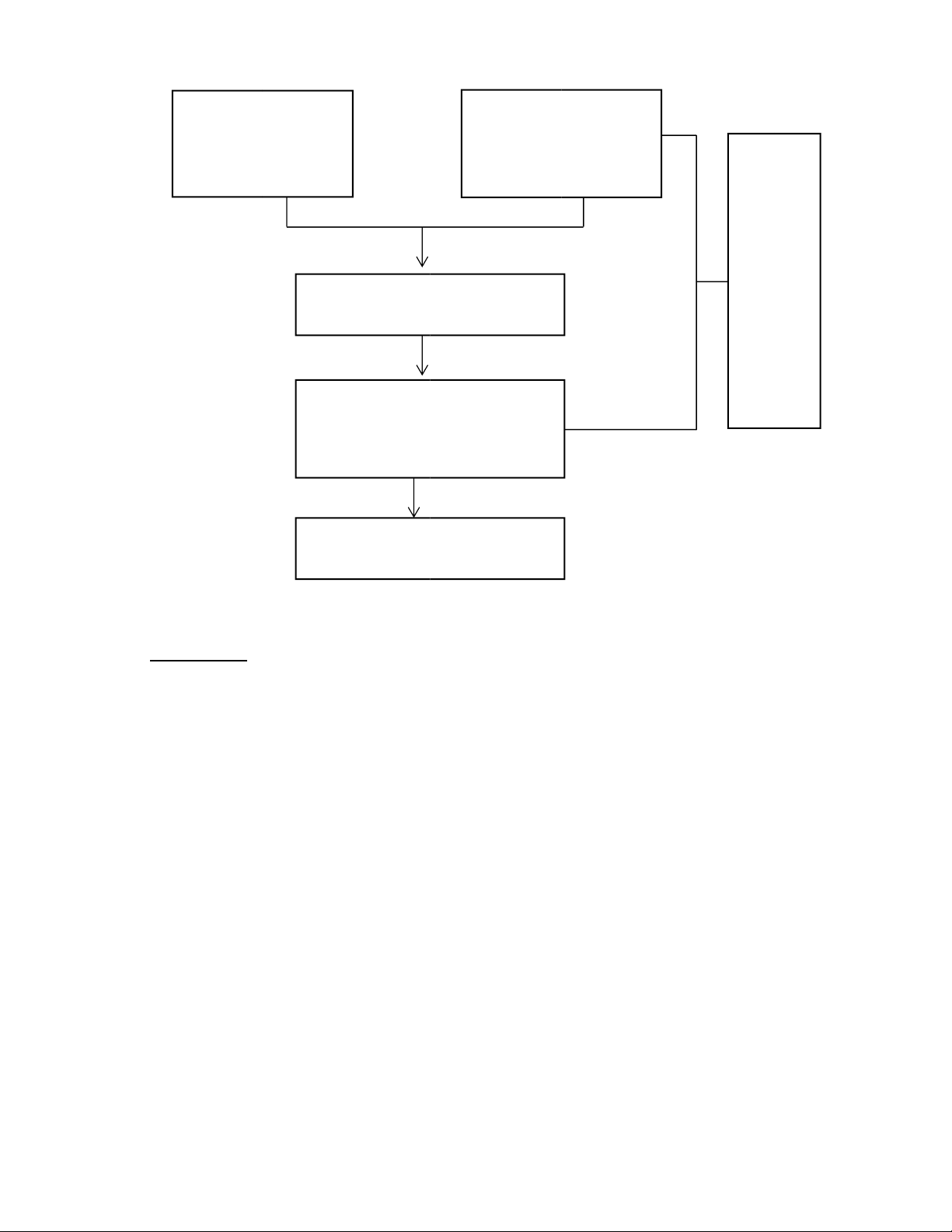
- Xác định lại nồng độ HCl với chỉ thị metyl da cam lOMoAR cPSD| 58797173 Erlen: 10 mL Burette: dung d ị ch Na 2 CO 3 0 ,1000N HCl v ừ a pha. + 1 gi ọ t metyl da cam 0 ,1%. Th ự c hi ệ n thao t á c
Th ự c hi ệ n chu ẩ n độ . t ươ ng t ự 3 l ầ n.
K ế t th ú c qu á tr ì nh khi dung
d ị ch chuy ể n sang m à u v à ng da cam
Ghi nh ậ n c á c gi á tr ị th ể t í ch V 2 ( L ý thuy ế t V 2 = 2V 1 )
* Xác định nồng độ các chất trong hỗn hợp NaOH và Na2CO3 Nguyên tắc
Dựa trên việc xác định hai điểm tương đương trên đường định phân Na2CO3
Cơ sở của phương pháp: HCl + NaOH → NaCl + H2O (1)
Na2CO3 + HCl → NaHCO3 + NaCl (2) NaHCO3 + HCl → NaCl + H2CO3 (3)
+ Phản ứng (1) – định phân một base mạnh bằng acid mạnh. Khi nồng độ NaOH và
HCl ~ 0,1000N thì bước nhảy pH khoảng 4 – 10. Kết luận, có thể kết thúc định phân bằng
sự đổi màu của chỉ thị có pT (4-10).
+ Phản ứng (2) - pH dung dịch ~ 8,34 vì Na2CO3 chuyển thành NaHCO3 trong dung
dịch có muối trung hòa NaCl, NaHCO3, H2O. Ở đây, dùng chỉ thị phenolphatalein huyển
từ màu hồng sang không màu.
+ Phản ứng (3) - NaHCO3 chuyển hết thành H2CO3, pH ~ 3,91. Giá trị pH nằm trong
khoảng mà metyl da cam đổi màu (3,1 – 4,4). Do đó, kết thúc theo sự đổi màu của metyl da cam. Cách tiến hành
- Định lượng hỗn hợp NaOH và Na2CO3bằng phenolphtalein lOMoAR cPSD| 58797173
II. KẾT QUẢ THÍ NGHIỆM
Bảng thể hiện σ của các dụng cụ thí nghiệm Dụng cụ σ lOMoAR cPSD| 58797173 Burette ± 0,03 (mL) Pipette ± 0,05(mL) Bình định mức 100 mL ± 0,1000 (mL) Cân kỹ thuật ± 0,0001 (gram)
TN1. Pha dung dịch chuẩn Na2CO3 0,1000 N từ muối rắn Na2CO3 (M = 106 mol/g)
- Số gam Na2CO3 (chất gốc) cần lấy để pha 50,00 mL dung dịch Na2CO3 0,1000N. mtheo. =
0,5300 (gram) - Cân chính xác khối lượng Na2CO3:
mrel. = 0,5303 (gram) - Hệ
số hiệu chỉnh: Kcor. = 𝒓. = .𝟓𝟓 = , 𝒕.
.𝟓 - Nồng độ thực
của Na2CO3 (khoảng tin cậy ± ɛ0,95%) : , × 𝒉.
= , × , = 0,100057 (N) , = ±
( , 𝟓𝟓 ) + ( , ) = ± 0,0010
CNa2CO3 = 0,1001 ± 0,0010 (N) TN2.
Pha dung dịch HCl gần đúng 0,1N
- Thể tích HCl đậm đặc cần lấy để pha 250,0 mL dung dịch HCl 0,1N là:
V HCl đậm đặc = 2ml
TN3. Xác định nồng độ dung dịch HCl
a) Bước nhảy với chỉ thị phenolphtalein HCl Na2CO3 Dụng cụ Burrette Pipette σ (mL) ± 0,03 ± 0,05 Lần 1 (mL) 5,00 10,00 Lần 2 (mL) 4,90 10,00 Lần 3 (mL) 4,80 10,00 Trung bình (mL) 4,90 10,00 SV 0,10 0,00
Biểu diễn CN cua HCl kem theo ε0.95 VHCl ×CHCl = VNa2CO3 ×CNa2CO3 ↔ CHCl = Na2CO3×CNa2CO3 2×VHCl ↔ CHCl = = 0,1020989796 (N) lOMoAR cPSD| 58797173
Tra bảng student với f = 3 – 1 = 2, thu được t(0,95;2) = 4,30 0 ,00 10 2 4, 30 × 0, 10 2 0 05 , × 1 96 , 2 + + 0,95; 𝐻= ± 0,1020989796 0,100 1 4 90 , × 3 10 00 , × 3 = ±0,0053 = (0,1021 ± 0,0053) (N)
b) Bước nhảy với chỉ thị metyl da cam HCl Na2CO3 Dụng cụ Burrette Pipette σ (mL) ± 0,03 ± 0,05 Lần 1 (mL) 9,9 10,00 Lần 2 (mL) 9,9 10,00 Lần 3 (mL) 10,1 10,00 Trung bình (mL) 9,97 10,00 SV 0,12 0,00
Biểu diễn CN cua HCl kem theo ε0.95 VHCl ×CHCl = V Na2CO3 ×C Na2CO3 ↔ CHCl = Na2CO3×CNa2CO3 𝐻 ↔ CHCl = = 0,100358 (N)
Tra bảng student với f = 3 – 1 = 2, thu được t(0,95;2) = 4,30 0 00 , 10 2 4 30 , × 0 12 , 2 1 96 , × 0 05 , 2 + + 0,95; 𝐻= ± 0,100358 0 10 , 01 9 97 , × 3 , 10 00 × 3 = ± 0,0032 = (0,1003 ± 0,0032)(N)
TN4. Xác định nồng độ dung dịch hỗn hợp NaOH + Na2CO3 HCl (phenolphtalein) HCl (metyl da cam) NaOH + Na2CO3 V1 V2 Dụng cụ Buret Buret Pipet σ (mL) ± 0,03 ± 0,03 ± 0,05 Lần 1 (mL) 9,80 14,80 10,00 Lần 2 (mL) 9,90 14,75 10,00 lOMoAR cPSD| 58797173 Lần 3 (mL) 9,90 14,70 10,00 Trung bình (mL) 9,87 14,75 10,00 SV 0,058 0,050 00,00
Lượng HCl cần để định phân nấc 1 Na2CO3:V2 – V1 = 14,750 – 9,870= (4.880 ± 0,076) (mL)
Lượng HCl cần để định phân NaOH: 2V1 –V2 = 2*9,870 – 14,750= (4.990 ± 0,076) (mL).
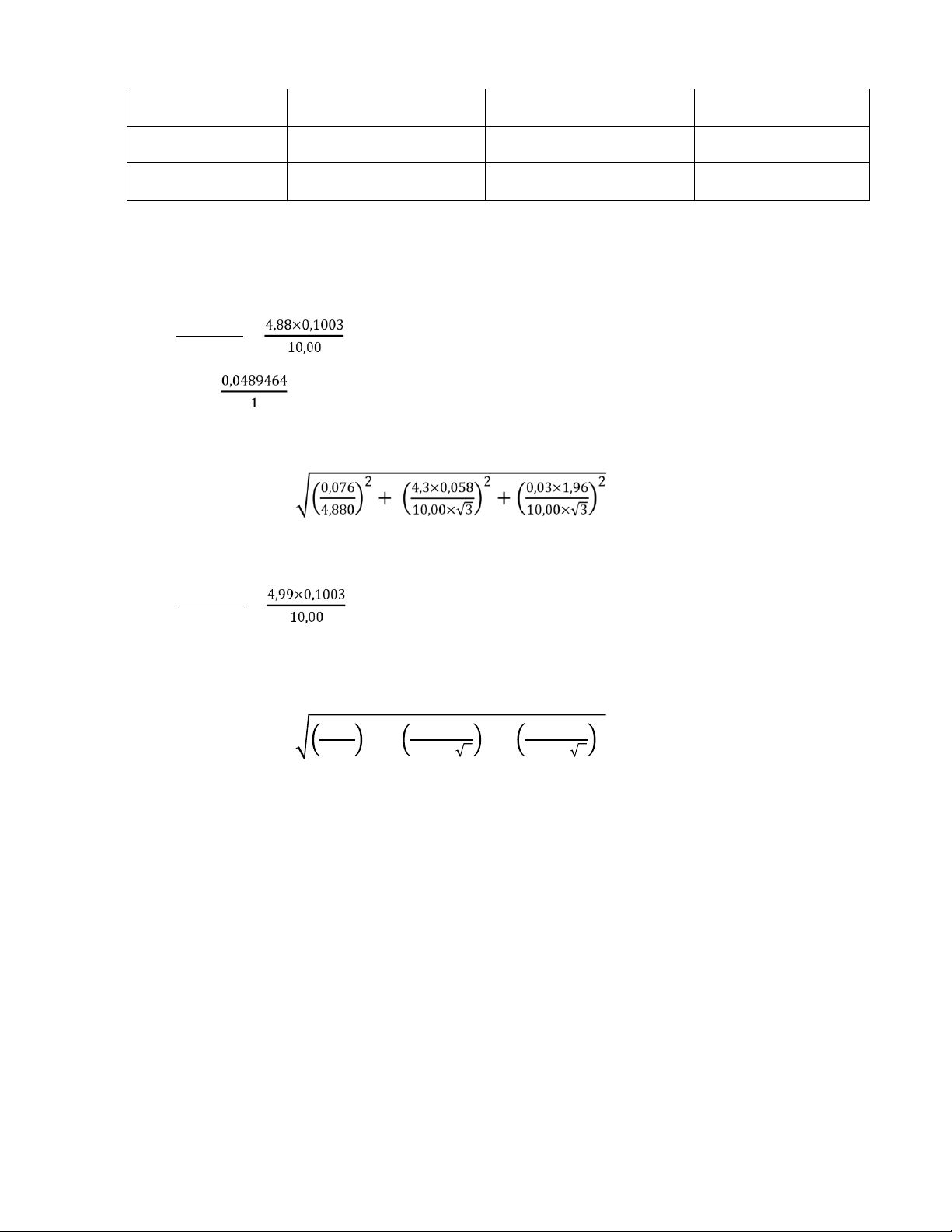
Biểu diễn CM cua Na2CO3 kem theo ε0.95 𝐻 ×𝐻 CN = == 0,0489464 (N) 𝑁23 CM = == 0,0489464 ()
Tra bảng student với f = 3 – 1 = 2, thu được t(0,95;2) = 4,30 ε0.95 = ± 0,0489464 = 0,0011 μ = 0,0489 ± 0,0011(M)
Biểu diễn CM cua NaOH kem theo ε0.95 𝐻 ×𝐻 CM = == 0,0500497 (M) 𝑁
Tra bảng student với f = 3 – 1 = 2, thu được t(0,95;2) = 4,30 0 ,0 76 2 4, 3 × 0,050 2 0 03 , × 1 96 , 2 ε + + 0.95 = ± 0,0500497 4,990 10 00 , × 3 10 00 , × 3 = 0,00010 μ = (0,05005 ± 0,00010) (M) lOMoAR cPSD| 58797173
III. ĐÁNH GIÁ KẾT QUẢ *
Xác định nồng độ HCl
- Với chỉ thị Phenolphtalein
+ Nồng độ dung dịch HCl sau khi được chuẩn độ lại bằng dung dịch gốc Na2CO3 với
chỉ thị phenolphthalein cho giá trị nồng độ là: (0,1021 ± 0,0053) (N).
- Với chỉ thị methyl da cam
+ Nồng độ dung dịch HCl sau khi được chuẩn độ lại bằng dung dịch gốc Na2CO3 với
chỉ thị metyl da cam cho giá trị nồng độ là: (0,1003 ± 0,0032)(N). - Đánh giá
+ Theo lý thuyết, VHCl,metyl da cam = 2VHCl,phenolphtalein. Nhưng kết quả thực tế là
VHCl,metyl da cam > 2VHCl,phenolphtalein , lớn hơn 0,17 mL, khoảng 3,47%.
+ Giá trị nồng độ HCl với chỉ thị metyl da camcó độ chính xác cao hơn so với tính
theo chỉ thị phenolphatalein do bước nhảy chuẩn độ của điểm tương đương thứ hai dài
hơn nên việc định lượng sẽ chính xác hơn.
+ Việc xác định nồng độ dung dịch HCl bằng Na2CO3tại điểm tương đương thứ nhất
mắc sai số lớn hơn một lượng tương ứng 0,0021.
+ Qua hai lần chuẩn độ với chỉ thị phenolphtalein và metyl da cam ta thấy nồng độ
của HCl có sự sai lệch không đáng kể. Cụ thể, lượng tương ứng: 0,1021-0,1003 = 0,0018 Sai lệch khoảng × 100 ≈ 1,8%
Lý do của sự sai lệch trên là vì: Do cảm quan màu sắc của mỗi người hoặc kỹ thuật khi
thực hiện chuẩn độ dẫn đến sai lệch thể tích từ sai lệch thể tích dẫn đến sai lệch nồng độ.
* Xác định nồng độ dung dịch hỗn hợp NaOH + Na2CO3
+ Nồng độ của NaOH trong hỗn hợp là (0,05005 ± 0,00010) M, ứng với độ tin cậy 95%.
+ Nồng độ của Na2CO3 trong hỗn hợp là (0,0489 ± 0,0011) M, ứng với độ tin cậy 95%.
IV. CÂU HỎI VÀ BÀI TẬP
Câu 1: Tại sao phương pháp xác định NaOH và Na2CO3 trong cùng một dung dịch
HCl với hai chất chỉ thị không chính xác? H+ + OH- ⟶ H2O H+ + CO32- ⟶ HCO3- 𝐻3− = 4,7.10-11= K H+ + HCO - 2- 3 ⟶ CO3 3 = 4,5.10-7 = K1 2
Bước nhảy chuẩn độ ở điểm tương đương thứ nhất không đủ lớn nên sự chỉ thị màu
của chất chỉ thị này sẽ không rõ ràng tạo nên sự không chính xác, khó xác định vị trí điểm
tương đương. Thứ 2 là do sự hấp thụ CO2. lOMoAR cPSD| 58797173
Câu 2: Trong phương pháp thứ hai, nếu sau khi kết tua CO 2- 3
bằng BaCl2, chuẩn độ
dung dịch NaOH cần xác định lại bằng HCl với chất chỉ thị phenolphatelin thì không
cần lộc kết tua BaCO3 nếu dùng chất chỉ thị dacam có được không? Giải thích?
Không thể sử dụng chỉ thị metyl da cam thay cho chỉ thị phenolphthalein được chỉ thị
phenolphthalein được sử dụng để chuẩn độ một một base mạnh bằng một acid mạnh,
trong trường hợp này bước nhảy chuẩn độ có pH từ 5 đến 10, nằm trong khoảng pH
chuyển màu của phenolphthalein nên mới sử dụng làm chỉ thị; còn metyl da cam có
khoảng pH chuyển màu từ 3,1 đến 4,4 và pT= 4 nên không phù hợp và không nên được sử
dụng để làm chỉ thị cho phản ứng này.
Câu 3: Tính lượng KOH và K2CO3 trong mọt mẫu sản phẩm KOH kỹ thuật nếu sau
khi hòa tan mẫu, chuẩn độ dung dịch bằng HCl 0,09500N với chất chỉ thị
phenolphthalein thì hết 22,40 mL dung dịch với chất chỉ thị metyl da cam thì hết 25,8 mL dung dịch HCl? V1 = 22,40 mL V2 = 25,80 mL ⟶ 2 V1 >V2
VHCl định phân 1 nấc K2CO3 (1): V2 – V1 = 25,80 – 22,40 = 3,40 mL VHCl định phân KOH
(2): 2V1 – V2 = 2. 22,40 – 25,80 = 19,00 mL m KOH =
VHCl(2). CHCl.M = 19.0,09500. 10-3.56 =1,011g mK2CO3
= 0,09500.3,4.10-3.138 = 0.046 g
Câu 4: Khi định phân 25,00 mL hỗn hợp Na2CO3 và NaHCO3 bằng dung dịch H2SO4
0,1200N với chất chỉ thị phenolphthalein thì hết 9,46 mL dung dịch với chất chỉ thị
metyl da cam thì hết 24,8 mL H2SO4 như trên. Tính số gam Na2CO3 và NaHCO3 trong
250 mL dug dịch hỗn hợp trên?
- Đối với chỉ thị phenolphthalein
PTHH: 2Na2CO3 + H2SO4 → 2NaHCO3 + Na2SO4 (1) n H2SO4 = = 5,67610−4 (mol)
m Na2CO3 (25ml) = (5,67610−4 x 2) x 106 = 0,1203 (g) m
Na2CO3 (250ml) = 0,1203 x 10 = 1,203 (g)
- Đối với chỉ thị metyl da cam
PTHH: 2NaHCO3 + H2SO4 → Na2SO4 + 2H2CO3 (2) n H2SO4 = = 1,488−3 (mol)
Số mol NaHCO3 phản ứng với H2SO4 là NaHCO3 ban đầu trong hỗn hợp và lượng
NaHCO3 sinh ra từ phản ứng (1) lOMoAR cPSD| 58797173
Gọi x là số mol NaHCO3 trong hỗn hợp ban đầu và được sinh ra từ phản ứng (1). Ta
có: n H2SO4 = 5,67610−4 + = 1,488-3 mol => X = 1,8408 x 10-3 (mol) 2
m NaHCO3 bd (25ml) = [ (1,8408 x 10-3 ) - (5,67610−4 x 2)]x 84 = 0,05989 (g) m
NaHCO3 (250ml) = 0,05989 x 10 = 0,05989 (g)
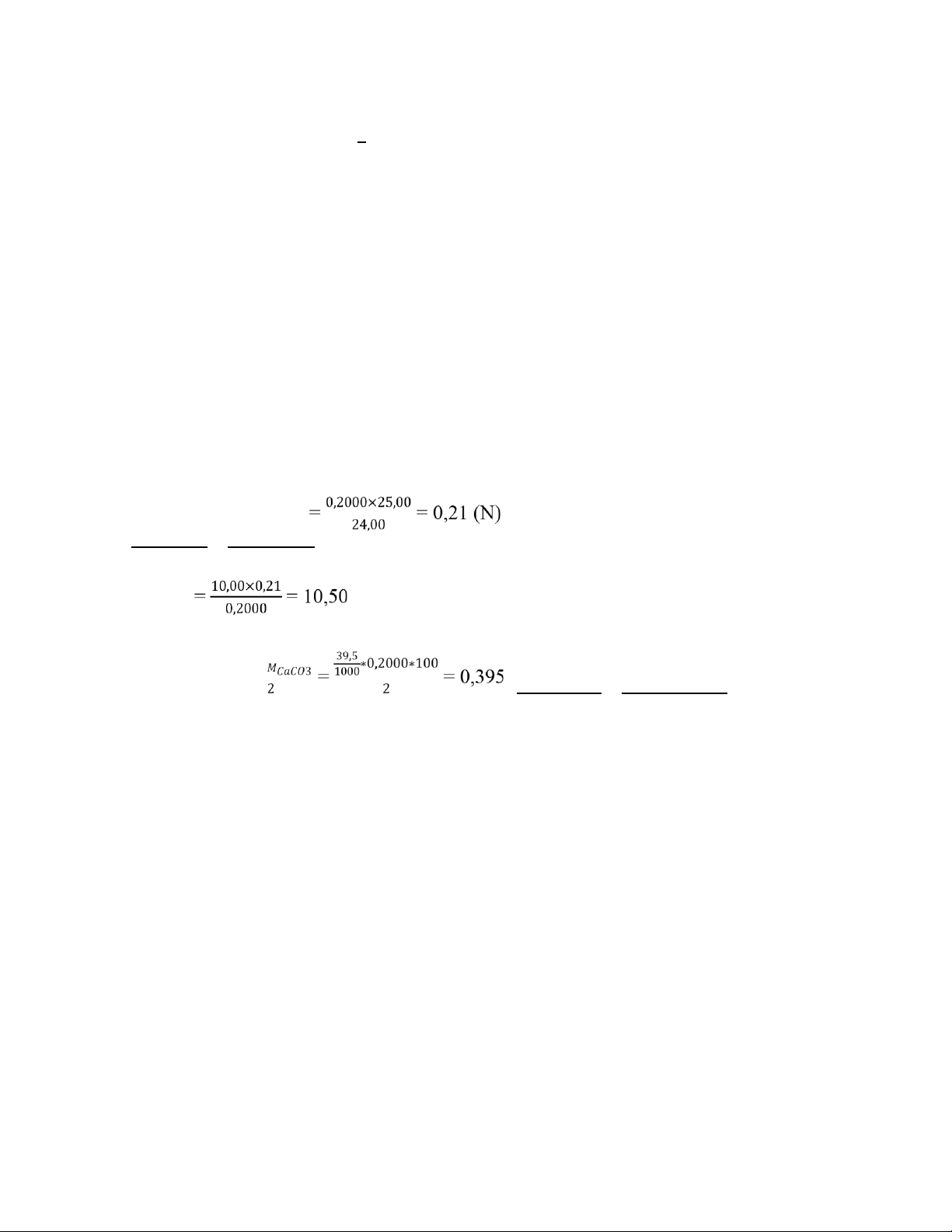
Câu 5: Sau khi hòa tan một mẫu CaCO3 vào 50,00 ml dung dịch HCl 0,2000N, người
ta cần dùng 10,00 ml dung dịch NaOH để chuẩn độ lượng dư HCl. Biết rằng để chuẩn
độ 25,00 mL dung dịch HCl trên cần 24,00 mL dung dịch NaOH. Tính số gam CaCO3
có trong mẫu phân tích. H+ + OH- → H2O H+ + CO32- → HCO3- VHCl × CHCl = VNaOH × CNaOH ↔ CNaOH = V HCl × CHCl VNaOH ↔ VHCl ml
→ VHCl phản ứng = 50,00 – 10,50 = 39,50 (mL) 𝐻 × → mCaCO3 = (gram)



