
















Preview text:
ĐẠI HỌC ĐÀ NẴNG
TRƯỜNG ĐẠI HỌC BÁCH KHOA KHOA HÓA
BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG
GVHD: ……………………………………………
SVTH: …………………………………………….
LỚP:……………………………………………..... NHÓM:
…………………………………………… Đà Nẵng, 2020
NHỮNG ĐIỀU CẦN LƯU Ý KHI ĐI LÀM THÍ NGHIỆM
1. Trước khi đi làm thí nghiệm, sinh viên phải đọc kỹ tài liệu hướng dẫn để hiểu rõ
cơ sở lý thuyết và bản chất các bài thí nghiệm.
2. Nắm vững các bước tiến hành thí nghiệm.
3. Đi làm thí nghiệm đúng giờ và đúng nhóm đã được phân theo lịch của phòng Đào tạo.
4. Cẩn thận với các hóa chất độc hại và nguy hiểm.
5. Khi gặp sự cố phải báo ngay với giáo viên hoặc cán bộ phụ trách phòng thí
nghiệm để kịp thời giải quyết.
6. Phải giữ gìn dụng cụ, hóa chất cẩn thận, trật tự trong quá trình làm thí nghiệm.
7. Sau khi làm thí nghiệm xong, lau chùi sạch sẽ bàn thí nghiệm, sắp xếp dụng cụ
và hóa chất gọn gàng, ngăn nắp.
8. Nộp báo cáo thí nghiệm đúng thời gian quy định.
9. Báo cáo thí nghiệm viết tay, tính toán rõ ràng từng bước, chỉ cho phép vẽ đồ thị trên máy tính.
10. Đi làm thí nghiệm nhớ mang theo thẻ sinh viên.
CÁC TRƯỜNG HỢP XỬ LÝ KHẨN CẤP TẠI PTN
1. Rơi đổ hóa chất
- Kịp thời thông báo cho mọi người để có biện pháp xử lý
- Hóa chất bị đổ có khả năng gây cháy thì phải tắt nguồn điện và thiết bị cung cấp ngu n ồ - Sử d ng các v ụ
ật liệu cần thiết như chất hấp thụ để làm sạch các hóa chất rơi đổ
- Mang đầy đủ các d ng c ụ b ụ ảo h cá nhân khi x ộ
ử lý các hóa chất rơi đổ - Thu h i và x ồ
ử lý các vật liệu hấp thụ
- Vệ sinh lại toàn b khu v ộ ực bị rơi hóa chất
2. Hóa chất văng bắn vào người
- Dùng vòi sen hay vòi rửa mắt rửa ít nhất 15 phút
- Trong trường hợp có người bị thương cần giữ nạn nhân bình tĩnh, sơ cấp cứu và báo cho cán b y t ộ ế của trường.
3. Rơi đổ chủng vi sinh vật
- Để tránh trường hợp đổ chủng vi sinh vật trong phạm vi lớn, m i
ọ thao tác tiến hành với
chủng chuẩn phải được thực hiện trên khay bằng vật liệu có thể hấp tiệt trùng.
- Rác thải nhiêm vi sinh phải được hấp tiệt trùng ở 120°C trong 20 phút trước khi đổ bỏ vào thùng gom
3.1 Rơi đổ ở mức độ nhỏ
- Dùng vật liệu thấm chất tiệt trùng thích hợp (c n
ồ 70°) phủ lên bề mặt phạm vi ch ng ủ vi sinh vật bị đổ - Toàn b các v ộ
ật liệu vào vật chứa và đem hấp khử trùng
- Vệ sinh bề mặt bằng chất khử trùng (c n 70° ồ )
3.2 Phạm vi đổ m ở l ức độ ớn Trong t c ủ y s ấ inh h c, t ọ ủ m ấ - Mang đầy đủ d ng c ụ b
ụ ảo h cá nhân khi làm v ộ ệ sinh vùng lây nhiễm
- Trong suốt quá trình làm vệ sinh tủ phải luôn mở
- Nếu pham vi nh thì dùng v ỏ
ật liệu thấm chất tẩy tiệt trùng, lau sạch và b ỏ như rác thải nhiễm vsv
- Nếu chủng VSV đổ trên bề mặt làm việc phủ toàn bộ bề mặt bằng vật liệu có chất tẩy
tiệt trùng, để yên 20ph. Thu hồi và loại bỏ như rác thải nhiễm - Vệ sinh toàn b b ộ ề mặt t và các ch ủ b
ỗ ị văng bắn bằng chất tẩy tiệt trùng - Thu h i nh ồ
ững vật bị nhiệm cho vào vật chứa và đem hấp khử trùng Bên ngoài t c ủ y ấ , t ủ m và bên trong pt ấ n - Nếu ch ng ủ
VSV bị đổ trong phạm vi lớn thì di chuyển toàn b
ộ nhân viên trong khu vực
đổ. Dán giấy cảnh báo lên cửa PTN và đóng cửa khu vực đó lại
- Nếu có tai nạn xảy ra đổi với khu vực đó cần phải được trang bị đầy đủ: chất tẩy, dụng
cụ chứa, khán thấm, túi đựng. Mang đầy đủ dụng cụ bảo hộ cá nhân khi xử lý - Vệ sinh toàn b khu v ộ ực bị b
đổ ằng chất tẩy tiệt trùng theo các bước sau: + Cô lập toàn b ộ khu vực bị
đổ bằng chất tẩy tiệt trùng để ngăn chặn sự chảy tràn. Phủ lên toàn bộ bề mặt b
đổ ằng chất vật liệu có thấm chất tẩy
+ Để yên 20ph sau đó thu hồi, loại b ỏ i nhi như rác thả ễm
+ Vệ sinh những vật liệu k hấp hử c b trùng đượ
ằng các chất tẩy sát trùng - Những vật sắc nh n
ọ mà có nhiệm vsv cần phải thu hôi và để vào bình chứa thích hợp
trước khi đem hấp khử trùng và loại b ỏ
- Những vật liệu khác bị nhiễm VSV thì được thu h i
ồ và hấp khử trùng để tái sử d ng ụ hoặc loại bỏ 4. Sự c cháy n ố ổ - Ngay lập t ng ức báo độ
- Tắt hệ thống điện ở khu vực cháy n ổ - Cô lập d ng c ụ , h ụ ệ th ng và hóa ch ố ất v ới đám cháy
- Lập tức đưa người bị thương ra khỏi khu vực nguy hiểm và sơ cứu nếu cần thiết.
- Phạm vi nhỏ: có thể chữa cháy bằng bình chữa cháy - Ph m ạ
vi lớn: Sơ tán mọi người khỏi đám cháy, di chuyển về nơi an toàn. Gọi hỗ trợ
của những người xung quanh, g i ọ 114 hoặc s
ố điện thoại khẩn cấp 5. Ch y máu v ả
ết thương do bị c t ắ
5.1. Vết thương nhỏ do dụng c có dính hóa ụ chất gây ra
- Nếu không tự sơ cứu được thì gọi trợ giúp ngay
- Cho vết thương chảy máu vài phút rồi rửa vết thương với nhiều nước sạch
- Sát trùng vết thương với oxy già hay c n y ồ tế
- Băng vết thương lại và đến phòng y tê xử lý tiếp t c ụ
5.2. Vết thương lớn, chảy máu nhiều
- Lập tức kêu gọi giúp đỡ và tiến hành cầm máu bằng cách ấn mạnh miệng vết thương
- Băng chặt vết thương và nhanh chóng đưa về phòng y tế
- Thông báo hiện trạng và hóa chất có thể nhiễm 6. Bỏn g 6.1 B ng nhi ỏ ệt - Lập tức tách kh i ngu ỏ n
ồ nhiệt, nếu là cháy tóc hay quần áo thì lập tức cởi bỏ quần áo
và dập lửa bằng phương tiện thích hợp - Nhanh chóng cởi b
ỏ vải và trang sức quanh khu vực bỏng, lập tức ngâm vết thuong
trong nước mát ít nhất 10 phút (không dùng nước đá) - B ng v ă
ết thương bằng gạc y tế rồi đến trung tâm y tế. 6.2. Bỏng hóa ch t ấ - Lập tức yêu cầu h
ỗ trợ và cảnh báo người xung quanh về hóa chất gây tai nạn
- Bản thân người hỗ trọ mang bảo hộ thích hợp
- Ngay lập tức tách phần lớn hóa chất kh i
ỏ vết thương. Nếu hóa chất có phản ứng với
nước cần lau sạch vết thương bằng vải khô trước. Sau đó nhanh chóng rửa vết thương
bằng nước sạch ít nhất 15
– 20 phút. Nếu hóa chất dính vào mắt nhanh chóng dùng vòi
rửa mắt rửa ít nhất 15 phút.
- Nhanh chóng đến phòng y tế của trường. BÀI 1
KỸ THUẬT PHÒNG THÍ NGHIỆM I/ Giới thiệu:
Kỹ thuật phòng thí nghiệm (PTN), nói chung sẽ được lần lượt giới thiệu trong quá
trình thực tập lâu dài của sinh viên ở các năm học. Trong bài mở đầu này chỉ giới thiệu
những gì cơ bản nhất mà sinh viên cần nắm trước khi làm bài thí nghiệm đầu tiên tại phòng TN.
Các loại dụng cụ thông dụng nhất trong phòng thí nghiệm hoá học: 1. Cân:
Là dụng cụ đo lường dùng để xác định khối lượng của một vật, trong phòng thí
nghiệm thường phân biệt 2 loại cân: cân kỹ thuật và cân phân tích.
*Cân kỹ thuật là cân dùng để cân các khối lượng tương đối lớn (vài trăm gam),khối
lượng nhỏ nhất mà cân kỹ thuật cân được khoảng 1g. Các loại cân kỹ thuật thường dùng
là: cân Robeval, cân quang, cân bàn, cân điện tử 0.01g …
*Cân phân tích là cân dùng để cân các khối lượng nhỏ từ 100g trở xuống đến
0,1mg (0,0001g) do đó người ta cũng thường gọi cân phân tích là cân 4 số lẻ hoặc cân 2
số lẻ. Có các loại cân phân tích: cân phân tích thường, cân phân tích điện, cân phân tích điện tử,…
Không nên nhầm lẫn rằng cân phân tích luôn luôn chính xác hơn cân kỹ thuật, nó
chỉ chính xác hơn khi cân các khối lượng nhỏ, vì vậy không dùng cân phân tích để cân
các khối lượng lớn hơn 200g. Trong trường hợp cân 1 lượng nhỏ 10g, 20g, nếu không
cần độ chính xác cao, ta nên dùng cân kỹ thuật để nhanh hơn.
Những quy định khi sử dụng cân:
- Trước khi cân hay sau một loạt phép cân liên tục cần kiểm tra lại trạng thái
thăngbằng của cân và đĩa cân, lau bụi trên đĩa cân rồi mới tếp tục cân.
- Khi sử dụng, thấy cân không bình thường, báo ngay với CBHD, không tự ý sửa chữa.
- Không được cân vật nặng hơn khối lượng quy định của từng cân.
- Không đụng mạnh vào cân khi cân đang dao động, chỉ đặt hoặc lấy quả cân, vật cân
sau khi đã khoá cân. Mở khoá hay đóng khoá phải nhẹ nhàng, thận trọng.
- Khi cân hoá chất không để trực tiếp lên đĩa cân, phải để trên mặt kính đồng hồ, chén
sứ, lọ cân … Cân các chất dễ hút ẩm, chất lỏng bốc hơi … dễ làm hỏng cân nhất thiết
phải dùng lọ rộng miệng có nút nhám với lượng lớn hoặc lọ cân với lượng nhỏ.
- Không cân vật quá nóng hay quá lạnh. Vật cân phải có nhiệt độ phòng. Nếu cân vật
nóng hay lạnh phải đặt vào bình hút ẩm để trở lại nhiệt độ phòng rồi mới cân.
- Khi cân chỉ được mở hai cửa bên, cửa trước chỉ dùng khi sửa chữa hoặc tháo lắp cân.
- Phải dùng cặp để gắp quả cân, không được cầm tay. Các quả cân phải để đúng vị trí.
- Trong một thí nghiệm, nếu cần cân nhiều lần, để tránh sai số nên thực hiện trên cùng một cân.
2.Các dụng cụ thuỷ
tinh: Gồm 3 loại chính sau:
a/ Dụng cụ để đựng hoá chất:
- Cốc thuỷ tinh (becher), bình tam giác (erlen), bình cầu.
b/ Dụng cụ để lấy hoá chất:
*Loại có thể tích chính xác: Ống hút (pipet bầu 1ml, 5ml, 25ml…), bình định mức
(fiol) 100ml, 250ml, 1000ml… các loại này có sai số rất nhỏ để lấy các thể tích chính xác.
*Loại có chia độ: Gồm ống nhỏ giọt (buret), ống hút (pipet có khắc vạch), ống
đong các loại cốc thuỷ tinh và bình tam giác đôi khi cũng chia độ. Ngoài buret là loại có
độ chính xác cao, các loại dụng cụ thuỷ tinh có chia độ khác nói chung có độ chính xác không cao lắm.
c/Sử dụng pipet:
*Pipet có 2 loại: loại pipet có dung tích cố định và loại chia độ.
Pipet thường có dung tích 10, 20, 25 và 50ml và những micro pipet dung tích 1, 2 và 5ml.
*Cách sử dụng pipet: muốn lấy chất lỏng vào pipet phải dùng quả bóp cao su để
tạo ra sự chênh lệch áp suất, tay trái cầm pipet, chú ý ngón trỏ của tay trái để gần miệng
trên pipet có thể sẵn sàng bịt lại khi lấy chất lỏng. Đặt đầu hở quả bóp cao su vào miệng
pipet. Nhúng pipet vào chất lỏng và thả lỏng từ từ tay phải để chất lỏng vào pipet cho tới
quá ngấn trên của pipet một chút. Dùng ngón trỏ tay trái bịt lại. Nhấc pipet lên khỏi bề
mặt chất lỏng, dùng giấy lau khô chất lỏng bên ngoài pipet. Sau đó nâng ngấn trên của
pipet lên ngang mắt, hé mở ngón trỏ cho chất lỏng chảy từ từ từng giọt cho tới khi vòm
khum khớp với ngấn chia độ. Đưa pipet qua bình đựng, mở ngón trỏ cho chất lỏng chảy
vào bình. Nếu pipet có ngấn ở phía dưới thì dùng ngón trỏ điều chỉnh cho khum chất
lỏng còn lại khớp với ngấn dưới pipet. Nếu pipet không có ngấn dưới để chất lỏng chảy
hết, không dùng miệng thổi chất lỏng còn dính lại đầu cuối pipet.
Sau khi hút chất lỏng xong phải rửa sạch bằng nước sạch rồi mới cất vào chỗ quy định. Thực hành như sau:
- Dùng pipet 10ml lấy 10ml nước từ becher cho vào erlen.
- Lặp lại phần thực hành trên nhưng hút nước bằng quả bóp cao su.
d/Sử dụng Buret:
Dùng để đo một lượng nhỏ dung dịch, thường chính xác tới 0.1ml, vạch số 0 ở
phía trên. Buret dùng để chuẩn độ có dung tích 25ml và 50ml.
*Có 2 loại buret: có khoá và không có khoá, ở đầu cuối của buret không có khoá,
có một ống cao su nối với ống thuỷ tinh đầu vuốt nhọn, ở giữa đoạn cao su có kẹp mo.
Khi dùng thì mở kẹp mo, chất lỏng sẽ chảy ra. Buret có khoá thuỷ tinh đựng được các
chất lỏng trừ kiềm vì kiềm sẽ làm khoá gắn chặt lại. Buret không có khoá không được
dùng với các chất có tác dụng với cao su như KMnO4, I2 …
+Đổ chất lỏng vào buret phải dùng phễu cuống ngắn không chạm tới vạch số
không. Sau đó mở khoá để dung dịch chảy xuống chiếm đầy bộ phận buret nằm dưới
khoá đến tận đầu cùng của ống vuốt. Chú ý không để bọt khí ở phần chảy ra của buret.
Chỉ được đưa buret về điểm 0, khi trong ống vuốt không còn bọt khí.
+Dùng xong phải rửa sạch buret bằng nước, cặp vào giá, quay đầu hở xuống.
+Lấy khoá nhám ra, bọc giấy lọc rồi đặt lại khoá vào buret.
Để đọc thể tích trên buret chính xác, thường để sau buret một mảnh giấy trắng, nửa dưới
bôi đen làm màn ảnh. Do phản xạ ánh sáng, mặt khum sẽ hoá đen và đọc được rõ. Thực hành như sau:
- Dùng becher 50ml cho nước vào buret.
- Kiểm tra không có bọt khí còn sót lại trong buret.
- Chỉnh buret đến mức 0.
- Dùng tay trái điều chỉnh khoá buret cho 10ml nước từ buret vào becher.
e/Sử dụng Nhiệt kế:
Có nhiều loại dụng cụ để đo nhiệt độ: nhiệt kế lỏng, nhiệt kế điện trở, piromet
nhiệt điện, piromet quang học, …
*Nhiệt kế lỏng là nhiệt kế có chứa chất lỏng. Chất lỏng chứa trong nhiệt kế thường
là rượu màu, thuỷ ngân, toluen, pentan … Nhiệt kế chứa pentan đo nhiệt độ thấp đến -
2200°C. Nhiệt kế thuỷ ngân đo đến nhiệt độ cao nhất là 5500°C …
Khi đo nhiệt độ một chất lỏng, nhúng ngập bầu thuỷ ngân của nhiệt kế vào chất lỏng,
Không để bầu thuỷ ngân sát vào thành bình. Theo dõi đến khi cột thuỷ ngân không thay
đổi nữa mới đọc kết quả, khi đọc kết quả để mắt ngang với mực thuỷ ngân.
Sử dụng nhiệt kế phải cẩn thận, tránh va chạm mạnh, rơi vỡ, không để nhiệt kế
thay đổi nhiệt độ đột ngột. Không được đo nhiệt độ cao quá nhiệt độ cho phép của nhiệt
kế, sẽ làm nhiệt kế nứt vỡ. Cần đặc biệt lưu ý thuỷ ngân và hơi thuỷ ngân rất độc, nếu
không may nhiệt kế vỡ, dùng mảnh giấy thu gom những hạt thuỷ ngân vào lọ, không
được nhặt bằng tay, khử thuỷ ngân còn sót bằng bột Lưu Huỳnh, hoặc tạo hỗn
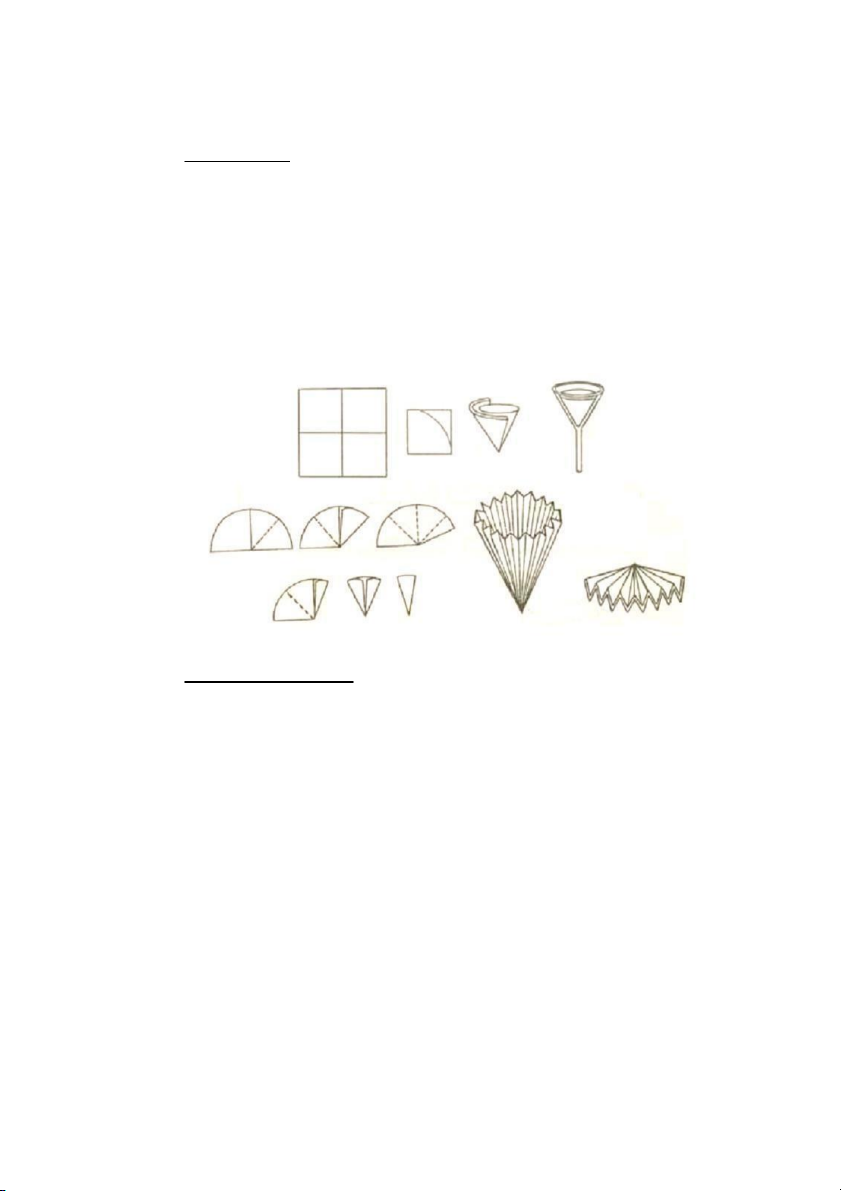
hợp với Kẽm … đồng thời làm thay đổi không khí trong phòng: mở cửa, quạt thông gió … 3.Xếp giấy lọc:
Thực hành lọc nước bằng giấy lọc và phễu thuỷ tinh.
Ứng dụng: tinh chế muối ăn bằng phương pháp kết tinh.
- Dùng cân kỹ thuật cân 10g muối ăn cho vào becher có chứa 50ml nước cất.
- Đun nước, khuấy cho muối tan hết, không cần sôi.
- Chuẩn bị phễu lọc nóng, khi muối tan hết lọc nóng qua phễu lọc thuỷ tinh. Hứng nước vào một bercher.
- Đem dung dịch muối qua lọc cô cho đến khi có váng tinh thể thì dừng lại.
- Để nguội, sau đó cho bercher vào chậu nước lạnh cho muối kết tinh hoàn toàn.
- Lọc chân không. Cân tính hiệu suất.
4.Rửa dụng cụ hóa học:
Rửa dụng cụ hoá học cần biết tính chất của những chất làm bẩn dụng cụ. Từ đó
chọn phương pháp rửa cũng như dung môi để rửa.
*Có 2 phương pháp rửa: phương pháp cơ học và phương pháp hoá học.
a/Phương pháp cơ học:
Dụng cụ rửa là chổi lông. Nếu chất bẩn không phải là chất béo, chất không tan
trong nước thì dùng nước nóng hoặc nước lạnh. Ví dụ rửa ống nghiệm cần chú ý:
- Một tay cầm chổi, một tay cầm hơi chếch ống nghiệm.
- Cho nước vào ống nghiệm, cầm chổi xoay nhẹ để cho lông chổi cọ sát vào đáy
và thành ống, đồng thời kéo chổi lên xuống, vừa kéo vừa xoay để rửa thành ống.
- Không thọc mạnh chổi vào đáy ống nghiệm làm vỡ, gây xát thương.
- Cần chọn chổi thích hợp với từng loại ống nghiệm.
Sau khi rửa sạch bằng nước máy, dùng nước cất tráng lại. Để kiểm tra ống nghiệm
sạch bằng cách cho nước cất vào đầy ống nghiệm úp ngược cho ống chảy hết, nếu ống
sạch trên thành ống không còn hạt nước bám vào, nếu ống còn bẩn phải rửa lại.
Đối với chất bẩn không tan trong nước, có thể rửa bằng các dung môi hữu cơ như: ete,
axeton, xăng, rượu etylic,…
b/Phương pháp hoá học:
Thường dùng hỗn hợp sunfocromic, hỗn hợp dung dịch acid sunfuric với
kalipemanganat, kiềm đặc,… để rửa.
Cách pha hỗn hợp sunfocromic: nghiền nhỏ 10g K2Cr2O7 cho vào cốc, tẩm ướt
bằng 3 – 5ml nước, vừa khuấy vừa thêm 100ml H2SO4 98%. Sau khi rửa xong dụng cụ,
hỗn hợp sunfocromic được đổ trở lại bình chứa để dùng lần sau. Khi nào hỗn hợp chuyển
sang màu xanh đen mới bỏ đi. Hỗn hợp sunfocromic là chất oxi hoá mạnh, tác dụng lên
da và quần áo phải cẩn thận khi sử dụng.Dung dịch KMnO4 4% axit hoá bằng H2SO4
đặc là dung dịch rửa tốt. Thường pha 4 – 5ml H2S 4
O đặc vào 100ml dung dịch KMnO4
4%. Ngoài ra có thể pha kiềm trong rượu bằng cách hoà tan 5 – 10g NaOH trong 100ml rượu etylic để rửa.
Khi rửa các dụng cụ cần chú ý:
- Dụng cụ phải rửa sạch, tráng bằng nước cất rồi để vào nơi quy định. Không
dùng giấy lọc, khăn mặt lau thành bên trong các dụng cụ vừa rửa xong, có thể
làm khô trong tủ sấy (trừ các dụng cụ chia độ).
- Tiết kiệm và dùng chất rửa rẻ tiền, thu hồi dung dịch, chất quý và hoá chất
rắn còn dùng được.
- Các dung dịch acid, kiềm đặc, chất độc, mùi thối … không được đổ vào chậu rửa. BÀI 2
I/XÁC ĐỊNH MÔI TRƯỜNG CỦA DUNG DỊCH BẰNG CHẤT CHỈ THỊ MÀU
Lấy vào 3 ống nghiệm mỗi ống 1ml dung dịch sau:
- Ống 1: dung dịch HCl 0.1N.
- Ống 2: dung dịch NaOH 0.1N. - Ống 3: nước cất.
Nhỏ vào mỗi ống 2 giọt mêtyl da cam. Ghi màu mêtyl da cam của các dung dịch trong 3 ống nghiệm trên.
Cũng tiến hành như trên và lần lượt thử màu với quỳ tím và Phênolftalein.
Lập bảng màu các chất chỉ thị theo môi trường như sau: Môi trường Màu chất chỉ thị Dung dịch HCl 0.1N Dung dịch NaOH 0.1N Nước cất Mêtyl da cam Quỳ tím Phenolphtalein
II/NHẬN BIẾT DUNG DỊCH
1/Nhận biết bằng thuốc thử quy định
Có 5 dung dịch bị mất nhãn Na2SO4, H2SO4, MgCl2, BaCl2, NaOH được đánh số thứ
tự 1,2,3,4,5 chỉ dùng PP và dung dịch có sẵn để nhận biết 5 dung dịch trên. Tiến hành:
……………………………………………………………………………………………
…………………………………………………………………………………………....
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
…………………………………………………………………………………………….
……………………………………………………………………………………………. Kết quả: - Dung dịch 1: - Dung dịch 2: - Dung dịch 3: - Dung dịch 4: - Dung dịch 5:
2/Nhận biết bằng thuốc thử tự chọn
Có 5 dung dịch bị mất nhãn Na2SO4, HCl, NaCl, NaNO3, NaOH được đánh số thứ
tự 6,7,8,9,10 chỉ dùng quỳ tím và dung dịch khác để nhận biết 5 dung dịch trên. Tiến hành:
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
………………………………………………………………………………………… Kết quả: - Dung dịch 6: - Dung dịch 7: - Dung dịch 8: - Dung dịch 9: - Dung dịch 10: BÀI 3
KHẢO SÁT ẢNH HƯỞNG CỦA CÁC YẾU TỐ ĐẾN CÂN BẰNG HÓA HỌC
1/Ảnh hưởng của nồng độ:
Lấy 40ml nước cất cho vào cốc thủy tinh có thể tích 100ml, thêm vào đó 1 giọt dung
dịch FeCl3 bão hòa và 1 giọt dung dịch NH4SCN bão hòa khuấy đều, phản ứng xảy ra theo phương trình sau:
FeCl3 + NH4SCN Fe(SCN)3 +3 NH4C l
Sau đó chia đều ra 4 ống nghiệm. Đánh số thứ tự 1, 2, 3, 4.
-Ống 1: giữ nguyên làm mẫu so sánh.
-Ống 2: Thêm 2 ÷ 3 giọt dung dịch FeCl3 bão hòa, lắc đều.
-Ống 3: Thêm 2 ÷ 3 giọt dung dịch NH4SCN bão hòa, lắc đều.
-Ống 4: Thêm 1 ít tinh thể NH4Cl, lắc cho tan.
So sánh màu của các dung dịch trong các ống nghiệm 2,3,4 với ống 1.
Giải thích kết quả
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
2/Sự chuyển dịch cân bằng ion:
Lấy vào ống nghiệm 2ml dung dịch CH3COOH 1N. Thêm 3 giọt mêtyl da cam. Quan sát màu của dung dịch.
……………………………………………………………………………………………
Chia dung dịch thành 2 phần bằng nhau vào 2 ống nghiệm.
- Ống 1 làm chuẩn để so màu.
- Ống 2 cho thêm 1 ít tinh thể NaCH3COO, lắc cho tan.
So sánh màu ống 1 và ống 2. Viết phương trình điện ly của CH3COOH và NaCH3COO
trong nước. Giải thích nguyên nhân của sự đổi màu.
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
…………………………………………………………………………………………… BÀI 4
KHẢO SÁT ẢNH HƯỞNG CỦA CÁC YẾU TỐ ĐẾN TỐC ĐỘ PHẢN ỨNG
1/Ảnh hưởng của nồng độ:
Dùng pipet hút chính xác 3ml dung dịch Na2S2O3 0.2M cho vào ống nghiệm sạch và
khô, dùng pipet khác lấy chính xác 3ml dung dịch H2SO4 0.2M vào ống nghiệm sạch và khô khác.
Rót nhanh dung dịch H2SO4 vào dung dịch Na2S2O3.
Dùng đồng hồ bấm giây xác định khoảng thời gian t từ lúc rót 2 dung dịch vào với nhau
cho đến khi dung dịch trong ống nghiệm bắt đầu xuất hiện kết tủa màu trắng đục. Tiến
hành thí nghiệm tương tự với dung dịch Na2S2O3 với nồng độ nhỏ đi 2, 3, 4, 6 lần. Các
nồng độ của dung dịch Na2S2O3 trong các thí nghiệm này được chuẩn bị bằng cách dùng
nước cất pha loãng dung dịch Na2S2O3 0.2M. Ghi kết quả thực nghiệm vào bảng sau: Thí Ống 1 Ống 2 [Na2S2O3] M [H2SO4] M t (s) v (1/Δt) nghiệm
VH2O (ml) VNa2S2O3 (ml) VH2SO4 (ml) 1 0 3 3 2 1,5 1,5 3 3 2 1 3 4 2,25 0,75 3 5 2,5 0,5 3
2/ Ảnh hưởng của nhiệt độ:
Dùng pipet hút chính xác 3ml dung dịch Na2S2O3 0.2M cho vào ống nghiệm sạch và
khô, dung pipet khác lấy chính xác 3ml dung dịch H2SO4 0.2M vào 1 ống nghiệm sạch và khô khác.
Lấy 1/3 cốc nước dùng nhiệt kế khuấy nhẹ và đo nhiệt độ t1. Đặt 2 ống nghiệm vào cốc
nước để khoảng 2 phút. Sau đó, rót nhanh dung dịch H2SO4 vào dung dịch Na2S2O3.
Dùng đồng hồ bấm giây xác định khoảng thời gian t1 từ lúc rót 2 dung dịch vào với
nhau cho đến khi dung dịch trong ống nghiệm xuất hiện màu trắng đục.
Tiến hành các thí nghiệm với nhiệt độ khác nhau và khoảng thời gian tham gia phản ứng.
t 2= t 1 + 10 C và t 3= t 2 + 10 C .
ghi kết quả thực nghiệm thu được vào bảng sau:
STT Nhiệt độ phản ứng Thời gian phản ứng Vận tốc phản ứng 1 t 1 = t1 = v1 = 2 t 2 = t2 = v2 = 3 t 3 = t3 = v3 =
3/ Ảnh hưởng của chất xúc tác:
Lấy vào 2 ống nghiệm sạch và khô, mỗi ống 2ml dung dịch H2C2O4 0.1N pha trong axit H2SO4 20%.
Thêm vào ống nghiệm thứ nhất 3 giọt dung dịch MnSO4 loãng, thêm vào ống nghiệm
thứ hai 3 giọt nước cất.
Sau đó, thêm vào mỗi ống 3 giọt dung dịch KMnO4 0.01M lắc đều. Dùng đồng hồ bấm
giờ để xác định khoảng thời gian t(s) từ lúc thêm dung dịch KMnO4 đến khi mất màu, trong suốt.
So sánh khoảng thời gian phản ứng của 2 ống nghiệm và có kết luận về tác dụng của
MnSO4 đối với tốc độ của phản ứng giữa KMnO4 và H2C2O4 trong môi trường axit.
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………