ĐẠI HỌC QUỐC GIA THÀNH PHỐ HỒ CHÍ MINH
ĐẠI HỌC BÁCH KHOA
KHOA KỸ THUẬT HÓA HỌC
__________
BÁO CÁO THÍ NGHIỆM
HOÁ VÔ CƠ
Giảng viên hướng dẫn : Nguyễn Tuấn Anh
Sinh viên thực hiện : Lê Hữu Toàn 61304190
Lương Thị Mỹ Trang 61304228
Lớp : HC13HD
Nhóm : L03 ( Buổi học - chiều thứ 3)
Tổ : 10
Thành phố Hồ Chí Minh, tháng 11 năm 2014
1
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 1:
KIM LOẠI KIỀM
(Phân nhóm IA)
Ngày thí nghiệm: 26/08/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững vị trí của kim loại kiềm trong bản phân loại tuần hoàn Mendeleev, cấu hình electron,
trạng thái oxy hóa, tính chất vật lý và hóa học kim loại kiềm và các hợp chất của nó.
- Hiểu rõ về cách điều chế cacbonat natri bằng phương pháp Solvay.
II/ KẾT QUẢ THÍ NGHIỆM
THÍ
NGHIỆM
MÔ TẢ THÍ NGHIỆM VÀ QUAN
SÁT HIỆN TƯỢNG
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT
PHƯƠNG TRÌNH ,TÍNH TOÁN VÀ RÚT
RA KẾT LUẬN
1
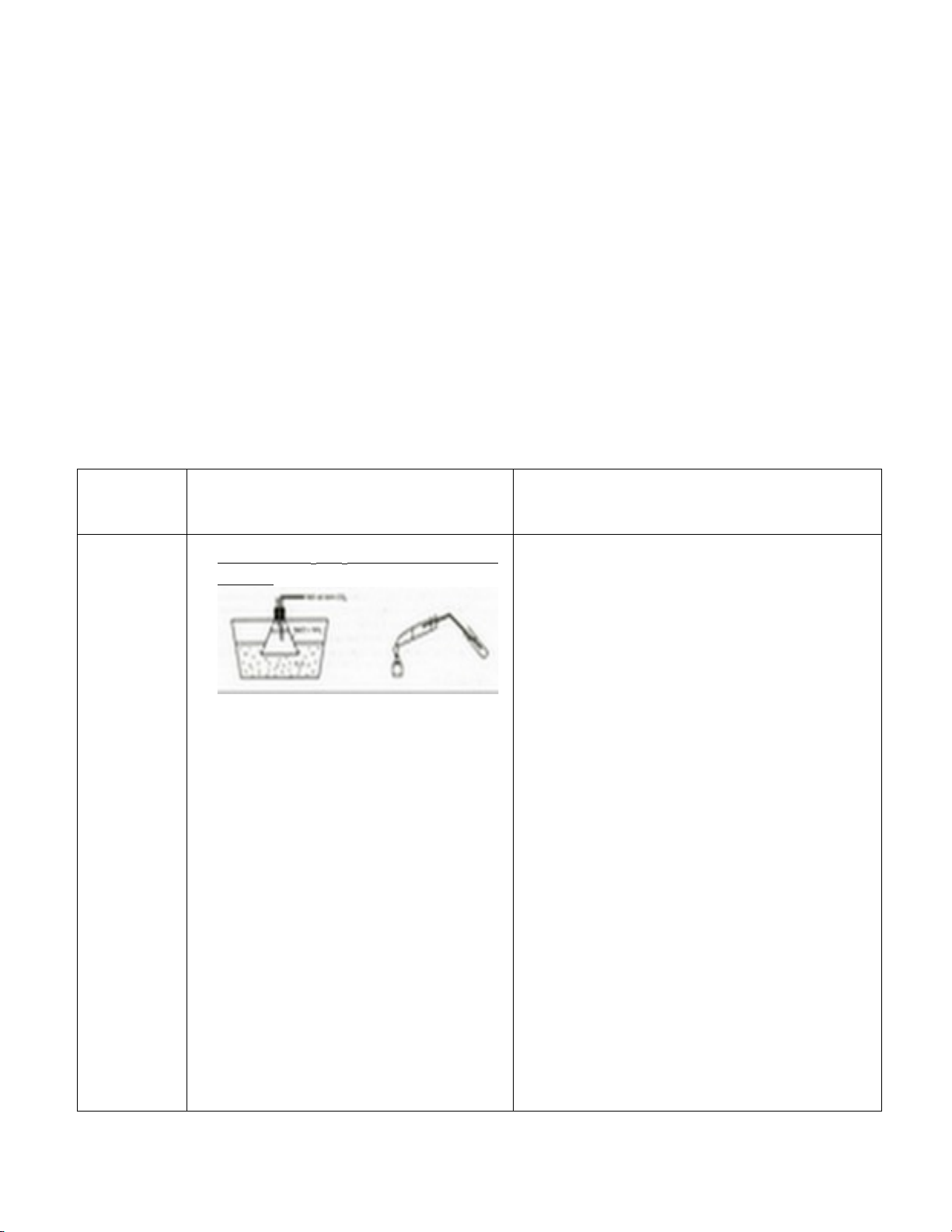
Điều chế Na
2
CO
3
bằng phương pháp
Solvay:
Sục CO
2
vào erlen 125ml
chứa 50ml dung dịch NaCl bão hòa trong
NH
3
. Ngâm erlen trong chậu nước lạnh,
đợi cho đến khi có tinh thể trắng tạo
thành. Lọc chân không lấy tinh thể (tráng
bằng cồn, không tráng bằng nước lạnh).
Lấy một ít tinh thể trên
cho vào cốc nước. Thêm vào một giọt
phenolphtalein ta thấy dung dịch chuyển
sang màu hồng nhạt.
- CO
2
bị hấp thụ trong nước tạo thành H
2
CO
3
theo phản ứng:
CO
2
+ H
2
O H
2
CO
3
NH
3
+ H
2
CO
3
NH
4
+
+ HCO
3
-
HCO
3
-
+ Na
+
NaHCO
3
Cả 4 chất: NaCl, NH
4
HCO
3
, NaHCO
3
và
NH
4
Cl đều tan trong nước nhưng NaHCO
3
hơi
ít tan hơn nên tách ra dưới dạng tinh thể (dung
dịch ban đầu là bão hòa NH
3
). Đây là sự cân
bằng giữa khả năng phản ứng và tốc độ phản
ứng. Nhiệt độ vừa phải để vận tốc không chậm
và độ tan của NaHCO
3
không lớn hơn độ tan
của NaCl.
Tinh thể NaHCO
3
là muối tan
trong H
2
O có tính bazơ yếu:
H
2
O + HCO
3
-
OH
-
+ H
2
CO
3
(1)
H
2
CO
3
CO
2
+ H
2
O
H
2
CO
3
không bền phân hủy tạo CO
2
làm cân
bằng của phản ứng (1) dịch chuyển về phía tạo
ra OH
-
làm phenolphtalein hóa hồng.
2

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Cho một ít tinh thể vào ống nghiệm, đậy
bằng nút cao su có gắn ống thủy tinh.
Đun nóng ống nghiệm bằng đèn cồn.
Dẫn khí thoát ra vào nước vôi trong ta
thấy dung dịch nước vôi trong bị đục
dần. Nếu để trong một thời gian dài thì
nước vội bị đục sẽ trong trở lại.
Do xảy ra các phản ứng sau
đây:
2NaHCO
3
Na
2
CO
3
+ CO
2
+ H
2
O
CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
CO
2
+ H
2
O + CaCO3 Ca(HCO
3
)
2
tan
Kết luận:
Có thể điều chế muối NaHCO
3
dựa vào
sự khác nhau về độ tan đủ lớn ở nhiệt độ nhất
định. Trong công nghiệp ta có thể thu lại CO
2
bị giải phóng khi nhiệt phân NaHCO
3
cũng
như khi nung đá vôi để sử dụng cho giai đoạn
đầu.
2
Quan sát màu ngọn lửa của kim loại
kiềm:
Nhúng một đầu mẫu giấy lọc vào
dung dịch LiCl bão hòa rồi đưa vào ngọn
lửa đèn cồn ta thấy ngọn lửa có màu đỏ
tía.
Làm thí nghiệm tương tự như trên
với dung dịch NaCl bão hòa ta thấy ngọn
lửa có màu vàng, còn với dung dịch KCl
bão hòa thì ta thấy ngọn lửa có màu tím.
Khi thay LiCl bằng Li
2
SO
4
thì thấy
màu ngọn lửa không thay đổi.
Ở trong ngọn lửa, những electron của
nguyên tử và ion kim loại kiềm được kích
thích nhảy lên các mức năng lượng cao hơn.
Khi trở về những mức năng lượng ban đầu,
các electron này phát ra năng lượng dưới dạng
các bức xạ trong vùng khả kiến. Vì vậy, ngọn
lửa có màu đặc trưng cho từng kim loại.
Do anion giữ electron chặt hơn Cl
-
nên năng lượng từ ngọn lửa đèn cồn không đủ
lớn để kích thích electron lên trạng thái kích
thích nên Li
+
trong Li
2
SO
4
không thể hiện
được tính chất như LiCl.
Kết luận:
Khi đốt cháy cation kim loại kiềm (trong
hợp chất với anion thích hợp) sẽ cho ngọn lửa
có màu đặc trưng. Trong phân nhóm chính
nhóm IA, khi đi từ trên xuống dưới màu đặc
trưng của ngọn lửa sẽ chuyển từ đỏ đến tím,
nghĩa là năng lượng tăng dần do bán kính
nguyên tử tăng, electron dễ chuyển sang mức
năng lượng cao hơn.
3

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
3
Phản ứng của kim loại kiềm với nước:
Cho nước vào chén sứ đến ½ thể
tích, nhỏ vào đó 1 giọt phenolphtalein.
Dùng kẹp sắt lấy một mẫu kim loại Na,
dùng dao nhựa cắt thành một mẫu nhỏ
(1x1mm) ta thấy Na rất mềm. Cho mẫu
Na vừa cắt vào chén sứ ta thấy Na phản
ứng với nước mãnh liệt làm nước nóng
lên, có khói trắng bay lên, mẫu Na chạy
trên mặt nước.Phản ứng ban đầu rất
nhanh nhưng sau đó chậm dần và dung
dịch chuyển sang màu hồng đậm.
Làm lại thí nghiệm trên nhưng thay
nước bằng dung dịch CuSO4 0.5M ta
thấy phản ứng xảy ra mãnh liệt hơn thí
nghiệm trên: Na bốc cháy kèm theo tiếng
nổ, có khói trắng xuất hiện, có kết tủa
màu lam và tại chỗ bốc cháy có tủa màu
đen. Dung dịch chuyển sang màu hồng
sau đó mất màu hồng đi.
Phương trình phản ứng:
Na + H
2
O NaOH + H
2
(1)
H
2
+ O
2
H
2
O (2)
Khói trắng là hỗn hợp của H
2
và
hơi nước. Do phản ứng (1) tỏa nhiệt rất lớn tạo
điều kiện cho phản ứng (2) xảy ra.
Do phản ứng sinh ra NaOH là một
bazơ mạnh nên dung dịch có chứa
phenolphtalein hóa hồng. Một phần NaOH
sinh ra bao quanh mẫu làm giảm bề mặt tiếp
xúc của Na với H
2
O nên phản ứng xảy ra
chậm. H
2
sinh ra phân bố không đồng đều tạo
nên lực nâng và lực đẩy, đẩy Na chạy trên mặt
nước.
Ngoài phản ứng (1) còn có phản ứng:
2NaOH + CuSO
4
Cu(OH)
2
+ Na
2
SO
4
xanh lam
Natri phản ứng mãnh liệt hơn vì:
+ Trong TN đầu NaOH vừa tạo thành bao
quanh mẫu Na làm giảm bề mặt tiếp xúc giữa
Na với H
2
O.
+ Trong TN sau NaOH vừa tạo thành đã
phản ứng ngay với CuSO
4
nên không làm
giảm bề mặt tiếp xúc giữa Na với H
2
O. Vì vậy,
phản ứng mãnh liệt hơn.
Mặt khác, do NaOH mới sinh ra
phản ứng tức thời với lượng dư CuSO
4
nên
dung dịch chứa phenolphtalein ban đầu
chuyển sang màu hồng nhưng sau đó mất màu.
Kết tủa màu đen là do nhiệt tỏa ra
của phản ứng (a) làm nhiệt phân tủa Cu(OH)
2
thành CuO có màu đen:
Cu(OH)2 CuO + H2O
đen
4
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Kết luận:
Kim loại kiềm mềm, dễ cắt, rất hoạt động
về mặt hóa học. Trong các phản ứng chúng thể
hiện tính khử mạnh.Ở điều kiện thường, trong
không khí khô kim loại thường được phủ 1 lớp
oxít. Trong không khí ẩm thì lớp oxít sẽ kết
hợp với hơi nước tạo thành các hydroxít kết
hợp với CO
2
tạo muối carbonat vì vậy kim loại
kiềm thường được bảo quản trong bình kín
hoặc ngâm trong dầu hỏa.
4
Độ tan của các muối kim loại kiềm:
Cho vào 2 ống nghiệm mỗi ống khoảng 1
ml dung dịch LiCl 0.5M và 5 giọt NH
4
OH
đậm đặc.
Ống 1: thêm vào 1ml dung dịch NaF
0.5M, lắc đều để yên vài phút ta thấy có
tủa trắng tạo thành. Khi thêm NH
4
OH vào
thì lượng tủa nhiều hơn.
Ống 2: thêm vào 1ml dung dịch
NaH
2
PO
4
lắc đều để yên vài phút ta thấy
có tủa trắng tạo thành. Khi thêm NH
4
OH
vào thì tủa vẫn không tan.
NaF + LiCl NaCl + LiF
Vì NH
4
OH đặc làm dung môi phân cực hơn
mà LiF có một phần liên kết cộng hóa trị nên
tủa nhiều hơn.
OH
-
+ H
2
PO
4
-
H
2
O + HPO
4
2-
OH
-
+ HPO
4
2-
H
2
O + PO
4
3-
3Li
+
+ PO
4
3-
LiPO
4
Kết luận:
Đa số các muối kim loại kiềm là dễ tan
trừ một số muối của Li.
Các muối của K
+
dễ tan hơn của Li
+
vì
khi thay LiCl bằng KCl thì trong các ống đều
không có hiện tượng.
5
Lắc chung hỗn hợp gồm 0.5g LiCl
và 0.5g KCl với 3ml cồn trong becher
50ml khoảng 5 phút. Lọc và rửa phần rắn
không tan 3 lần, mỗi lần với 1ml cồn.
Phần cồn qua lọc và cồn dùng để rửa gộp
chung trong một becher. Đun cách thủy
đền khi cạn khô sẽ thu được 2 khối rắn:
một ở trên lọc và một do cô cạn. Lấy
mẫu rắn trên lạo hòa tan trong 2ml nước
rồi chia thành 2 ống nghiệm để thử Li
+
:
Ống 1: thêm 1ml NaF và 5
giọt NH
4
OH đậm đặc, không có hiện
tượng gì xảy ra.
Khi hòa tan hỗn hợp bằng cồn thì do
Li
+
có bán kính nguyên tử nhỏ nên lực hút hạt
nhân vơi electron ngoài cùng lớn làm cho độ
phân cực trong muối LiCl giảm mà cồn là
dung môi phân yếu nên LiCl được hòa tan tốt
còn KCl thì không tan do tính phân cực mạnh.
Vì vậy, phần qua lọc có chứa LiCl còn mẫu
rắn là KCl.
Điều này chứng tỏ chất rắn trên lọc
không chứa ion Li
+
mà chứa ion K
+
.
5

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ống 2: thêm 10 giọt acid
piric vào có xuất hiện kết tủa hình kim.
Làm tương tự với mẫu rắn thu được
do cô cạn thì thấy trong
Ống 1: có kết tủa màu trắng
Ống 2 : không có hiện tượng
Điều này chứng tỏ trong dung dịch
thu được có chứa ion Li
+
Kết luận:
Tr
ong phân nhóm IA khi đi từ trên xuống thì độ
phân cực của muối kim loại tăng dần.
Cá
c chất sẽ tan dễ dàng trong dung môi tương tự
với nó.
6

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 2:
KIM LO ẠI KIỀM THỔ
(Phân nh óm IIA)
Ngày thí nghiệm: 19/08/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững vị trí của kim loại kiềm thổ trong bảng tuần hoàn, hiểu được các tính chất của chúng qua
các phản ứng đặc trưng.
- Hiểu thêm về tính chất nước cứng, tính chất đặc trưng, cách làm mềm nước cứng, thang đo độ cứng.
II/ KẾT QUẢ THÍ NGHIỆM
THÍ
NGHIỆM
MÔ TẢ THÍ NGHIỆM VÀ QUAN
SÁT HIỆN TƯỢNG
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT
LUẬN
1
* Quan sát màu của ngọn lửa khi kim
loại kiềm thổ cháy:
- Nhúng một đầu giấy lọc sạch vào dung
dịch CaCl
2
bão hoà rồi hơ trên ngọn lửa
đèn cồn ta thấy ngọn lửa có màu đỏ da
cam.
- Tiến hành tương tự với dung dịch SrCl
2
bão hào và dung dịch BaCl
2
ta thấy ngọn
lửa có màu đỏ tươi ứng với dung dịch
SrCl
2
và màu vàng lục ứng với dung dịch
BaCl
2
.
Hiện tượng này được giải thích là do ion kim loại
của muối hấp thụ năng lượng từ ngọn lửa, các
electron ở lớp ngoài cùng bị kích thích lên mức
năng lượng cao hơn nên khi trở về trạng thái cơ
bản nó sẽ phát ra bức xạ có bước sóng trong vùng
khả kiến đặc trưng cho mỗi ion kim loại và có
màu sắc khác nhau.
Kết luận :
Khi đốt cháy cation kim loại kiềm thổ (trong hợp
chất với anion thích hợp) sẽ cho ngọn lửa có màu
đặc trưng. Trong phân nhóm chính nhóm IIA, khi
đi từ trên xuống dưới màu đặc trưng của ngọn lửa
sẽ chuyển từ đỏ đến vàng, nghĩa là năng lượng
tăng dần do bán kính nguyên tử tăng, electron dễ
chuyển sang mức năng lượng cao hơn.
2
* Phản ứng của kim loại kiềm thổ với
nước:
Lấy 2 ống nghiệm cho vào mỗi ống 1-2
giọt nước, một ít bột Mg và 1 giọt
phenolphtalein.
- Ống 1:
- Phản ứng xảy ra chậm do Mg(OH)
2
tạo thành
che phủ bề mặt của Mg:
Mg + H
2
O Mg(OH)
2
↓ + H
2
↑ (1)
7

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
+ Khi để nguội phản ứng xảy ra rất chậm.
Tại bề mặt tiếp xúc pha xuất hiện màu
hồng nhạt đồng thời có bọt khí nổi lên.
Đó là khí hydro.
+ Khi đun nóng
Bọt khí xuất hiện nhiều hơn, màu hồng
đậm hơn và lan ra toàn bộ dung dịch.
- Ống 2: Cho từ từ dung dịch NH
4
Cl vào.
Phản ứng xảy ra mãnh liệt, màu dung
dịch nhạt dần đến mất màu, đồng thời khí
thoát ra nhiều hơn. Sau đó màu hồng xuất
hiện trở lại.
- Do T
Mg(OH)2
= 10
-9.22
nên vẫn có một phần
Mg(OH)
2
tan tạo ion OH
-
khiến phenolptalein hóa
hồng tại bề mặt phân chia giữa Mg và nước.
Mg(OH)
2
Mg
2+
+ 2OH
-
(2)
- Ở nhiệt độ cao Mg(OH)
2
tan nhiều hơn trong
nước nên tạo nhiều OH
-
khiến màu hồng dung
dịch đậm hơn. Đồng thời sự che phủ của Mg(OH)
2
giảm nên phản ứng (1) xảy ra nhanh hơn bọt
khí thoát ra nhiều hơn.
- Khi cho NH
4
Cl vào thì Mg(OH)
2
bị hòa tan, giải
phóng bề mặt Mg làm phản ứng (1) mãnh liệt hơn
và khí thoát ra nhiều hơn.
Mg(OH)
2
+ NH
4
Cl MgCl
2
+ NH
3
↑ + H
2
O
- Do Mg(OH)
2
bị hòa tan nên cân bằng (2) bị dịch
chuyển theo chiều thuận làm giảm OH
-
dẫn đến
mất màu phenolptalein.
- Màu hồng xuất hiện trở lại do hai nguyên nhân:
NH
3
sinh ra ở phản ứng trên và OH
-
do phản ứng
(2) sinh ra.
Kết luận:
Kim loại kiềm thổ tác dụng yếu với nước ở nhiệt
độ thường nhưng phản ứng mạnh khi đun nóng
hoặc có xúc tác thích hợp.
3
* Điều chế và tính chất của Mg(OH)
2
:
Lấy 3 ống nghiệm cho vào mỗi ống
dung dịch NaOH ta thấy xuất hiện kết tủa
trắng và hầu như không tan trong nước.
Ly tâm bỏ phần dung dịch phía trên và
cho phần kết tủa vào 3 ống nghiệm.
- Ống 1: Cho tác dụng với HCl. Kết tủa
tan và dung dịch trở nên trong suốt.
- Ống 2: Cho tác dụng với NH
4
Cl. Kết tủa
tan tạo dung dịch trong suốt và có mùi
MgCl
2
+ 2NaOH → Mg(OH)
2
↓ + 2NaCl
Mg(OH)
2
+ 2HCl → MgCl
2
+ 2H
2
O
8

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
khai.
- Ống 3: Cho NaOH vào. Không có hiện
tượng xảy ra.
* Điều chế và tính chất của hydroxit kim
loại kiềm thổ:
Lấy 4 ống nghiệm, mỗi ống lần lượt
chứa 1 ml dung dịch muối Mg
2+
, Ca
2+
,
Ba
2+
và Sr
2+
0.5M; thêm vào mỗi ống 0.5
ml dung dịch NaOH 1M, ta thấy trong
các ống nghiệm đều xuất hiện kết tủa .
Lượng kết tủa tăng dần theo thứ tự Ba
2+
,
Sr
2+
, Ca
2+
vaø Mg
2+
. Như vậy độ tan của
các hydroxyt tương ứng giảm dần.
Mg(OH)
2
+ 2NH
4
Cl MgCl
2
+ 2NH
3
↑ + 2H
2
O
NaOH và Mg(OH)
2
đều có tính bazơ nên không
phản ứng.
Mg
2+
+ 2OH
-
Mg(OH)
2
↓
Ca
2+
+ 2OH
-
Ca(OH)
2
↓
Sr
2+
+ 2OH
-
Sr(OH)
2
↓
Ba
2+
+ 2OH
-
Ba(OH)
2
Do đi từ Mg đến Ba thì bán kính nguyên tử tăng
lên nên lực hút hạt nhân với electron ngoài cùng
giảm và do oxi có độ âm điện lớn nên rút electron
về phía nó làm cho phân tử hydroxyt phân cực
mạnh nên tạo dung môi phân cực.
Kết luận:
Có thể điều chế các hydroxyt của kim loại
kiềm thổ bằng cách cho muối tan của chúng tác
dụng với kim loại kiềm, Hydroxyt của kim loại
kiềm thổ có tính bazơ.
4
* Khảo sát sự hòa tan của muối sunfat
kim loại kiềm thổ:
- Lấy 4 ống nghiệm cho vào mỗi ống 1
ml lần lượt các dung dịch MgCl
2
, CaCl
2
BaCl
2
và SrCl
2,
sau đó nhỏ từ từ dung
dịch H
2
SO
4
2N vào. Ta thấy :
Ống chứa MgCl
2
không có hiện tượng
Ông chưa CaCl
2
bị vẫn đục do tạo chất
ít tan..
Ống chứa SrCl
2
có
màu trắng đục.
Ông chứa BaCl
2
bị đục nhiều
- Cho H
2
SO
4
đến dư các kết tủa không
tan.
Ca
2+
+ SO
4
2-
CaSO
4
↓
Sr
2+
+ SO
4
2-
SrSO
4
↓
Ba
2+
+ SO
4
2-
BaSO
4
↓
Điều này hoàn toàn phù hợp với tích số tan của
chúng T
CaSO4
= 10
-5.04
, T
SrSO4
= 10
-6.49
T
BaSO4
= 10
-9.97
Do nồng độ của SO
4
2-
tăng lên nên cân bằng
chuyển dịch theo chiều thuận nghĩa là tăng lượng
kết tủa.
Kết luận :
Độ tan cuûa hydroxyt vào muối sunfat khi đi từ
Mg đến Ba ngược nhau vì đối với muối sunfat
năng lượng hoạt hóa của cation lớn hơn năng
lượng mạng tinh thể hơn nữa đi từ Mg đến Ba bán
9

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
kính X
2+
tăng dần nên khả năng phân cực trong
nước giảm và năng lượng hydrat giảm dần nên độ
tan giảm từ Mg đến Ba.
5
* Xác định độ cứng của nước :
- Hút 10ml nước cứng cho vào erlen
250ml, thêm nước cất 100ml, thêm 5ml
dung dịch đệm pH 10 và khoảng 5 giọt
chỉ thị Erio T đen. Lắc đều và chuẩn độ
bằng dung dịch ETDA 0.02N cho nên khi
chỉ thị chuyển từ đỏ tím sang xanh dương
hẳn. Tiến hành chuẩn độ 2 lần.
V
1
= 7.7 ml
V
2
= 7.9 ml
V
ETDA
= 7.8 ml
V
mẫu
= 10 ml
C
N ETDA
= 0.02 N
Tổng hàm lượng Mg
2+
và Ca
2+
:
X = V
ETDA
x C
N ETDA
x 1000/ V
mẫu
= 7.8 x 0.02 x 1000/ 10 = 15.6 (mN)
6
*Làm mềm nước:
- Lấy 50 ml nước cứng cho vào becher
250ml, thêm 5ml dung dịch Na
2
CO
3
0.1M và 2ml vôi sữa. Đun sôi hỗn hợp
trong 3 phút, lọc bỏ kết tủa. Tiến hành
chuẩn độ phần nước trong như thí nghiệm
5.
V
1
=17,5ml, V
2
= 18.3ml V
ETDA
= 17.9 ml
V
mẫu
= 50 ml.
Tổng hàm lượng Mg
2+
và Ca
2+
còn lại:
X = V
ETDA
x C
N ETDA
x 1000/ V
mẫu
= 17.9x 0.02 x 1000/ 50 = 7.16(mN)
Nhận xét:
X < X chứng tỏ hàm lượng Mg
2+
và Ca
2+
trong mẫu giảm=>nước được làm mềm khi thêm
Na
2
CO
3
vaø Ca(OH)
2
vào thì xảy ra phản ứng:
Mg
2+
+ 2OH
-
Mg(OH)
2
↓
Ca
2+
+ CO
3
2-
CaCO
3
↓
Làm giảm hàm lượng Mg
2+
vaø Ca
2+
trong
dung dich sau lọc.
10

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 3:
NGUYÊN TỐ NHÓM IIIA
Ngày thí nghiệm: 16/09//2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững vị trí của kim loại nhóm IIIA trong bảng tuần hoàn
- Hiểu được các tính chất của các đơn chất và hợp chất qua các phản ứng đặc trưng.
II/ KẾT QUẢ THÍ NGHIỆM
THÍ
NGHIỆM
MÔ TẢ THÍ NGHIỆM VÀ QUAN SÁT
HIỆN TƯỢNG
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
1
Hydroxyt nhôm – Điều chế và tính
chất:
a) Lấy 10g quặng
bauxite (46% Al
2
O
3
) cho vào becher
250ml, thêm 40ml dd NaOH 3M. Đun
sôi, khuấy đều trong 15 phút. Lọc bỏ
cặn đỏ. Phần nước trong qua lọc được
trung hòa bằng dd HCl 1M cho đến pH
7 ( dùng vài giọt phenolphtalein để
kiểm tra). Ta thấy có kết tủa keo trắng
hình vói nồng trên nền hồng của
phenolphtalein. Lọc rửa kết tủa rồi sấy
ở 100
o
C, sản phẩm sau sấy là Al(OH)
3
,
cân được 4.3g.
Hòa tan tủa đã sấy khô với HCl và
NaOH ta thấy tủa tan tạo dd trong suốt.
b) Lấy 3 ống nghiệm,
a)
Đây là phần nước qua lọc.
Lượng tủa lý thuyết thu được:
Hiệu suất:
Kết luận: Al(OH)
3
là một hidroxit lưỡng tính, vừa tác dụng
acid vừa tác dụng với bazơ
b) Al
3+
+ 3OH
-
Al(OH)
3
Al(OH)
3
+ NaOH NaAlO
2
+ 2H
2
O
Al(OH)
3
+ 3NH
4
OH (NH
4
)
3
[Al(OH)
6
]
11

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
mỗi ống cho 5 giọt dd muối Al
3+
, thêm
từ từ từng giọt dd NaOH 1M cho đến
khi tạo tủa. Sau đó thêm vào:
Ống 1: cho
NH
4
Cl vào ta thấy không có hiện
tượng.
Ống 2: cho
dd NaOH 1M ta thấy kết tủa tan.
Ống 3: cho
dd NH
4
OH đậm đặc ta thấy tủa tan
nhưng chậm hơn ống 2.
Kết luận:
Al(OH)
3
là một chất có tính acid và bazơ đều yếu.
2
Phản ứng của nhôm với acid và
kiềm:
Lấy 4 ống nghiệm lần lượt cho vào
mỗi ống 1ml dung dịch đậm đặc sau:
H
2
SO
4
, HNO
3
, HCl, NaOH. Thêm vào
mỗi ống 1 miếng nhôm.
Để ở nhiệt
độ phòng. Quan sát ta thấy:
Ống 1: chứa H
2
SO
4
đậm
đặc, không có hiện tượng.
Ống 2: chứa HNO
3
đậm
đặc, không có hiện tượng.
Ống 3: chứa HCl đậm đặc,
phản ứng xảy ra mãnh liệt tạo bọt khí
đồng thời có rắn màu đen xuất hiện.
Ống 4: chứa NaOH đậm
đặc, phản ứng xảy ra mãnh liệt tạo bọt
khí đồng thời có rắn màu đen xuất hiện
giống ống 3.
Ở nhiệt độ
cao. Ta thấy:
Ống 1: phản ứng mãnh
liệt, Al tan ra tạo dung dịch màu vàng,
có khí SO
2
bay ra
Ống 2: phản ứng mãnh liệt
có khí màu nâu bay ra. Khi để nguội thì
Al lại bị thụ động hóa.
Ống 3: phản ứng rất mãnh
liệt, có khí thoát ra, rắn đen xuất hiện
- Do nhôm bị thụ động hóa trong H
2
SO
4
và HNO
3
đặc nguội.
- Xuất hiện rắn đen là do nhôm chuyển dạng thù
hình.
2Al + 6HCl 2AlCl
3
+ 3H
2
2Al + 2NaOH +6H
2
O 2Na[Al(OH)
4
] + 3H
2
2Al+6H
2
SO
4, dđ
Al
2
(SO
4
)
3
+3SO
2
+6H
2
O
Al+6HNO
3, đđ
Al(NO
3
)
3
+3NO
2
+ 3H
2
O
12

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
do nhôm bị chuyển dạng thù hình.
Ống 4: phản ứng rất mãnh
liệt, có khí thoát ra, có rắn đen xuất
hiện do Al bị chuyển dạng thù hình.
* Làm lại thí nghiệm trên với các
dung dịch loãng.
Để ở nhiệt
độ phòng. Quan sát ta thấy:
Ống 1: phản ứng xảy ra
chậm, có khí thoát ra trên bề mặt Al.
Ống 2: phản ứng xảy ra
chậm tạo khí không màu hóa nâu trong
không khí.
Ống 3: phản ứng xảy ra
chậm, có bọt khí trên bề mặt Al.
Ống 4: Al tan chậm, có bọt
khí thoát ra trên bề mặt Al.
Ở nhiệt độ
cao. Quan sát ta thấy:
Ống 1: phản ứng mãnh
liệt, khí thoát ra rất nhiều.
Ống 2: có khí màu nâu
bay ra.
Ống 3: phản ứng xảy ra
mãnh liệt, khí thoát ra nhiều.
Ống 4: phản ứng xảy ra
nhanh hơn khi chưa đun nóng, khí thoát
ra nhiều.
2Al + 6HCl
đđ
2AlCl
3
+3H
2
2Al + 2NaOH +2H
2
O 2NaAlO
2
+ 3H
2
2Al+3H
2
SO
4
Al
2
(SO
4
)
3
+ 3H
2
Al + 4HNO
3
Al(NO
3
)
3
+ NO + 2H
2
O
2NO + O
2
2NO
2
2Al + 6HCl
2AlCl
3
+3H
2
2Al + 2NaOH +2H
2
O 2NaAlO
2
+ 3H
2
2Al+3H
2
SO
4
Al
2
(SO
4
)
3
+ 3H
2
Al+6HNO
3
Al(NO
3
)
3
+ 3NO
2
+ 3H
2
O
2Al + 6HCl
2AlCl
3
+3H
2
2Al + 2NaOH +2H
2
O 2NaAlO
2
+ 3H
2
Kết luận:
Al có thể tan được trong kiềm và acid nhất là
khi đun nóng. Ở nhiệt độ thường Al được bảo vệ bởi
màng oxit nên bị thụ động hóa trong một số acid. Vì
thế ta dùng nhôm để đựng một số acid đậm đặc như
HNO
3
và H
2
SO
4
.
Phản ứng của Al với oxy và nước:
Lấy 2 miếng Al, đánh sạch bề mặt,
rửa sạch bằng nước rồi thấm khô bằng
giấy lọc. Nhỏ lên mỗi miếng một giọt
dd muối Hg
2+
. Ta thấy giọt dd Hg
2+
từ
không màu chuyển sang màu xám đen.
Sau vài phút dùng giấy lọc thấm
khô dd Hg
2+
. Một miếng để ngoài
không khí, một miếng ngâm trong
2Al + 3Hg
2+
2Al
3+
+ 3Hg
Chính Hg sinh ra làm cho giọt dung dịch Hg
2+
chuyển màu xám đen.
13

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
3
nước.Quan sát hiện tượng ta thấy:
Miếng nhôm để ngoài không
khí có 1 lớp màu trắng xám hình kim
phồng dần lên.
Miếng ngâm trong nước ban
đầu sủi bọt khí nhưng sau đó thì hết
đồng thời xuất hiện màng keo tại nơi
phản ứng.
- Tại chỗ nhỏ Hg
2+
, miếng nhôm tạo thành hỗn
hống Hg – Al. Hỗn hống này tiếp xúc với oxy trong
không khí:
4 Al – Hg + 3O
2
2Al
2
O
3
+ 4Hg
Lớp oxit hình thành rồi bong ra, lớp hỗn hống
phía trong tiếp xúc tác dụng và cứ thế làm lớp oxit
cao dần.
- Do tạo lớp hydroxit nhôm che phủ bề mặt không
cho nhôm tiếp xúc với nước nên không cho phản
ứng tiếp diễn.
2Al + 6H
2
O 2Al(OH)
3
+ 3H
2
Kết luận:
Nhôm có thể tác dụng với oxy trong không khí và
nước nếu không có lớp oxit bảo vệ bên ngoài.
4
Nhận biết acid boric và borat:
a) Cho 0,5g H
3
PO
3
vào
ống nghiệm rồi thêm vào đó 2ml
C
2
H
5
OH. Đun nhẹ ta thấy hầu như
không tan. Rót dd vào chén sứ rồi đốt
ta thấy ngọn lửa có màu xanh lục
chứng tỏ H
3
PO
3
có tan trong C
2
H
5
OH.
b) Lấy một ít tinh thể
borat Na
2
B
4
O
7
vào chén sứ. Nhỏ lên vài
giọt H
2
SO
4
đặc cho đến khi tinh thể
borat hoàn toàn bị thấm ướt. Sau đó
thêm một ít CaF
2
, trộn đều, đem đun
cho đến khi có khói trắng bay ra. Đốt
trên khói trắng, ta thấy ngọn lửa có màu
xanh lục.
H
3
BO
3
+ 3C
2
H
5
OH B(OC
2
H
5
)
3
+3H
2
O
Na
2
B
4
O
7
+ H
2
SO
4
+ 5H
2
O Na
2
SO
4
+ H
3
BO
3
CaF
2
+ H
2
SO
4
CaSO
4
+ 2HF
3HF + H
3
BO
3
BF
3
+ 3H
2
O
Nếu HF dư: BF
3
+ HF HBF
4
Ở điều kiện thường, BF
3
là một chất khí không
màu và bốc khói mạnh trong không khí. Do trong
khói trắng tồn tại nguyên tố Bo nên khi đốt ngọn lửa
có màu xanh.
Kết luận:
Acid boric và borat có thể nhận biết bằng màu
đặc trưng của ngọn lửa khi đốt cháy những hợp chất
của chúng.
14

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo cáo thí nghiệm bài 5
NITƠ VÀ CÁC HỢP CHẤT NHÓM VA
Ngày thí nghiệm: 09/09/2014
I/MỤC ĐÍCH THÍ NGHIỆM
Nắm vững phương pháp điều chế khí Nitơ.
Tính chất của axit nitric, tính chất của các muối nitrit.
Điều chế và tính chất muối NH
3
II/ KẾT QUẢ THÍ NGHIỆM
THÍ
NGHIỆM
MÔ TẢ THÍ NGHIỆM VÀ
QUAN SÁT HIỆN TƯỢNG
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
1
Điều chế Nitơ:
Cho 2g NaNO
2
vào ống nghiệm
và rót vào ống 5ml dd NH
4
Cl bão
hòa ta thấy có bọt khí sủi nhẹ. Lắp
hệ thống thu khí như hình vẽ:
Đun nhẹ thì phản ứng mạnh hơn.
Thu khí vào ống nghiệm lớn chứa
đầy nước úp ngược trên 1 chậu
đựng nước. Lấy que nhang đang
cháy đưa vào ống nghiệm chưa khí
thu được thì ngọn lửa tắt ngay.
NH
4
Cl + NaNO
2
NH
4
NO
2
+ NaCl
NH
4
NO
2
N
2
+ 2H
2
O
Khí thu được là khí N
2
mà khí N
2
thì không duy
trì sự cháy nên ngọn lửa tắt ngay.
Kết luận:
Có thể điều chế khí N
2
bằng cách nhiệt phân muối
amoni nitrat. Khí N
2
không duy trì sự cháy.
2
Tính chất của acid nitric:
a/ Cho vào 2 ống nghiệm nhỏ
mỗi ống 3 giọt HNO
3
đậm đặc.
Ống 1: thêm vào 1 mẫu Zn + 4HNO
3, đđ
Zn(NO
3
)
2
+ 2NO
2
+ H
2
O
15

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
kẽm ta thấy kẽm tan ra, có khí màu
nâu bốc lên, phản ứng tỏa nhiệt
mạnh, dd sau phản ứng không màu.
Ống 2: thêm vào 1 mẫu
đồng ta thấy đồng tan ra, có khí
màu nâu bay ra, phản ứng tỏa nhiệt
mạnh, dd sau phản ứng có màu
xanh.
b/ Cho vào ống nghiệm một ít
lưu huỳnh. Sau đó thêm 1ml HNO
3
đậm đặc. Đun nhẹ ta thấy lưu huỳnh
tan ra, ống nghiệm nóng lên. Khi
cho 1ml dd Ba
2+
vào dd sau phản
ứng thì thấy xuất hiện kết tủa màu
trắng.
c/ Cho vào ống nghiệm 1ml
FeSO
4
bão hòa, 5-6 giọt H
2
SO
4
đậm
đặc. Làm lạnh ống nghiệm trong
chậu nước. Thêm từ từ 1ml HNO
3
loãng dọc theo thành ống nghiệm và
không lắc. Quan sát màu sắc của dd
ta thấy:
Dung dịch trước khi cho
HNO
3
vào có màu xanh lơ của Fe
2+
.
Khi cho HNO
3
vào thì
phần dd phía trên có màu vàng nâu,
có bọt khí đồng thời ở giữa dần dần
xuất hiện lớp phân cách màu đen,
dd phía dưới vẫn màu xanh lơ.
Khi lắc mạnh dd thì lớp
phân cách màu đen biến mất, đồng
thời co khí bay ra hóa nâu trong
không khí và dd sau cùng có màu
nâu đỏ. Khi thêm H
2
SO
4
vào thì
thấy màu nâu đỏ nhạt dần.
Không màu màu nâu
Cu + 4HNO
3, đđ
Cu(NO
3
)
2
+ 2NO
2
+ H
2
O
dd màu xanh màu nâu
S + 4HNO
3, đđ
H
2
SO
4
+ 2NO
2
+ 2H
2
O
Ba
2+
+ SO
4
2-
BaSO
4
- Dung dịch phía trên có màu vàng nâu là do Fe
2+
bị oxy hóa thành Fe
3+
theo phản ứng:
6FeSO
4
+3H
2
SO
4
+HNO
3
3Fe
2
(SO
4
)
3
+2NO+4H
2
O
Do ống nghiệm bị lạnh nên khí NO tạo thành bị
giữ lại trong dd và tạo phức với FeSO
4
chưa phản
ứng thành một phức có màu đen:
FeSO
4
+xNO [Fe(NO)
x
]SO
4
đen
- Do phức trên không bền nên khi ta lắc mạnh sẽ
phân hủy tạo NO thoát ra ngoài rồi hóa nâu ngoài
không khí.
[Fe(NO)
x
]SO
4
FeSO
4
+xNO
2NO + O
2
2NO
2
Dung dịch sau cùng màu nâu đỏ là do Fe
2
(SO
4
)
3
thủy phân tạo Fe(OH)
3
màu nâu đỏ. Để kiểm chứng
ta cho H
2
SO
4
vào thì màu nâu đỏ nhạt dần do sự
thủy phân củaFe
2
(SO
4
)
3
phụ thuộc vào pH của dung
dịch.
Kết luận:
16

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
có tính oxy hóa mạnh nên nó có thể tác dụng được với cả kim loại đứng trước, sau hydro,
3
Tính chất của dd cường thủy:
Cho vào 3 ống nghiệm, mỗi ống
1 giọt Hg(NO
3
)
2
và thêm từ từ dd
(NH
4
)
2
S cho đến khi kết tủa hoàn
toàn. Quan sát ta thấy kết tủa màu
đen.
Li tâm và gạn bỏ phần dd trên
kết tủa.
Ống 1: thêm vào từ từ 1 ml
cường thủy (3HNO
3
: HCl), ta thấy
kết tủa tan ra, có khí thoát ra rồi hóa
nâu trong không khí và trong dd
xuất hiện tủa màu vàng. Khi cho
đến dư nước cường thủy thi tủa
vàng tan ra. Thử bằng dd Ba
2+
thì có
tủa trắng.
Ống 2: thêm từ từ dd
HNO
3
đậm đặc ta thấy không có
hiện tượng.
Ống 3: thêm từ từ dd HCl
đậm đặc thì thấy không có hiện
tượng.
Hg(NO)
3
+ (NH
4
)
2
S HgS + 2NH
4
NO
3
đen
- Nước cường thủy có tính oxy hóa mạnh do tạo
ra clo nguyên tử:
HNO
3
+ 3HCl NO + 3Cl + 2H
2
O
Chính clo nguyên tử đã hòa tan HgS:
2Cl + HgS HgCl
2
+ S vàng
Khi cho dư cường thủy:
6Cl + S 6Cl
-
+ S
6+
SO
4
2-
+ Ba
2+
BaSO
4
trắng
Kết luận:
Dung dịch nước cường thủy có tính oxy hóa rất
mạnh
4
Tính chất muối nitrit:
Cho vào 4 ống nghiệm mỗi ống
1ml dung dịch NaNO
2
.
Ống 1: thêm vào 1 ít dd
KMnO
4
loãng có pha 1 giọt H
2
SO
4
đậm đặc. Ta thấy màu tím của hỗn
hợp mất đi và tạo dd trong suốt.
Ống 2: thêm vào dd FeSO
4
và vài giọt H
2
SO
4
đậm đặc (không
lắc). Ta thấy xuất hiện lớp màu nâu
đen và có bọt khí không màu rồi
hóa nâu.
Ống 3: thêm dd KI có pha
1 giọt H
2
SO
4
loãng. Ta thấy đầu tiên
dd có màu vàng nhạt của KI, sau đó
tạo tủa màu tím than. Khi cho dư dd
6H
+
+2MnO
4
2-
+5NO
2
-
5NO
3
-
+ 2Mn
2+
+ 3H
2
O
Không màu
Fe
2+
+2H
+
+NO
2
-
Fe
3+
+ NO + H
2
O
Khí không màu
FeSO
4
+xNO [Fe(NO)
x
]SO
4
đen
2NO + O
2
2NO
2
2I
-
+2NO
2
-
+4H
+
2NO +I
2
+2H
2
O
Tím than
17

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
KI thì tủa tan tạo dd màu nâu đất.
Trong quá trình phản ứng có bọt khí
sinh ra.
Ống 4: thêm vài giọt
H
2
SO
4
đặc ta thấy dd có sủi bọt khí
không màu.
Khi dư KI: I
2
+ KI KI
3
nâu đất.
NO
2
-
+ H
+
HNO
2
3HNO
2
HNO
3
+ 2NO +H
2
O
Kết luận:
Muối nitrit vừa có tính khử vừa có tính oxy
hóa. Acid nitrit là acid không bền sẽ tự phân hủy
theo cơ chế tự oxy hóa khử.
5
Điều chế và tính chất của
amoniac:
a) Điều chế NH
3
:
Lắp bộ phận điều chế NH
3
.
Cho vào ống nghiệm 3g NH
4
Cl
và 5ml dd NaOH đậm đặc. Lắc kĩ
ống nghiệm, đun nóng bằng đèn
cồn và thu khí thoát ra trong 1
erlen, khi nghe mùi NH
3
bay ra và
thành bình mờ như sương mù thì
ngưng đun.
Đậy ống nghiệm bằng nút cao
su có gắn ống thủy tinh và nhúng
ngược bình erlen vào chậu nước có
thêm vài giọt phenolphtalein. Quan
sát hiện tượng ta thấy nước từ từ bị
hút vào erlen sau đó bỗng nhiên
phụt mạnh và chuyển sang màu
hồng
b) Cân bằng trong dung dịch
NH
3
:
Lấy dd thu được thí nghiệm trên
cho vào 4 ống nghiệm, mỗi ống
nghiệm 1ml:
Ống 1: thêm một ít dd
NH
4
Cl và lắc cho tan ra ta thấy màu
hồng nhạt dần. Cho đến dư thì màu
hồng không mất hẳn.
NH
4
Cl + NaOH NH
4
OH + NaCl (1)
NH
4
OH NH
3
+ H
2
O (2)
NH
3
+ H
2
O NH
4
+
+ OH
-
(3)
Phenolphtalein hóa hồng là do có OH
-
sinh ra.
Sở dĩ nước bị hút vào erlen là vì áp suất trong
erlen giảm.Áp suất giảm do:
+ 1 mol NH
4
OH khi tan trong nước thì nó chỉ
chiếm khoảng 15ml nhưng nếu 1 mol NH
4
OH ở thể
hơi thì nó chiếm đến 22,4l.
+ NH
3
ngưng tụ và tan vào nước.
NH
4
Cl NH
4
+
+ Cl
-
Phản ứng này làm nồng độ NH
4
+
tăng lên làm cân
bằng (3) dịch chuyển theo chiều làm giảm OH
-
nên
màu hồng nhạt dần. Nhưng màu hồng không mất
hẳn vì bản chất (3) vẫn là phản ứng thuận nghịch.
H
+
+ OH
-
H
2
O
Acid vào trung hòa lượng OH
–
trong dd. Khi cho
đến dư acid thì hoàn toàn hết OH
–
nên màu hồng
của dd mất hẳn.
18

Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ống 2: thêm từ từ H
2
SO
4
loãng đến dư ta thấy màu hồng nhạt
dần rồi mất hẳn.
Ống 3: đun nhẹ ta thấy
màu hồng nhạt dần nhưng không
mất hẳn.
Ống 4: giữ để so sánh.
So sánh màu trong 4 ống ta thấy
màu dung dịch nhạt dần theo thứ tự
ống 4 > ống 3 > ống 1 > ống 2.
Khi đun nóng thì NH
3
bay hơi làm cân bằng phản
ứng (3) dịch chuyển theo chiều làm giảm lượng OH
-
nên màu hồng của dd nhạt dần.
Kết luận:
- NH
3
tan nhiều trong nước.
- Dung dịch NH
3
là một bazơ yếu
6
Nhiệt phân muối amoni:
Cho một ít tinh thể NH
4
Cl
vào ống nghiệm, đun nóng. Quan
sát ta thấy trên thành ống nghiệm có
tinh thể trắng bám lên. Làm tương
tự như trên nhưng ta cẩn thận xua
hơi ẩm ra khỏi ống thì không xảy ra
hiện tượng thăng hoa vật lý.
Làm lại thí nghiệm trên
nhưng thay NH
4
Cl bằng (NH
4
)
2
SO
4
.
Ta thấy khi đặt giấy tẩm
phenolphtalein thì giấy xuất hiện
những vệt hồng, đồng thời dd còn
lại tạo tủa trắng với dd Ba
2+
và trên
thành ống nghiệm không có tinh thể
trắng tạo thành. Đây là hiện tượng
thănh hoa hóa học.
- Do
NH
4
Cl có nhiệt độ phân hủy lớn hơn nhiệt độ thăng
hoa nên sẽ thăng hoa trước. Khi gặp nhiệt độ thấp và
hơi nước sẽ đọng lại trên thành ống nghiệm.
NH
4
Cl NH
3
+ HCl
NH
3
+ HCl NH
4
Cl (r)
Đây là hiện tượng thăng hoa vật lý vì trước khi
đạt nhiệt độ phân hủy thì NH
4
Cl đã thăng hoa và
không bị biến đổi chất.
(NH
4
)
2
SO
4
2NH
3
+H
2
SO
4
(1)
Ba
2+
+ SO
4
2-
BaSO
4
Đây là hiện tượng thăng hoa hóa học vì
(NH
4
)
2
SO
4
bị phân hủy theo phản ứng (1), không thể
kết hợp lại với nhau.
Kết luận:
Muối amoni không bền, dễ bị nhiệt phân, phản
ứng phân hủy phụ thuộc vào gốc acid tạo thành
muối amoni đó.
19
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Bài báo cáo thí nghiệm số 6:
HYDRO – OXY – LƯU HUỲNH ( H
2 –
O
2
– S)
Ngày thí nghiệm: 16/09/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
Điều chế khí hydro và oxi
Tính chất hóa học của hydro, oxy, lưu huỳnh
II/ KẾT QUẢ THÍ NGHIỆM
THÍ
NGHIỆ
M
MÔ TẢ THÍ NGHIỆM VÀ
QUAN SÁT HIỆN TƯỢNG.
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT
PHƯƠNG TRÌNH ,TÍNH TOÁN VÀ
RÚT RA KẾT LUẬN
1
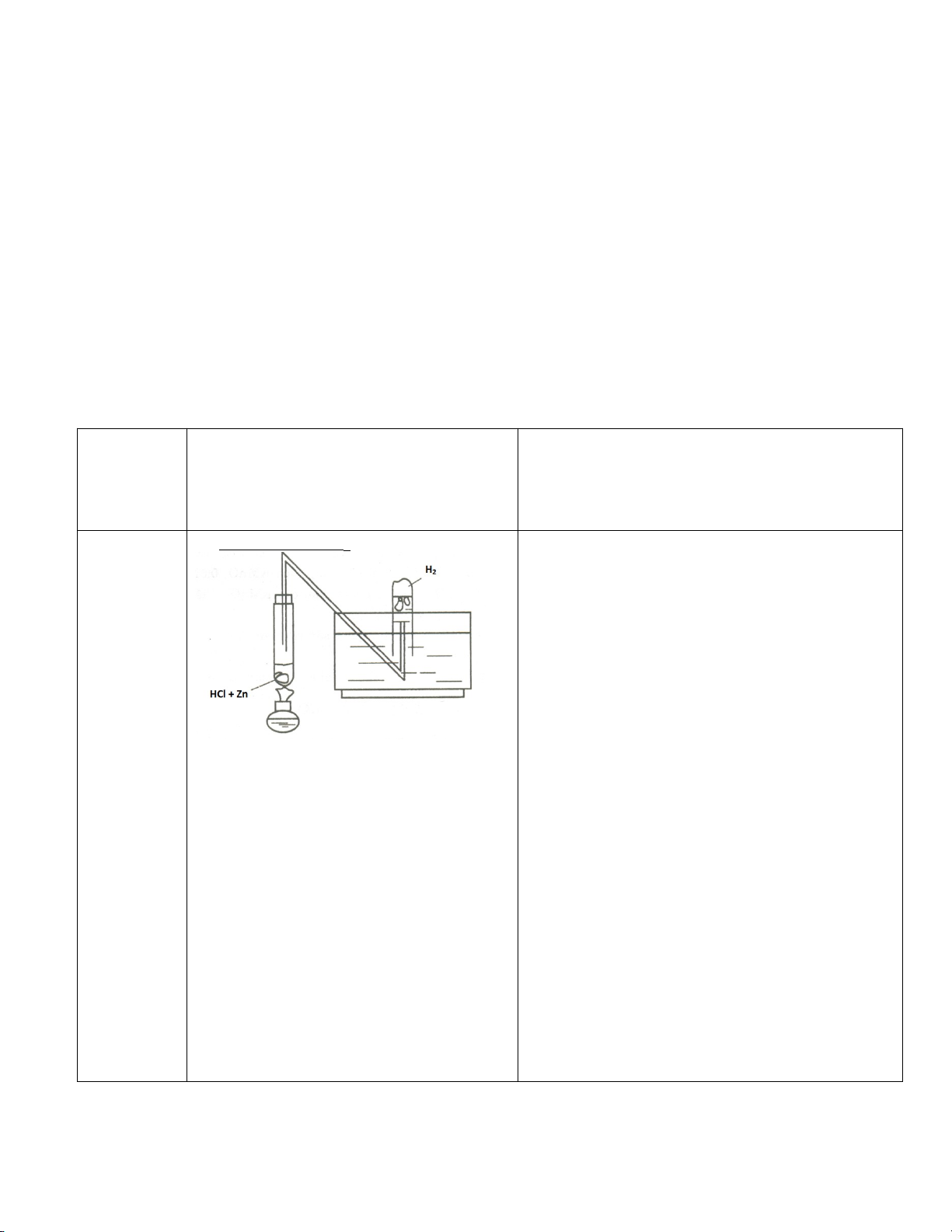
Ñieàu cheá H
2
- Lắp hệ thống thu khí.
- Cho vào ống nghiệm 3 hạt
kẽm+5ml HCL đậm đặc.Thu khí sinh ra
bằng ống nghiệm nhỏ chứa đầy nước úp
ngược trong chậu.
-
Châm lửa đốt khí hydro thoát ra ở
đầu ống dẫn có tiếng nổ nhẹ, ngọn lửa
màu xanh đồng thời tỏa nhiều nhiệt.
- Lấy thành phễu thủy tinh khô chà
lên ngọn lửa. Ta thấy có hơi nước động
lên thành phễu.
Zn + 2HCl ZnCl
2
+ H
2
Do hydro tác dụng với oxi có lẫn trong
ống nghiệm và trong hệ thống dẫn khí nên có
tiếng nổ. Ban đầu lượng oxi nhiều hơn nên có
tiếng nổ lớn.
2H
2
+ O
2
t
0
H
2
O
Hơi nước tạo thành gặp thủy tinh lạnh nên
ngưng tụ.
Kết Luận:
- Ñieàu chế hydro bằng cách cho kim loại
mạnh tác dụng với axid.
- Hốn hợp hydro và oxi là hỗn hợp nổ mà
mạnh nhất khi tỉ lệ xấp xỉ 2:1.
20
Bấm Tải xuống để xem toàn bộ.


