

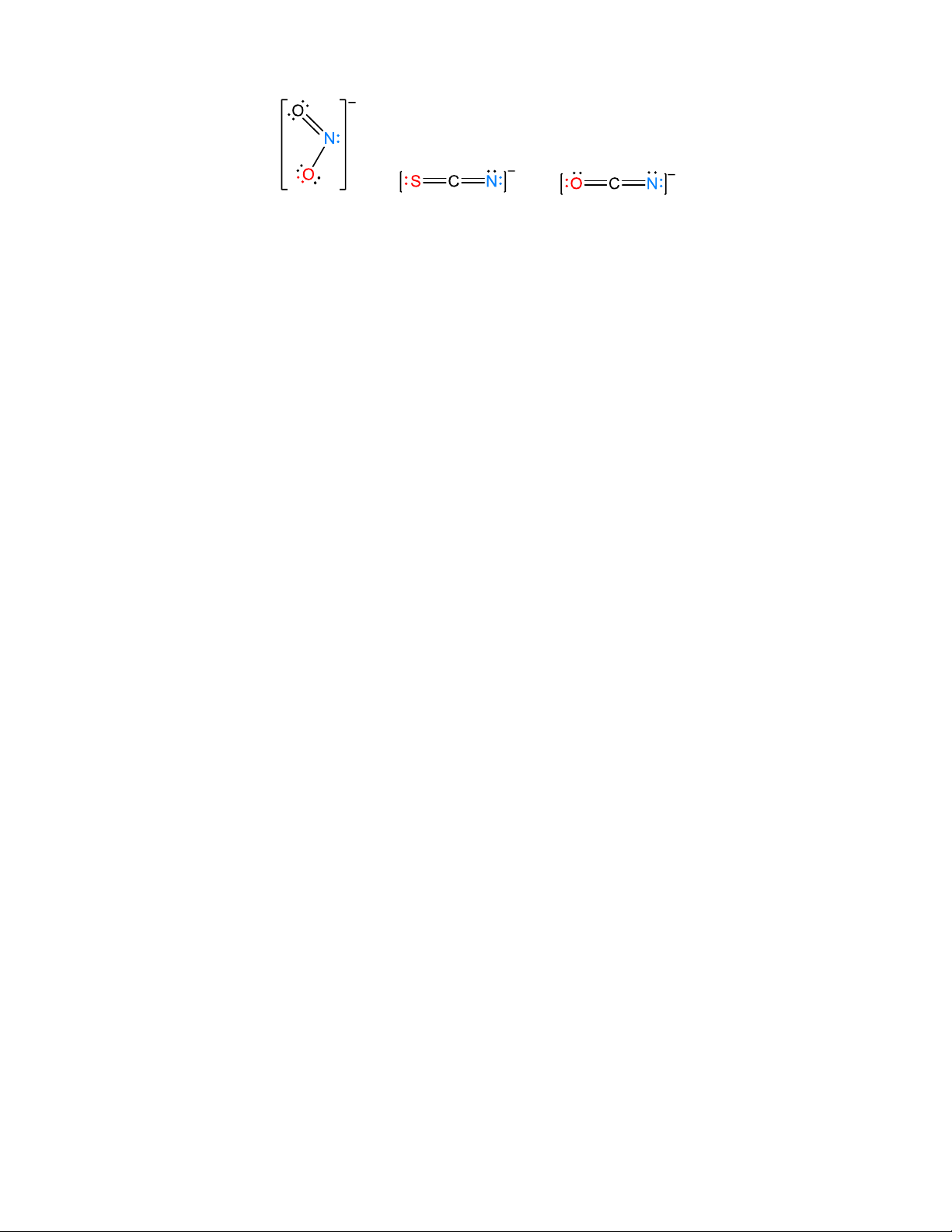



Preview text:
MỘT SỐ VẤN ĐỀ CƠ BẢN VỀ PHỨC CHẤT
I. Một số khái niệm cơ bản về phức chất
Các thành phần của một phân tử phức chất thường gặp: Phối tử [Co(NH 3)6]Cl3 Cầu nội Cầu ngoại ion trung tâm
Thành phần của phức chất: Trong cấu tạo của phức chất người ta chia ra cầu nội và cầu ngoại. Cầu
nội được viết trong dấu móc vuông bao gồm nguyên tử trung tâm và phối tử. Những ion nằm ngoài
và ngược dấu với cầu nội tạo nên cầu ngoại
Tuỳ thuộc vào điện tích của cầu nội, có thể phân loại thành phức cation, phức anion và phức chất trung hoà. Ví dụ:
- Phức cation: [Ag(NH3)2]Cl, [Cu(NH3)4]SO4, [Fe(H2O)6]Cl3
- Phức anion: K4[Fe(CN)6], H[AuCl4], K2[Ni(CN)4]
- Phức trung hoà [Pt(NH3)2Cl2], [Ni(CO)4].
a) Nhân trung tâm: trong các phức chất nhân trung tâm thường là các ion kim loại, đa phần là kim
loại chuyển tiếp (nên có thể gọi là ion trung tâm).
Trong một số phức chất nguyên tử kim loại (số oxi hoá bằng 0) đóng vai trò nhân trung tâm, ví dụ
nguyên tử trung tâm Ni trong Ni(CO)4
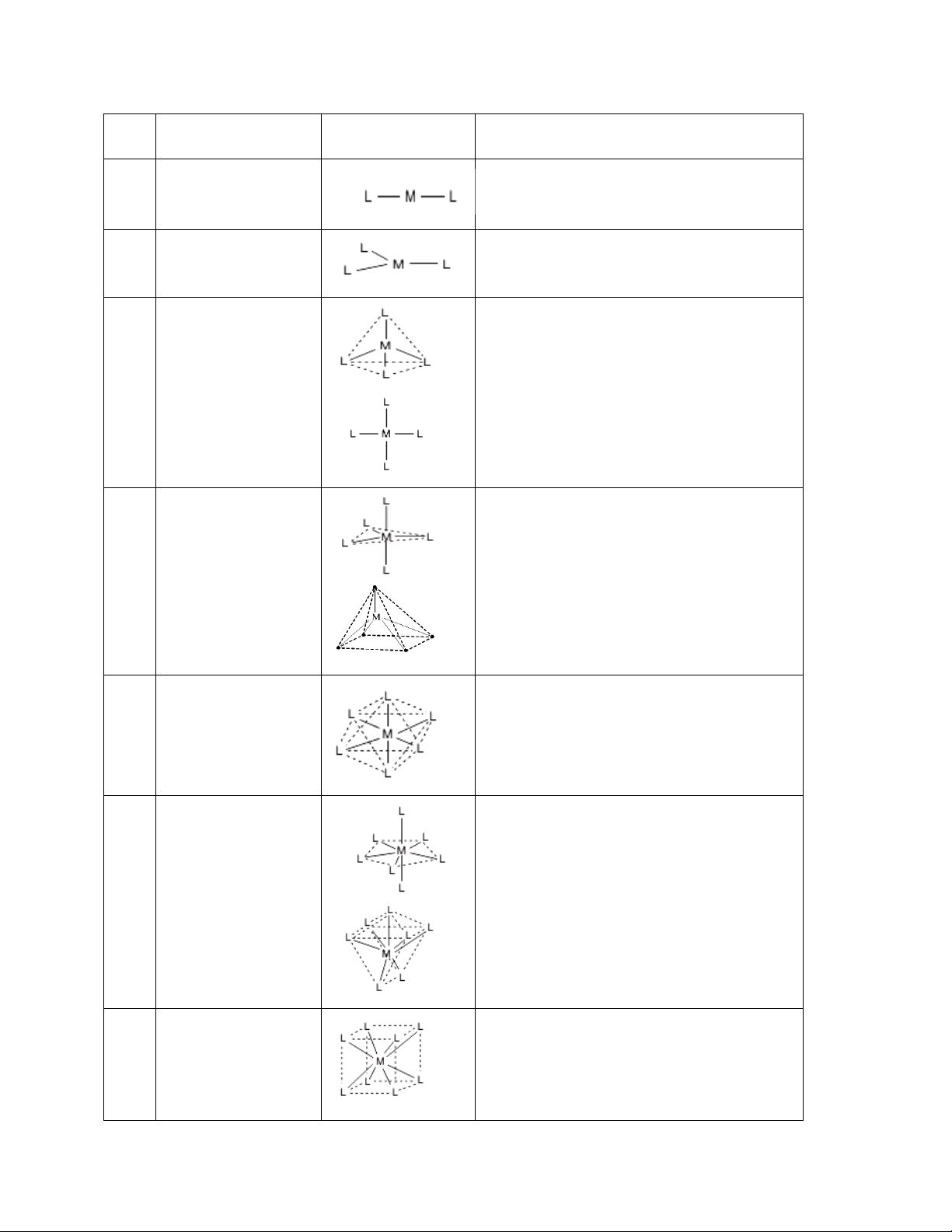
c) Số phối trí và hình học của phức chất
- Số phối trí (spt): là số liên kết xung quanh ion (nguyên tử) trung tâm.
Nếu phối tử đơn càng thì spt bằng số phối tử. Nếu phối tử đa càng thì spt khác số phối tử,
khi đó cần xác định dung lượng phối trí của phối tử.
Mỗi ion kim loại chuyển tiếp thường có spt đặc trưng.Ví dụ Zn(II), Pd(II), Pt(II), Au(III)…
có spt 4, Co(III), Cr(III), Fe(II),Fe(III), Pt(IV)… có spt 6.
Tuy nhiên trong một số phức chất của cùng một ion trung tâm thì spt phụ thuộc vào loại phối tử
Ví dụ: [Ni(CN)4]2-, Ni(II) có spt 4, phức chất vuông phẳng
[NiCl4]2-, Ni(II) có spt 4, phức chất tứ diện
[Ni(NH3)6]2+, Ni(II) có spt 6, phức chất bát diện
- Dạng hình học của phức chất
Bảng 1.1: Một số dạng hình học thường gặp spt Dạng hình học Hình vẽ Ví dụ 2 Đường thẳng
[CuCl2]-, [Ag(NH3)2]+, [AuCl2]- [Hg(CN)2] 3 Tam giác [HgI3]- 4 Tứ diện
[BeF4]2-, [BF4]-, [BBr4]-, [ZnCl4]2-, [Cd(CN) 4]2-... [PtCl Vuông phẳng
4]2-, [Cu(NH3)4]2+, [Zn(CN)4]2-… Lưỡng tháp tam giác 5 Fe(CO)5 Chóp đáy vuông [Ni(CN)5]3-, [MnCl5]2- 6 Bát diện
[Co(NH3)6]3+, [Ti(H2O)6]3+ , [Fe(CN)6]4-, [RhCl 6]3-.. 7 Lưỡng chóp ngũ giác
[ZrF7]3-, [UO2F5]3-, [UF7]3-, [HfF7]3-, Lưỡng chóp tam [ReOCl6]2- phương 8 Lập phương [U(NCS)8]4-, Na[PaF8]
Bài giảng Hoá học Phức chất Trần Ngọc Tuyền
Số phối trí > 6 ít gặp vì khi thêm một phối tử vào phức bát diện thì lực đẩy A-A
tăng nên liên kết M-A trở nên yếu.
Bảng 1. Mối quan hệ giữa số phối trí và cấu trúc hình học của phức chất Số Cấu trúc hình học Ví dụ phối trí của phức chất 2 Thẳng
[CuCl2]-, [Ag(NH3)2]+, [AuCl2]-
Bài giảng Hoá học Phức chất Trần Ngọc Tuyền 4 Vuông phẳng
[Ni(CN)4]2-, [PdCl4]2-, [Pt(NH3)4]2+
Số phối trí > 6 ít gặp vì khi thêm một phối tử vào phức bát diện thì lực đẩy A-A 4 Tứ diện
[Cu(NH3)4]2+, [Zn(NH3)4]2+, [MnCl4]2-
tăng nên liên kết M-A trở nên yếu. 6 Bát diện
[Cr(H2O)6]3+, [V(CN)6]4-, [Cu(NH3)4Cl2]+, [Co(En)3]3+
Bảng 1. Mối quan hệ giữa số phối trí và cấu trúc hình học của phức chất Số Cấu trúc hình học
c) Phối tử (ligand): là các phâ 1 n .5 t.ử P ha hốy i ion tử đ sắ ơ p n x r ế ă p ngm , ộ đ t
a cráăch ng xá
c định xung quanh nhân trung tâm Ví dụ phối trí của phức chất
để tạo nên phân tử hoặc ion phức. Phối tử (ligand) có thể là các ion hoặc phân tử vô cơ, hữu cơ.
- Phối tử đơn răng là phối tử chỉ cho M một cặp electron tự do, mặc dù nó có 2 Thẳng [CuCl2]-, [ - A gPh (Nối t H3 ử )2 ]+có th , [Aể u cá Cl c2 g ]- ốc axit: F- t , C hể l- c , I- ó n, hOH- iều , C cặ N- p e , l S ecC tr N- on, NO - 2- 2- tự d 2 o , S . 2O3 , C2O4 4 Vuông phẳng [Ni(CN)
- Phối tử có thể là các phân tử trung hoà Ví dụ: X- : , H O2O, N H-, C H N-3,, C S O, N CN-, O, H NH3,2 N H - 2 CH
O...2 -CH2-NH2 (etilenđiamin) 4]2-, [PdCl4]2-, [Pt(NH3)4]2+
d) Dung lượng phối trí của mộ t phối tử - l P à h s ố ố i tli ửê n đ k a ế r t ă ng lm à àp n h ó ố it ạto ử đ c ư ó ợ t c h v ể ớ c i h n o g uy M ê t n ừ thửa it ru c n ặ g p t e â l m ec .t ron trở lên. 4 Tứ diện
[Cu(NH3)4]2+, [Zn(NH3)4]2+, [MnCl4]2- Căn cứ vào dung lượng V ph í d ốụi : trí
các phối tử được chia thành phối tử đơn càng và phối tử đa 6 Bát diện
[Cr(H2O)6]3+, [V(CN)6]4-, [Cu(NH3)4Cl2]+, [Co(En)3]3+ càng
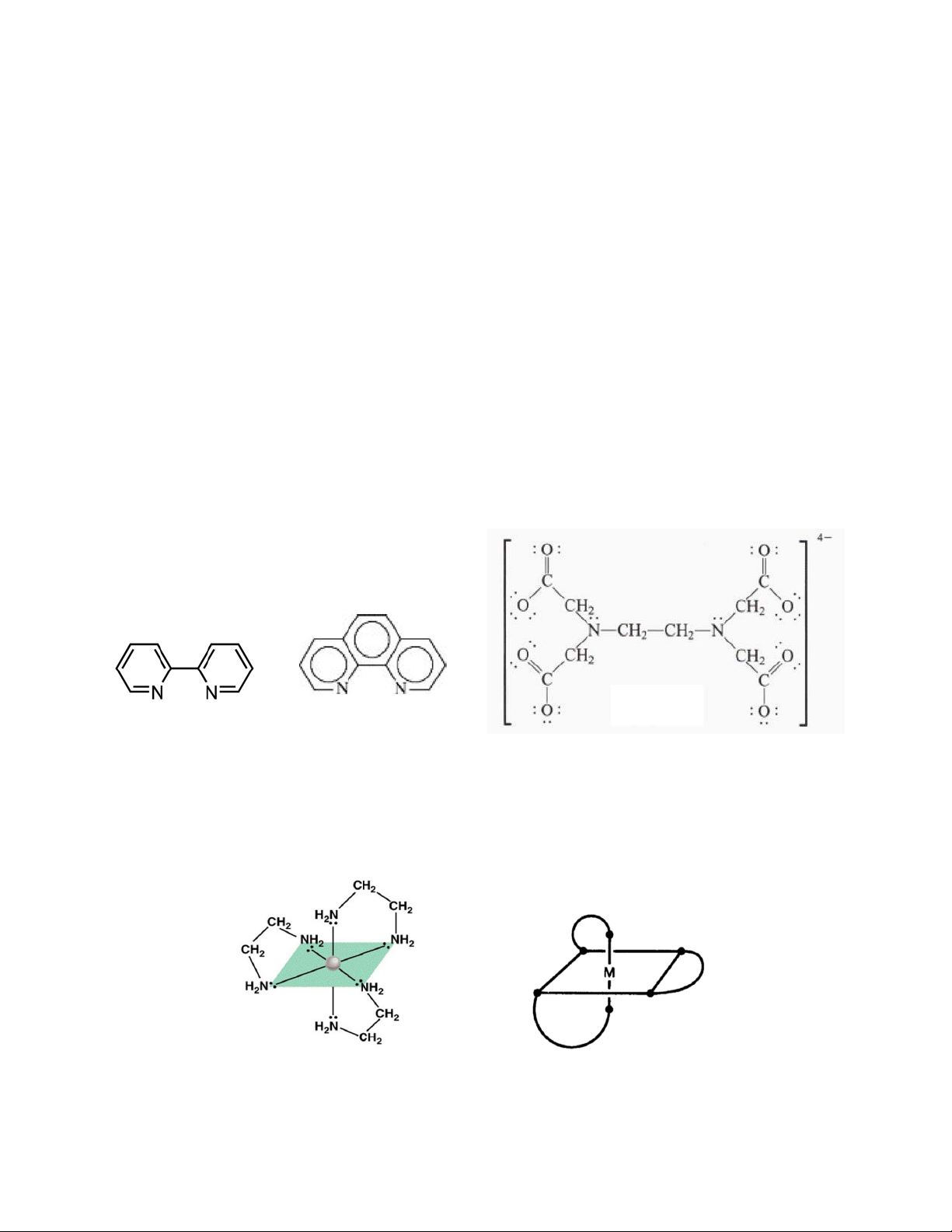
+ Phối tử 2 răng: etylendiamin: NH2-CH2-CH2-NH2 (En), cacbonat, oxalat, bpy
+ Phối tử đơn càng có (bidung pyrid lư in ợ ), ng o- ph ph ố e i na trí nth b r ằ o n li g n. 1:
.. các phối tử liên kết trực tiếp với ion
1.5. Phối tử đơn răng, đa răng
trung tâm bằng một liên kết. Các gốc axit hóa trị 1, các phân tử trung hòa như NH3, CH3NH2,
- Phối tử đơn răng là phối tử chỉ c C h ù ó 5 o H5 M N, H một 2 O... cặp là nh elect ữ r ng ph on tự ố di t o, ử đơn c mặc d àng n có
thể có nhiều cặp electron tự do.
Ví dụ: Trong các phức [Cu(NH3)4]2+, [Al(H2O)6]3+… NH3, H2O là các phối tử đơn càng.
Ví dụ: X- , OH-, CN-, SCN-, NH3, H2O...
+ Phối tử đa càng có dung lượng phối trí 2: phối tử liên kết với nhân trung tâm qua hai
- Phối tử đa răng là phối tử có thể c ha ho y nhi M từề u h ali i ê cn k ặp ếet. le ctron trở lên. Oxalat Cacbonat bipyridin o-phenanthrolin Ví dụ:
Một số phối tử đa càng thường gặp:
+ Phối tử 6 răng: EDTA4- (etylen diamin tetraaxetat)
+ Phối tử 2 răng: etylendiamin: NH2-CH2-CH2-NH2 (En), cacbonat, oxalat, bpy
(bipyridin), o-phenanthrolin... EDTA Oxalat Cacbonat bipyridin o-phenanthrolin
+ Phối tử 6 răng: EDTA4- (etylen diamin tetraaxetat)
Ví dụ phức chất [Ni(en)3]2+: phối tử ethylendiamine (en) có dung lượng phối trí 2 3 Các gốc axit SO 2- 2-
4 , C2O4 ..., các phân tử trung hòa như etilenđiamin H2N-CH2-CH2-NH2 có
dung lượng phối trí 2, triaminopropan H2N-CH2-CH(NH2)-CH2-NH2 có dung lượng phối trí 3. EDTA 3 hay hay
Hợp chất nội phức là 1 dạng của phức vòng nhưng chúng không điện ly hoặc điện ly rất
ít. Để tạo được các hợp chất nội phức thì phối tử phải có một nhóm chứa nguyên tử H có thể thay
thế bằng ion kim loại, như nhóm cacboxyl-COOH, sunfo-SO3H, hyđroxyl -OH, oxim =NOH,
amino bậc nhất -NH2, bậc hai-NHR… và nhóm kia phải có cặp electron chưa chia để hình thành
liên kết phối trí như amino bậc nhất, bậc hai, bậc ba, nhóm CO,… Thông thường, các muối nội
phức được tạo thành với ion Mn+ có số phối trí gấp hai lần điện tích của nó. Thí dụ các muối nội
phức của Be(II), Ni(II) có số phối trí 4; của Fe(III), Al(III), Co(III)… có số phối trí 6. Với
Co(II), Fe(III) thì loại hợp chất này ít gặp. Một thí dụ cổ điển về muối nội phức là Cu-glycolat:
Người ta thấy rằng các muối nội phức có số phối trí 6 cũng có cấu trúc bát diện, chẳng
hạn như phức chất của Pt, Pd, Al và một số của Ni, với số phối trí 4 có cấu trúc tứ diện hoặc
vuông phẳng như ví dụ dưới đây:
Các muối nội phức thường có một số tính chất đặc trưng như ít tan trong nước, tan nhiều
trong các dung môi hữu cơ không phân cực; độ phân ly trong dung dịch rất nhỏ; thường có màu
đặc trưng; có khả năng chuyển sang trạng thái khí mà không bị phân huỷ; tuỳ điều kiện, có thể
chuyển thành hợp chất không vòng chẳng hạn: 41 hay hay
Hợp chất nội phức là 1 dạ
ng của phức vòng nhưng chúng không điện ly hoặc điện ly rất
ít. Để tạo được các hợp chất nội 1.2. Danh phức thì ph phốáp i p tửh ức c
phảhiấ t: có
một nhóm chứa nguyên tử H có thể thay
thế bằng ion kim loại, như nhóm cacboxyl-COOH, sunfo-SO
- Tên phức chất đọc theo thứ tự tên cation + 3H, hyđroxyl -OH, oxim =NOH, tên anion
amino bậc nhất -NH2, bậc hai-NHR… và nhóm kia phải có cặp electron chưa chia để hình thành
- Đọc tên cầu nội theo thứ tự: số phối tử + tên phối tử + tên nguyên tử trung tâm + số oxi hóa của
liên kết phối trí như amino bậc nguyê nhất, n t bậ ử c trung tâm
hai, bậc ba, nhóm CO,… Thông thường, các muối nội
phức được tạo thành với ion Mn+ rí ấ ệ í ủ nó. ố - có Số sốph ối phốtử: i Đ t ể ch g ỉ số p lượ ha ng i lầphố n đi tiử m n ộtt c c àng h c (dung a lượ ng Thíph ố dụi trí các bằng 1) mu ngư i ờ nội ta i dùng các tiếp
phức của Be(II), Ni(II) có số ph đ ốầiu ng tríữ như đi ( 4; của 2), tr Fe i (3 (I ), te II), tra A(l4), pe (III nta( ), 5 C ), he o(I x IIa(6)...
)… có số phối trí 6. Với
Co(II), Fe(III) thì loại hợp chất này ít Đố g i ặ vớ p. i ph M ố ộ it tử t nh hí i dều ụ ccàng ổ đ (dung iển v lư ề ợng mu ph ốiối n trí ội ≥2) ph ngư ức lờài ta dùng Cu-gl cá yc c ti ol ế a p t: đ ầu ngữ bis, tris,
tetrakis, pentakis, hexakis... để chỉ 2, 3, 4, 5, 6.. phối tử. Tên phối tử:
- Nếu phối tử là anion: người ta lấy tên anion và thêm đuôi “o”
- Tên một số phối tử là gốc axit:
Người ta thấy rằng các muố F- i nội Flu ph oro ức c NO - 2- ó số rúc ẳ 2 phốNitrit i trí o -N 6 cũ C2 ng O có 4 cấOx u atlato bát diệ NCS- n, c hThioc ng yanato-N-
hạn như phức chất của Pt, Pd, Al và một số của Ni, với số phối trí 4 có cấu trúc tứ diện hoặc Cl- Chloro ONO- Nitrito-O OH- Hydroxo CO 2- 3 carbonato
vuông phẳng như ví dụ dưới đây: Br- Bromo SO - 3 Sulfito CN- Cyano I- Iodo S 2- 2O3 tiosunfato SCN- Thiocyanato-S-
- Nếu phối tử là phân tử trung hoà người ta lấy tên của phối tử đó
C2H4 (ethylene), C5H5N (pyridine), NH2-CH2-CH2-NH2 (ethylenediamine) N
Các muối nội phức thường có một số tính chất đặc trưng như ít tan trong nước, tan nhiều
trong các dung môi hữu cơ không phân cực; độ phân ly trong dung dịch rất nhỏ; thường có màu
đặc trưng; có khả năng chuyển sang trạng thái khí mà không bị phân huỷ; tuỳ điều kiện, có thể
chuyển thành hợp chất không vòng chẳng hạn: 41 C5H5N (pyridin)
- Một số phối tử trung hoà có tên riêng:
H2O (aqua), NH3(ammine), CO (carbonyl), NO (nitrrozyl).
- Nếu trong cầu nội có nhiều loại phối tử thì đọc tên phối tử mang điện rồi đến phối tử trung hòa,
hoặc theo thứ tự vần chữ cái không kể tên tiền tố chỉ số lượng
Ví dụ: K2[Pt(NCS)I3]: Potassium triiodothiocyaxato-N platinate(II)
- Tên của nguyên tử trung tâm:
- Nếu nguyên tử trung tâm ở trong phức cation: Lấy tên của nguyên tử đó kèm theo số la mã
viết trong ngoặc đơn để chỉ trạng thái oxi hoá.
- Nếu nguyên tử trung tâm ở trong phức anion: Lấy tên của nguyên tử đó thêm đuôi ate và
kèm theo số la mã viết trong ngoặc đơn để chỉ trạng thái oxi hoá. Nếu phức là axit thì thay đuôi ate
bằng đuôi ic Ví dụ:
[Co(NH3)3Cl3]: hexaamminecobalt (III) chloride
[Cu(en)2]SO4: bisethylenediaminecopper (II) sulfate
K2[Zn(OH)4]: potassium tetrahydroxozincate(II)
H[Au(Cl)4]: tetrachloroauric(III) acid
K3[Fe(CN)6]: potassium hexacyanoferrate (III)
Một số phức chất có thể có tên riêng:
Ví dụ potassium trichloroethyleneplatinate (II): K[PtCl3(C2H4)] còn có tên riêng là muối Zeise.
1.3. Đồng phân phức chất
1.3.1. Đồng phân lập thể
* Đồng phân hình học
Đồng phân hình học là những hợp chất có cùng công thức phân tử, nhưng khác nhau ở sự
phân bố các phối tử quanh ion trung tâm trong cầu nội phức.
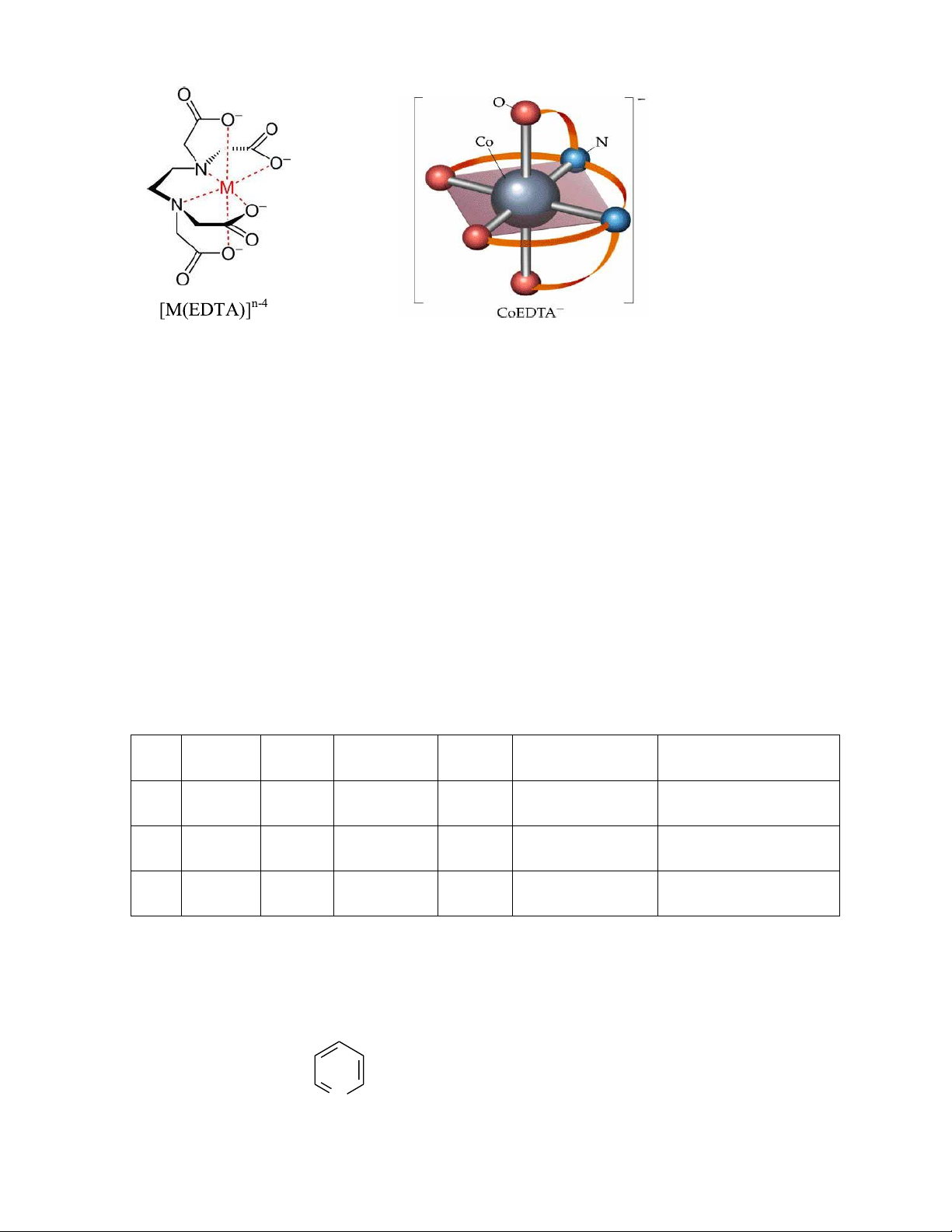
- Phức vuông phẳng
- Dạng [MA2B2]: có 2 đồng phân cis và trans.
1.6. Đồng phân của phức chất
Đồng phân là các chất có cùng công thức nhưng khác nhau về cấu tạo và tính chất. Trong hóa
học phức chất, hiện tượng đồng phân tương đối phổ biến. Có hai loại đồng phân chính là đồng
phân lập thể và đồng phân cấu trúc, mỗi loại này lại chia thành các loại nhỏ hơn (Hình 1.1). Hợp chất phối trí Đồng phân cấu trúc Đồng phân lập thể Đồng phân Đồng phân Đồng phân Đồng phân Đồng phân Đồng phân liên kết phối trí ion hóa solvat hóa hình học quang học
Hình 1.1. Các loại đồng phân của hợp chất phối trí
Đồng phân lập thể là các đồng phân có cùng công thức hóa học và liên kết hóa
học, chỉ khác nhau về sự sắp xếp của các nguyên tử (ion) trong không gian, trong khi đó
đồng phân cấu trúc có liên kết hoàn toàn khác nhau. Dưới đây sẽ giới thiệu một số dạng
đồng phân quan trọng nhất của hợp chất phối trí.
1.4.1. Đồng phân hình học
Đồng phân hình học thường gặp ở phức chất đa ligan. Sự sắp xếp hình học của
ligan ở các vị trí khác nhau dẫn tới hiện tượng đồng phân. Dạng phổ biến nhất trong đồng
phân hình học trong hợp chất phối trí là đồng phân cis và trans của phức chất vuông
phẳng và phức chất bát diện. Đối với trường hợp phức tứ diện, không tồn tại đồng phân
vì mọi vị trí phối trí trong phức tứ diện là tương đương nhau. Phức chất [ML2X2] vuông
phẳng, trong đó L, X là các ligan đơn càng, tồn tại hai dạng đồng phân cis và trans. [ML2X2]
Ví dụ phức chất [PtCl2(NH3)2]
Bài giảng Hoá học Phức chất Trần Ngọc Tuyền - D
ạng [MABCD]: có 3 đồng phân hình h ọ c
Đối với phức chất bát diện đều, 6 vị trí phối trí là tương đương nhau. Do vậy, phức chất có công thức ML ạ đồ 5X chỉ Ph tồ ứ n ct bát di i mộ ệ t n:
ng phân duy nhất. Phức chất có công thức ML4X2 có hai đồng
phân. Ví dụ, với phức chất [CoCl - Dạng [MA
2(NH3)4]+, hai dạng đồng phân cis - trans
4X2] có 2 đồng phân hình học 52
Hình 2.2. Đồng phân hình học của phức [Co(NH3)4Cl2]
- Số lượng đồng phân hình học của phức chất phụ thuộc vào cấu trúc không gian của
nó. Chẳng hạn: phức chất dạng đường thẳng và tứ diện không có đồng phân hình học,
trong khi phức chất dạng vuông phẳng và dạng bát diện có đồng phân hình học.
Dạng [MA3X3] cũng có 2 đồng phân hình học
- Số đồng phân hình học của phức chất phụ thuộc vào số phối tử khác nhau:
● Phức chất vuông phẳng dạng MA2B2 có 2 đồng phân hình học: A A A B M M B B B A cis trans - D ạ ng [MA ● Phứ2B c 2 c X hấ 2 t ] c bá ấ t u hình bát di diện dạng M ện c A
ó 5 đồng phân hình học
2B2C2 có 5 đồng phân hình học A A A B B B C A C M M M C C C B C B A A B A A A B A B M M C C B C - B C * Đ - C ồ á n c g ph đồngân p qu hân a h n ì g h nh ọ
họcc (hay đ có độ ồ t n ang ph khá ân c n gươ hau: n d g)
o các đồng phân hình học có độ phân
cực phân tử khác nhau, dạng trans ít phân cực hơn dạng cis nên độ tan trong các dung
môi của chúng sẽ khác nhau.
- Các đồng phân hình học có tính chất hóa học khác nhau. 4
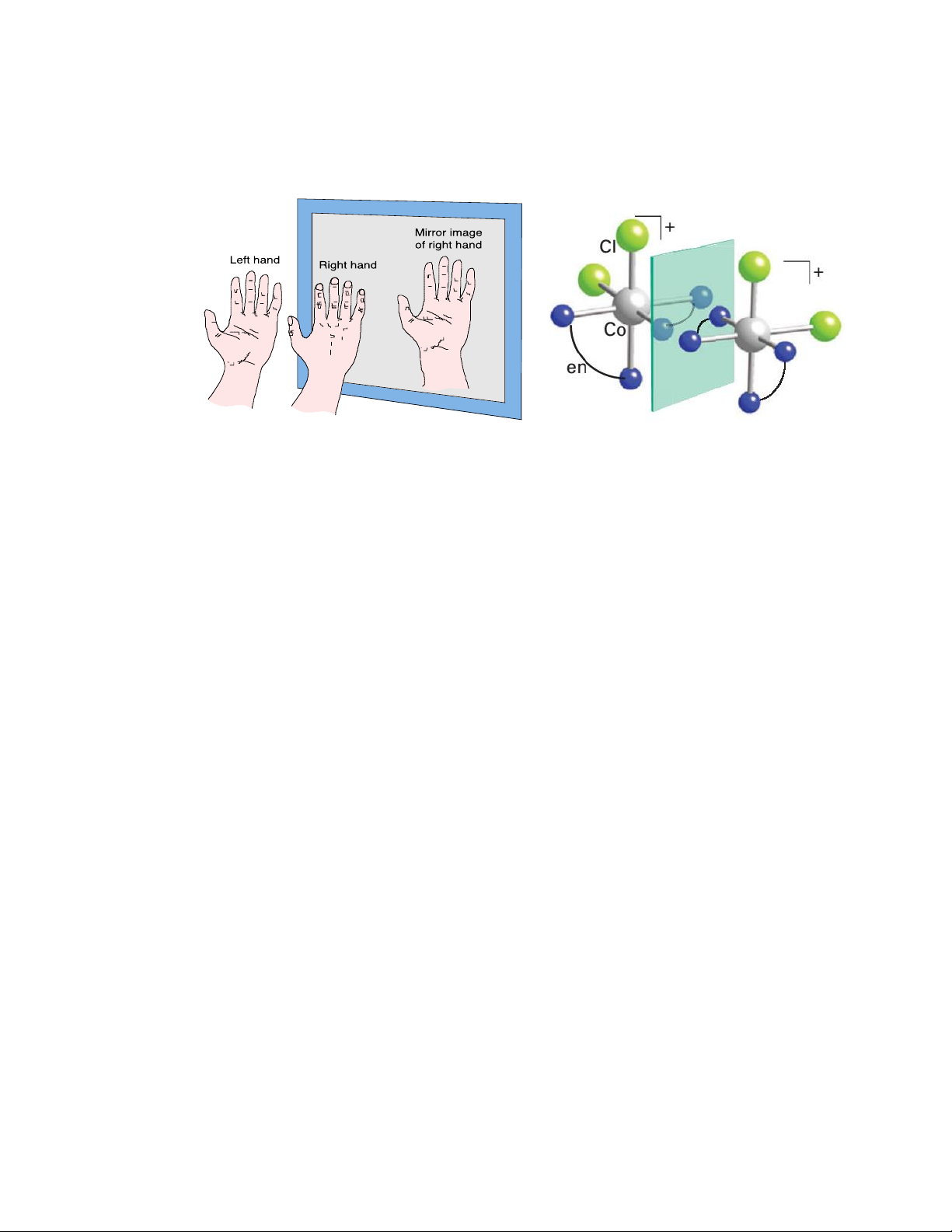
Đồng phân quang học là những hợp chất có cùng thành phần và tính chất vật lí, hóa học,
nhưng khác nhau về khả năng quay mặt phẳng phân cực của ánh sáng. Hợp chất quay mặt phẳng
phân cực của ánh sáng sang phải gọi là hợp chất quay phải (d- dextro), còn hợp chất quay mặt
phẳng phân cực của ánh sáng sang trái được gọi là hợp chất quay trái ( l- levo). cis [Co(en)2Cl2]
1.3.2. Đồng phân cấu trúc
* Đồng phân ion hóa
Những hợp chất có cùng thành phần nhưng tạo thành những ion khác nhau được gọi là đồng phân ion hóa.
Ví dụ: [Co(NH3)5Br]SO4 và [Co(NH3)5SO4]Br
[Co(NH3)4Cl2]NO2 và [Co(NH3)4ClNO2]Cl
* Đồng phân phối trí
Đồng phân phối trí đặc trưng cho những hợp chất mà cả cation và anion đều là phức chất
Ví dụ: [Co(NH3)6][Cr(CN)6] và [Cr(NH3)6][Co(CN)6]
[Pt(NH3)4][PtCl4] và [Pt(NH3)3Cl][PtNH3Cl3]
* Đồng phân liên kết
Đồng phân liên kết: trong phức chất phối tử có thể phối trí với nguyên tử trung tâm qua các nguyên tử khác nhau.
Ví dụ điển hình là đồng phân nitro và nitrito của cobalt (III)
Ví dụ: [Co(NH3)5NO2]2+: màu vàng, không bị axit vô cơ phân hủy, phối tử -NO2 (nitro) liên kết với
Co(III) qua nguyên tử nitơ.
[Co(NH3)5ONO]2+: màu nâu đỏ, bị axit vô cơ phân hủy cho HNO2 thoát ra, kém bền, dễ chuyển
thành đồng phân nitro bền hơn, phối tử -O-N=O (nitrito) liên kết với Co(III) qua nguyên tử oxi.
Một số phối tử thường gặp trong các phức chất có đồng phân liên kết kinh điển nitrit thiocyanat cyanat Nitrite thiocyanate cyanate
Ion nitrit có thể liên kết với các ion kim loại thông qua nguyên tử N (nitro, O N: 2 ) hoặc
* Trùng hợp phối trí
qua nguyên tử O (nitrito, ONO:). Nghiên cứu đầu tiên về đồng phân liên kết là vào những năm 1890s, th C ựcá c ph hiệ ứ n c c b h ởi ấ t c S ông . M th . ứ J c ø th rge ực ns e nghi n v ệ ề m như phức nha ch u, ất nhưng nitro kh và ối ni lư triợ t ng o cphâ ủa n ctử khá oban c nha (III): u. Ví [C d o ụ: [P (NH 2+ Đồ phâ 3 t(N )5 H NO 3 2 ) ]2+ 2Cl và 2], [ P [C t(N o H (N 3 H ) 3 4 ) ][ 5 P O tCl4 NO] ] và . [Pt(N ng H3)3C n l] ni2t[PtC rito l4] (c
hứa liên kết Co-ONO) kém bền
hơn và dễ chuyển thành dạng đồng phân -NO
2 cả trong dung dịch và ở trạng thái rắn dưới tác
dụng của nhiệt hoặc tia tử ngoại.
II. LIÊN KẾT TRONG PHỨC CHẤT 1. Đ 4. ể
4. Đồng phân phối trí
giải thích liên kết trong phức chất, người ta thường sử dụng các thuyết: thuyết liên kết hoá trị; thuyết t Đồ rườ ng ng ti phâ nh th n phối ể t và rí t x huy ảy ế ra t obi khi tan phâ hai chấtn t c ử ó . cỞ đâ ùng y c thà hỉ xé nh t đ phầ ế n n h hợ a p i t c huy hất ết t phố huy i trí ế t l nh iên k ưng ế t t hoá tr hành ị phầvà n thuy trong ếct t ầ rư u ờ ph ng ti ối t nh th rí (cầ ể u .
nội) khác nhau. Đây là loại đồng phân đặc trưng cho những hợp chất
có chứa hai hay nhiều ion phức chất. Loại đồng phân này xảy ra theo hai cách:
2.1. THUYẾT LIÊN KẾT HOÁ TRỊ (THUYẾT VB)
Trao đổi tiểu phân giữa ligan và ion trung hòa điện tích ở cầu ngoại. Ví dụ, hợp chất phối trí [PtNh (N ữ Hng k ó và ệ 3)4 ế Cl t qu 2](N ả Ov 2 ề ) 2 s ự c hình t ion hà Cl- nh li là li ên k gan ết hoá h ion Nọc O 2 do He là i it on ler tru - nLonlon t g hòa đi hu đư n tíc ợ h.c đ T ối v ron ớ g i phân t cấu ử trú hiđro đã c [Pt(N đư H rò và đổ â à phâ 3)4 ợc (N P O a 2 uli )2 ng ph ]Cl2, á va t t i t riển, m của ở i rộ on ng c Cl- ho nh N ữ O2 ng phâ được n tử i nhi c ề ho u nguyê nhau. Đ n t y ử l , trong đó c hai đồng ó phứ n c ph ch ối tất c
rí. ủa kim loại chuyển tiếp họ d. Thuyết liên kết hoá trị là thuyết lượng tử đầu tiên giải thích bản chất c C ủ ó a li th ê ể n k ki ế ể t hoá h m chứ ọc ng trong ph sự khác ức bi c ệ h t ấ c t. ấ
u trúc của hai đồng phân này bằng thí nghiệm đơn
giản, trong đó người ta sử dụng AgNO
2.1.1. Những luận điểm cơ bản của thu
3 để xác định sự có mặt của ion Cl- trong cầu ngoại. Khi yết VB
xử lý hợp chất [Pt(NH3)4(NO2)2]Cl2, thấy xuất hiện kết tủa trắng của AgCl, trong khi với trường
Thuyết liên kết cộng hoá trị (thuyế t VB) được xây dựng dựa trên các luận điểm cơ bản sau: hợp [Pt(NH đã 3)4Cl2](NO2)2, các ion Cl-
bị giữ lại bởi liên kết với nguyên tử trung tâm. - Liên Tr kết ao hó
đổia lh i ọ g c a ngi . ữa Lo n ạ guyê i đồ n ng tử trung phân nà tâm y xả và y ph ra ối khi t ử t trong rong h ph ợ ứ p c c h c ấ h t ất phlà ối li t ên rí k c ế ó t cchộứng a ho hai ái trị on được ph t ứ ạco . bở V i í 2 e d lec ụ tron các có ph spi ức n đố ch i ất song [C okiể (N u H và 3He )6 it ][ ler Co -London. (CN)6], Tr [C ong o(N đó, H3)5 ph CN ối ][ t C ử o cho (NH3 c )(ặp C e N lec )5] tron chưa [C li o ên (NHk ùng hà ấ ề 3 ế ) t 4 và (C o N )2obit ][C a o n t (N rố H3n)g 2 c (C ủa N) 4nguyê ] có c n tử ttrung nh tâm. phần tCá ro c n gngu hợ yê p cnh tử t trun phối g trítâm , chỉ đóng khác vai nha trò u v là axit sự Lewis, c phân bố álic ph gan ốti t ro ử n g(liga cầ n u d) đó phối t ng va rí, dẫ i t n t rò là ới hi c ệ á n ct ba ượ zơ Le ng đồ wis. ng
phân phối trí. Do đồng phân nay liên
quan chủ yếu đến ligan nên người ta còn gọi là đồng phân ligan.
- Trong cầu nội nếu chỉ có 1 loại phối tử, các liên kết giữa nguyên tử trung tâm và các phối tử phải
tương đương nhau về mặt năng lượng cũng như hình dạng. Để giải thích được điều này người ta
Ngoài các loại đồng phân ở trên, còn có một số dạng đồng phân khác như đồng phân ion hóađưa , đ ồ ra ng khá phâi nni h ệ ym d v ratề hsự óa .la
i hóa các obitan của nguyên tử trung tâm. Các obitan sau khi lai hóa sẽ tạo
ra một hệ obitan tương đương nhau, phân bố trong không gian theo một trật tự xác định, qui định
cấu trúc không gian của phức chất. Số obitan tham gia lai hoá tạo thành liên kết bằng số phối trí của nguyên tử trung tâm.
- Điều kiện để xảy ra lai hoá:
- các obitan có mức năng lượng xấp xỉ nhau.
- Các obitan d có số lượng tử chính bằng hoặc thấp hơn một đơn vị so với số lượng tử chính của obitan s và p. 55
Để tạo thành liên kết giữa nguyên tử trung tâm và phối tử, mỗi obitan lai hoá của nguyên tử
trung tâm sẽ tổ hợp với một obitan nào đó của phối tử có mật độ electron lớn cùng nằm trên trục
liên kết. Sự xen phủ này tương tự như sự xen phủ các obitan trong phân tử hidro. Nếu vùng xen phủ
của các obitan này nằm trên trục liên kết thì liên kết đó được gọi là liên kết σ (xich ma). Các obitan
của nguyên tử trung tâm là các obitan lai hoá còn trống, còn phối tử là chất cho cặp electron.
2.1.2. Sự lai hóa các obitan của nguyên tử trung tâm và hình học của phức chất
Một số dạng lai hoá thường gặp và cấu trúc không gian của một số phức chất được trình bày
trong bảng 3.1 và hình 3.1.
Bảng 3.1: Một số dạng lai hoá và cấu trúc không gian của phức chất Số phối trí Dạng lai hoá Dạng hình học Ví dụ 2 sp, đường thẳng [Ag(NH3)2]+, [Ag(CN)2]- 3 sp2 tam giác [Au(PPh3)3]+,[Au(PPh3)2Cl ] sp3; tứ diện [NiCl4]2- ; 4 d3s Tứ diện CrO 2 4 - dsp2 vuông phẳng [PtCl4]2-; [Ni(CN)4]2- 5 dsp3 lưỡng chóp tam giác [Fe(CO)5], [CuCl5]3- sp2d2 chóp đáy vuông [Co(CN)5]3-; [MnCl5]2- d2sp3 hoặc sp3d2 bát diện [Co(NH3)6]3+;[Fe(CN)6]3- 6 spd4 Lăng trụ tam giác Re[S2C2(C6H5)2]3 sp3d3 Lưỡng tháp ngũ giác IF7 7 sp3d2f
Chóp lăng trụ tam giác [NbF7]2-
2.1.3. Áp dụng thuyết VB giải thích sự tạo thành liên kết trong phức chất
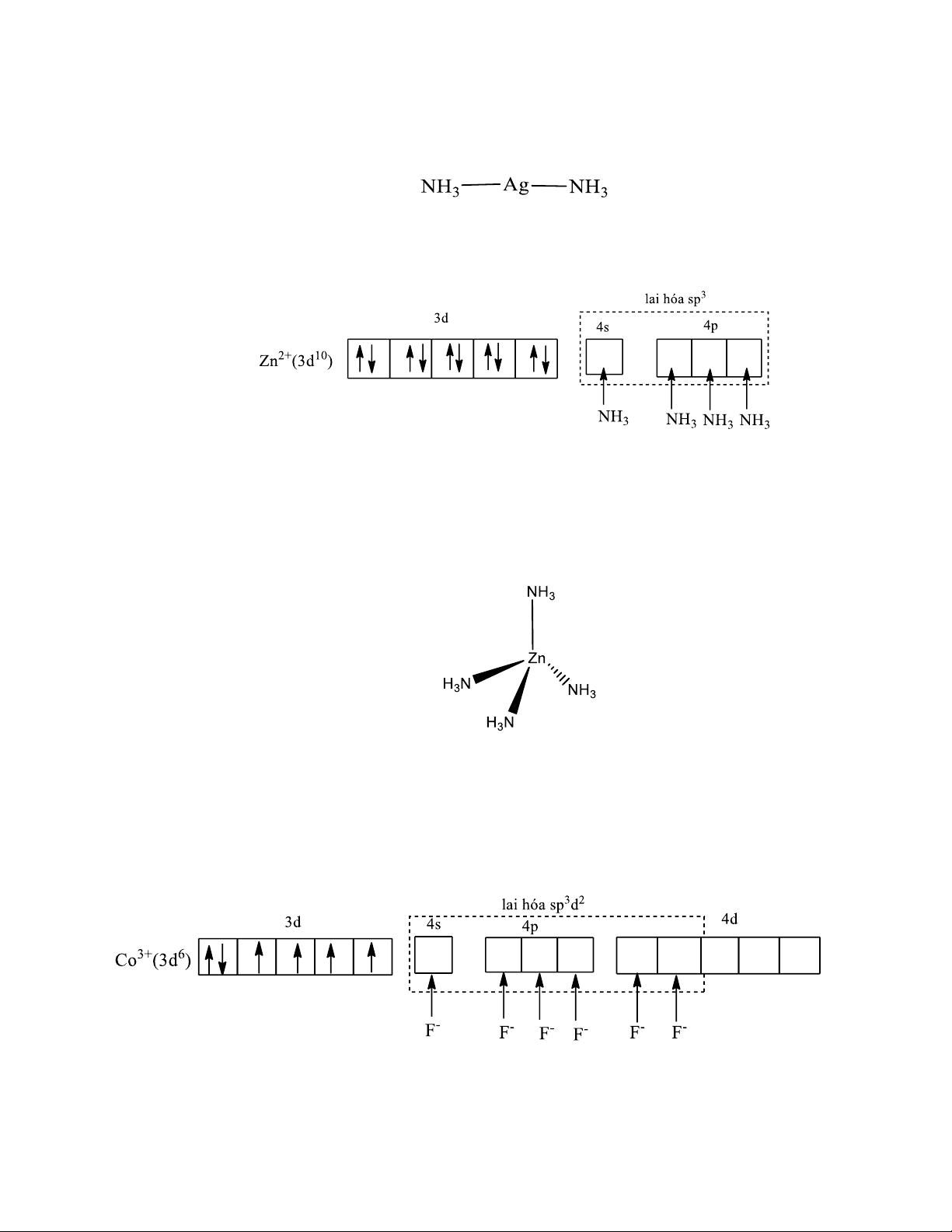
Ví dụ 1: Xét cation phức [Ag(NH3)2]+ Ag+: [Xe]4d10
Liên kết trong phức chất [Ag(NH3)2]+ được hình thành bằng các liên kết cho nhận giữa cặp
electron tự do của NH3 và các obitan lai hoá sp trống của ion Ag+.
Hai obitan lai hoá sp nằm trên một đường thẳng nên phức chất có dạng đường thẳng.
Ví dụ 2: Xét cation phức [Zn(NH3)4]2+
30Zn: [Ar]3d104s2 Zn2+: [Ar]3d10
Liên kết trong ion phức chất [Zn(NH3)4]2+ được hình thành bằng các liên kết cho nhận giữa
cặp electron tự do của NH3 và các obitan lai hoá sp3 trống của ion Zn2+.
Các obitan lai hoá sp3 hướng về 4 đỉnh của hình tứ diện nên phức chất có cấu trúc tứ diện.
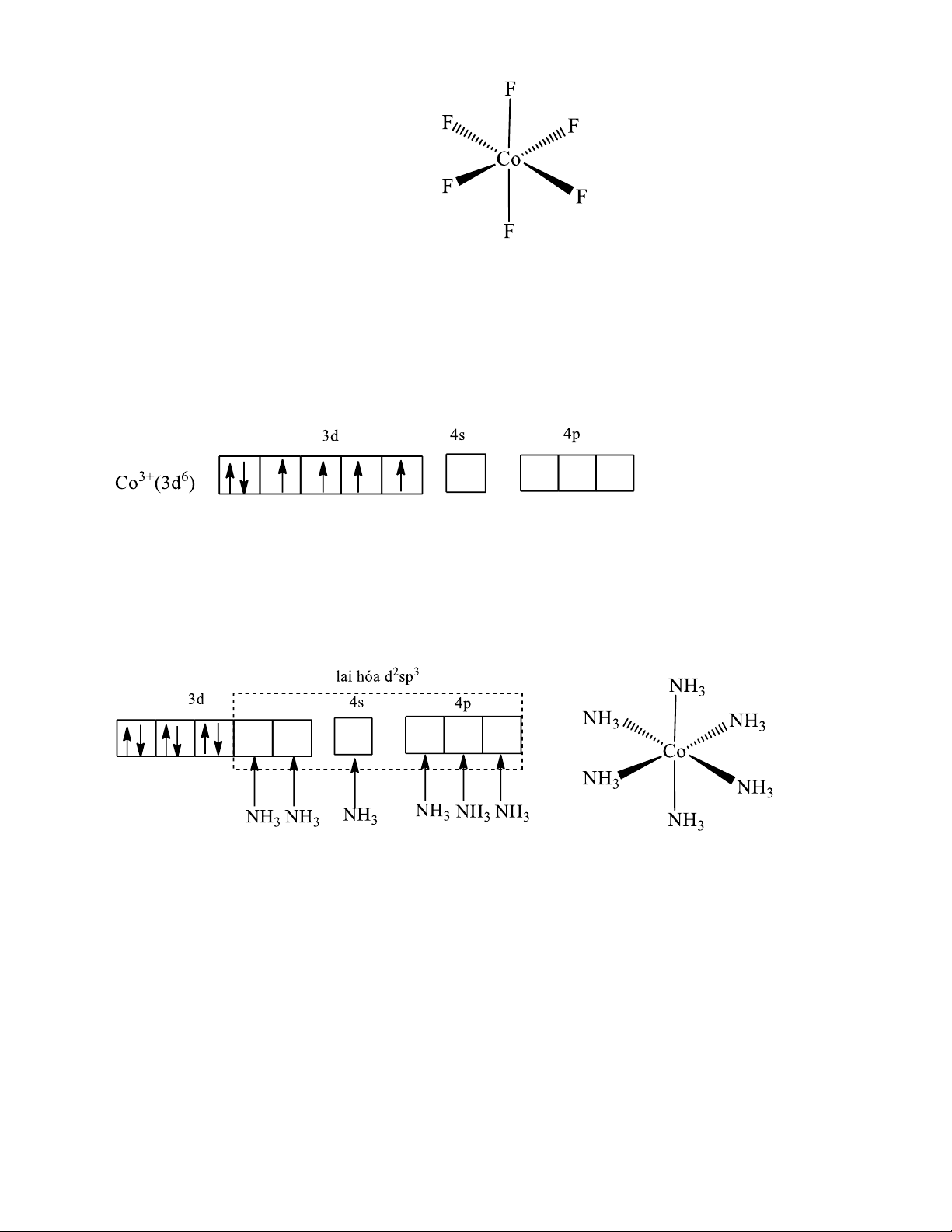
Ví dụ 3: Xét anion phức [CoF6]3-:
27Co: [Ar]3d74s2 Co3+ : [Ar]3d6
Liên kết trong ion phức chất [CoF6]3- được hình thành bằng các liên kết cho nhận giữa cặp
electron tự do của ion F- và các obitan lai hoá sp3d2 trống của ion Co3+. Các obitan lai hoá sp3d2
hướng về 6 đỉnh của hình bát diện nên phức chất có cấu trúc bát diện đều
- Nhận xét: Trong anion phức [CoF6]3- còn 4 electron độc thân, phức chất có tính thuận từ,
∑spin = 2, ion phức [CoF6]3- được gọi là phức spin cao.
Ví dụ 4: Xét cation phức [Co(NH3)6]3+:
27Co: [Ar]3d74s2 Co3+ : [Ar]3d6
Ở trạng thái cơ bản các electron được phân bố vào các obitan như sau:
Khác với anion phức [CoF6]3-, trong ion phức [Co(NH3)6]3+, dưới tác dụng của phối tử, các
electron của ion Co3+ ghép đôi. Liên kết trong ion phức chất [Co(NH3)6]3+ được hình thành bằng các
liên kết cho nhận giữa cặp electron tự do của NH3 và các obitan lai hoá d2sp3 trống của ion Co3+.
Các obitan lai hoá d2sp3 hướng về 6 đỉnh của hình bát diện nên phức chất có cấu trúc bát diện đều.
Như vậy, trong hai ion phức chất [CoF6]3- và [Co(NH3)6]3+ cùng có ion trung tâm là Co3+
nhưng lại có 2 dạng lai hoá khác nhau: trong ion phức [CoF6]3-, ion Co3+ lai hoá sp3d2 (do sử dụng
obitan 4d lớp ngoài tham gia lai hoá nên gọi là lai hoá ngoài) còn trong ion phức [Co(NH3)6]3+ ion
Co3+ lai hoá d2sp3 (do sử dụng obitan 3d lớp trong tham gia lai hoá nên gọi là lai hoá trong).
Anion phức [CoF6]3- còn 4 electron độc thân, ∑spin = 2, phức [CoF6]3- được gọi là phức spin
cao, phức chất có tính thuận từ.
Cation phức [Co(NH3)6]3+ không còn electron độc thân, ∑spin = 0, phức [Co(NH3)6]3+ được
gọi là phức spin thấp và là phức nghịch từ.
2.1.4. Từ tính của phức chất
Một trong những tính chất quan trọng của phức chất, đó là từ tính. Người ta đã biết đến phức
chất có tính nghịch từ và phức chất có tính thuận từ. Chất nghịch từ là chất mà tất cả các electron
đều đã ghép đôi, chúng không bị hút bởi từ trường ngoài. Các chất chứa electron độc thân thì thuận
từ và bị hút bởi từ trường.
Momen từ phụ thuộc vào số lượng tử spin toàn phần S và số lượng tử obitan toàn phần L theo biểu thức sau: 1
𝜇𝑆+𝐿 = 𝑔√𝑆(𝑆 + 1) + . 𝐿(𝐿 + 1) 4
trong đó: μ = momen từ, g = hệ số từ (K), S = số lượng tử spin, L = số lượng tử obitan
Mặc dù việc xác định giá trị momen từ đòi hỏi phải biết mômen obitan, nhưng trong hầu hết
các phức chất của kim loại thuộc dãy chuyển tiếp dãy 3d, sự đóng góp của mômen obitan không
đáng kể, do đó có thể coi giá trị momen từ của một phức chất chính bằng giá trị momen từ spin .
Lúc đó biểu thức tính momen từ spin, μs là: 𝜇𝑠 = 𝑔. √𝑆(𝑆 + 1)
Trong hệ thống đơn vị Bohr, hệ số từ tính g là 2.00023, và thường được làm tròn đến 2. Phương
trình μs trở thành: 𝜇𝑠 = 2√𝑆(𝑆 + 1) = √4𝑆(𝑆 + 1)
Vì S = ½. n, với n là số electron độc thân, phương trình này có thể viết thành: 𝜇 = √𝑛(𝑛 + 2)
Đây là phương trình được sử dụng nhiều nhất. Do đó nếu biết giá trị momen từ của một
phức chất của kim loại chuyển tiếp dãy 3d, người ta có thể dự đoán số electron độc thân trong phức
chất. Giá trị momen từ thực nghiệm có thể sai khác so với việc tính theo phương trình trên, tuy
nhiên sai số là không quá lớn, không ảnh hưởng đến việc dự đoán số lượng electron độc thân trong
phức chất. Với các kim loại nặng và kim loại thuộc nhóm lantan, đóng góp từ mômen obitan lớn
hơn và không thể bỏ qua được.
Sự phụ thuộc của μS và μS+L vào n, và một số giá trị mômen đo được từ thực nghiệm được trình bày trong bảng 3.2:
Bảng 3.2: Giá trị momen từ lý thuyết và thực nghiệm của một số ion kim loại Ion n S L μs μ S+L μ thực nghiệm V4+ 1 ½ 2 1,73 3,00 1,7-1,8 Cu2+ 1 ½ 2 1,73 3,00 1,7-2,2 V3+ 2 1 3 2,83 4,47 2,6-2,8 Ni2+ 2 1 3 2,83 4,47 2,8-4,0 Cr3+ 3 3/2 3 3,87 5,20 ≈3,8 Co2+ 3 3/2 3 3,87 5,20 4,1-5,2 Fe2+ 4 2 2 4,9 5,48 5,1-5,5 Co3+ 4 2 2 4,9 5,48 ≈5,4 Mn2+ 5 5/2 0 5,92 5,92 ≈5,9 Fe3+ 5 5/2 0 5,92 5,92 ≈5,8
Kết quả thu được từ thực nghiệm khá phù hợp với kết quả giải thích sự tạo thành liên kết
trong phức chất theo thuyết VB.
Ta có thể xét một số trường hợp :
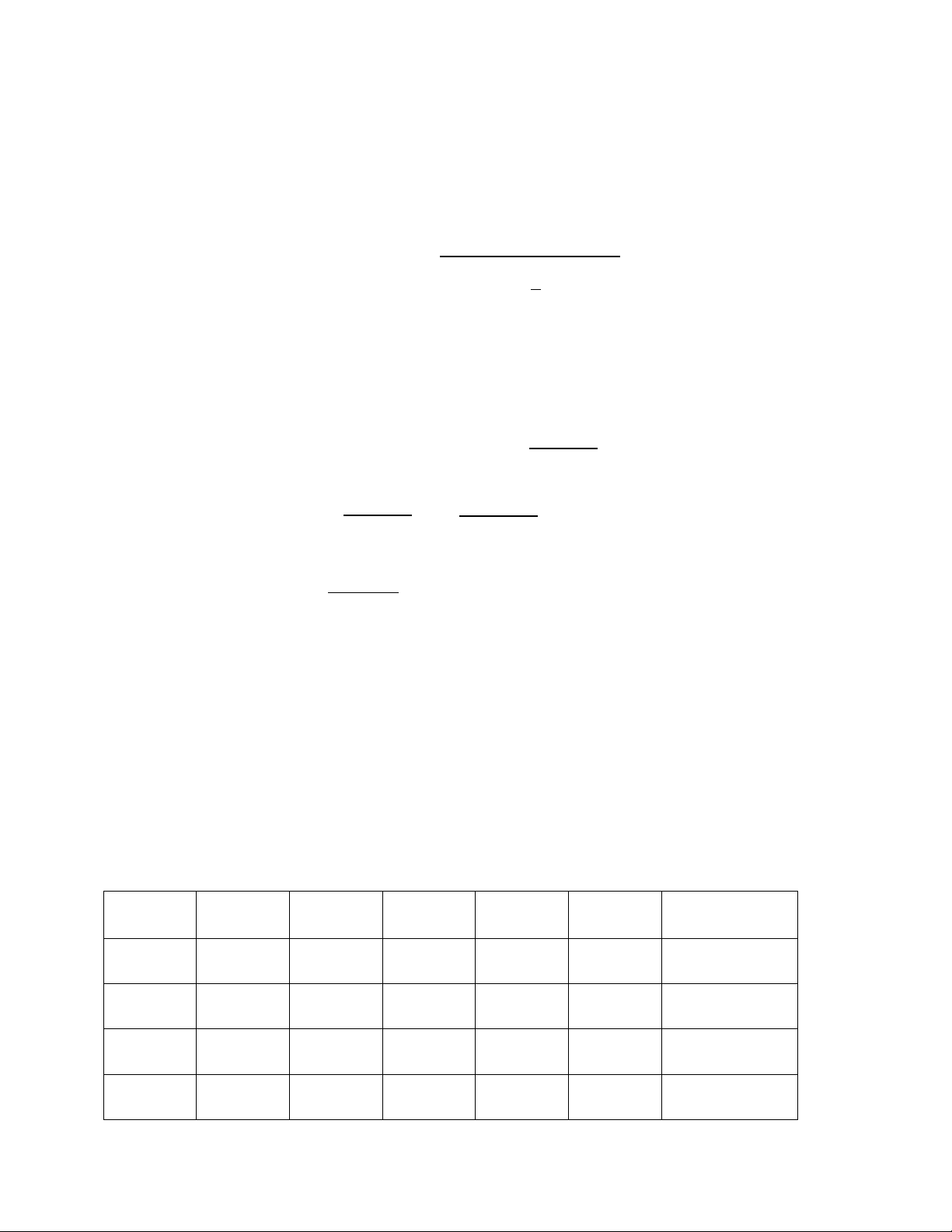
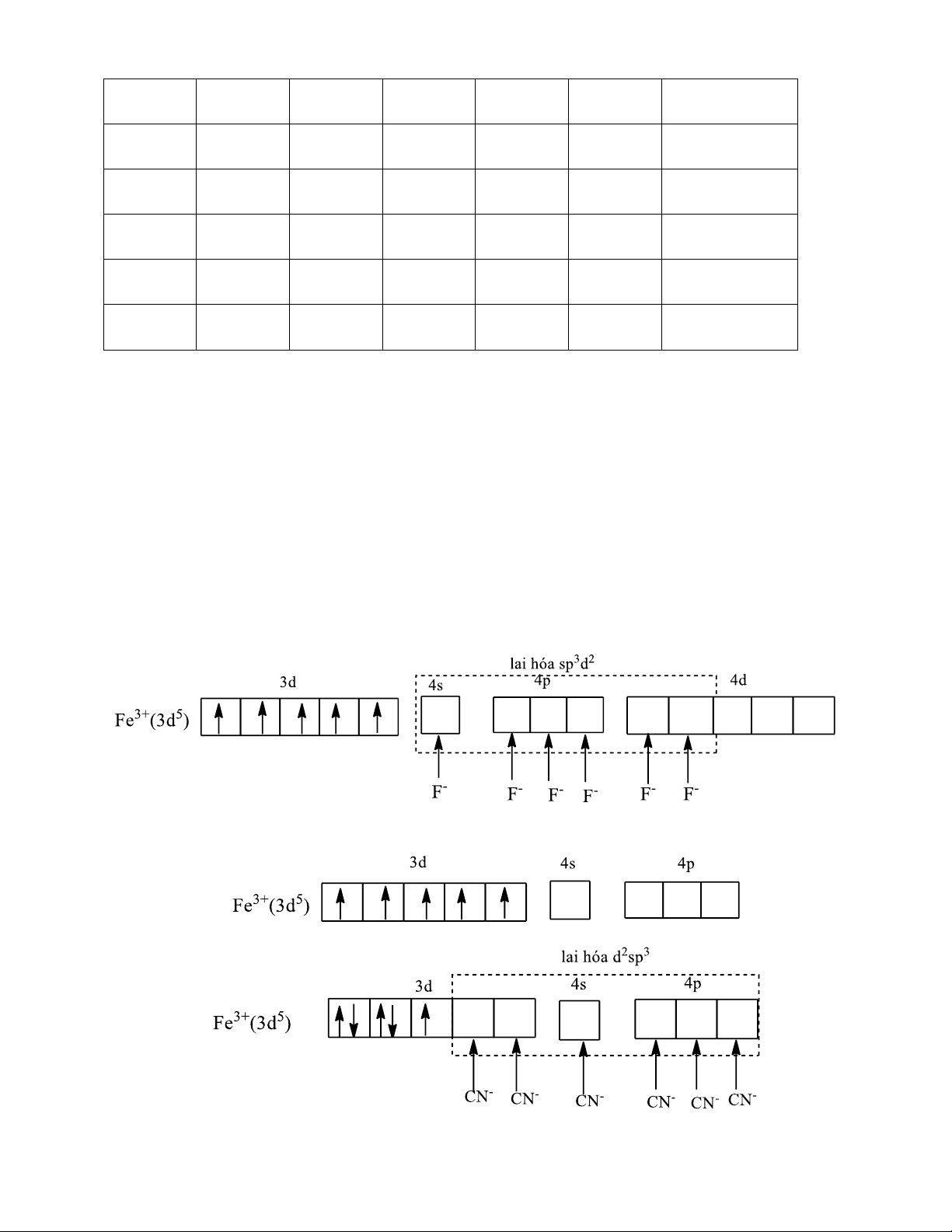
Thực nghiệm đã xác định được giá trị momen từ của ion phức [FeF6]3- và [Fe(CN)6]3- lần
lượt là 5,9 và 1,7μB. Thuyết VB đã giải thích được sự khác nhau về giá trị momen từ của hai phức chất trên.
Cấu hình electron của nguyên tử và ion 26Fe: [Ar]3d64s2 Fe3+ : [Ar]3d5
Đối với ion phức chất [FeF6]3-, liên kết trong phức chất được hình thành như sau:
Đối với ion phức chất [Fe(CN)6]3-, liên kết trong phức chất được hình thành như sau:
Dạng hình học của cả hai ion phức chất trên đều là bát diện
Trong phức chất [FeF6]3- ion Fe3+ ở trang thái lai hoá sp3d2 (lai hoá ngoài), anion phức chất
còn 5 electron độc thân, 𝜇 = √5(5 + 2) ≈ 5,9μ𝐵. Còn trong phức chất [Fe(CN)6]3-, ion Fe3+ ở
trang thái lai hoá d2sp3 (lai hoá trong), trong phức chất còn 1 electron độc thân 𝜇 = √1(1 + 2) ≈ 1,73μ𝐵
Như vậy với cùng một ion kim loại trung tâm nhưng do tương tác của chúng với các phối tử
khác nhau mà hình thành các dạng lai hoá khác nhau (lai hoá trong d2sp3 và lai hoá ngoài sp3d2 như
trong phức chất [Fe(CN)6]3- và [FeF6]3-. Phức chất có lai hoá ngoài có số electron độc thân lớn và là
phức spin cao, còn phức chất lai hoá trong có số eléctron độc thân nhỏ và là phức spin thấp. Ta có
thể xét thêm một số ví dụ khác:
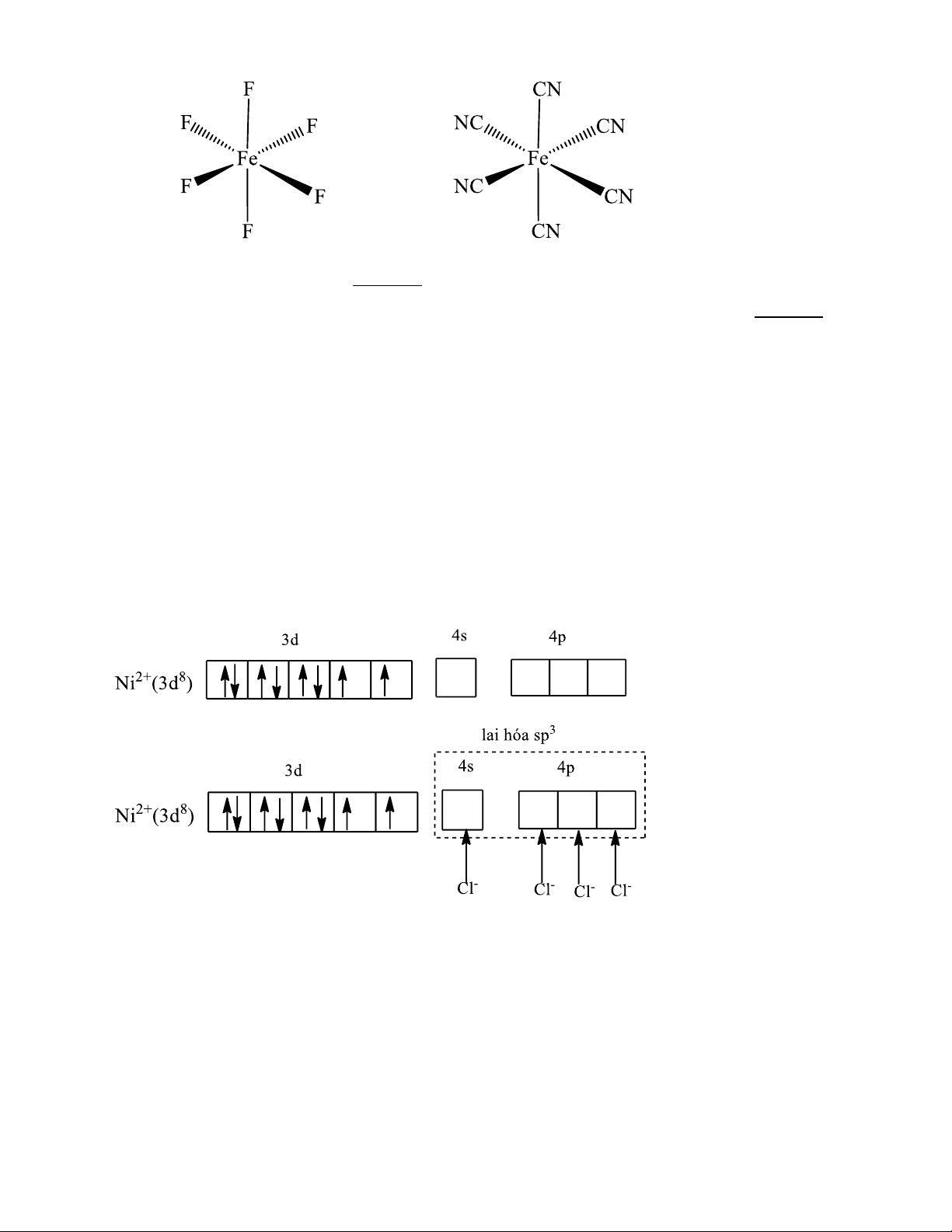
Ví dụ 5: Xét phức [NiCl4]2-
28Ni: [Ar]3d84s2 Ni2+ : [Ar]3d8
Ở trạng thái cơ bản các electron được phân bố vào các obitan như sau:
Liên kết trong ion phức chất [NiCl4]2- được hình thành bằng các liên kết cho nhận giữa cặp
electron tự do của Cl- và các obitan lai hoá sp3 trống của ion Ni2+. Các obitan lai hoá sp3 hướng về 4
đỉnh của hình tứ diện nên phức chất có cấu trúc tứ diện. Anion phức [NiCl4]2- còn 2 electron độc
thân, ∑spin = 1, như vậy phức [NiCl4]2-gọi là phức spin cao, có tính thuận từ.
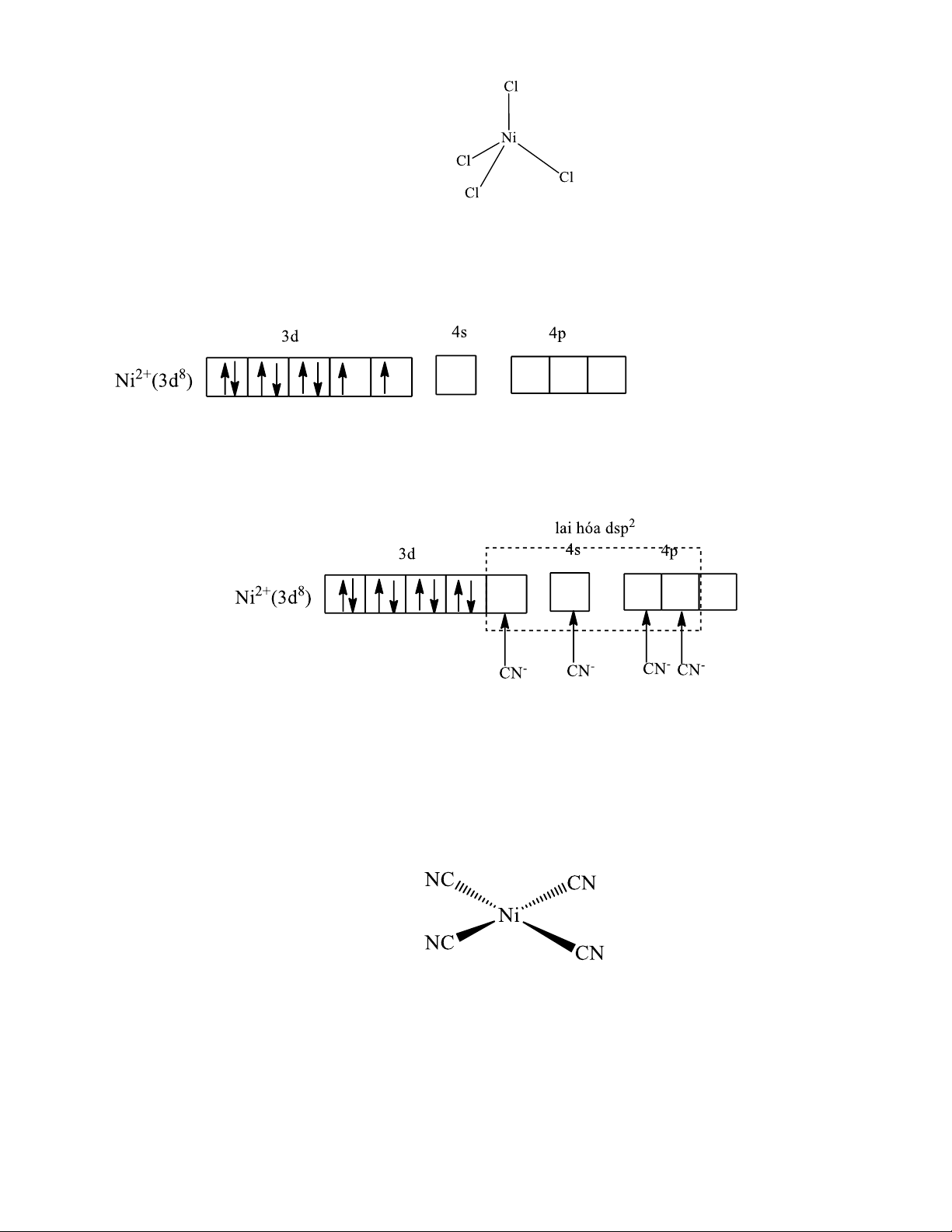
Ví dụ 6: Xét phức [NiCN4]2-:
28Ni: [Ar]3d84s2 Ni2+ : [Ar]3d8
Ở trạng thái cơ bản các electron được phân bố vào các obitan như sau:
- Vì ion CN- tương tác mạnh với nhân trung tâm nên các electron của ion Ni2+ sẽ ghép đôi,
ion trung tâm ở trạng thái lai hoá dsp2.
Liên kết trong ion phức chất [Ni(CN)4]2- được hình thành bằng các liên kết cho nhận giữa
cặp electron tự do của CN- và các obitan lai hoá dsp2 trống của ion Ni2+. Các obitan lai hoá dsp2
hướng về 4 đỉnh của hình vuông nên phức chất có cấu trúc vuông phẳng. Anion phức [Ni(CN)4]2-
không còn electron độc thân, ∑spin =0 , vì vậy ion phức [Ni(CN)4]2- gọi là phức spin thấp và là phức chất ngịch từ.
Như vậy hai phức chất [NiCl4]2- và [Ni(CN)4]2- có cùng ion trung tâm là Ni(II) nhưng lại có
hai dạng lai hoá khác nhau là lai hoá sp3 và dsp2, dẫn đến hai phức chất này có các dạng hình học, từ tính khác nhau.
2.2.5. Ưu, nhược điểm của thuyết VB Ưu điểm:
- Rõ ràng, dễ hiểu, cho phép giải thích được cấu hình không gian của các phức chất trên cơ sở lai hoá các obitan.
- Giải thích được tính chất cho nhận của các liên kết nguyên tử trung tâm -ligand trong phức chất.
-Giải thích được mối quan hệ cấu trúc điện tử của phức chất đến tính chất từ tính của chúng
Nhược điểm:
-Phương pháp chỉ hạn chế ở giải thích định tính.
-Không cho phép giải thích và tiên đoán về phổ hấp thụ của các phức chất
-Không giải thích và tiên đoán các tính chất từ của phức chất (cộng hưởng thuận từ, sự bất đẳng
hướng của độ cảm từ..)
-Không giải thích được năng lượng tương đối của của liên kết đối với các cấu trúc khác nhau và
không tính đến việc tách năng lượng của các obitan ở phân lớp d. 2.2.
THUYẾT TRƯỜNG TINH THỂ
Thuyết trường tinh thể do hai nhà vật lý Bethe và Vleck đề ra năm 1933 để giải thích tương
tác giữa các ion trong tinh thể nên mới có tên gọi đó. Mãi đến những năm 50 của thế kỷ XX, thuyết
này mới được áp dụng để nghiên cứu phức chất.
2.2.1. Những luận điểm cơ bản của thuyết trường tinh thể
- Liên kết giữa nguyên tử trung tâm và các phối tử trong phức chất không phải là liên kết cộng hoá
trị kiểu cho nhận mà là tương tác tĩnh điện giữa ion trung tâm mang điện tích dương và các phối tử mang điện tích âm.
- Cấu trúc electron của ion trung tâm được xét một cách chi tiết, không chú ý đến kích thước và cấu
tạo của các phối tử, các phối tử chỉ được coi là các điện tích điểm hoặc các lưỡng cực được sắp xếp
xung quanh ion trung tâm sao cho lực đẩy giữa chúng là nhỏ nhất và tạo thành một trường đối xứng
nhất định. Nếu phức chất có 6 phối tử thì chúng sẽ sắp xếp ở các đỉnh của hình bát diện tạo nên
trường bát diện. Nếu phức chất có 4 phối tử thì chúng sẽ sắp xếp ở các đỉnh của hình tứ diện tạo nên trường tứ diện.
- Thuyết trường tinh thể xem xét vị trí của các obitan d của nguyên tử trung tâm và xét lực đẩy
electron trên những obitan đó bởi các phối tử.
2.2.2. Sự tách mức năng lượng của các obital d trong các trường đối xứng
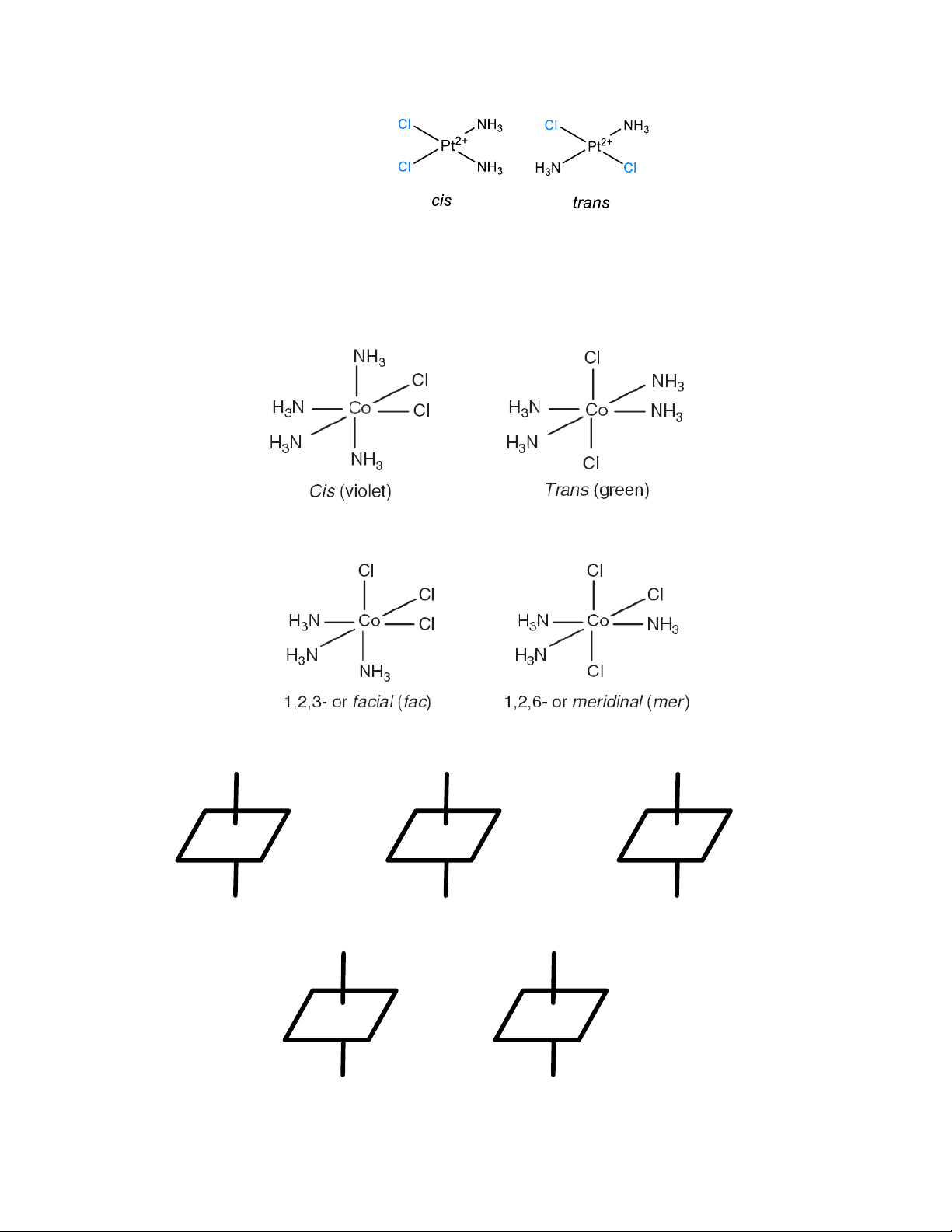
2.2.2.1. Trường bát diện
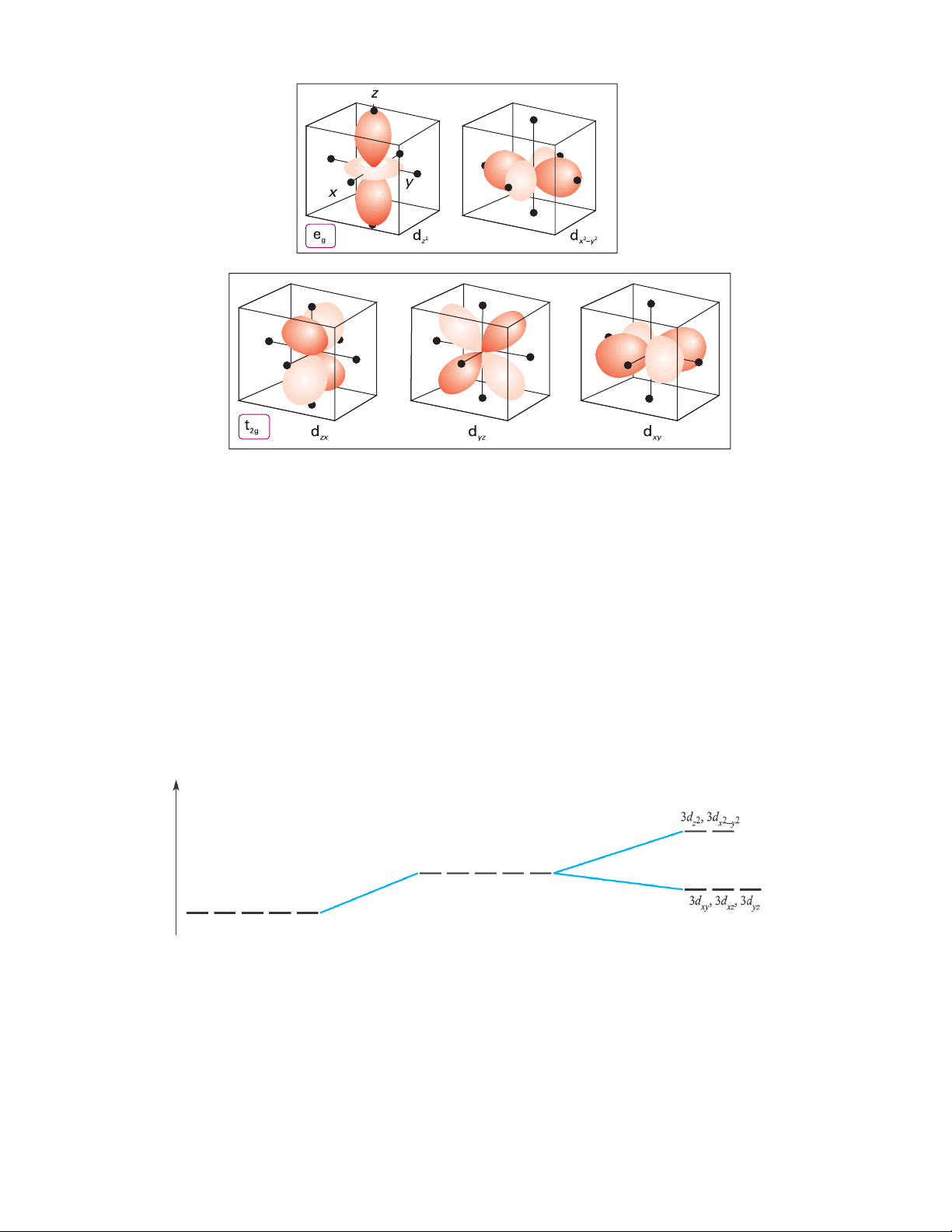
Trong nguyên tử, cũng như trong ion tự do của kim loại chuyển tiếp, phân lớp d có 5 obitan
dxy, dxz, dyz, dx2-y2, dz2 có mức năng lượng bằng nhau (suy biến bậc 5).
Nếu phối tử tạo quanh ion kim loại một trường đối xứng cầu (điện tích phân bố đồng đều
trên toàn khối cầu) thì sự suy biến về năng lượng vẫn không đổi, năng lượng của các obitan tăng lên
do bị đẩy nhưng chúng vẫn có năng lượng như nhau.
Hình 3.2: Định hướng trong không gian của 5 obitan d và các phối tử trong phức chất bát diện
Trong trường bát diện, hai obitan dx2-y2 và dz2 có mật độ electron trên các trục lớn, các
nhánh hướng trực tiếp vào các phối tử nên chịu lực đẩy từ các phối tử mạnh hơn và năng lượng của
chúng tăng lên mạnh hơn. Ba obitan dxy, dxz và dyz có mật độ elctron trên các đường phân giác lớn
và trên các trục nhỏ hơn, không hướng trực tiếp vào các phối tử nên chịu lực đẩy từ các phối tử yếu
hơn và năng lượng của chúng tăng ít hơn (hình 3.2). Như vậy dưới tác dụng của trường phối tử 5
obitan d bị tách thành hai mức năng lượng, mức thứ nhất gồm 2 obitan dx2-y2 và dz2 có năng lượng
cao được gọi là mức Eg (trạng thái e là trạng thái suy biến bậc 2, g là ký hiệu hàm chẵn gerade),
mức thứ hai gồm 3 obitan 3 obitan dxy, dxz và dyz có năng lượng thấp hơn được gọi là mức T2g (
trạng thái T là trạng thái suy biến bậc 3). Giữa hai mức này chênh lệch nhau một khoảng năng
lượng ∆0 được gọi là năng lượng tách (hình 3.3)
Ion tự do Trường đối xứng cầu Trường bát diện
Hình 3.3: Sự tách các mức năng lượng của obitan d trong phức bát diện
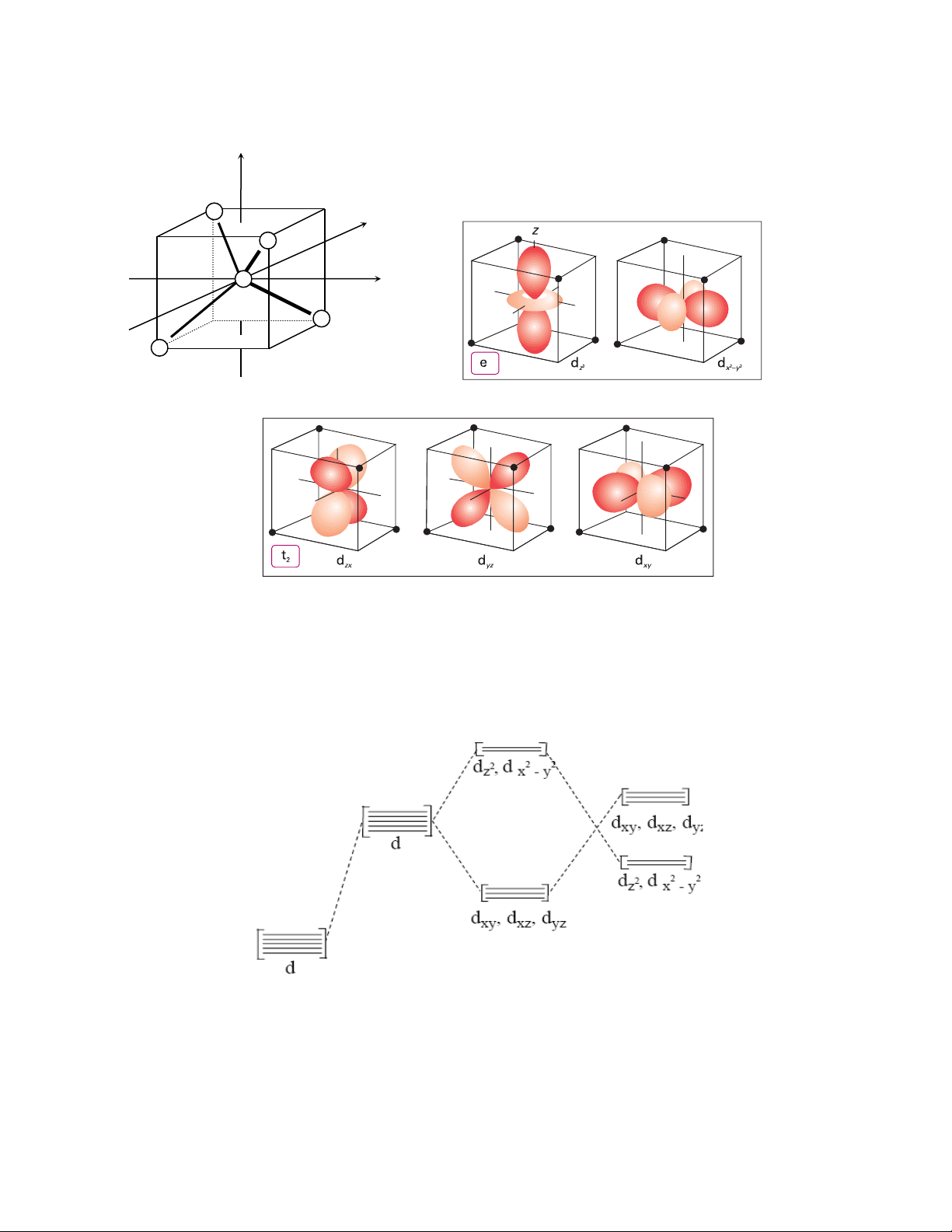
3.2.2.2. Trường tứ diện
Trong các phức tứ diện, các phối tử nằm trên các đỉnh của hình tứ diện thì sự tách mức năng
lượng của các obitan d sẽ xảy ra ngược lại, vì lúc này các phối tử không nằm trên các trục tọa độ mà
nằm giữa khoảng không gian giữa các trục. Lúc này các obitan dxy, dyz, dzx (T2g) lại chịu tương tác
của các phối tử mạnh hơn do đó chúng có năng lượng cao hơn, các obitan dx2-y2 và dz2 (Eg) có mức
năng lượng thấp hơn (hình 3.4). z L y L x M L L
Hình 3.4: Định hướng trong không gian của 5 obitan d và các phối tử trong phức chất tứ diện
Sự tách mức năng lượng các obitan d trong trường bát diện và tứ diện được trình bày trên hình 3.5 .
Hình 3.5: Sự tách mức năng lượng trong trường bát diện và tứ diện
3. 2.3. Các yếu tố ảnh hưởng đến thông số tách
Thông số tách năng lượng là hiệu của obitan d “cao” và d “thấp”, trong trường hợp phức
chất bát diện có một electron d, thông số tách là khoảng cách giữa các mức năng lượng T2g và Eg.
Khi số electron d nhiều hơn 1, các trạng thái của phức chất có thay đổi.
Bằng thực nghiệm có thể xác định được giá trị o khi nghiên cứu phổ hấp thụ electron của các phức
chất hoặc từ các đại lượng nhiệt động. Do đó bên cạnh việc biểu diễn năng lượng tách bằng đơn vị
năng lượng J (hoặc kJ) người ta còn có thể đồng nhất với số sóng 𝜈 và biểu diễn bằng đơn vị cm-1
(đơn vị đo thường gặp trong phép đo phổ)
Thông số tách phụ thuộc vào cấu hình của phức chất, bản chất của ion trung tâm và bản chất của phối tử.
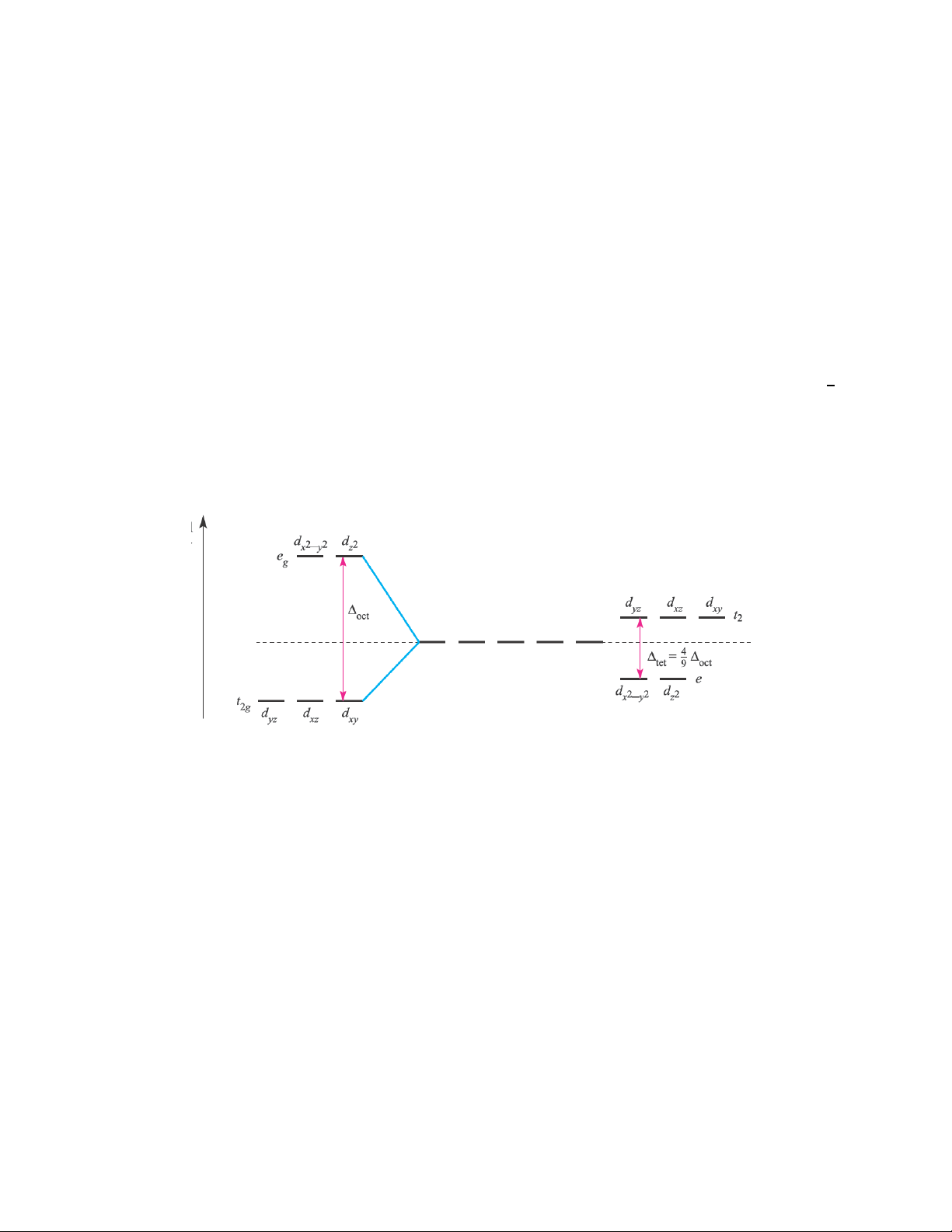
- Ảnh hưởng của dạng hình học phức chất: phức chất bát diện có thông số tách lớn hơn phức chất 4
tứ diện. Trong điều kiện cùng phối tử, cùng ion trung tâm, phức chất tứ diện có thông số tách = 9
thông số tách trong trường bát diện (t = 4/9 o), xem hình 3.7.
Ví dụ t của phức chất [Co(NH3)4]2+ là 5900cm-1, còn o của [Co(NH3)6]2+ là 10200cm-1.
Hình 3.7: So sánh năng lượng tách trong phức chất bát diện và phức chất tứ diện
- Ảnh hưởng của nguyên tố trung tâm: Nếu nguyên tố trung tâm có điện tích dương càng lớn thì,
thì nó càng hút mạnh các phối tử về phía nó và các electron d càng bị đẩy mạnh, làm cho năng
lượng tách ∆0 có giá trị lớn.
Ví dụ: ∆o của phức chất [Cr(H2O)6]2+ và [Fe(CN)6]4- nhỏ hơn của ∆o của các ion phức [Cr(H2O)6]3+ và [Fe(CN)6]3-
- Nguyên tố trung tâm ở chu kỳ lớn, có bán kính lớn, điện tích hạt nhân lớn, tạo ra xung quanh mình
một điện trường mạnh hơn (tác dụng phân cực mạnh) sẽ tạo điều kiện cho các phối tử tiến lại gần
gây tách càng mạnh dẫn đến năng lượng tách ∆ có giá trị lớn. Vì vậy các phức chất của các ion
trung tâm thuộc các dãy kim loại chuyển tiếp thứ 2 và thứ 3 luôn có năng lượng tách lớn hơn so với
dãy kim loại chuyển tiếp thứ nhất, ví dụ bảng 3.3.
Bảng 3.3: Giá trị thông số tách ∆o (cm-1) của một số ion phức chất của kim loại chuyển tiếp dãy thứ
nhất, dãy thứ hai và dãy thứ ba [Fe(H2O)6]3+ [Fe(Ox)3]3- [Co(H2O)6]3+ [Co(NH3)6]3+ 14000 14140 20800 22900 [Ru(H2O)6]3+ [Ru(Ox)3]3- [Rh(H2O)6]3+ [Ru(NH3)6]3+ 28600 28700 27200 34000 [Ir(NH3)6]3+ 41200
- Cấu trúc electron của ion trung tâm: Số electron ở mức T2g càng lớn thì lực đẩy giữa chúng càng
mạnh, năng lượng của mức T2g càng cao, do đó khoảng cách giữa mức T2g và Eg càng giảm, ∆o
giảm. Càng có nhiều electron ở mức cao thì năng lượng của mức này lại càng cao, ∆o càng lớn. Do
đó, đối với phức bát diện thì ∆o giảm theo thứ tự các ion d1, d2, d3 và tăng mạnh đối với ion d4.
- Ảnh hưởng của phối tử
+ Nếu phối tử có điện tích âm càng lớn và có bán kính càng nhỏ thì càng dễ dàng tiến lại gần ion
trung tâm và các electron d của ion trung tâm càng bị đẩy mạnh, làm cho năng lượng tách ∆0 có giá trị lớn.
Ví dụ: ∆0( F-) > ∆0( Cl-) > ∆0( Br-) > ∆0( I-)
- Phối tử có một cặp electron tự do, ví dụ NH3 sẽ đưa cặp electron của mình đến gần các obitan của
ion trung tâm hơn so với các phối tử có hai hay nhiều cặp electron tự do ví dụ H2O hoặc các ion
halogenua. Vì vậy các phức của NH3 có giá trị ∆o lớn hơn H2O và các ion halogenua
Bằng thực nghiệm, nghiên cứu phổ hấp thụ electron của các phức chất, người ta đã sắp xếp
các phối tử thành một dãy theo sự tăng dần của ∆o và gọi là dãy phổ hoá học (do được xác định từ phương pháp phổ): I- < Br- < Cl-2- -
2O4 < H2O < NCS- < Py ≈ NH3 < en < phen Trong dãy trên phối tử đứng sau gây ra trường mạnh hơn phối tử đứng trước. Thông thường các
phối tử đứng trước NH3 gây ra trường yếu, đứng sau NH3 gây ra trường mạnh.
Một số giá trị năng lượng tách của các phức chất ion kim loại chuyển tiếp dãy 3d được trình bày trong bảng 3.4:
Bảng 3.4: Giá trị thông số tách ∆o (cm-1) của một số ion phức chất kim loại chuyển tiếp dãy 3d Ion TT Cấu hình Phối tử F- H2O NH3 CN- Ti(III) d1 17500 20300 23400


