lOMoARcPSD|40651217
Bộ Công Thương
Trường Đại Học Công Nghiệp Thành Phố Hồ Chí Minh
🙟🙟🙟🙟🙟
BÁO CÁO THỰC HÀNH
MÔN: Hóa sinh học
Giảng viên: Lưu Thảo Nguyên Lớp:
DHTP18BTT
Mã học phần: 422000373102
Nhóm thực hành:1
Tổ 4
Dương Mạnh Duyệt : 22698641
Nguyễn Đoàn Thiên Ân : 22707421
Đào Trung Hậu 22724181
Contents

lOMoARcPSD|40651217
Bài 3 PHÂN TÁCH VÀ NHẬN DẠNG CASEIN...........................................................3
I. Lý thuyết.......................................................................................................................3
Bài 4 xác định nitơ tổng số theo phương pháp KJELDAHL............................................7
(xác định hàm lượng protein thô).....................................................................................7
I.quy trình thí nghiệm:.....................................................................................................7
BÀI 5: KHẢO SÁT HOẠT TÍNH ENZYM PROTEASE.............................................12
I. Lý thuyết....................................................................................................................12
BÀI 6: ĐỊNH LƯỢNG ĐƯỜNG KHỬ BẰNG PHƯƠNG PHÁP DNS........................16
I.Quy trình thí nghiệm....................................................................................................16
Bài 8: ĐỊNH LƯỢNG MỘT SỐ CHỈ SỐ DẦU MỠ.....................................................20
I XÁC ĐỊNH CHỈ SỐ acid...........................................................................................20
lOMoARcPSD|40651217
Bài 3 PHÂN TÁCH VÀ NHẬN DẠNG CASEIN
I. Lý thuyết
II. Thực hành
1. Phân tách casein trong sữa
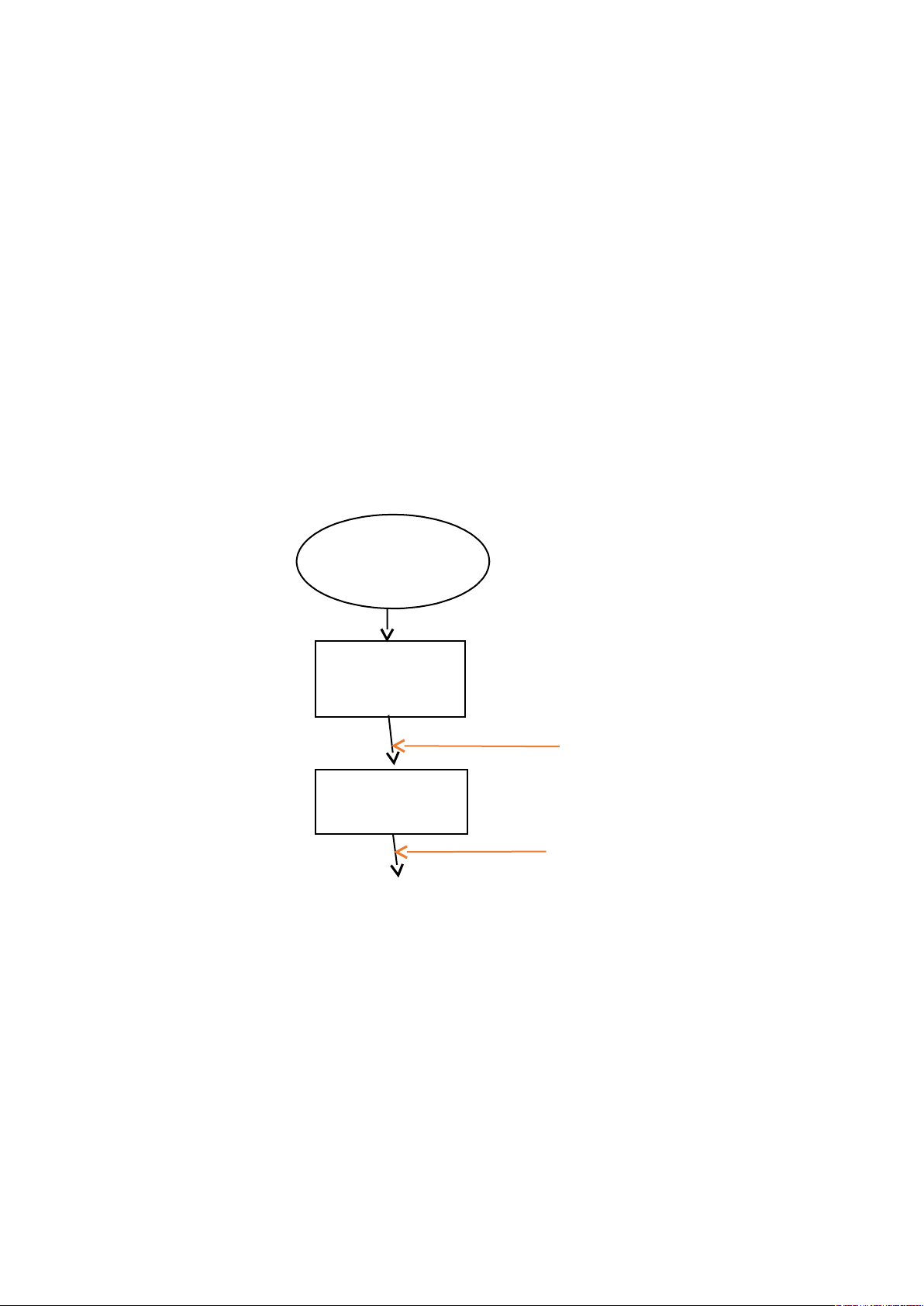
Lấy becher 250ml đem đi cân 20g sữa xong rồi đem đi nung dưới bể ổn nhiệt ở
nhiệt là 40
0
C rồi khuấy đều dung dịch . Dùng ống nhỏ giọt để nhỏ từng giọt acid
acetic rồi khuấy đều cho đến khi xuất hiện kết tủa rồi dừng lại . Sau đó đem dung
dịch đó bỏ vào ống nhựa có nắp xanh rồi đem đi ly tâm. Lấy dung dịch đó ra khỏi
máy li tâm và bỏ hết nước. Rồi lấy kết tủa cho vào becher , bỏ một ít ethanol
95% vào để dễ lấy kết tủa trong ống. Dùng pipet 10ml hút thêm ethanol cho đến
khi đủ 25ml bỏ vào becher . Rồi khuấy đều cho đến khi chất rắn lắng xuống , loại
bỏ chất lỏng chứa chất béo . Dùng pipet 10ml để hút 25ml cồn cho vào becher có
chứa chất rắn . Rồi đem đi lọc để lấy chất rắn đó , rồi đem đi sấy khô và cân để
lấy kết quả
Nhỏ từng giọt acid acetic, khuấy đều
25ml ethanol 95%
Khuấy đều trong 5p
Cân 20g
becher 250
Đun dưới bể
ổn nhiệt 40
o
C
Đem đi ly tâm
Thu kết tuả

lOMoARcPSD|40651217
% Casein= =
2. Phản ứng biuret :
Lấy 5 ống nghiệm sạch đánh số từ 1 đến 5. Sau đó dùng ống nhỏ giọt để nhỏ 15
giọt 2% glycine vào ống nghiệm 1 , rửa sách rồi lấy tiếp 2% gelatin nhỏ 15 giọt
cho vào ống nghiệm 2 , cứ như thế với 2% albumin vào ống nghiệm 3. Lấy 1 cái
becher cho một ít casein từ thí nhiệm trên rồi pha với 50ml nước cất. Sau đó dung
ống nhỏ giọt đã rửa sách để lấy 15 giọt casein vừa pha cho vào ống ngiệm 4 , và
dùng ống nhỏ giọt đã rửa sách lấy 15 giọt 1% tyrosine cho vào ống nghiệm 5 .
Đem ống nhỏ giọt đi rửa sach rồi lấy 5 giọt dung dịch NaOH 10% cho vào tất cả
ống nghiệm từ 1 đến 5 . Đem ống nhỏ giọt đi rửa rồi lấy 2 giọt dung dịch CuSO
4
1% cho vào tất cả ống nghiệm từ 1 đến 5. Cuối cùng đợi quan sát hiện tượng
3. Phản ứng ninhydrin :
Lấy 5 ống nghiệm sạch đánh số từ 1 đến 5. Sau đó dùng ống nhỏ giọt để nhỏ 15
giọt 2% glycine vào ống nghiệm 1 , rửa sách rồi lấy tiếp 2% gelatin nhỏ 15 giọt
cho vào ống nghiệm 2 , cứ như thế với 2% albumin vào ống nghiệm 3. Lấy 1 cái
becher cho một ít casein từ thí nhiệm trên rồi pha với 50ml nước cất. Sau đó dung
ống nhỏ giọt đã rửa sách để lấy 15 giọt casein vừa pha cho vào ống ngiệm 4 , và
25ml cồn
Lọc và sấy khô
KQ
m
sữa
Casein Giấy
8,435 0,805KQ 20,046

lOMoARcPSD|40651217
dùng ống nhỏ giọt đã rửa sách lấy 15 giọt 1% tyrosine cho vào ống nghiệm 5 .
Đem ống nhỏ giọt đi rửa sach rồi lấy 5 giọt thuốc thử ninhydrin 0,1% cho vào tất
cả ống nghiệm từ 1 đến 5. Rồi đem đi gia nhiệt ở bể nước sôi trong 5p . Cuối
cùng đợi quan sát hiện tượng
4. The xanthoprotein test :
Lấy 5 ống nghiệm sạch đánh số từ 1 đến 5. Sau đó dùng ống nhỏ giọt để nhỏ 15
giọt 2% glycine vào ống nghiệm 1 , rửa sách rồi lấy tiếp 2% gelatin nhỏ 15 giọt
cho vào ống nghiệm 2 , cứ như thế với 2% albumin vào ống nghiệm 3. Lấy 1 cái
becher cho một ít casein từ thí nhiệm trên rồi pha với 50ml nước cất. Sau đó dung
ống nhỏ giọt đã rửa sách để lấy 15 giọt casein vừa pha cho vào ống ngiệm 4 , và
dùng ống nhỏ giọt đã rửa sách lấy 15 giọt 1% tyrosine cho vào ống nghiệm 5 .
Đem ống nhỏ giọt đi rửa sach rồi lấy 10 giọt HNO
3
cho vào tất cả ống nghiệm từ
1 đến 5. Rồi đem đi gia nhiệt ở bể nước sôi trong 5p . Cuối cùng đợi quan sát hiện
tượng
Biện Luận

lOMoARcPSD|40651217
•Khi so sánh đối chiếu kết quả thu được với một nhóm khác có sự khác biệt về
mặt thông số, kết quả đo có thể sự khác nhau ấy do một trong những nguyên nhân
sau:
lOMoARcPSD|40651217
Do phương pháp c a nhóm em thu th p sai trong quá trình làm s kiên ủ ậ
ự nhẫẫn và bình @nh seẫ giúp cho sốố li u đ t kêốt qu tốốt h n. Nh
ng có th ệ ạ ả ơ ư ể do mẫốt đi s nhẫnẫ trong các khẫu làm g
i là đốốt cháy giai đự ọ o n dẫnẫ đêốn ạ sai sốố.
+ Hoặc do nhóm khác khi đối chiếu với họ do họ đo chưa rõ ràng chưa có sự
đồng nhất về mặt số liệu từ đó dẫn đến kết quả ghi có sự khác biệt
+ Về mặt dụng cụ có thể do nhóm em hoặc nhóm Mai đối chiếu số liệu khi sử
dụng dụng cụ có thể chưa kiểm tra về mặt ổn định thiết bị đo không tốt
hoặc bị hỏng dẫn đến sai số
+ Về ảnh hưởng bên ngoài do thời tiết như (mưa, gió, nhiệt độ, không khí)
khi tác động vào dù chỉ là nhỏ nhất có thể làm là số liệu lệch đi khá đáng
kể.
Bài 4 xác định nitơ tổng số theo phương pháp KJELDAHL
(xác định hàm lượng protein thô)
I.quy trình thí nghiệm:
*Quy trình bằng chữ:
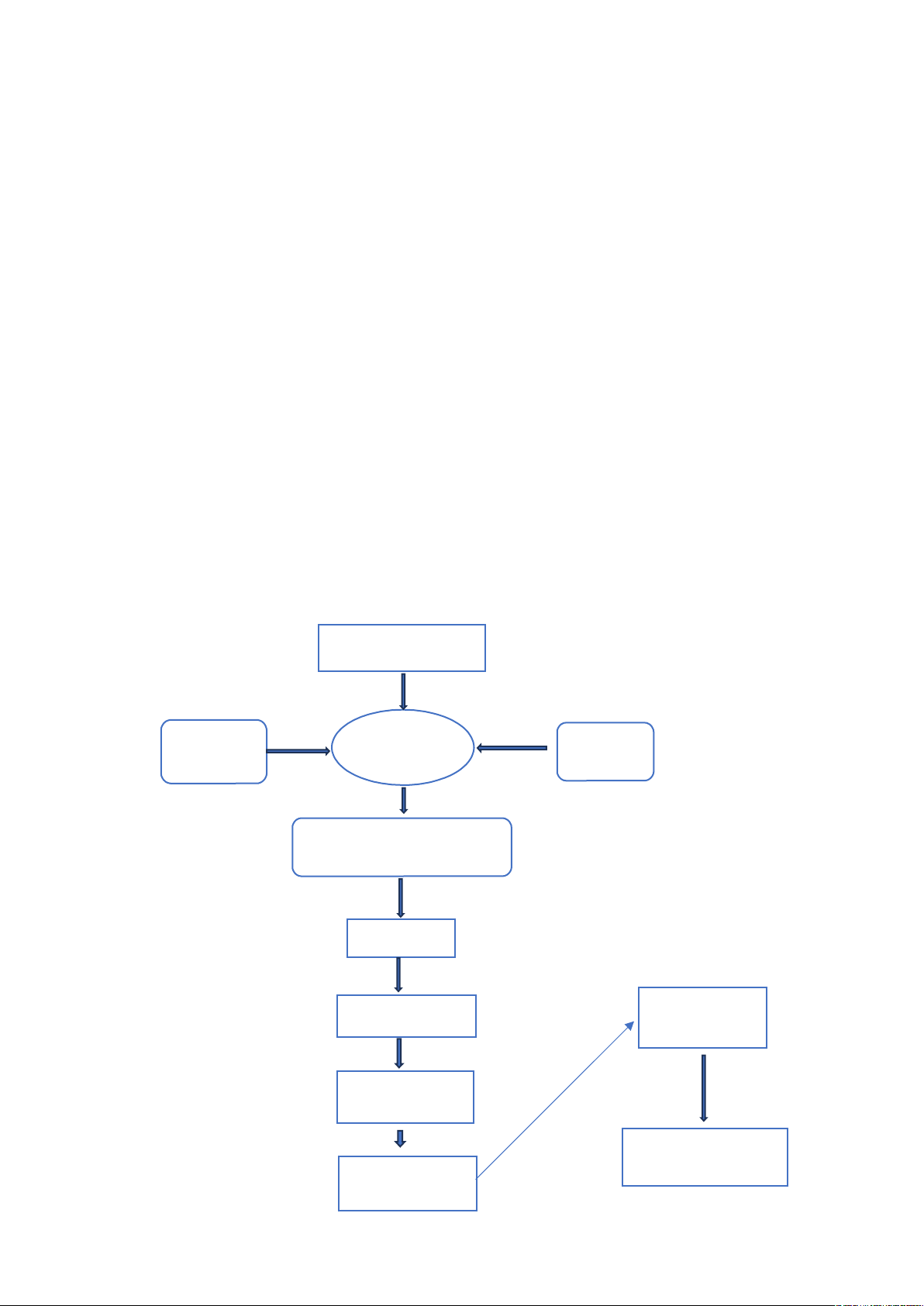
1. vô cơ hóa mẫu:
6
0,5g
chất xúc
Không màu hoặc
xanh lơ của
Đun đến bốc
hơi, hình
Thưc phẩm
còn H2O
Để vào tủ
Đun từ từ
Để nghiêng bình
kjeldahl trên bếp amiăng
H2SO4
đậm đặc
Bình
Kjeldahl
Cân 0,1g thực
Tan bọt, đun
sôi
lOMoARcPSD|40651217
- ta đem cân 0,1g thực phẩm (hoặc 1ml nếu là nguyên liệu lỏng) và cho vào
bìnhKjeldahl với H2S04 đậm đặc và khoảng 0,5g chất xúc tác.
- ta để nghiêng bình kjeldahl trên bếp có lưới Amiăng và đun từ từ trên bêp
điện.Sau đó Đem để vào tủ Hotte
- nếu thực phẩm chứa nhiều nước, ta tiếp tục đun sôi cho đến khi nước bốc
hơi vàhình thành khói trắng SO2. Khi tan bọt, đun sôi cho đến khi dung dịch
trong suốt không màu hoặc có màu xanh lơ của CuSO4 thì ta ngừng lại và để
nguội.
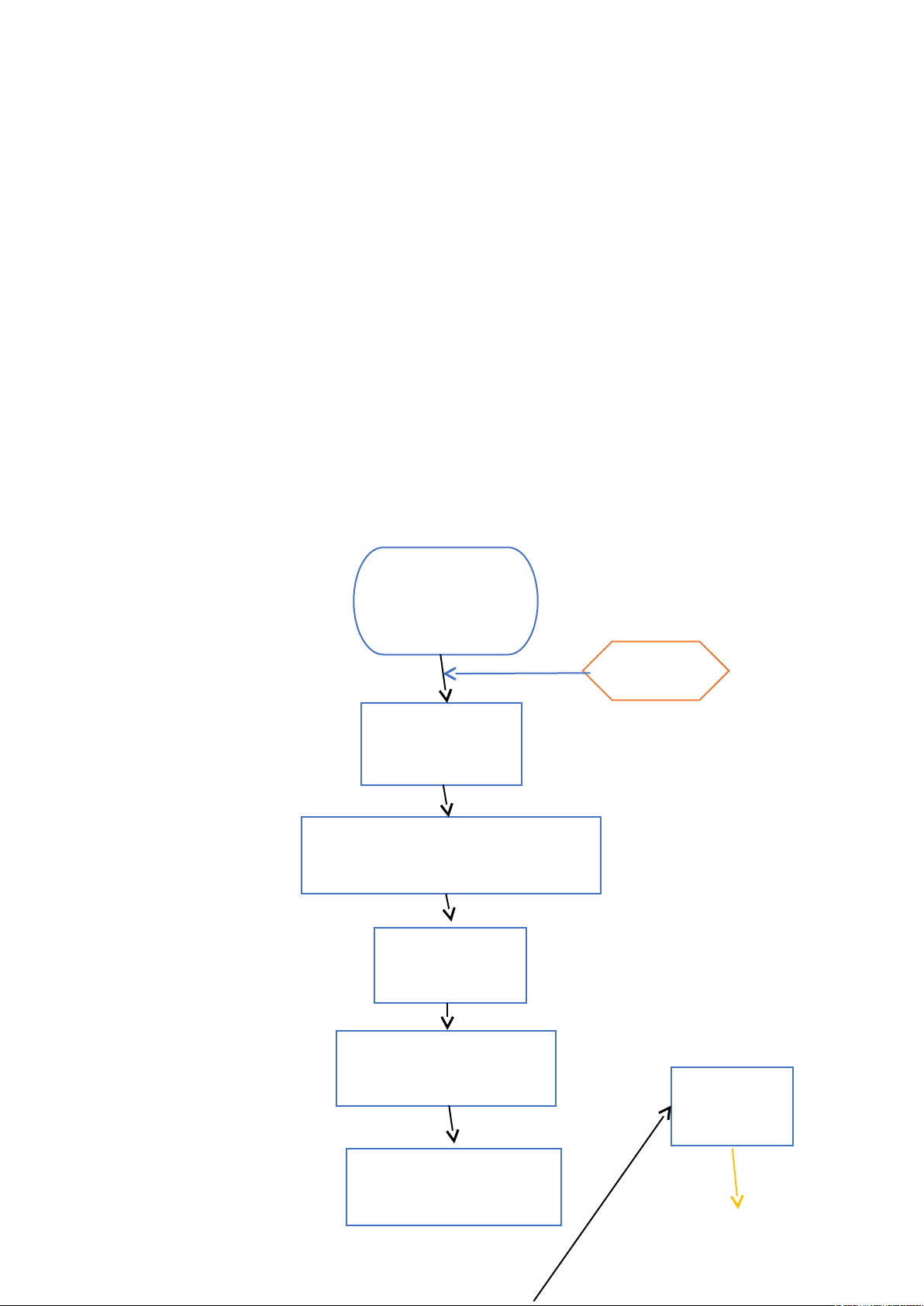
:2 chưng cất
Erlen 250ml chứa
25ml H2S 04
Methyl
đỏ 0,5%
Lấp erlen vào
ống sinh hàn sau
Bật nước lạnh chảy vào, hút 10ml
vô cơ hóa pha loãng cho vào phễu
Mở khóa cho
vào bình c
Tráng phễu 3 lần (lần
thứ 3 cho 5 giọt pp 1%
Định phân
bằng NaOH
Cho 10ml NaOH30%
vào phễu b cho chảy
lOMoARcPSD|40651217
Quy trình bằng chữ:
- ta chuẩn bị erlen 250ml chứ 25ml H2SO4 0,01N và vài giọt methyl đỏ
0,5% và ta tiến hành lắp erlen vào ống sinh hàn sao cho đầu ống ngập trong dung
dịch. Ta bật cho nước lạnh chảy vào ống sinh hàn.
- ta hút 10ml dung dịch vô cơ hóa đã pha loãng ( đối với mẫu trắng thay
bằngnước cất) bên trên bằng bình định mức 100ml cho vào phễu b của máy
chưng cất và mở khóa từ từ cho dung dịch chảy vào bình c ta tiến hành tráng
phễu 3 lần vào lần thứ 3 ta cho 5 giọt phenophthalein 0,1% vào phễu và xả từ từ
vào bình c và tráng bằng một ít nước cất ( để lại 1 it nước cất ở đáy để hệ thống
kín khí), ta cho 800ml nước cất vào bình đun để máy lôi cuốn trong 15 phút rồi
hạ erlen xuống để thêm 2 phút, ta tiến hành rửa vòi bằng nước cất ( nước rửa cho
xuống erlen), ta lấy erlen tiến hành định phân bằng dung dịch NaOH 0,01N đến
khi có màu vàng cam.
Kết quả chuẩn độ mẫu trắng
KQ
Tráng
bằng 1 ít
Để máy lôi cuốn
trong 15p, rồi hạ
Kết quả chuẩn độ mẫu thật:
Lần 2 Lần 3Lần 1
Thể _ch NaOH
chuẩn độ (ml)
16,5 16,16 55,
Trung bình NaOH
chuẩn độ
16,5
Lần 1 lần 2 Lần 3
Thể _ch NaOH
chuẩn độ (ml)
26,5 26,5 26,5
Trung bình NaOH
chuẩn độ
26,5

lOMoARcPSD|40651217
∆V= Vo- V1= 26,5 - 16,5= 10 (ml)
Hàm lượng Nitơ có trong mẫu
Số lượng N trong 100ml dung dịch vô
cơ hóa là (g/ml)
364,58
Nồng độ protein trong nguyên liệu với
m=1ml là (g/1000ml)
364,58
HÌNH ẢNH:

lOMoARcPSD|40651217
II. Biện luận
Ưu điểm phương pháp Kjeldahl
Phương pháp Kjeldahl được ứng dụng phổ biến và vẫn là phương pháp tiêu chuẩn
để có thể so sánh với các phương pháp khác. Với độ chính xác rất cao và khả
năng tái sản xuất rất tốt nên đây được xem là phương pháp chủ yếu để ước tính
lượng protein trong thí nghiệm.
Nhược điểm phương pháp Kjeldahl
Khó để thước đo chính xác Nito vì tất cả nitơ không ở dạng protein. Với các loại
protein khác nhau thì cần các yếu tố hiệu chỉnh khác nhau do trình tự axit amin
khác nhau. Việc sử dụng axit sunfuric đậm đặc ở nhiệt độ cao sẽ ít nhiều gây ra
một mối nguy hại đáng kể và chất xúc tác cũng vậy. Vì thế kỹ thuật này sẽ mất rất
nhiều thời gian để có thể thực hiện.
lOMoARcPSD|40651217
BÀI 5: KHẢO SÁT HOẠT TÍNH ENZYM PROTEASE
I. Lý thuyết
II. Thực hành
1. Chuẩn bị mẫu
Dùng becher 100ml cân 10g thơm đã được bọt bỏ lớp vỏ ngoài ,cắt nhỏ và
xay nát . Sau đó lấy dịch lọc để định mức 100ml với nước cất. Rồi bỏ ra
ống nhựa có nắp để đem đi ly tâm 6000 vòng /10p . Xong rồi lấy dịch bên
trong có chứa enzyme Bromeline.
Cân 10g thơm
bằng becher
100ml
BĐM
100ml
lOMoARcPSD|40651217
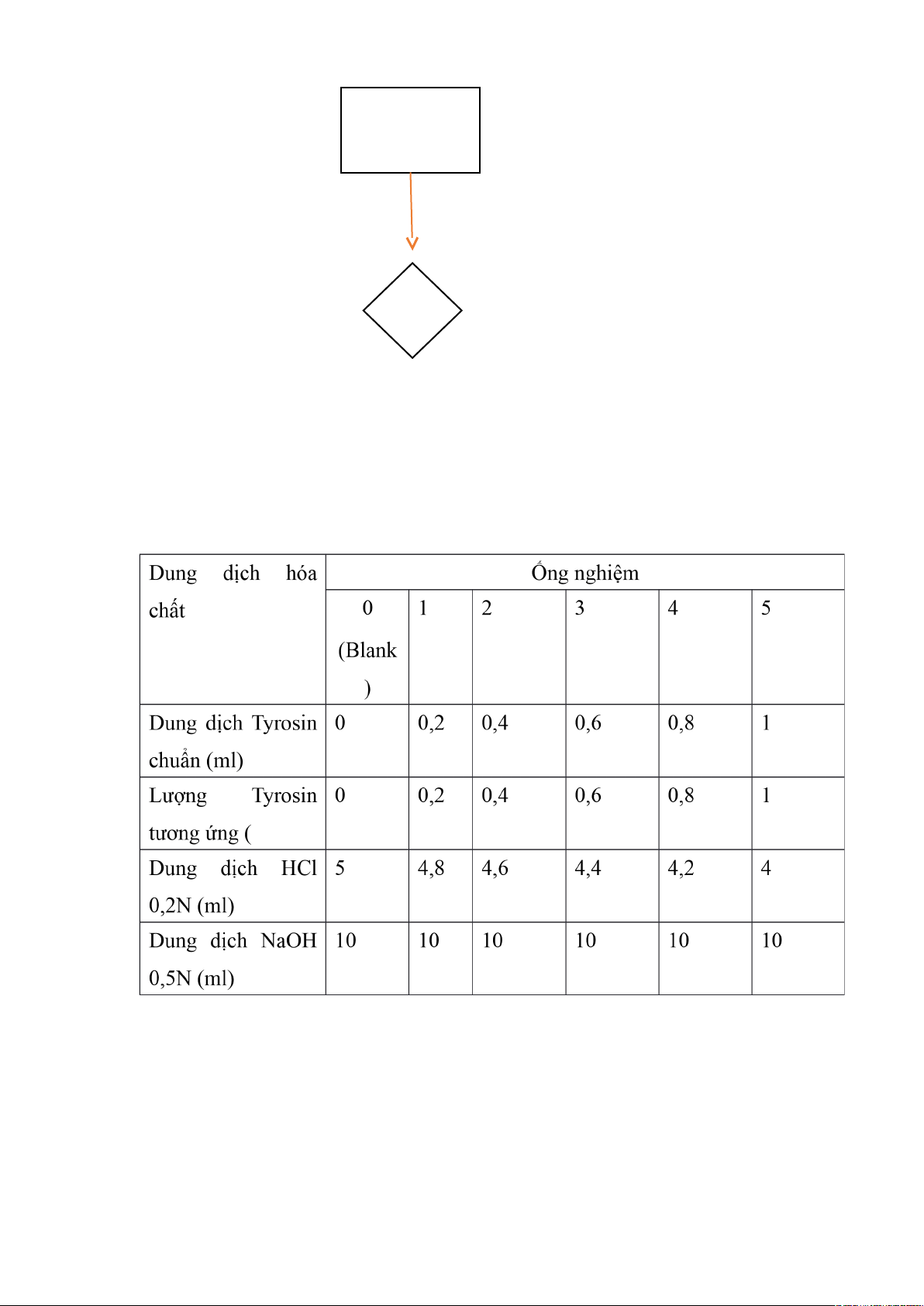
2. Dựng đường chuẩn Tyrosine :
Lấy 6 cái ống nghiệm sạch đánh số từ 0 đến 5. Sau đó cho các chất trong bảng
sau vào từng ống nghiệm
Sau đó lắc đều tất cả các ống , xong rồi dùng pipet 5ml hút 3ml từ mỗi ống đó
ra 6 ống sạch khác cũng được đánh số như trên . Dùng pipet 1ml hút 0,6ml
thuốc thử Folin. Lắc đều tất cả các ống rồi để yên trong vòng 10 p . Cuối cùng
đem đi đo quang trong với bước sóng 720nm
Đem đi ly tâm
6000 vòng / 10p
KQ
lOMoARcPSD|40651217
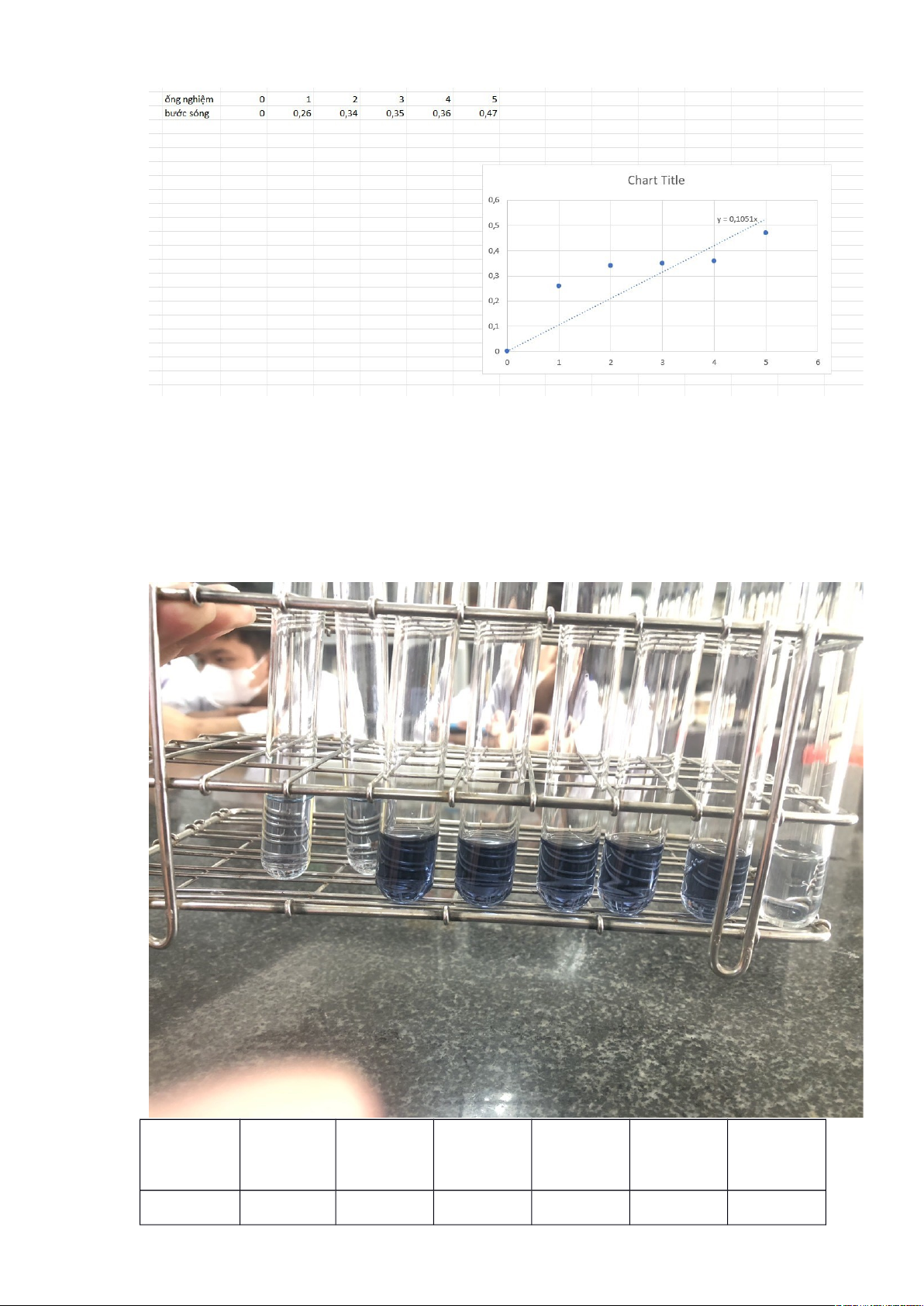
Ống
nghiệm
0 1 2 3 4 5
OD 0 0,26 0,34 0,35 0,36 0,47

lOMoARcPSD|40651217
3. Xác định lượng Tyrosin trong dung dịch nghiên cứu
Lấy 2 ống nghiệm sạch đánh dấu 1 và 2 rồi thêm những chất trong bảng
sau vào :
Sau khi đem đi ly tâm , rồi dùng 2 ống nghiệm sạch khác đánh dấu A ,B . Dùng
pipet 5ml hút dung dịch đã ly tâm cho vào mỗi ống 5ml dung dịch . Sau đó thêm
dùng pipet 10ml hút NaOH 0,5N cho vào mỗi ống 10ml . Xong lắc đều 2 hai
ống , rồi dùng pipet 5ml hút dung dịch của cả hai ống ra hai ống nghiệm mới có
đánh dấu 1, 2 với 3ml của ống A qua ống 1 và 3ml của ống B ra ống 2 . Rồi thêm
vào mỗi ống 0,6 ml thuốc thử folin được hút bằng pipet 1ml . Rồi lắc mạnh để
yên trong 10p cả hai ống , xong đem đi đo quang với bước 720nm
Hóa chất Ống Nghiệm
Thử thật (ống 1) Thử không (ống 2)
Dung dịch casein 1% (ml) 5 5
Dung dịch TCA 5% (ml) 0 10
Dung dịch enzyme mẫu (ml) 1 1
Lắc đều và giữa ở nhiệt độ phòng trong 30p
Dung dịch TCA 5% 10 0
Để yên trong 30p , rồi đem đi ly tâm

lOMoARcPSD|40651217
Kết Quả
Phương trình: y= 0,1051x
Thay y= 0,191 vào phương trình => x= 1,817(
Hoạt độ Enzyme Protease được tính theo công thức:
Hoạt độ P = = 9,054(UI/g)
Biện Luận :
•Khi so sánh đối chiếu kết quả thu được với một nhóm khác có sự khác biệt về
mặt thông số, kết quả đo có thể sự khác nhau ấy do một trong những nguyên nhân
sau:
+ Do phương pháp của nhóm em thu thập sai trong quá trình làm sự kiên nhẫn
và bình tĩnh sẽ giúp cho số liệu đạt kết quả tốt hơn. Nhưng có thể do mất đi
sự nhẫn trong các khâu làm gọi là đốt cháy giai đoạn dẫn đến sai số.
+ Hoặc do nhóm khác khi đối chiếu với họ do họ đo chưa rõ ràng chưa có sự
đồng nhất về mặt số liệu từ đó dẫn đến kết quả ghi có sự khác biệt
+ Về mặt dụng cụ có thể do nhóm em hoặc nhóm Mai đối chiếu số liệu khi sử
dụng dụng cụ có thể chưa kiểm tra về mặt ổn định thiết bị đo không tốt
hoặc bị hỏng dẫn đến sai số
+ Về ảnh hưởng bên ngoài do thời tiết như (mưa, gió, nhiệt độ, không khí)
khi tác động vào dù chỉ là nhỏ nhất có thể làm là số liệu lệch đi khá đáng
kể.
BÀI 6: ĐỊNH LƯỢNG ĐƯỜNG KHỬ BẰNG PHƯƠNG PHÁP DNS
I.Quy trình thí nghiệm
1.Chuẩn bị mẫu
*Sơ đồ khối Chưng cách
Cho NaOH(nồng
thủy hỗn hợp
Chuẩn bị 12 Chưng cấtkhi từ màu vàng15 độ 20%)để trung
ống 1 ống 2
0,299 0,108Kết quả
lOMoARcPSD|40651217
Cân 1g nho
ống nghiệĐo bước m đsónãg đến khi nước hòa(thử bằng giấyĐịnh mức lên
chuyển sang
chín đã chuẩn
đánh số 540nmsẵn cạn 100quỳ pH 6,5-7,5ml
màu đỏ cam
bị
*Nguyên liệu:
1g mẫu nho cần định lượng đường được cân chính xác,nho được nghiền nhỏ sau
đó hút một lượng H
2
SO
4
10% được thêm vào cho đến khi ngập dung dịch
mẫu.Dung dịch được đun cách thủy đến khi cạn thì dừng.Mẫu được lấy ra và cho
từng giọt NaOH(nồng độ 20%) để trung hòa mẫu.Mẫu sau khi được trung hòa
được pha loãng và được định mức thành một thể tích nhất định(100ml).Nếu dung
dịch có cặn thì cần được đem đi lọc.
-Lắc đều và hút ra từ mỗi ống nghiệm trên 0,5ml cho vào 6 ống nghiệm sạch và
khô khác,thêm mỗi ống 0,5ml thuốc thử DNS.Đậy nắp chặt và đem đi đun ách
17
Downloaded by Phuong Le (lephuong0301@gmail.com)
lOMoARcPSD|40651217
Ống nghiệm 0 51 2 3 4
Nồng độ glucose tương
ứng
100 200 300 400 5000
Dung dịch
glucose(0,5mng/ml)
(ml)
0 1 2 3 4 5
Nước cất (ml) 5 4 3 2 1 0

thủy cho đến khi dung dịch trong ống nghiệm chuyển sang màu nâu đỏ,để nguội
và thêm 4ml nước cất.
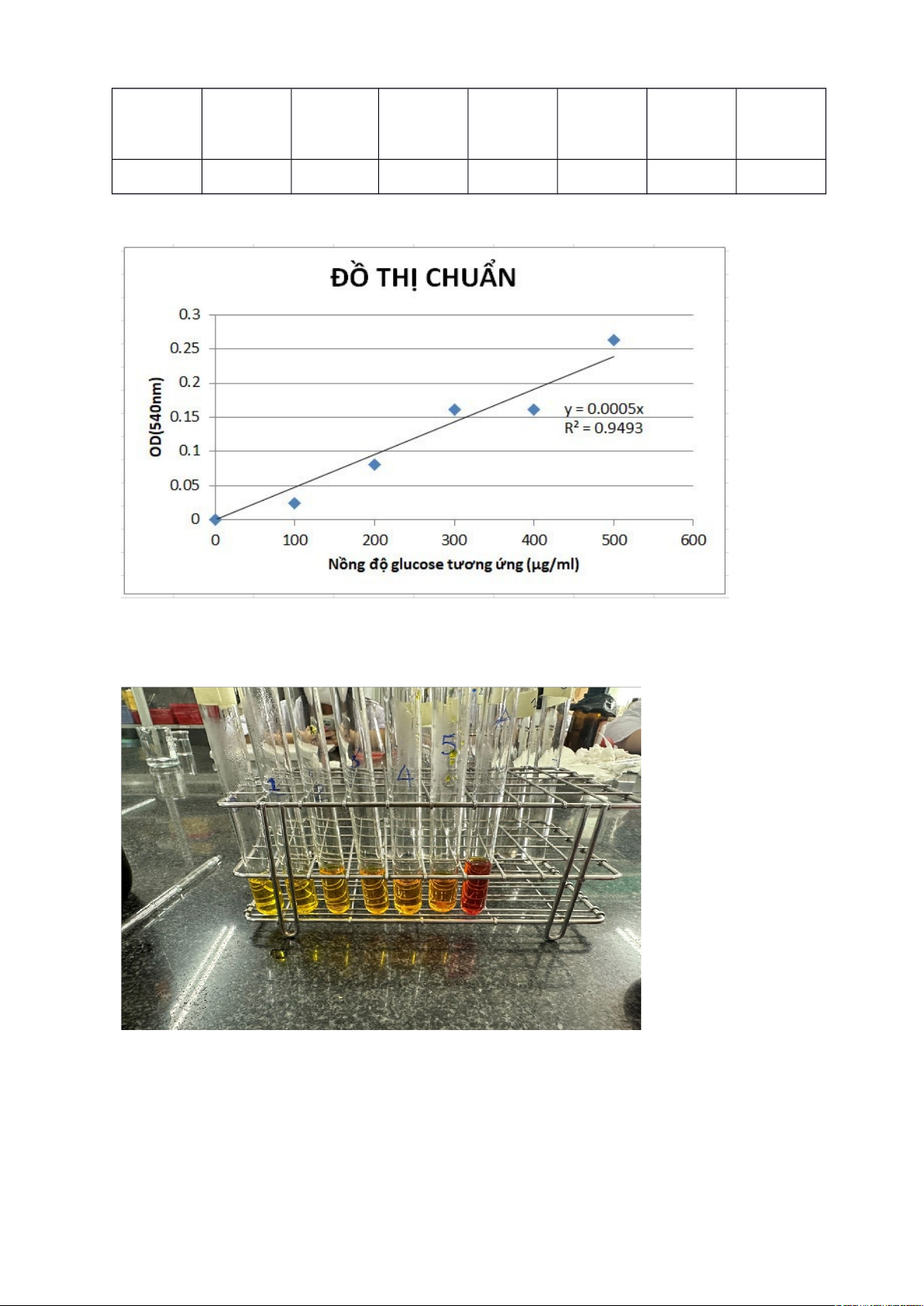
-Đem mẫu thử và mẫu trắng đồng thời đi đo quang với nhau ở bước sóng
540nm.Ta được đồ thị chuẩn glucose với trục tung là mật độ quang trục hoành là
nồng độ glucose.
-Xác định hàm lượng đường khử trong dung dịch trích:Phản ứng của dung dịch
đường cần phân tích với thuốc thử DNS được tiến hành tương tự như phần xây
dựng đồ thị chuẩn.Sau các bước,ta đem đo quang ở bước sóng 540nm,ta được giá
trị mật độ quang(OD mẫu).Nồng độ đường trong mẫu được xác định nhờ vào
đường chuẩn glucose đã dựng bên trên.
II.Kết quả
lOMoARcPSD|40651217
Kết quả
III.Biện luận
Nhận xét và biện luận
•Khi so sánh đối chiếu kết quả thu được với một nhóm khác có sự khác biệt về
mặt thông số, kết quả đo có thể sự khác nhau ấy do một trong những nguyên nhân
sau:
Ống
nghiệm
ống
mẫu
0 1 2 3 4 5
Kết quả 1,723 0 0,025 0,081 0,161 0,162 0,263

lOMoARcPSD|40651217
+ Do phương pháp của nhóm em thu thập sai trong quá trình làm sự kiên nhẫn
và bình tĩnh sẽ giúp cho số liệu đạt kết quả tốt hơn. Nhưng có thể do mất đi
sự nhẫn trong các khâu làm gọi là đốt cháy giai đoạn dẫn đến sai số.
+ Hoặc do nhóm khác khi đối chiếu với họ do họ đo chưa rõ ràng chưa có sự
đồng nhất về mặt số liệu từ đó dẫn đến kết quả ghi có sự khác biệt
+ Về mặt dụng cụ có thể do nhóm em hoặc nhóm Mai đối chiếu số liệu khi sử
dụng dụng cụ có thể chưa kiểm tra về mặt ổn định thiết bị đo không tốt
hoặc bị hỏng dẫn đến sai số
+ Về ảnh hưởng bên ngoài do thời tiết như (mưa, gió, nhiệt độ, không khí) khi
tác động vào dù chỉ là nhỏ nhất có thể làm là số liệu lệch đi khá đáng kể.
Kết luận :
Định lượng đường khử bằng phương pháp DNS cho kết quả nhanh
chóng, thực hiện dễ dàng. Tuy nhiên, các đường khử khác nhau cho màu
sắc khác nhau với thuốc thử DNS. Do đó, phương pháp này không được
khuyến khích dùng cho xác định hỗn hợp đường khử.
Bài 8: ĐỊNH LƯỢNG MỘT SỐ CHỈ SỐ DẦU MỠ
I XÁC ĐỊNH CHỈ SỐ acid
1.1)lý thuyết
Định nghĩa :chỉ số acid là lượng mg KOH cần thiết để trung hòa các
acid tự do chứa trong 1g chất cần thử.
Nguyên lý ;dung NaOH 0,1N để trung hòa các acid tự do trong chất
cần thử ,với PP làm chỉ thị màu.
1.1.2) Thực hành; ,
1.1.3)Dụng cụ : 1.1.4)Hóa chất :
buret 25ml -Cồn 960,
-giá đỡ Buret, -Ether trung _nh,
Erlen 250ml -KOH 0,1N
-Cốc 100ml,
-Phenolphtalein1%
-Ống đong 50ml,
-Pipet 5ml,
Bấm Tải xuống để xem toàn bộ.