















































Preview text:
B Ộ GIÁO DỤC VÀ ĐÀO TẠ O
TRƯỜNG ĐẠ I H ỌC SƯ PHẠ M K Ỹ THU Ậ T TP H Ồ CHÍ MINH
KHOA CÔNG NGHỆ HÓA HỌ C & TH Ự C PH Ẩ M
B Ộ MÔN CÔNG NGHỆ K Ỹ THU ẬT MÔI TRƯỜ NG BÁO CÁO TH
Ự C T Ậ P X Ử LÝ NƯỚ
C TH Ả I
GVHD TS. Nguyễn Quỳnh Mai Nhóm 0 _
1 CLC. Th ứ 2
SVTH: Trương Hoàng Việ t H ằ ng 2115006 6
Lê Thị Băng Tâm 21150093
Trương Văn Khả i 21150066
Nguy ễn Bá Tùng Lâm 21150075 Ngô Thùy Trang 21150102
Tp. H ồ Chí Minh, ngày 06 tháng 12 năm 2023 MỤC LỤC
DANH MỤC BẢNG .................................................................................................................. i
DANH MỤC HÌNH ................................................................................................................. iii
BÀI 1. KEO TỤ - TẠO BÔNG ................................................................................................ 5 1.1
Mục ích thí nghiệm .................................................................................................. 5
1.2. Cơ sở lý thuyết ............................................................................................................... 5
1.3. Quy trình thực hiện thí nghiệm .................................................................................... 8
1.3.1 Thí nghiệm 1: Xác ịnh giá trị pH tối ưu .............................................................. 8
1.3.2 Thí nghiệm 2: Xác ịnh liều lượng phèn tối ưu .................................................... 9
1.3.3 Thí nghiệm 3: Xác ịnh thời gian keo tụ tối ưu .................................................. 10
1.4. Kết quả thí nghiệm và nhận xét ................................................................................. 10
1.4.1. Thông số ầu vào .................................................................................................. 10
1.4.2. Xác ịnh pH tối ưu: .............................................................................................. 11
1.4.3. Xác inh liều lượng PAC tối ưu: ......................................................................... 12
1.4.4. Xác ịnh thời gian tối ưu: .................................................................................... 15
1.5. Trả lời câu hỏi .............................................................................................................. 17
BÀI 2 PHƯƠNG PHÁP BÙN HOẠT TÍNH ........................................................................ 19
2.1 Mục ích thí nghiệm ..................................................................................................... 19
2.2 Cơ sở lý thuyết .............................................................................................................. 19
2.2.1Mục ích của quá trình sinh học trong nước thải ............................................... 19
2.2.3 Hiện tượng cơ bản xảy ra trong quá trình oxy hóa sinh học ............................. 19 2.2.4
Yếu tố ảnh hưởng ến quá trình phân hủy sinh học ..................................... 19
2.2.5. Xác ịnh các thông số ộng học Y, kd, 𝝁𝒎, Ks .................................................. 19 2.3 Quy trình thực hiện thí nghiệm
................................................................................... 21 2.3.1 Mô hình thực hiện thí nghiệm
.............................................................................. 21 2.3.2 Xác ịnh thông số bùn
........................................................................................... 23 2.3.3 Xác ịnh COD
........................................................................................................ 24 2.3.4 Hàm lượng SS
........................................................................................................ 25 2.3.5 Xác ịnh DO
........................................................................................................... 27 2.3.6 Xác ịnh BOD5
....................................................................................................... 28 2. 4 Kết quả thí nghiệm
...................................................................................................... 29
2.4.1 Xác ịnh thông số ầu vào của nước ................................................................... 29 2.4.2.
Xác ịnh thông số ầu vào của bùn .................................................................... 29 2.4.3.
Nồng ộ bùn giả thuyết ........................................................................................
30 2.4.4. Các thông số tại các nồng ộ bùn theo thời gian ............................................... 30
2.5 Xử lý số liệu ................................................................................................................... 31
2.5 Trả lời câu hỏi ............................................................................................................... 42
3.1 Mục ích thí nghiệm ..................................................................................................... 43
3.2 Cơ sở lý thuyết .............................................................................................................. 43
3.2.1 Quá trình Fenton ồng thể ................................................................................... 43
3.3.2 Quá trình Fenton dị thể ........................................................................................ 44
3.3 Quy trình thực hiện thí nghiệm ................................................................................... 45
3.3.1 Thí nghiệm 1: Khảo sắt tỉ lệ H2O2 và phèn sắt ã sử dụng................................ 45
3.3.2. Thí nghiệm 2: Khảo sắt hiệu quả của phản ứng khi có mặt chất xúc tác Mn2+
.......................................................................................................................................... 47
3.4 Kết quả thí nghiệm và nhận xét .................................................................................. 50
3.4.1 Kết quả o mẫu nước thải ầu vào ...................................................................... 50
3.4.2 Thí nghiệm 1: Khảo sắt tỉ lệ H2O2 và phèn sắt ã sử dụng............................... 50
3.4.3 Thí nghiệm 2: Khảo sắt hiệu quả của phản ứng khi có mặt chất xúc tác Mn2+
..........................................................................................................................................
52 3.5 Trả lời câu hỏi ...............................................................................................................
53 BÀI 4. KHỬ TRÙNG ............................................................................................................. 56
4.1 Mục ích thí nghiệm ..................................................................................................... 56
4.2 Cơ sở lý thuyết .............................................................................................................. 56
4.2.1 Khử trùng nước bằng Clo và các hợp chất của nó ............................................. 56
4.2.2. Khử trùng nước bằng tia UV ............................................................................... 57
4.3. Quy trình thực hiện thí nghiệm .................................................................................. 58
4.3.1. Thí nghiệm 1: Khử trùng bằng hóa chất NaOCl ............................................... 58
4.3.3. Thí nghiệm 3: Khử trùng bằng UV ..................................................................... 59 4.4
Kết quả và nhận xét ................................................................................................. 60
4.4.1 Thông số ầu vào của nước thải: ......................................................................... 60
4.4.2 Thí nghiệm 1: Khử trùng bằng hóa chất NaOCl ........................................... 60
4.4.3 Thí nghiệm 2: Khử trùng bằng èn UV ......................................................... 64
4.5. Trả lời câu hỏi .............................................................................................................. 65
BÀI 5: XỬ LÝ PHOTPHAT BẰNG PHƯƠNG PHÁP HÓA LÝ ...................................... 67
5.1 Mục ích thí nghiệm ..................................................................................................... 67
5.2 Cơ sở lý thuyết .............................................................................................................. 67
5.3 Quy trình thực hiện thí nghiệm ................................................................................... 68
5.3.1 Thí nghiệm 1: Xác ịnh giá trị pH tối ưu ............................................................ 68
5.3.3 Phương pháp xác ịnh hàm lượng Photpho ....................................................... 71
5.4 Kết quả thí nghiệm ....................................................................................................... 72
5.4.1. Xác ịnh thông số ầu vào ................................................................................... 72
5.4.2. Thí nghiệm 1: Xác ịnh lượng pH tối ưu ........................................................... 72
5.5 Xử lý số liệu ................................................................................................................... 73
5.5.1 Xác ịnh thông số ầu vào .................................................................................... 73
5.5.2 Thí nghiệm 1: Xác ịnh lượng pH tối ưu ............................................................ 74 5.5.3 Thí nghiệm 2: Xác ịnh lượng vôi tối ưu
............................................................. 77
TÀI LIỆU THAM KHẢO ........................................................................................................ 2 DANH MỤC BẢNG
Bảng 1.1 Thông số ầu vào ........................................................................................... 10
Bảng 1.2. Thông số thí nghiệm pH tối ưu ..................................................................... 11
Bảng 1.3 Thông số của thí nghiệm xác inh PAC tối ưu .............................................. 12
Bảng 1.4 Thông số thí nghiệm xác ịnh thời gian tối ưu .............................................. 15
Bảng 2.1 Thông số ầu vào .......................................................................................... 29
Bảng 2.2 Nồng ộ bùn giả thuyết ................................................................................. 30
Bảng 2.3 Bể 1 nồng ọ bùn 500mg/L............................................................................ 30
Bảng 2.4 Bể 2 nồng ộ bùn 1000mg/L.......................................................................... 30
Bảng 2.5 Bể 3 nồng ộ bùn 2000mg/L.......................................................................... 31
Bảng 2.6 Bể 4 nồng ộ bùn 3000mg/L.......................................................................... 31
Bảng 2.7 Mối tương quan giữa pH và thời gian xử lý .................................................. 31
Bảng 2.8 Kết quả hiệu suất xử lý của COD % .............................................................. 33
Bảng 2.9 Số liệu thực bể 1 ............................................................................................. 34
Bảng 2.10 Kết quả tính toán xô 1 .................................................................................. 34
Bảng 2.11 Số liệu thực xô 2 .......................................................................................... 36
Bảng 2.12 Kết quả tính toán xô 2 .................................................................................. 36
Bảng 2.13 Số liệu thực xô 3 .......................................................................................... 38
Bảng 2.14 Kết quả tính xô 3 .......................................................................................... 38
Bảng 2.15 Số liệu thực xô 4. ......................................................................................... 40
Bảng 2.16 Kết quả tính xô 4. ......................................................................................... 40
Bảng 3.1 Tỉ lệ H2O2/Fe ứng với mỗi cốc ở thí nghiệm 1 .............................................. 47
Bảng 3.2 Tỉ lệ H2O2/Fe và Mn2+ ứng với mỗi cốc ở thí nghiệm 2 ................................ 49
Bảng 3.3 Thông số ầu vào ........................................................................................... 50
Bảng 3.4 Thông số o COD mẫu un và không un .................................................... 50
Bảng 3.5 Kết quả thí nghiệm 1 ...................................................................................... 50
Bảng 3.6 Hiệu suất xử lí ộ màu, COD với các tỉ lệ H2O2 và Fe khác nhau ................ 50
Bảng 3.7 Kết quả thí nghiệm 2 ...................................................................................... 52
Bảng 3.8 Hiệu suất xử lí ộ màu, COD khi có xúc tác Mn2+ ........................................ 52
Bảng 4.1 Thông số ầu vào ........................................................................................... 60
Bảng 4.2 Kết quả thí nghiệm 1: Khử trùng bằng hóa chất NaOCl ................................ 60
Bảng 4.3 Hình ảnh thí nghiệm 1 ộ ục 10 NTU .......................................................... 61
Bảng 4.4 Hình ảnh thí nghiệm 1 ộ ục 100 NTU ........................................................ 62
Bảng 4.5 Hình ảnh thí nghiệm 1 ộ ục 100 NTU ........................................................ 63
Bảng 4.6 Kết quả thí nghiệm 2: Khử trùng bằng èn UV ............................................. 64
Bảng 5.1 Đường chuẩn photpho .................................................................................... 71
Bảng 5.2 Thông số ầu vào .......................................................................................... 72
Bảng 5.3 Xác ịnh lượng hóa chất iều chỉnh pH......................................................... 72
Bảng 5.4 Kết quả của thí nghiệm xác ịnh lượng pH tối ưu ......................................... 72
Bảng 5.5 Kết quả của thí nghiệm xác ịnh lượng vôi tối ưu ......................................... 73
Bảng 5.6 Xử lý thông số ầu vào ................................................................................. 73
Bảng 5.7 Xử lý kết quả của thí nghiệm xác ịnh lượng pH tối ưu................................ 75
Bảng 5.8 Xử lý kết quả của thí nghiệm xác ịnh lượng vôi tối ưu ............................... 77
DANH MỤC HÌNH
Hình 1.1 Mô hình thí nghiệm jartest ............................................................................... 7
Hình 1.2 Đồ thị thể hiện mối liên hệ giữa pH và hiệu quả xử lý COD, màu ................ 11
Hình 1.3 Mối tương quan giữa PAC với hiệu quả xử lý COD, màu ............................. 13
Hình 1.4 Mối tương quan giữa PAC với hiệu quả xử lý COD, màu mẫu có than ........ 14
Hình 1.5 Đồ thị thể hiện mối tương quan giữa thời gian và hiệu suất xử lý COD, màu
....................................................................................................................................... 16
Hình 1.6 Đồ thị thể hiện mối tương quan giữa thời gian và hiệu suất xử lý COD, màu
của mẫu có than ............................................................................................................. 17
Hình 2.1 Biểu ồ thể hiện mối tương quan giữa pH và thời gian xử lý ........................ 32
Hình 2.2 Đồ thị hiệu suất xử lý .................................................................................... 33
Hình 2.3 Đồ thị xác ịnh các thông số ộng học xô 1 .................................................. 35
Hình 2.4 Đồ thị tuyến tính các thông số ộng học xô 1 ................................................ 36
Hình 2.5 Đồ thị xác ịnh các thông số ộng học xô 2 .................................................. 37
Hình 2.6 Đồ thị tuyến tính các thông số ộng học xô 2 ................................................ 38
Hình 2.7 Đồ thị xác ịnh các thông số ộng học xô 3 .................................................. 39
Hình 2.8. Đồ thị tuyến tính các thông số ộng học xô 3 ............................................... 40
Hình 2.9 Đồ thị xác ịnh các thông số ộng học xô 4 .................................................. 41
Hình 2.10 Đồ thị tuyến tính các thông số ộng học xô 4 .............................................. 42
Hình 3.1 Chuẩn bị mẫu cho thí nghiệm 1 ...................................................................... 47
Hình 3.2 Chuẩn bị mẫu cho thí nghiệm 2 ...................................................................... 47
Hình 3.3 Chuẩn ộ COD dung dịch từ màu xanh chuyển sang màu nâu ỏ ................. 49
Hình 3.4 Biểu ồ so sánh hiệu suất xử lý ộ màu, COD ứng với các tỉ lệ H2O2 và Fe
khác nhau ....................................................................................................................... 51
Hình 3.5 Biểu ồ hiệu suất so sánh suất hiệu suất xử lý ộ màu, COD khi có xúc tác
Mn2+ ............................................................................................................................... 53
Hình 4.1 Tổng Coliforms bằng hóa chất NaOCl ........................................................... 64
Hình 4.2 Biểu ồ lượng Coliform xử lý bằng UV ......................................................... 65
Hình 5.1. Mẫu trong quá trình khuấy Jartest ................................................................. 74
Hình 5.2. Mẫu Photpho xác ịnh pH tối ưu ................................................................. 75
Hình 5.3. Đồ thị mối tương quan giữa pH, hiệu suất xử lý ộ ục và P (lọc, không lọc)
....................................................................................................................................... 76
Hình 5.4. Mẫu Photpho xác ịnh liều lượng Ca(OH)2 tối ưu ........................................ 78
Hình 5.5. Đồ thị mối tưn quan giữa lượng Vôi, hiệu suất xử lý ộ ục, P (lọc, không
lọc) ................................................................................................................................. 78
BÀI 1. KEO TỤ - TẠO BÔNG
1.1 Mục ích thí nghiệm
Giúp sinh viên làm quen với những kỹ năng cần thiết của người kỹ sư tương lai.
- Lý thuyết keo tụ tạo bông – lắng.
- Đánh giá khả năng keo tụ của từng loại phèn.
- Tìm ra iều kiện tối ưu cho từng loại nước thải.
- Luyện tập khả năng viết một báo cáo ký thuật.
1.2. Cơ sở lý thuyết
Xử lý bằng phương pháp keo tụ là cho vào trong nước một loại hóa chất gọi là chất keo
tụ có thể ủ làm cho các hạt rất nhỏ biến thành những hạt lớn lắng xuống. Thông thường quá
trình keo tụ tạo bông xảy ra qua hai giai oạn sau:
Giai oạn 1: Bản thân chất keo tụ phát sinh thuỷ phân, quá trình hình thành dung dịch keo và ngưng tụ.
Giai oạn 2: Trung hòa Khử trùng lọc các tạp chất trong nước. Kết quả của quá trình trên
là hình thành các hạt lớn lắng xuống.
Để thực hiện quá trình keo tụ, người ta cho vào nước các chất keo tụ thích hợp như phèn
nhôm, phèn sắt FeSO4 hoặc loại FeCl3. Các loại phèn này ược ưa vào nước dưới dạng dung dịch hòa tan.
Khi cho phèn nhôm vào nước, chúng phân li thành các ion Al3+. Sau ó, các ion này bị thuỷ phân thành Al(OH)3. Al3+ + 3H2O = Al(OH)3 + 3H+
Trong phản ứng thuỷ phân trên ây, ngoài Al(OH)3 (nhân tố quyết ịnh ến hiệu quả keo tụ)
ược tạo thành mà còn giải phóng ra ion H+. Các ion này sẽ ược khử bằng ộ kiềm tự nhiên của
nước ( ược ánh giá bằng HCO3- ). Trường hợp ộ kiềm tự nhiên của nước thấp, không ủ ể
trung hoà ion H+ thì cần phải kiềm hóa nước. Chất dùng ể kiềm hoá thông dụng là vôi. Một
số trường hợp khác có thể dùng soda (Na2CO3) hay xút (NaOH).
Sau ây là các yếu tố ảnh hưởng ến quá trình keo tụ tạo bông khi sử dụng PAC nhôm:
Trị số pH của nước
Nước thiên nhiên sau khi ã cho Al2(SO4)3 vào, trị số pH bị giảm thấp vì ây là một loại
muối gồm axit mạnh và bazơ yếu. Sự thuỷ phân của nó có thể tăng thêm tính axit của nước.
Đối với hiệu quả keo tụ, ảnh hưởng chủ yếu là trị số pH của nước sau khi cho phèn nhôm
vào. Cho nên trị số pH dưới ây ều là trị số pH của nước sau khi cho phèn nhôm vào. Lượng dùng chất keo tụ
Quá trình keo tụ không phải là một phản ứng hóa học ơn thuần, nên lượng phèn cho vào
không thể căn cứ vào tính toán ể xác ịnh. Tuỳ iều kiện cụ thể khác nhau, phải làm thực nghiệm
chuyên môn ể tìm ra lượng phèn cho vào tối ưu.
Lượng phèn tối ưu nói chung cho vào trong nước là 0.1 – 0.5 mg l/l, nếu dùng
Al2(SO4)3.18H2O thì tương ương 10 – 50 mg/l. Nói chung vật huyền phù trong nước cũng
nhiều, lượng chất keo tụ cần thiết cũng lớn. Cũng có thể chất hữu cơ trong nước tương ối ít
mà lượng chất keo tụ vẫn cần tương ối nhiều. Nhiệt ộ nước
Khi dùng muối nhôm làm chất keo tụ, nhiệt ộ nước ảnh hưởng lớn ến hiệu quả keo tụ.
Khi nhiệt ộ nước rất thấp (thấp hơn 5oC), bông sinh ra to và xốp, chủ yếu là nước, lắng xuống
rất chậm nên hiệu quả kém.
Khi dùng nhôm sunfat tiến hành keo tụ nước thiên nhiên, nhiệt ộ nước tốt nhất là 25 – 30oC.
Tốc ộ hỗn hợp của nước với chất keo tụ:
Quan hệ tốc ộ hỗn hợp của nước và chất keo tụ ến tính phân bổ ồng ều của chất keo tụ và
cơ hội va chạm giữa các hạt keo cũng là một nhân tố trọng yếu ảnh hưởng ến quá trình keo
tụ. Tốc ộ khuấy tốt nhất là từ nhanh chuyển sang chậm. Khi mới cho chất keo tụ vào nước,
phải khuấy nhanh, vì sự thuỷ phân của chất keo tụ trong nước và tốc ộ hình thành keo rất
nhanh. Cho nên phải khuấy nhanh mới có khả năng hình thành lượng lớn keo hydroxit hạt
nhỏ làm cho nó nhanh chóng khuếch tán ến các nơi trong nước kịp thời cùng với các tạp chất
trong nước tác dụng. Sau khi hỗn hợp hình thành bông cặn và lớn lên, không nên khuấy quá
nhanh, vì không những bông cặn khó lớn lên mà còn phá vỡ những bông cặn ã hình thành.
Tạp chất trong nước
Nếu cho các ion ngược dấu vào dung dịch nước có thể khiến dung dịch keo tụ. Cho nên
ion ngược dấu là một loại tạp chất ảnh hưởng ến quá trình keo tụ. Khi dùng Al2(SO4)3 làm
chất keo tụ, dung dịch keo Al(OH)3 hình thành thường mang iện tích dương nên ảnh hưởng
của tạp chất trong nước ến quá trình keo tụ dung dịch chủ yếu là anion. Môi chất tiếp xúc
Khi tiến hành keo tụ hoặc xử lý bằng phương pháp kết tủa khác, nếu trong nước duy trì
một lớp cặn bùn nhất ịnh sẽ làm cho quá trình kết tủa càng hoàn toàn, làm cho tốc ộ kết tủa
nhanh thêm. Lớp cặn bùn có tác dụng làm môi chất tiếp xúc, trên bề mặt của nó có tác dụng
Khử trùng, thúc ẩy và tác dụng của các hạt cặn bùn ó như những hạt nhân kết tinh. Cho nên
hiện nay thiết bị dùng ể keo tụ hoặc xử lý bằng kết tủa khác, phần lớn thiết kế có lớp cặn bùn.
Rất nhiều nhân tố ảnh hưởng ến hiệu quả keo tụ. Để tìm ra iều kiện tối ưu ể xử lý bằng
keo tụ, khi thiết kế thiết bị hoặc iều chỉnh vận hành, có thể trước tiên tiến hành thí nghiệm
mẫu ở phòng thí nghiệm bằng thiết bị jartest.
Hình 1.1 Mô hình thí nghiệ m jartest
1.3. Quy trình thực hiện thí nghiệm
Chuẩn bị mẫu: 15L nước sinh hoạt - kí túc xá Đại Học Quốc Gia cho vào 1.5g metyl blue vào.
Tại TN2 ở mẫu có than cho vào 0.4g than hoạt tính/1 cốc 400ml nước thải.
1.3.1 Thí nghiệm 1: Xác ịnh giá trị pH tối ưu
Bước 1: Định lượng hóa chất iều chỉnh pH
- Lấy 400ml mẫu nước thải cho vào cốc jartest.
- Cho vào cốc 2 ml phèn (10%).
- Dùng dung dịch NaOH 0.1N/H2SO4 0.1N iều chỉnh pH ến các giá trị 5, 5.5 ,6, 6.5, 7 ,7.5.
- Ghi nhận giá trị NaOH /H2SO4 ã dùng.
Bước 2: Keo tụ - tạo bông Lấy Lấy Lấy Lấy Lấy Lấy 2ml phèn 2ml phèn 2ml phèn 2ml phèn 2ml phèn 2ml phèn + + + + + + Lượng hóa Lượng hóa Lượng hóa Lượng hóa Lượng hóa Lượng hóa chất nâng hạ chất nâng hạ chất nâng hạ chất nâng hạ chất nâng hạ chất nâng hạ pH ã xác pH ã xác pH ã xác pH ã xác pH ã xác pH ã xác
ịnh ở bước 1 ịnh ở bước 1 ịnh ở bước 1 ịnh ở bước 1 ịnh ở bước 1 ịnh ở bước 1 ↓ ↓ ↓ ↓ ↓ ↓ pH=5 pH=5.5 pH=6 pH=6.5 pH=7 pH=7.5
Đưa vào giàn Jartest khuấy với tốc ộ 100 vòng/ phút
Sau 1 phút iều chỉnh chậm lại trong 15 phút tốc ộ 15 vòng/ phút Lắng tĩnh 30p
Lấy mẫu nước ã lắng o pH, ộ màu, COD Tại ộ màu COD
thấp nhất lấy pH tương ứng làm pH tối ưu
Lưu ý: pH tối ưu ( o sau khi lắng) là ứng với mẫu có ộ màu thấp nhất.
1.3.2 Thí nghiệm 2: Xác ịnh liều lượng phèn tối ưu 400ml mẫu 0.5ml phèn
1ml phèn 1.5ml phèn 2ml phèn 2.5ml phèn 3ml phèn ↓ ↓ ↓ ↓ ↓ ↓
Cho lượng hóa chất NaOH, H2SO4 ể ược pH tối ưu ã xác ịnh ở TN1 cùng lúc
Đưa vào giàn Jartest khuấy với tốc ộ 100 vòng/ phút
Sau 1 phút iều chỉnh chậm lại trong 15 phút tốc ộ 15 vòng/ phút Lắng tĩnh 30p
Lấy mẫu nước ã lắng o pH, ộ màu, COD
Tại ộ màu, COD thấp nhất lấy lượng phèn tương ứng làm lượng phèn tối ưu
Liều lượng phèn tối ưu là liều lượng phèn ứng với mẫu có ộ màu, COD thấp nhất.
1.3.3 Thí nghiệm 3: Xác ịnh thời gian keo tụ tối ưu
Bước 1: Xác ịnh thời gian keo tụ tối ưu
- Lấy cốc cho 400 mL nước thải
- Chỉnh mẫu nước tại pH tối ưu và lượng phèn tối ưu xác ịnh tại các bước trên.
- Đặt cốc vào giàn Jartest
- Điều chỉnh vòng khuấy chậm lại ở tốc ộ 15 – 20 vòng/ phút.
- Lấy mẫu sau 30 phút, 60 phút, 90 phút (lọc qua giấy lọc – pha loãng 2 lần + 10ml nước cất).
Bước 2: Phân tích mẫu
Lấy mẫu nước lắng (lớp nước ở phía trên, lấy dưới lớp váng bề mặt) phân tích chỉ tiêu pH, ộ màu, COD.
Thời gian tối ưu là thời gian ứng với mẫu có ộ màu, COD thấp nhất.
1.4. Kết quả thí nghiệm và nhận xét
1.4.1. Thông số ầu vào
Mẫu trắng không un V0 = 2.2ml Mẫu trắng un V0 = 1.9ml
Bảng 1.1 Thông số ầu vào pH COD Độ màu, A 6.55 V 0.21 FAS = 1,5 ml
Phương trình ường chuẩn ộ màu: y = 0.006x + 0.001 R2 = 0.9953 Chọn bước sóng 455mm
Nồng ộ màu của nước là C = 34.83 mg/L. 1.5 × 0.1 (1.9 − 1.5) × × 8000 COD = 2.2= 87.27mg/l 2.5 1.4.2.
Xác ịnh pH tối ưu:
Bảng 1.2 Thông số thí nghiệm pH tối ưu pH 5 5.5 6 6.5 7 7.5
pH sau khi bỏ phèn nhôm 4.02 4.02 4.02 4.02 4.02 4.02 V NaOH 7.5 8.75 10.75 13.25 14.5 15.4 pH sau 6.29 6.32 6.64 5.91 7.16 7.54 Độ màu (mg/l) 23.17 2.33 2.67 1.67 3.5 1.83 HSXL màu (%) 33.48 93.31 92.33 95.21 89.95 94.75 COD (mg/L) 65.45 76.36 54.54 10.9 21.81 32.72 HSXL COD (%) 25 12.5 37.5 87.51 75 62.5
Chọn pH tối ưu là pH = 5.91
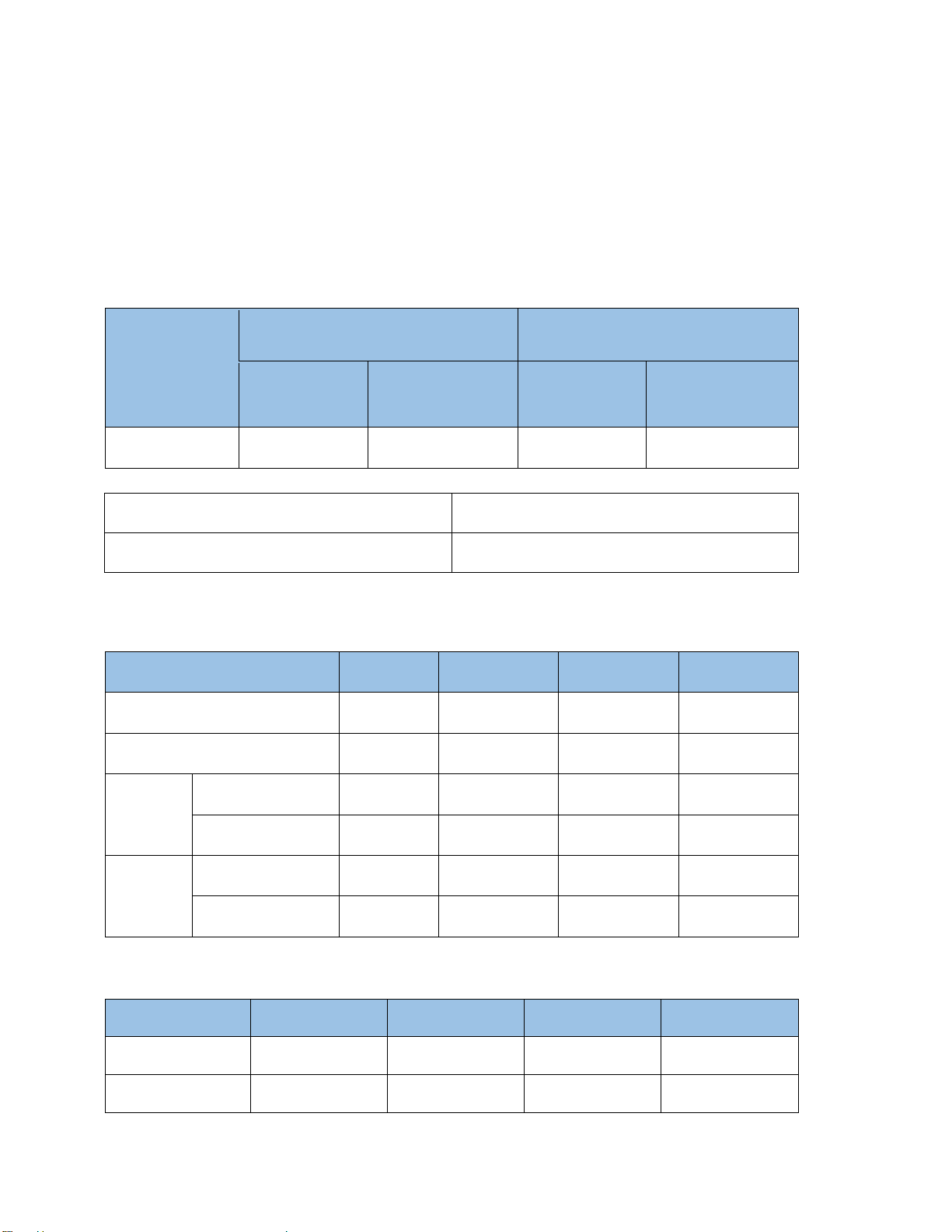
Mối tương quan giữa pH và hiệu quả xử lý COD, ộ màu:
Biểu ồ thể hiện mối tương quan giữa hiệu suất xử lý COD, pH 100 90 80 70 60 50 40 30 20 10 0 5 5.5 6 6.5 7 7.5 pH
Hiệu suất xử lí ộ màu Hiệu suất xử lí COD
Hình 1.2 Đồ thị thể hiện mối liên hệ giữa pH và hiệu quả xử lý COD, màu. Nhận xét: Theo như thí nghiệm:
- Ở COD thì khi pH 6.29. 6.32, 6.64, 5.91 hiệu suất xử lí cũng tăng lần lượt và ỉnh iểm
là tại pH 5.91 hiệu suất xử lí ạt 87.51 %, sau mức ỉnh iểm thì hiệu suất giảm dần theo pH lần
lượt 7.16, 7.54 ứng với % hiệu suất là 75, 62.5%.
- Ở ộ màu tại pH 6.59 có hiệu suất xử lí kém nhất, sau ó từ pH 6.32, 6.64, 5.91, 7.16,
7.54 hiệu suất tăng lần lượt 93.31, 92.33, 95.21, 89.95, 94.75. Tuy nhiên ể lựa chọn, chúng
ta sẽ lựa chọn tại vị trí có hiệu suất xử lí ộ màu cao nhất là 95.21% tại pH 5.91.
- Chọn pH tối ưu của thí nghiệm tại pH 5.91, pH o ược sau khi lắng
- Tuy nhiên tjai ây vẫn có một vài sự chênh lệch số liệu do sai số từ quá trình thao tác kĩ
thuật thí nghiệm, vì vậy từ ây rút ra bài học cho sinh viên, khi thao tác thí nghiệm cần chuẩn
bị kĩ, và thao tác thật chuẩn ể tránh ược các sai số không áng có.
1.4.3. Xác inh liều lượng PAC tối ưu:
Bảng 1.3 Thông số của thí nghiệm xác inh PAC tối ưu Phèn nhôm 0,5 1 1,5 2 2,5 3 NaOH 3 8 11,1 15 20.5 24 pHsau 6 4.72 4.22 4.11 4 3.96 Độ màu 11.83 6.67 17.33 8 5.5 9.83 Hiệu suất xử lí ộ 66 80.85 50 77 84 71.78 màu (%) Độ màu có than 43.5 10 7.5 6 9.33 6.83 Hiệu suất xử lí ộ -25 71.29 78.5 82.8 73.2 80.4 màu có than (%) COD 80.72 61 43.64 54.54 19.63 50.18 Hiệu suất xử lí 7.5 30 50 37.5 77.5 42.5 nồng ộ COD (%) COD có than 414 65.45 87.27 32.72 43.63 41.45 Hiệu suất xử lí -374 25 0 62.5 50 52.5 nồng ộ COD có than (%)
Lượng phèn tối ưu là 2,5ml
Lượng phèn tối ưu ở mẫu có than là 2ml
Biểu ồ thể hiện mối tương quan giữa hiệu suất xử lý COD với lượng PAC 90 80 70 60 50 40 30 20 10 0 0.5 1 1.5 2 2.5 3 Lượng PAC tương ứng
Hiệu suất xử lí ộ màu
Hiệu suất xử lí nồng ộ COD
H ì nh 1.3 M ối tương quan giữ a PAC v ớ i hi ệ u qu ả x ử lý COD, màu Nh ận xét:
- Lượng phèn cho vào trong thí nghiệm sẽ quyết ịnh ến hiệu quả thí nghiệm, dư lượng
phèn trong nước không làm hiệu quả xử lý chất ô nhiễm cao lên mà còn làm tiêu tốn hóa chất
và làm dư lượng phèn trong nước xử lý ầu ra. Khi lượng phèn cho vào là tối ưu thì hiệu quả
xử lý COD và ộ màu cũng ạt hiệu quả cao nhất.
- Nhìn vào biểu ồ trên, ta thấy ối với lượng PAC là 2.5ml thì cho ra hiệu suất xử lý
COD và ộ màu cao nhất, chứng tỏ lượng PAC tối ưu cho quá trình là 2.5ml.
- Tuy nhiên bên cạnh ó tại lượng PAC là 2ml và 3 ml hiệu quả xử lí COD lại kém
i, tại lượng PAC 1, 1.5, 2, 3ml có sự chênh lệch không hợp lí, chứng tỏ tại ây có sự sai
số, sai xót về mặt kĩ thuật và thao tác, tuy nhiên tại ây có vài sự chênh lệch khá lớn vì
vậy sinh viên thực hiện cần khắc phục tình trạng trên ể tránh sai số một cách tối thiểu.
Biểu ồ thể hiện mối tương quan giữa hiệu suất xử lý COD với lượng PAC 100 100 50 80 0 60 -50 -100 40 -150 20 -200 -250 0 0.5 1 1.5 2 2.5 3 -300 -20 -350 -40 -400 Lượng PAC lương ứng
Hiệu suất xử lí ộ màu có than
Hiệu suất xử lsi nồng ộ COD có than
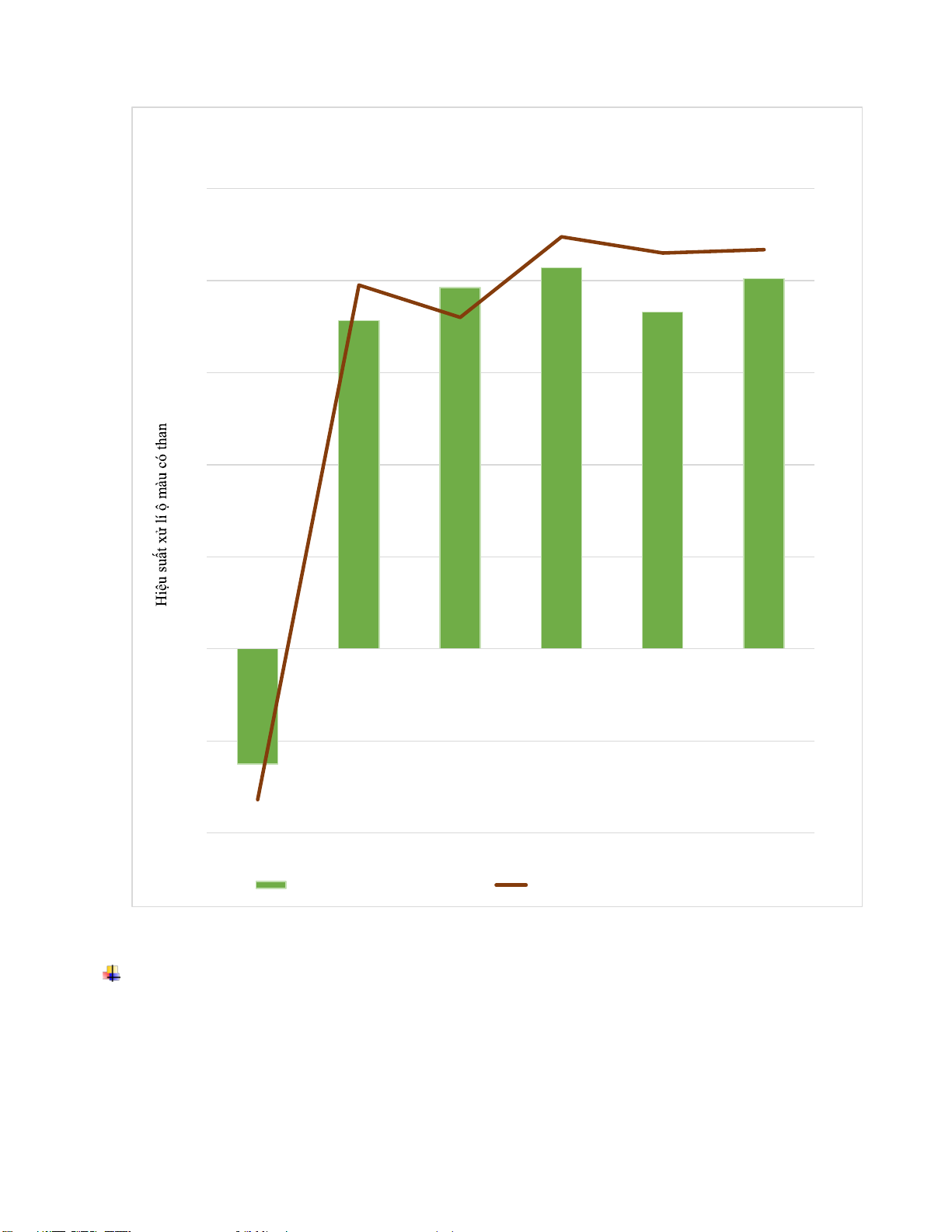
Hình 1.4 Mối tương quan giữa PAC với hiệu quả xử lý COD, màu mẫu có than: Nhận xét:
- Từ biểu ồ cho chúng ta thấy khi có sự tham gia của than chưa rửa sạch, tại mẫu có PAC
0.5ml hiệu quả xử lí rất kém, thậm chí là ộ màu và COD tăng hơn so với ban ầu.
- Tuy nhiên từ mẫu PAC 1, 1.5, 2, 2.5, 3 ml thì hiệu suất xử lí trở nên ổn ịnh hơn, nhưng
vẫn còn sự chênh lệch không áng có, vì vậy khi thực hiện thí nghiệm sinh viên lưu ý cần thao
tác về mặt kĩ thuật thật chuẩn, ể tránh ược các tình trạng sai số diễn ra một cách tối thiểu nhất.
- Từ mặt số liệu và biểu ồ ta rút ra ược tại PAC 2ml là tối ưu cho quá trình, vì chúng ta
ược hiệu quả xử lí COD ộ màu cao nhất tại vị trí này.
1.4.4. Xác ịnh thời gian tối ưu:
Bảng1.4 Thông số thí nghiệm xác ịnh thời gian tối ưu. Thời gian 30 phút 60 phút 90 phút pHsau 7.12 5.96 6.6 pHsau có than 6.6 6.7 6.6 Độ màu 3.5 1.83 1 HSXL màu (%) 90 95 97 Độ màu có than 5.67 2.33 1.33 HSXL màu có than (%) 84 93 96 COD 43.63 10.9 21.8 HSXL COD (%) 50 88 75 COD có than 0 54.54 43.63 HSXL COD có than (%) 100 37.5 50 Pha loãng 5 lần.
Thời gian tối ưu là 60 phút.
Thời gian tối ưu tại có than 30 phút
Mối tương quan giữa thời gian và hiệu suất xử lý COD, màu:
Biểu ồ thể hiện mối tương quan giữa hiệu suất xử lý COD và thời gian 100 90 80 70 60 50 40 30 20 10 0 30 60 90 Thời gian HSXL màu HSXL COD
Hình 1.5 Đồ thị thể hiện mối tương quan giữa thời gian và hiệu suất xử lý COD, màu Nhận xét:
- Thời gian thí nghiệm sẽ quyết ịnh ến hiệu quả thí nghiệm, khi thời gian vừa dư làm cho
kết quả trở nên thuận lợi nhất và tốt nhất, ược cho thấy là ộ màu, COD thấp nhấp so với các
chỉ tiêu thời gian khác.
- Theo như thí nghiệm trên, thời gian tối ưu nhất là 60 phút vì tại ây cho hiệu suất
xử lý COD và ộ màu cao nhất, ạt ược hiệu suất là 88% ối với COD và 95% ối với ộ
màu, mặc dù 90 phút cho kết quả cao hơn nhưng chờ 30 phút ể lấy thêm 2% hiệu quả
xử lý màu là quá tốn thời gian, và bên cạnh ó hiệu quả xử lí COD cũng thấp hơn so với thời iểm 60 phút.
- Chọn thời gian tối ưu là 60 phút.
Biểu ồ thể hiện mối tương quan giữa hiệu suất xử lý COD và thời gian mẫu có than 120 100 80 60 40 20 0 30 60 90 Thời gian HSXL màu có than HSXL COD có than
Hình 1.6 Đồ thị thể hiện mối tương quan giữa thời gian và hiệu suất xử lý COD,
màu của mẫu có than Nhận xét:
- Theo như thí nghiệm trên, thời gian tối ưu nhất là 30 phút vì tại ây cho hiệu suất xử lý
COD và ộ màu cao nhất, ạt ược hiệu suất là 100% ối với COD và 84% ối với ộ màu, mặc dù
90 phút cho kết quả cao hơn nhưng chờ 60 phút ể lấy thêm 12% hiệu quả xử lý màu là quá
tốn thời gian, và bên cạnh ó hiệu quả xử lí COD cũng thấp hơn so với thời iểm 30 phút.
- Chọn thời gian tối ưu tại mẫu có than là 30 phút.
- Tại ây có thể do sự tham gia của than khi chưa rửa nên về mặt kĩ thuật có thể số liệu ã
xảy ra sai xót, vì vậy khi thao tác chúng ta cần khắc phục những lỗi trên tránh tình trạng xảy ra sai số không áng có.
1.5. Trả lời câu hỏi
Câu 1. Hãy nêu cơ chế quá trình keo tụ tạo bông trong xử lí nước thải?
- Phản ứng 1: Hấp phụ ban ầu ở liều lượng PAC tối ưu. Phân tử polime dính vào hạt keo.
- Phản ứng 2: Hình thành bông cặn. Đuôi PAC ã hấp phụ có thể duỗi ra và gắn kết với vị
trí trống trên bề mặt hạt keo khác → hình thành bông cặn.
- Phản ứng 3: Hấp phụ lần hai của PAC. Nếu oạn cuối duỗi ra và không tiếp xúc với vị
trí trống trên hạt khác và gấp lại → tiếp xúc với mặt khác của chính hạt ó → ổn ịnh lại
- Phản ứng 4: Khi liều lượng PAC dư. Nếu PAC thêm vào dư nhiều, bề mặt hạt bão hòa
các oạn PAC → không có vị trí trống ể hình thành cầu nối → hạt keo ổn ịnh trở lại
- Phản ứng 5: Vỡ bông cặn, vỡ vụn bông cặn khi xáo trộn nhiều.
Trong toàn bộ quá trình (5 phản ứng trên), Cơ chế chính là: Hấp phụ và tạo cầu nối. Cơ
chế phụ là: Trung hòa iện tích.
Câu 2. Tại sao cần thực hiện thí nghiệm 1?
Thực hiện thí nghiệm 1 vì việc thực hiện thí nghiệm 2 òi hỏi thời gian lớn ể iều chỉnh
từng cốc và ể phản ứng xảy ra ồng thời cho 6 cốc.
Câu 3. So sánh quá trình keo tụ tạo bông trong xử lí nước thải và nước cấp?
Quá trình keo tụ tạo bông trong nước thải có hiệu quả thấp hơn trong nước cấp do tính
chất của nước thải có chứa nhiều tạp chất và chất rắn lơ lửng không thể keo tụ. Do ó, quá
trình keo tụ trong nước thải yêu cầu sử dụng lượng hóa chất lớn hơn so với quá trình keo tụ trong nước cấp.
BÀI 2 PHƯƠNG PHÁP BÙN HOẠT TÍNH
2.1 Mục ích thí nghiệm
- Làm quen với phương pháp xử lý nước thải bằng vi sinh vật
- Đánh giá khả năng xử lý của bùn hoạt tính
- Xác ịnh các giá trị thông số ộng học
2.2 Cơ sở lý thuyết
2.2.1 Mục ích của quá trình sinh học trong nước thải
Chuyển hóa các hợp chất hữu cơ hòa tan và chất dễ phân hủy thành sản phẩm cuối chấp nhận ược (CO2, H2O, N2);
Nitơ, Photpho sẽ ược phân hủy hoặc chuyển hóa;
Bông bùn sinh học hay màng sinh học là quá trình của việc kết tụ cặn lơ lửng và chất keo không lắng;
Khử một số hợp chất và chất hữu cơ dang vết.
2.2.3 Hiện tượng cơ bản xảy ra trong quá trình oxy hóa sinh học
Sử dụng các hợp chất hữu cơ ể tổng hợp sinh khối
Duy trì hoạt ộng sống tế bào: sinh trưởng, sinh sản, tích lũy dinh dưỡng, bài tiết sản phẩm
Phương trình phản ứng xảy ra
CXHyOz + O2 + NH3 → tế bào mới + CO2 + H2O + NO3
2.2.4 Yếu tố ảnh hưởng ến quá trình phân hủy sinh học
Yếu tố ảnh hưởng bao gồm: Nhiệt ộ, pH, dinh dưỡng, ộ măn, DO, Ion chất ộc….. 2.2.5.
Xác ịnh các thông số ộng học Y, kd, 𝝁𝒎, Ks - Tại pha log: r t = dX/dt = 𝜇 X (1)
Trong ó: X: nồng ộ bùn hoạt tính, mg/L
𝜇: tốc ộ tăng trưởng riêng của bùn vi sinh, 1/giây t: thời gian thổi khí, (s)
𝑟t: tốc ộ tăng trưởng của vi khuẩn, mg/L.giây
- Trong trường hợp nuôi cấy theo mẻ, áp dụng theo phương trình Monod: 𝑆
𝜇 = 𝜇 𝑚 𝐾 𝑆 +𝑆 (2)
Trong ó: 𝜇: tốc ộ tăng trưởng riêng, L/s
𝜇𝑚: tốc ộ tăng trưởng riêng cực ại, L/s
𝑆: nồng ộ chất thải nền trong nước thải
KS: hằng số bán tốc ộ, mg/L
- Do trong quá trình xử lý, một phần các chất hữu cơ bị oxy hóa thành tế bào mới, một phần
bị oxy hóa thành các chất hữu cơ và các chất vô cơ ổn ịnh. Vì vậy, có thể thiết lập quan hệ
giữa tốc ộ tăng trưởng và lượng chất nền ược sử dụng. r t = -Y.r d (3)
Trong ó: Y: hệ số sản lượng tế bào, mg/mg
rd: tốc ộ sử dụng chất nền, g/m3.s 𝑄 𝑆 0 − 𝑆
r d = − 𝑉 (S 0 - S) = − 𝜃 (4)
Trong ó: Q: lưu lượng nước thải, m3/ngày V: thể tích bể BHT, m3
S0: nồng ộ BOD ban ầu, mg/L
S: nồng ộ BOD tại thời iểm xác ịnh, mg/L
𝜃: thời gian lưu nước, ngày hoặc giờ
Thời gian lưu nước trong hệ thống ược xác ịnh theo phương trình sau: 1 𝑟 𝑑
Trong ó: kd: tốc ộ sử dụng cơ = −𝑌 − 𝑘𝑑 (5) 𝜃 𝑋
chất riêng tối a, 1/ngày
Từ các phương trình (1), (2), (3), (4), (5) xây dựng ồ thị tuyến tính ể xác ịnh các giá trị thông
số ộng học Y; kd; 𝜇𝑚; Ks.
2.3 Quy trình thực hiện thí nghiệm
Chuẩn bị mẫu nước: Lấy bùn lắng, nuôi vi sinh vật hiếu khí bằng cách sục khí + ăn ường
2.3.1 Mô hình thực hiện thí nghiệm
- Bướ c 1: Xác ịnh các thông số ầ u vào pH ban ầu
Hàm lượng SS (MLSS, MLVSS) Đo COD Đo BOD
- Bướ c 2: Mô hình thí nghiệ m
- Bước 3: Lấy mẫu ở các thời iểm
- Bước 4: Xác ịnh các chỉ tiêu
- Bướ c 5: M ẫ u 2 gi ờ chi ề u
2.3.2 Xác ịnh thông số bùn Lấy V 1 (bùn) Lọc
Sấy ở 105℃→ Xác ịnh m ss (MLSS)
Tiếp tục sấy ở 550 ℃→ Xác ịnh MLVSS 2.3.3 Xác ịnh COD
Rửa ống COD bằng dung dịch H2SO4 20%
Lấy 2,5 mL mẫu + 1,5 𝐾2 𝐶𝑟2𝑂7 0.1N + 3,5 mL H2SO4 vào ống COD
(phản ứng xảy ra mạnh nên cho axit chảy
dọc theo thành ống nghiệm)
Cho ống COD vào tủ sấy, nung ở 150℃ trong 2h
Lấy ống COD ra ể nguội, ổ ra erlen + 2 giọt feroin Định phân bằng FAS 0.1N
(kết thúc chuẩn khi dd chuyển từ màu xanh sang nâu ỏ 1.5 × 0.1
(Vđun − Vmẫu) × Vo đun × 8 × 1000 Công thức: COD mgO2/L = 2.5
Tương tự, làm như vậy với 2 mẫu trắng (1 mẫu trắng un, 1 mẫu trắng không un).
2.3.4 Hàm lượng SS a) Chuẩn bị
Làm khô cốc ở nhiệt ộ 103℃ - 105℃ trong 1 giờ
Nung cốc 1h ở nhiệt ộ 550℃ ± 50℃ trong tủ nung (Nếu xác ịnh MLVSS)
Làm nguội cốc trong bình hút ẩm ến
nhiệt ộ cân bằng, trong 1 giờ Cân Po (mg) b) Xác ịnh MLSS Lấy 5mL bùn
Chuyển mẫu có dung tích ã
ược xáo trộn vào cốc ã cân
Làm bay hơi nước trong tủ sấy ở nhiệt ộ 103℃ - 105℃
Làm nguội trong bình hút ẩm ến nhiệt ộ cân bằng (trong 1h) Cân P 1 (mg) (P1 − P0) × 1000 MLSS = VmL mẫu c) Xác ịnh MLVSS
Thực hiện các bước như phần xác ịnh MLSS
Nung cốc trong tủ nung ở nhiệt ộ 550 ℃± 50 ℃
Làm nguội trong bình hút ẩm ến nhiệt ộ cân bằng (trong 1h) Cân P 2 (mg) (P1 − P2) × 1000 MLVSS = VmL mẫu
c) Xác ịnh chỉ số SVI Ống ong 1000mL Đợi 30 phút Cho bùn vào Ghi lại lắng V V × 1000 SVI = MLSS 2.3.5 Xác ịnh DO
2.3.6 Xác ịnh BOD5
Dùng NaOH hoặc H2SO4 ể trung hòa dung dịch mẫu ến pH = 7 – 7.5
Lấy thể tích mẫu thích hợp cho vô chai BOD Thêm vào 1mL dung dịch Đệm MgSO phosphate 4 CaCl 2 FeCl 2 Nh 4 Cl
Cho chai BOD vào tủ iều nhiệt giữ ở 20 ℃
Để ổn ịnh sau 20ph sau ó cho KOH vào
Vặn nút cao su úng vị trí ậy kín miệng chai
Sau 5 ngày, ọc kết quả chuẩn ộ trực tiếp
2. 4 Kết quả thí nghiệm
2.4.1 Xác ịnh thông số ầu vào của nước
Mẫu trắng không nung: VFAS = 1.5mL
Mẫu trắng nung: VFAS = 1.45mL
Bảng 2.1. Thông số ầu vào pH COD SS (100mL) BOD m0 = 0.112 g BOD ầu vào = 3.47mg/L 6.2 VFAS = 1.1mL m1 = 0.145 g BOD5 ầu ra = 1.56 mg/L Giá trị 112 330 mg/L 287 mg/L 1.5 × 0.1 mgO2
(Vđun − Vmẫu) × Vo đun × 8 × 1000 COD = L 2.5 1.5 × 0.1 (1.45 − 1.1) × × 8 × 1000 = 1.5= 112 mgO2/L 2.5 (m1 − m0) × 1000 (0.145 − 0.112) × 1000 SS = == 330 mg/L V 0.1
2.4.2. Xác ịnh thông số ầu vào của bùn (P1 − Po) × 1000 (25.0962 − 23.1878) × 1000 mg MLSS = = = 381.68 VmL mẫu 5 mL = 381690 mg/L (P1 − P2) × 1000 (25.0962 − 23.518) × 1000 MLVSS = = = 315.64 mg/mL VmL mẫu 5 Trong ó:
P0 = 23.1878 g. Khối lượng cốc sau khi sấy ở 105oC
P1 = 25.0962 g. Khối lượng cốc và mẫu sau khi sấy ở 105oC
P2 = 23.518 g. Khối lượng cốc và mẫu sau khi nung ở 550oC
Vml mẫu = 5 mL. Thể tích mẫu sử dụng Chỉ số thể tích bùn V×1000 SVI =
23.58 mL/g Bùn kết cụm MLSS
2.4.3. Nồng ộ bùn giả thuyết
Dựa vào MLSS ban ầu của mẫu ta pha loãng với nước thải ể ra nồng ộ bùn phù hợp. Áp dụng
công thức C1.V1= C2.V2 ta tính ược lượng bùn cần cho vô ể pha loãng ra nồng ộ thích hợp
Bảng 2.2 Nồng ộ bùn giả thuyết Nồng ộ bùn 500 1000 2000 3000 V bùn (mL) 2.6 mL 5.24 mL 10.48 mL 15.72 mL
2.4.4. Các thông số tại các nồng ộ bùn theo thời gian
Bảng 2.3 Bể 1 nồng ọ bùn 500mg/L Thời gian 30 phút 60 phút 120 phút
180 phút 2 giờ chiều pH 3.5 6.9 6.9 4.6 6.9 SS mg/L 312 285 250 234 212 COD mg/L 108 96 87 80 78 SVI ml/g - - - - 250 BOD5 (mg/L) - - - - 223
Bảng 2.4 Bể 2 nồng ộ bùn 1000mg/L Thời gian 30 phút 60 phút 120 phút
180 phút 2 giờ chiều pH 4.3 7 7.1 6.5 7 SS mg/L 110 75 62 58 54 COD mg/L 102 81 74 58 47 SVI ml/g - - - - 129.63 BOD5 (mg/L) - - - - 110
Bảng 2.5 Bể 3 nồng ộ bùn 2000mg/L Thời gian 30 phút 60 phút 120 phút
180 phút 2 giờ chiều pH 6.2 6.7 7.1 6.7 6.9 SS mg/L 302 285 263 221 195 COD mg/L 92 76 62 43 40 SVI ml/g - - - - 76.9 BOD5 (mg/L) - - - - 205
Bảng 2.6 Bể 4 nồng ộ bùn 3000mg/L Thời gian 30 phút 60 phút 120 phút
180 phút 2 giờ chiều pH 6.6 6.4 6.5 6.9 7 SS mg/L 165 153 121 101 85 COD mg/L 85 74 61 45 38 SVI ml/g - - - - 235.3 BOD5 (mg/L) - - - - 164
2.5 Xử lý số liệu
Bảng 2.7 Mối tương quan giữa pH và thời gian xử lý Thời gian 30 phút 60 phút 120 phút
180 phút 2 giờ chiều Bể 1 3.5 6.9 6.9 4.6 6.9 Bể 2 4.3 7 7.1 6.5 7 pH Bể 3 6.2 6.7 7.1 6.7 6.9 Bể 4 6.6 6.4 6.5 6.9 7
Biểu ồ thể hiện mối tương quan giữa phHvà thời gian xử lý 8 7 6 5 4 3 2 1 0 30 phút 60 phút 120 p hút 180 phút 2 PM Thời gian Bể 1 Bể 2 Bể 3 Bể 4
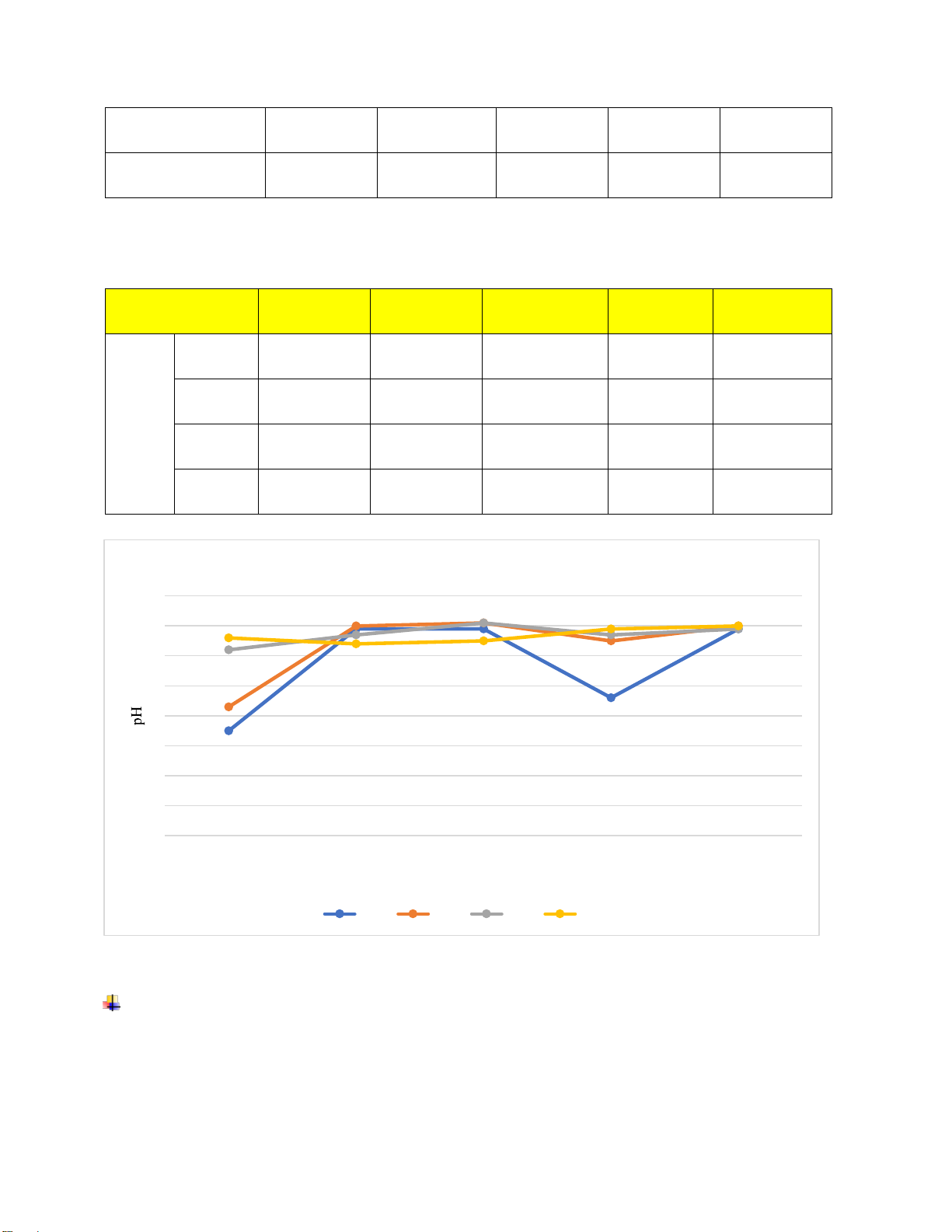
Hình 2.1 Biểu ồ thể hiện mối tương quan giữa pH và thời gian xử lý Nhận xét:
Biểu ồ có sự mất cân bằng giữa các nồng ộ khác nhau. pH của các nồng ộ có xu hướng khác nhau rõ rệt
Tại bể 2 và bể 3 có xu hướng giống nhau ều tăng lên trong khoản thời gian ầu và giảm
nhẹ tại thời iểm 180 phút. Lí giải cho iều này bởi vào giai oạn ầu, lúc ó vi sinh vật ang thích
nghi với môi trường, vi sinh vật hấp thụ cơ chất ể tăng sinh khối nên làm pH của nước tăng.
Càng về sau dinh dưỡng trong nguồn nước không ủ cung cấp cho vi sinh vật nên vi sinh vật
tiến hành phân huỷ nội bào khiến lượng vi sinh vật giảm làm giảm pH tại iểm 180 phút và
sau ó vi sinh vật tái sử dụng lượng dinh dưỡng và phát triển trở lại khiến pH tăng nhẹ trong thời gian ngắn
Tại bể 1 cũng xảy ra hiện tượng giống bể 2 và 3 nhưng vì nồng ộ vi sinh vật ban ầu thấp
nên khi quá trình phân huỷ nội bào xảy ra khiến pH giảm sâu hơn bể 2 và bể 3.
Riêng bể 4 có sự khác biệt là pH không dao ộng quá nhiều trong suốt quá trình. Vì hàm
lượng vi sinh vật nhiều nên khả năng xử lí xảy ra mạnh tại thời gian ầu nên quá trình về sau
không có sự biến ổi nhiều trong tính chất nước. Và quá trình phân huỷ sinh bào không diễn ra trong bể 4.
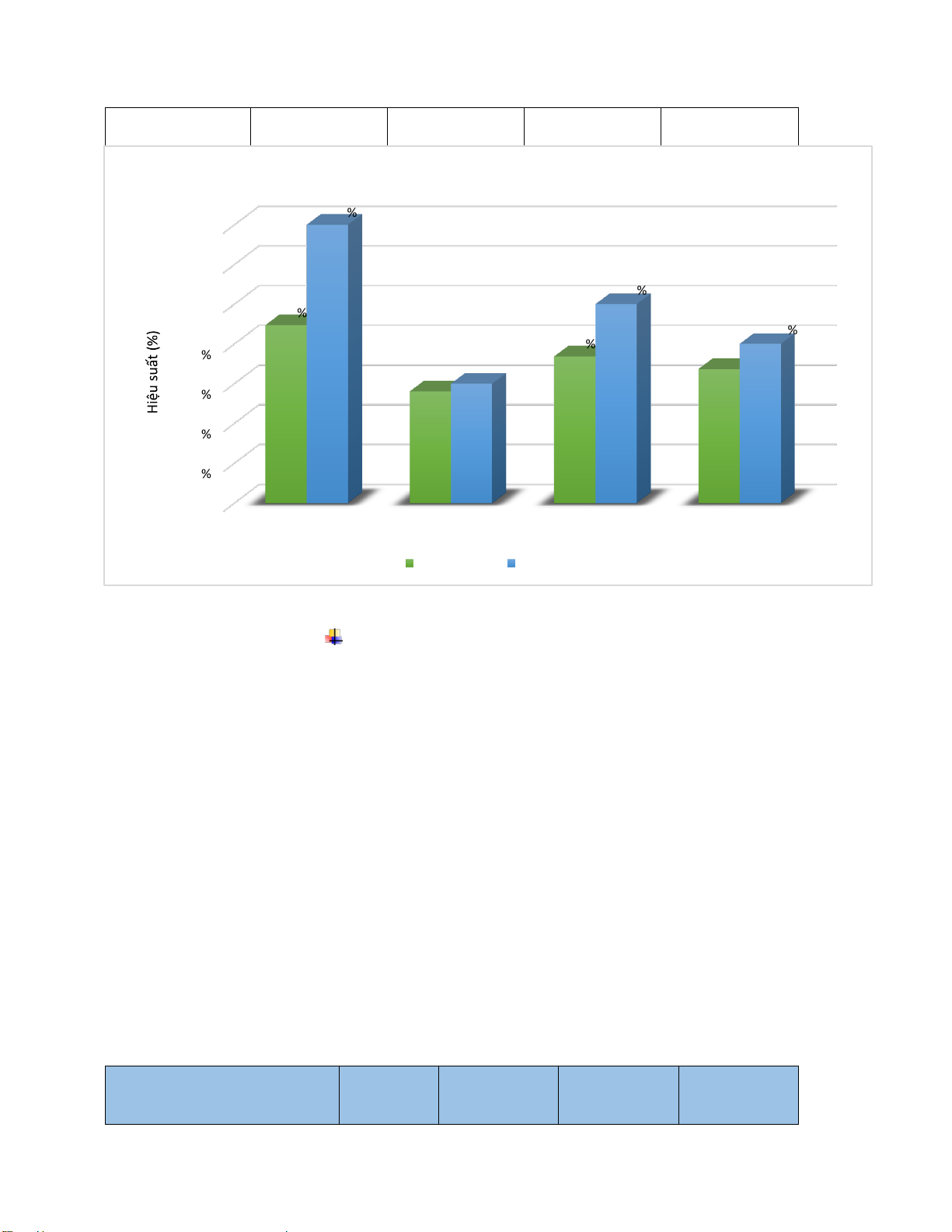
Mối quan hệ giữa hiệu quả xử lý COD và thời gian
Bảng 2.8 Kết quả hiệu suất xử lý của COD % Thời gian 30 phút 60 phút 120 phút 180 phút 2 giờ chiều Bể 1 3.6 14.3 22.3 28.6 30.4 Bể 2 9 26.7 33.9 48.2 58 Bể 3 17.85 32.2 44.7 61.6 64.3 Bể 4 24.1 33.9 45.6 60 66 Hiệu suất xử lí (%) 70 60 50 40 30 20 10 0 30 phút 1 ti ếng 2 ti ếng 3 ti ếng 2pm Bể 1 Bể 2 Bể 3 Bể 4
Hình 2 .2 Đồ thị hiệu suất xử lý Nh ận xét:
Theo ồ thị ta có thể thấy càng lâu thì hiệu suất xử lí COD tăng dần theo thời gian nhờ sự
tăng trưởng của vi sinh vật do vi sinh vật sử dụng COD làm chất hữu cơ ể phát triển sinh
khối. Do ó lượng vi sinh vật tăng lên ồng nghĩa với lượng COD giảm i.
Ở bể 3 và 4 cho hiệu suất ra hiệu suất xử lí gần như bằng nhau tại mọi thời iểm và có thời
iểm bể 3 có hiệu suất xử lí tốt hơn bể 4 tại khoảng 3 tiếng. Lí giải cho việc này là do tại thời
iểm 3 tiếng bể số 3 xảy ra hiện tượng phân huỷ phân bào và chứng minh cho việc này là do
pH giảm xuống. Đồng nghĩa với việc tại thời iểm 3 tiếng hiệu suất xử lí tối a của vi sinh vật.
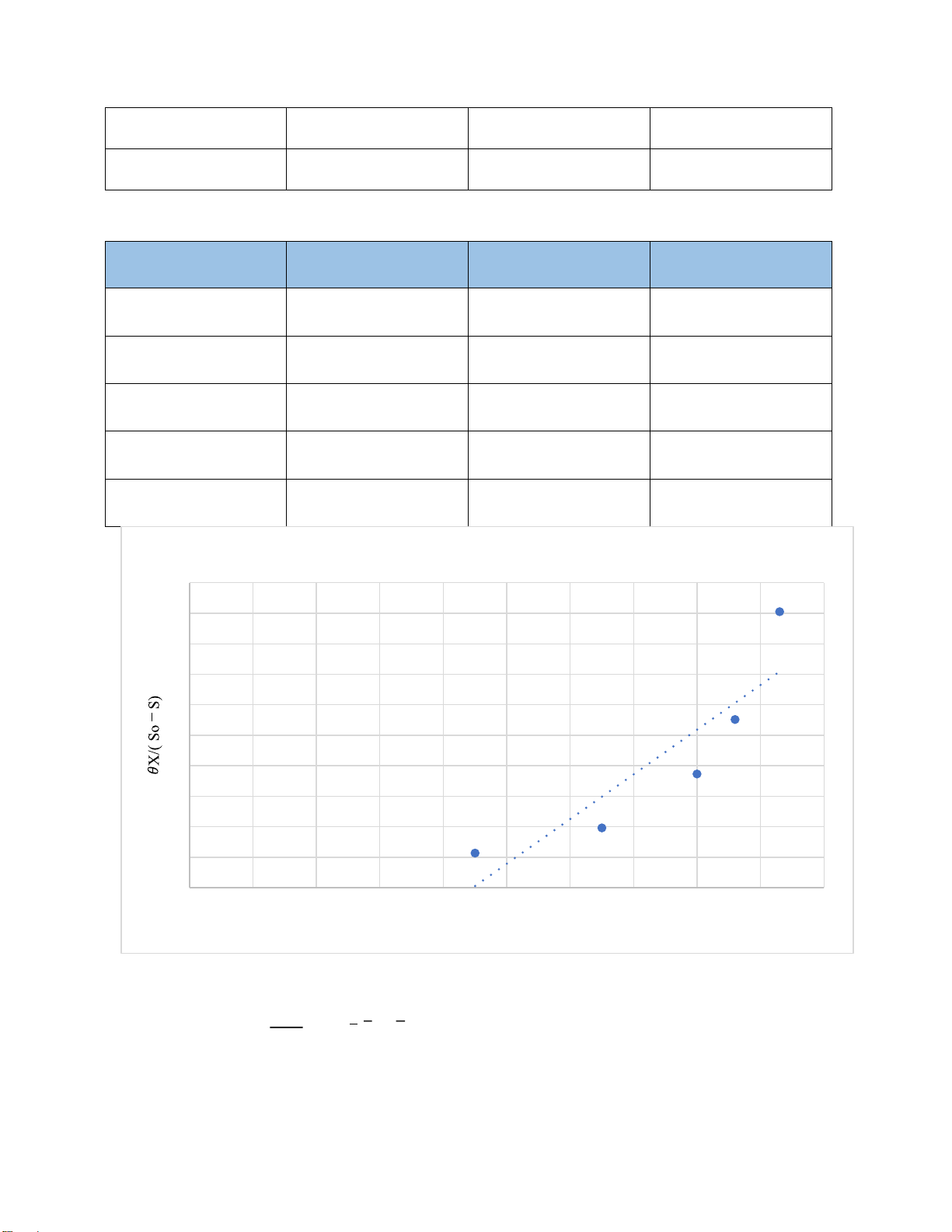
Xác ịnh các giá trị thông số ộng học Xô 1:
Bảng 2.9 Số liệu thực bể 1. So (mg/l) S (mg/l) 𝜃 (h) X (mg/l) 330 312 0.5 500 330 285 1 500 330 250 2 500 330 234 3 500 330 212 5 500
Bảng 2.10 Kết quả tính toán xô 1. So - S 𝜃X 𝜃X/(So – S) 1/S 18 250 13.9 0.003 45 500 11.1 0.0035 80 1000 12.5 0.004 96 1500 15.625 0.0043 118 2500 21.2 0.0047
Biểu ồ ường tuyến tính 25 20 y = 4219.1x -1.5895 R² = 0.516 15 10 5 0 0 0.0005 0.001 0.0015 0.002 0.0025 0.003 0.0035 0.004 0.0045 0.005 1/S
Hình 2.3 Đồ thị xác ịnh các thông số ộng học xô 1
Ta có phương trình: 𝜃𝑋 𝐾 1 1 𝑠 × + 𝑆 0 − 𝑆 = 𝑘 𝑆 𝑘 1
Trong ó: b = = 1.5895 → k = 0.63 (1/h) 𝑘 𝐾𝑠
a = = 4219.1 → Ks = 2654.15 (mg/L) 𝑘
Để xác ịnh các thông số ộng học còn lại, vẽ ồ thị tuyến tính với trục hoành là giá trị của 1 𝑆0−𝑆
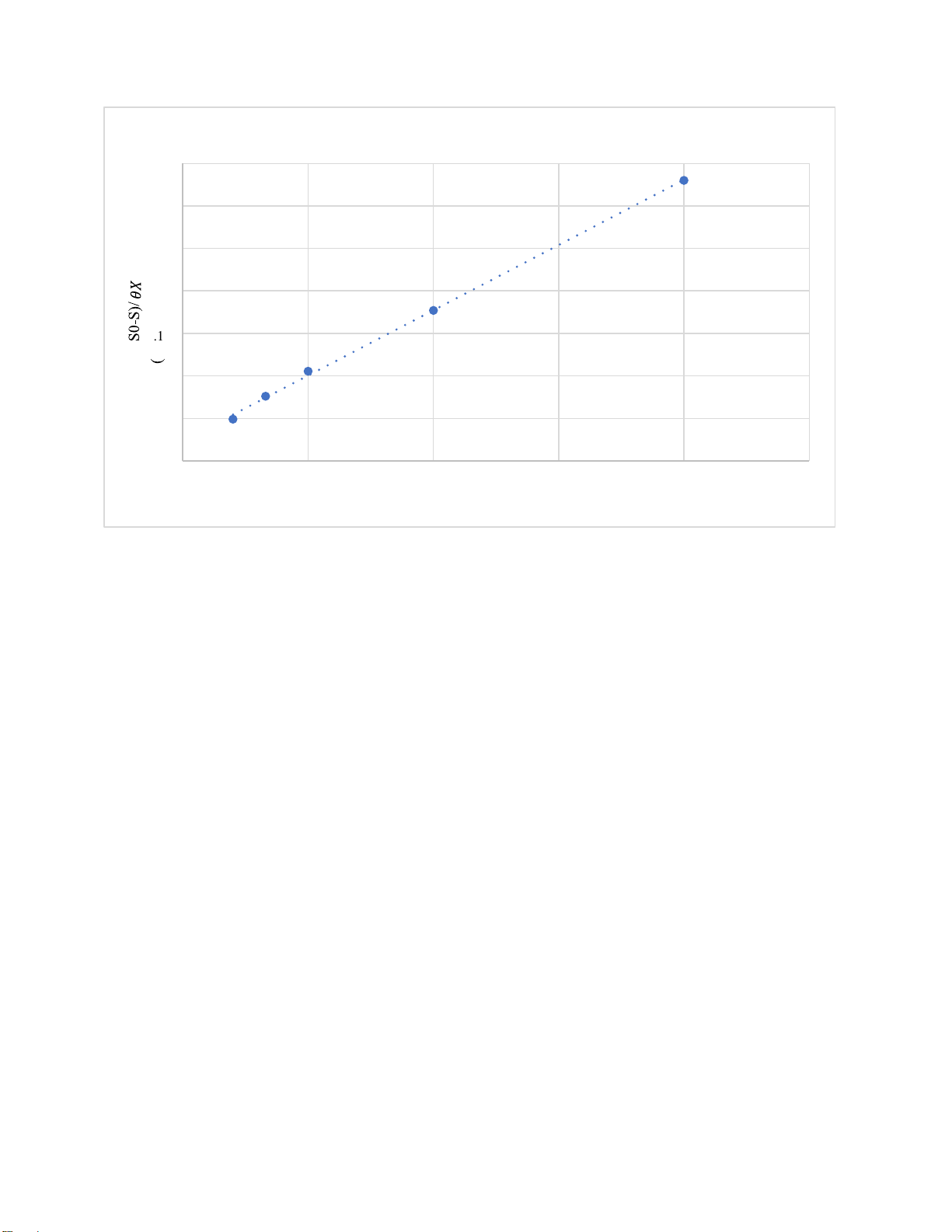
và trục tung là giá trị của 𝜃 𝜃𝑋 1/ 𝜃 2 1 0.5 0.33 0.2 (S0-S)/ 𝜃𝑋 0.072 0.09 0.08 0.064 0.0
Biểu ồ ường tuyến tính 0.1 0.09 y = 0.0085x + 0.0644 R² = 0.1648 0.08 0.07 0.06 0.05 0.04 0.03 0.02 0.01 0 0 0.5 1 1.5 2 2.5 1 / 𝜃
Hình 2.4 Đồ thị tuyến tính các thông số ộng học xô 1.
Phương trình: y = 0.0085x + 0.0644 Y = 0.0085 Kd = 0.0644 (1/h) Xô 2:
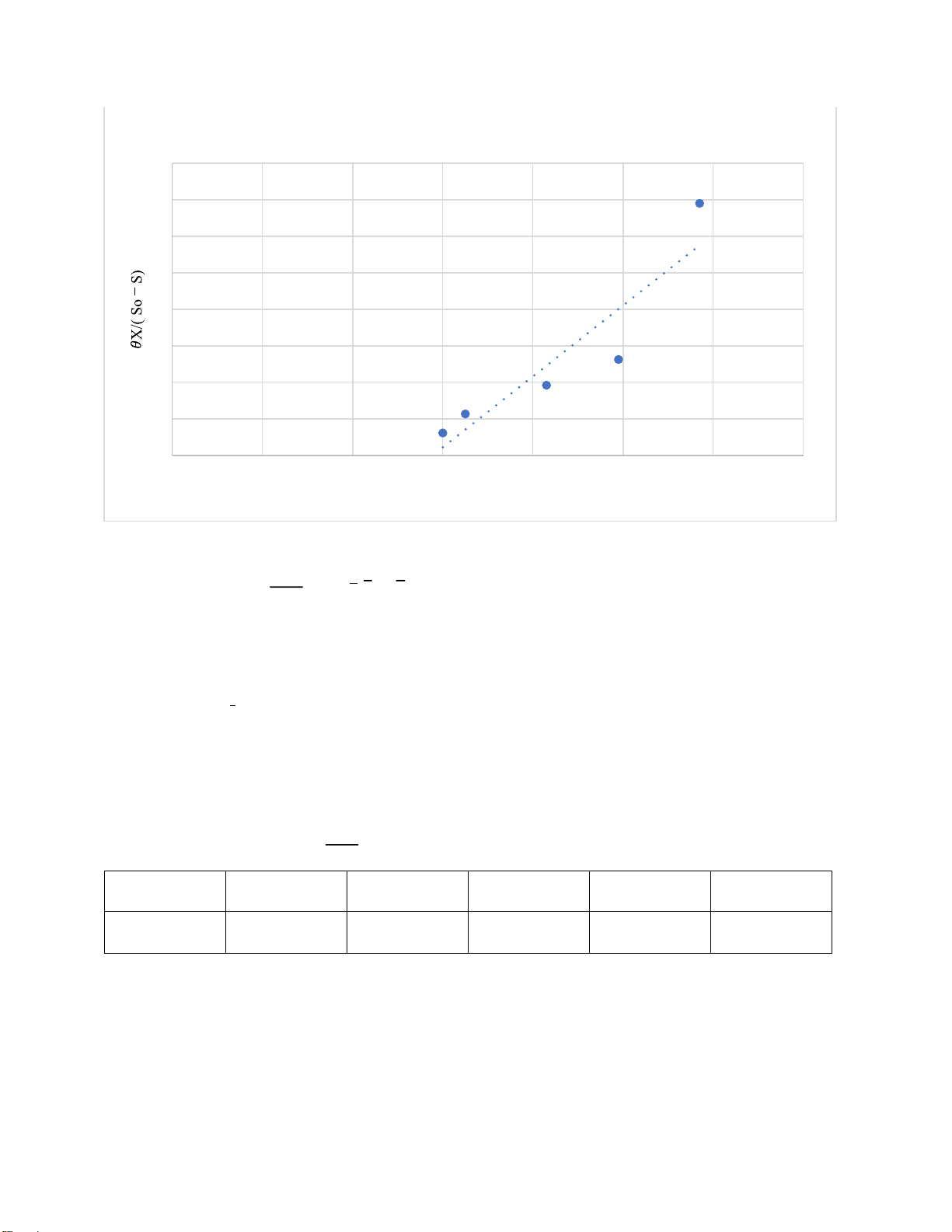
Bảng 2.11 Số liệu thực xô 2 So (mg/l) S (mg/l) 𝜃 (h) X (mg/l) 330 110 0.5 1000 330 75 1 1000 330 62 2 1000 330 58 3 1000 330 54 5 1000
Bảng 2.12 Kết quả tính toán xô 2 So - S 𝜃X 𝜃X/( So – S) 1/S 220 500 2.27 0.009 255 1000 3.92 0.013 268 2000 7.46 0.016 272 3000 11.03 0.0172 276 5000 18.11 0.0186
Biểu ồ ường tuyến tính 20 18 16 y = 1465.2x -13.068 14 R² = 0.787 12 10 8 6 4 2 0 0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 0.02 1 /S
Hình 2.5 Đồ thị xác ịnh các thông số ộng học xô 2 Ta có phương trình: 𝜃𝑋 = 𝐾𝑠 × 1 + 1 𝑆0−𝑆 𝑘 𝑆 𝑘
Trong ó: b = 1 = 13.068 → k = 0.0765 (1/h) 𝑘 𝐾𝑠
a = = 1465.2 → Ks = 112.0878 (mg/L) 𝑘
Để xác ịnh các thông số ộng học còn lại, vẽ ồ thị tuyến tính với trục hoành là giá trị của
1 và trục tung là giá trị của 𝑆0−𝑆 𝜃 𝜃𝑋 1/ 𝜃 2 1 0.5 0.33 0.2 (S0-S)/ 𝜃𝑋 0.44 0.255 0.134 0.09 0.0552
Biểu ồ ường tuyến tính 0.5 0.45 y = 0.2207x + 0.0113 R² = 0.9842 0.4 0.35 0.3 0.25 0.2 0.15 0.1 0.05 0 0 0.5 1 1.5 2 2.5 1 / 𝜃
Hình 2.6 Đồ thị tuyến tính các thông số ộng học xô 2 Phương trình: y = 0.2207x + 0.0113 Y = 0.2207 Kd = 0.0113 (1/h) Xô 3:
Bảng 2.13 Số liệu thực xô 3. So (mg/l) S (mg/l) 𝜃 (h) X (mg/l) 330 302 0.5 2000 330 285 1 2000 330 263 2 2000 330 221 3 2000 330 195 5 2000
Bảng 2.14 Kết quả tính xô 3. So - S 𝜃X 𝜃X/( So – S) 1/S 8 500 62.5 0.0033 45 1000 22.22 0.0035 67 2000 29.85 0.0038 109 3000 27.52 0.0045 135 5000 37.04 0.005
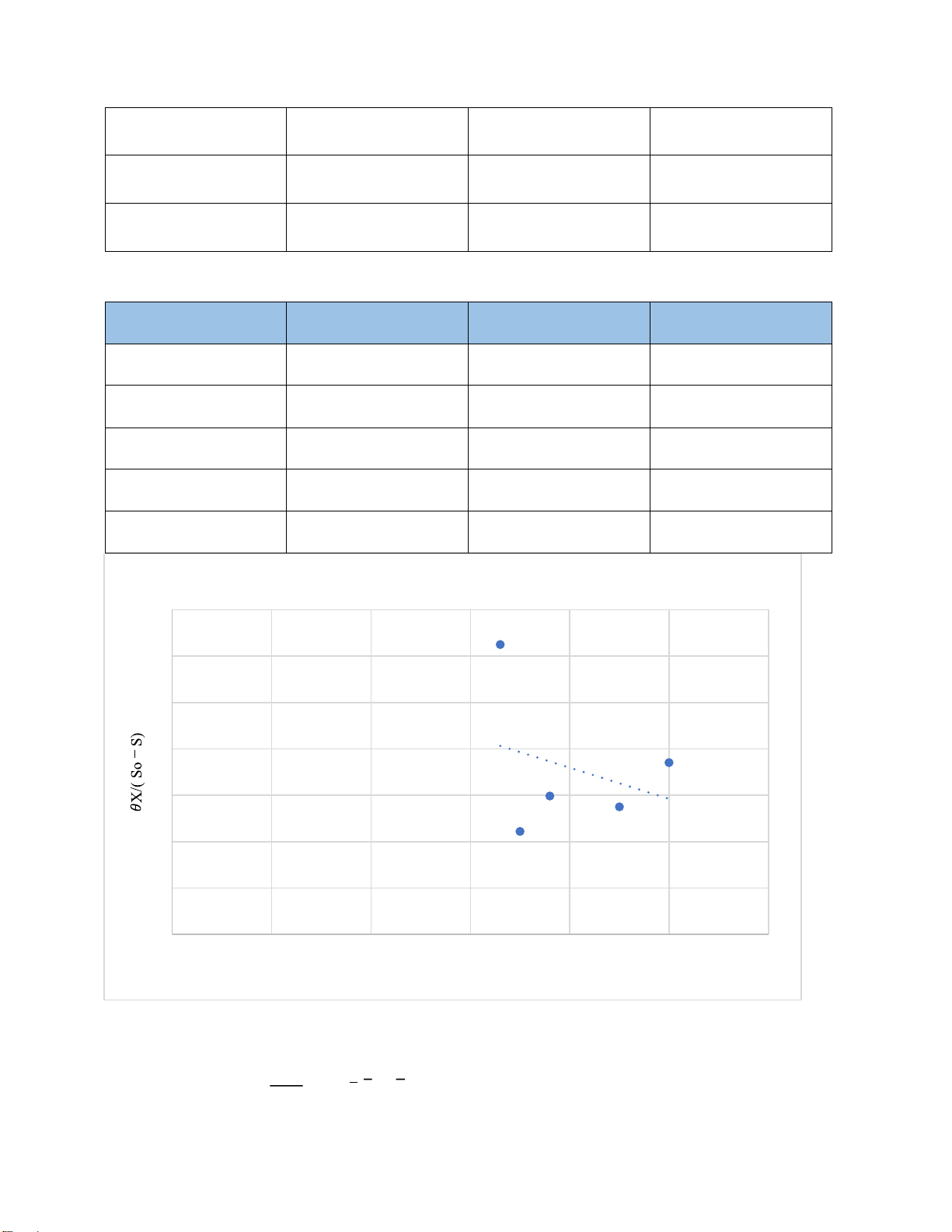
Biểu ồ ường tuyến tính 70 60 50 40 y = -6712.3x + 62.81 R² = 0.0911 30 20 10 0 0 0.001 0.002 0.003 0.004 0.005 0.006 1 /S
Hình 2.7 Đồ thị xác ịnh các thông số ộng học xô 3 Ta có phương trình: 𝜃𝑋 = 𝐾𝑠 × 1 + 1 𝑆0−𝑆 𝑘 𝑆 𝑘
Trong ó: b = 1 = 6712.3 → k = 0.00015 (1/h) 𝑘 𝐾𝑠
a = = 62.81 → Ks = 0.0095 (mg/L) 𝑘
Để xác ịnh các thông số ộng học còn lại, vẽ ồ thị tuyến tính với trục hoành là giá trị của 1 𝑆0−𝑆
và trục tung là giá trị của 𝜃 𝜃𝑋 1/ 𝜃 2 1 0.5 0.33 0.2 (S0-S)/ 𝜃𝑋 0.016 0.045 0.0335 0.0363 0.027
Biểu ồ ường tuyến tính 0.05 0.045 0.04 0.035 0.03 0.025 y = -0.0075x + 0.0376 R² = 0.2552 0.02 0.015 0.01 0.005 0 0 0.5 1 1.5 2 2.5 1/ 𝜃
Hình 2.8. Đồ thị tuyến tính các thông số ộng học xô 3
Phương trình: y = - 0.0075x + 0.0376 Y = - 0.0075 Kd = 0.0376 (1/h) Xô 4:
Bảng 2.15 Số liệu thực xô 4. So (mg/l) S (mg/l) 𝜃 (h) X (mg/l) 330 165 0.5 3000 330 153 1 3000 330 121 2 3000 330 101 3 3000 330 85 5 3000
Bảng 2.16 Kết quả tính xô 4. So - S 𝜃X 𝜃X/( So – S) 1/S 165 500 3,03 0.006 177 1000 5,65 0.0065 209 2000 9,57 0.0083 229 3000 13,1 0.0099 245 5000 20,4 0.0117
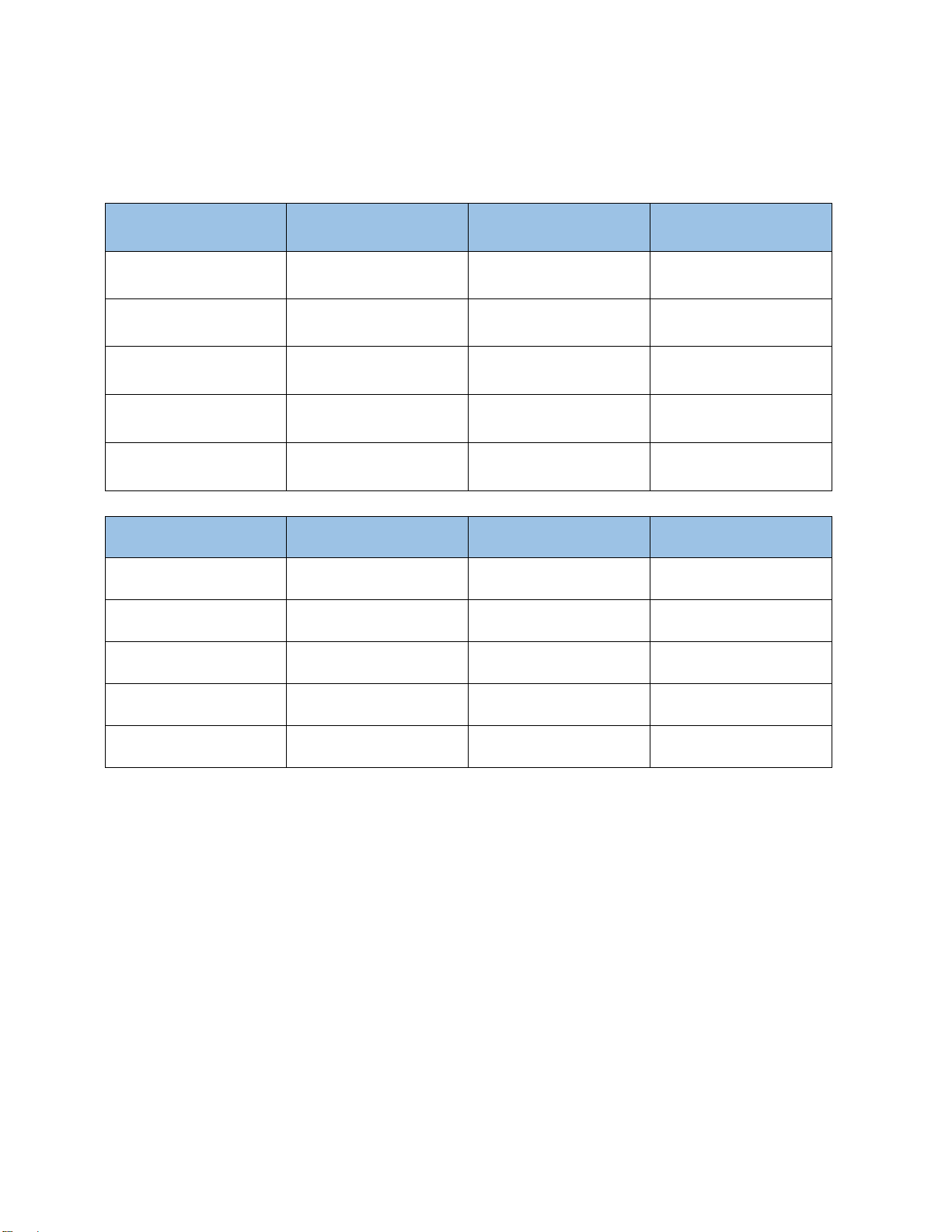
Biểu ồ ường tuyến tính 40 35 30 y = 4860.4x -28.044 R² = 0.8463 25 20 15 10 5 0 0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 1 /S
Hình 2.9 Đồ thị xác ịnh các thông số ộng học xô 4 Ta có phương trình: 𝜃𝑋 = 𝐾𝑠 × 1 + 1 𝑆0−𝑆 𝑘 𝑆 𝑘
Trong ó: b = 1 = 4860.4 → k = 0.0002 (1/h) 𝑘 𝐾𝑠
a = = 28.044 → Ks = 0.0056 (mg/L) 𝑘
Để xác ịnh các thông số ộng học còn lại, vẽ ồ thị tuyến tính với trục hoành là giá trị của 1 𝑆0−𝑆
và trục tung là giá trị của 𝜃 𝜃𝑋 1/ 𝜃 2 1 0.5 0.33 0.2 (S0-S)/ 𝜃𝑋 0.33 0.177 0.1054 0.076 0.049
Biểu ồ ường tuyến tính 0.35 y = 0.1535x + 0.0237 R² = 0.9989 0.3 0.25 0.2 0.15 0.1 0.05 0 0 0.5 1 1.5 2 2.5 1 / 𝜃
Hình 2.10 Đồ thị tuyến tính các thông số ộng học xô 4
Phương trình: y = 0.1535x + 0.0237 Y = 0.1535 Kd = 0.0237 (1/h)
2.5 Trả lời câu hỏi
Câu 1. Bùn hoạt tính là gì
Bùn hoạt tính là tập hợp các vi sinh vật có khả năng phân giải hợp chất hữu cơ trong
iều kiện hiếu khí theo phương pháp sinh học.
Câu 2. Vì sao cần xác ịnh các giá trị thông số ộng học của quá trình
Tính các thông số ộng học của quá trình ể có thể xác ịnh ược số lượng vi sinh vật, tốc
ộ sinh trưởng của vi sinh vật, thông qua ó sẽ biết ược lượng thức ăn cần cung cấp cho VSV ể
phát triển tránh hiện tượng thiếu hay thừa thức ăn, tính ược lượng cơ chất cần bổ sung trong 1 ngày.
BÀI 3. PHƯƠNG PHÁP OXH FENTON
3.1 Mục ích thí nghiệm
− Xác ịnh hiệu quả của quá trình oxi hóa bằng phương pháp Fenton
− Ứng dụng cho quá trình xử lý nước thải dệt nhuộm
3.2 Cơ sở lý thuyết
Trong vòng hai thập kỷ qua, thành tựa quan trọng có ý nghĩa nhất trong lĩnh vực xử lý
nước thải là sự phát triển ngoạn mục của các công trình nghiên cứu và ứng dụng những quá
trình oxy hóa nâng cao (Advanced Oxidation Processes – AOPs).
Năm 1894 trong tạp chí Hội hóa học Mỹ ã công bố công trình nghiên cứu của tác giả J.H
Fenton, trong ó ông quan sát thấy phản ứng oxy hóa axit malic bằng hydrogen peoxit ã ược
gia tăng mạnh khi có mặt các ion sắt. Sau ó, tổ hợp H2O2 với muối Fe2+ ược sử dụng làm tác
nhân oxy hóa rất hiệu quả cho nhiều ối tượng rộng rãi các chất hữu cơ và ược mang tên “tác nhân Fenton”.
3.2.1 Quá trình Fenton ồng thể
Hệ tác nhân Fenton là một hỗn hợp gồm các ion sắt hóa trị 2 (thông thường dùng muối
FeSO4) và hydrogen peroxide (H2O2), chúng tác dụng mạnh với nhau sinh ra các gốc tự do
hydroxyl (*OH), còn ion Fe2+ bị oxy hóa thành Fe3+. Theo chuỗi các phản ứng sau:
Fe2+ + H2O2 → Fe3+ + *HO + OH- (1)
Fe3+ + H2O2 → Fe2+ + H+ + *HO2 (2)
Sự oxi hóa Fe2+ thành Fe3+ và gốc tự do hydroxyl *HO theo phương trình (1) xảy ra rất
nhanh ược xem như khởi ầu của phản ứng Fenton, trong khi ó, phản ứng (2) xem như khởi
ầu của phản ứng Fenton biến thể tạp Fe2+ ể sau ó tiếp tục xảy ra theo phẩn ứng (1) tạo ra gốc
tự do hydroxyl *HO. Vì vậy, ường i của các phản ứng Fenton và Fenton biến thể cũng như một kiểu như nhau.
Cơ chế quá trình Fenton ồng thể cần thực hiện ở pH thấp (pH = 3.5). Sau ó nâng lên 7 ể tách
các ion Fe3+ ra khỏi nước thải sau xử lí bằng dung dịch vôi (hoặc kiềm nhằm chuyển
Fe(OH)3 kết tủa, sau ó loại bỏ bằng thiết bị lắng hoặc lọc ép.
Các phương trình của quá trình Fenton ồng thể: *HO + Fe2+ → Fe3+ + OH- *HO + Fe2+ → OH- + Fe3+ (3) *HO + H2O2 → H2O + *HO2 (4) *HO + RH → *R + H2O (5)
*R + Fe2+ → Fe3+ + RH (6) *R +
Fe3+ → Fe2+ + “sản phẩm” (7)
*R + *R → “Sản phẩm” (8) *HO - 2 + Fe2+ → HO2 + Fe3+ (9)
*HO2 + Fe3+ → H+ + O2 + Fe3+ (10) -
Phương trình Fenton tổng cộng có dạng:
H2O2 + Fe2+ + RH → H2O + Fe3+ + CO2 (11)
3.3.2 Quá trình Fenton dị thể
Nhược iểm của quá trình Fenton ồng thể: phải thực hiện ở pH thấp (pH 3.5), sau phản
ứng phải nâng pH >7 ể tách các ion Fe3+ ra khỏi nước thải sau xử lý bằng dung dịch vôi hoặc
kiềm nhằm chuyển sang dạng keo Fe(OH)3 kết tủa, sau ó phải qua thiết bị lắng hoặc lọc ép ể
tách bã keo Fe(OH)3, tạo ra một lượng bùn thải chứa rất nhiều sắt. -
Để khắc phục nhược iểm của quá trình Fenton ồng thể, nguồn sắt ược sử dụng làm chất
xúc tác ã ược thay thế bằng quặng sắt (Goethite, α-FeOOH), cát có chứa sắt, hoặc sắt trên
chất mang Fe/SiO2, Fe/ TiO2, Fe/ Than hoạt tính, Fe/ Zeolite…Đây là quá trình Fenton dị thể
và có nhiều ưu thế trong ứng dụng thực tế. -
Có thể sử dụng Goethite ể thay thế, Geothite là một khoáng sản có sẵn trong thiên nhiên,
ngay cả ở Việt Nam cũng tìm thấy ở các mỏ Geothite chất lượng tốt. Tuy vậy, Geothite cũng
có thể thu ược bằng cách tổng hợp từ ferric nitrat và kali hydroxit ở nhiệt ộ cao.
3.3 Quy trình thực hiện thí nghiệm
Chuẩn bị mẫu: Ngâm hạt tiêu với nước trước 1 tuần học.
2 muỗng 500 mL 500 mL Mẫu nước tiêu en nước sôi nước máy thải tiêu 1L
3.3.1 Thí nghiệm 1: Khảo sắt tỉ lệ H2O2 và phèn sắt ã sử dụng Pha loãng mẫu: 40 mL mẫu nước Định mức lên 1L Mẫu nước thải thải tiêu (nước máy) ã pha loãng
→ Mẫu nước thải pha loãng 25 lần.
Tiến hành o mẫu nước thải ầu vào
• Đo pH (sử dụng máy o pH)
• Đo ộ màu ( o ở bước sóng 455 nm) • Đo COD (ầu vào)
Rửa ống COD bằng dung dịch H 2 SO 4 20%
Lấy 2,5 mL mẫu + 1, 5 K 2 Cr 2 O 7 0.1 N + 3,5 m L H 2 SO 4 vào ống COD
( phản ứng xảy ra mạnh nên cho axit chảy dọc theo thành ống nghiệm)
Cho ống COD vào tủ sấy, nung ở 150 ℃ trong 2h
Lấy ống COD ra ể nguội, ổ ra erlen + 2 giọt feroin Định phân bằng FAS 0.1N
( kết thúc chuẩn khi dd chuyển từ màu xanh sang nâu ỏ
Tương tự, làm như vậy với 2 mẫu trắng (1 mẫu trắng un, 1 mẫu trắng không un).
Các bước thực hiện thí nghiệm 1
Cho 100 mL nước thải vào 4 cốc 250mL Cốc 1 Cốc 2 Cốc 3 Cốc 4
Cho H 2 O 2 50 % và FeSO 4 .7 H 2 O theo tỷ lệ như bảng 3.1
Chỉnh pH xuống 3.5 (dùng H 2 SO 4 chỉnh)
Để yên cho phản ứng oxi hóa xảy ra trong 2 giờ
Đem nâng pH lên 7 – 8 bằng NaOH
+ 1 giọt polymer anion, khuấy nhẹ và ều Lắng trong 30 phút
Lấy phần nước trong bên trên i o pH, ộ màu, COD.
Bảng 3.1 Tỉ lệ H2O2/Fe ứng với mỗi cốc ở thí nghiệm 1 STT 1 2 3 4 Tỉ lệ H2O2/Fe 1/10 1/5 1/2 1/1 0.05 0.1 0.15 0.2 H2O2 50% (ml) 0.5 0.4 0.3 0.2 FeSO4.7H2O 10% (ml)
Hình 3.1 Chuẩn bị mẫu cho thí nghiệm 1
3.3.2. Thí nghiệm 2: Khảo sắt hiệu quả của phản ứng khi có mặt chất xúc tác Mn2+
Bảng 3.2 Tỉ lệ H2O2/Fe và Mn2+ ứng với mỗi cốc ở thí nghiệm 2 STT 1 2 3 4 Tỉ lệ H2O2/Fe 1/10 1/5 1/2 1/1 0.05 0.1 0.15 0.2 H2O2 50% (ml) 0.5 0.4 0.3 0.2 FeSO4.7H2O 10% (ml) 0.5 0.4 0.3 0.2 Mn2+ (ml)
Các bước thực hiện thí nghiệm 2
Cho 100 mL nước thải vào 4 cốc 250mL Cốc 1 Cốc 2 Cốc 3 Cốc 4
Cho H 2 O 2 50 %, FeSO 4 .7 H 2 O , Mn 2+
theo tỷ lệ như bảng 3.2
Chỉnh pH xuống 3.5 (dùng H 2 SO 4 chỉnh)
Để yên cho phản ứng oxi hóa xảy ra trong 2 giờ
Đem nâng pH lên 7 – 8 bằng NaOH
+ 1 giọt polymer anion, khuấy nhẹ và ều Lắng trong 30 phút
Lấy phần nước trong bên trên i o pH, ộ màu, COD
Hình 3.2 Chu ẩ n b ị m ẫu cho thí nghiệ m 2
Hình 3.3 Chuẩn ộ COD dung dịch từ màu xanh chuyển sang màu nâu ỏ
3.4 Kết quả thí nghiệm và nhận xét
3.4.1 Kết quả o mẫu nước thải ầu vào
Mẫu nước thải ã ược pha loãng 25 lần Nồng ộ FAS 0.09 N
Đường chuẩn ộ màu: y = 0.006x + 0.001 với R2 = 0.9953
Bảng 3.3 Thông số ầu vào Độ màu (bước COD sóng 455nm) pH COD, A C (g/L) VFAS (mL) (mgO2/L) 6.17 0.115 475 0.5 3600
Bảng 3.4 Thông số o COD mẫu un và không un
COD mẫu trắng un, VFAS (mL) 1
COD mẫu trắng không un, VFAS (mL) 1.1
3.4.2 Thí nghiệm 1: Khảo sắt tỉ lệ H2O2 và phèn sắt ã sử dụng
Bảng 3.5 Kết quả thí nghiệm 1 STT 1 2 3 4 Tỉ lệ H2O2/Fe 1/10 1/5 1/2 1/1 pH 6.47 6.38 6.33 6.65 Độ màu A 0.064 0.083 0.073 0.077 C (g/L) 262.5 341.75 300 315 VFAS (mL) 0.85 0.65 0.75 0.7 COD COD, (mgO2/L) 1080 2520 1800 2160
Bảng 3.6 Hiệu suất xử lí ộ màu, COD với các tỉ lệ H2O2 và Fe khác nhau STT 1 2 3 4 Tỉ lệ H2O2/Fe 1/10 1/5 1/2 1/1 H% ộ màu 44.73% 28.05% 36.84% 33.68% H% COD 70% 30% 50% 40%
Hiệu suất xử lý COD, ộ màu ứng với các tỉ lệ H O và Fe khác nhau 2 2 70.00% 70.00 % 60.00 % 50.00% 50.00 % 44.73% % 40.00 36.84% % 40.00 33.68 % 28.05 % 30 % % 30.00 % 20.00 % 10.00 0.00% 1 2 3 4 H% Độ màu H% COD
Hình 3.4 Biểu ồ so sánh hiệu suất xử lý ộ màu, COD ứng với các
tỉ lệ H2O2 và Fe khác nhau Nhận xét:
Từ biểu ồ trên, thấy ược ứng với tỉ lệ H2O2/Fe bằng 1/10 thì khả năng xử lý ộ màu và
COD trong nước thải tiêu bằng phương pháp oxi hóa fenton ạt hiệu quả tốt nhất (hiệu suất xử
lý ộ màu ạt 44.74%, COD ạt 70%). Đới với tỉ lệ 1/5 thì khả năng xử lý ộ màu và COD ạt hiệu
quả thấp nhất (hiệu suất xử lý ộ màu ạt 28.05%, COD ạt 25%).
Hiệu suất xử lý ộ màu ứng với các tỉ lệ H2O2/Fe: 1/10 (44.73%), 1/5 (28.05%), 1/2
(36.84%), 1/1 (33.68%) và hiệu suất xử lý COD 1/10 (70%), 1/5 (30%), 1/2 (50%), 1/1 (40%)
có sự chênh lệch, tăng giảm không ồng ều do liều lượng H2O2 và phèn sắt cho vào có thể sai
cũng như trong quá trình thí nghiệm sắt bị oxi hóa (từ Fe2+ thành Fe3+) trước khi cho vào mẫu.
3.4.3 Thí nghiệm 2: Khảo sắt hiệu quả của phản ứng khi có mặt chất xúc tác Mn2+
Bảng 3.7 Kết quả thí nghiệm 2 STT 1 2 3 4 Tỉ lệ H2O2/Fe 1/10 1/5 1/2 1/1 pH 6.51 6.65 6.81 6.85 Độ màu A 0.072 0.089 0.068 0.056 C (g/L) 295.75 365 279 229.16 VFAS (mL) 0.8 0.75 0.7 0.6 COD COD, (mgO2/L) 1440 1800 2160 2880
Bảng 3.8 Hiệu suất xử lí ộ màu, COD khi có xúc tác Mn2+ STT 1 2 3 4 Tỉ lệ H2O2/Fe 10 5 2 1 Mn2+ (mL) 0.5 0.4 0.3 0.2 H% ộ màu 37.73% 23.15% 41.26% 51.75% H% COD 60% 50% 40% 20%
Hiệu suất xử lý COD, ộ màu khi có xúc tác Mn 2+ 60 % 60.0 % 0 51.75% 50.00% 50.00 % 41.26% 40.00% 37.73 % 40.0 % 0 30.0 % 0 23.15% 20.00 % 20.0 % 0 10.00 % 0.0 % 0 1 2 3 4 H% Độ màu H% COD
Hình 3.5 Biểu ồ hiệu suất so sánh suất hiệu suất xử lý ộ màu, COD
khi có xúc tác Mn2+ Nhận xét:
Dựa vào biểu ồ trên, ta thấy ược hiệu suất xử lí ộ màu, COD khi có một lượng xúc tác
Mn2+ ược cho vào thí nghiệm. Khả năng xử lý COD cũng giảm dần khi cho lượng Mn2+ vào
ứng với từng tỉ lệ H2O2/Fe (từ 60% giảm còn 20%). Lượng Mn2+ khi cho vào hoạt ộng rất hiệu quả.
Với tỉ lệ 1/10 lượng Mn2+ cho vào thì hiệu quả xử lý ộ màu không tỷ lệ với hiệu quả xử
lý COD. Hiệu quả xử lý ộ màu (37.73%), COD (60%).
Với tỉ lệ 1/2 lượng Mn2+ cho vào thì hiệu quả xử lý ộ màu và COD là tương ương nhau.
Hiệu quả xử lý ộ màu (41.26%), COD (40%).
Đối với tỉ lệ 1/1 thì lượng Mn2+ cho vào xử lý ộ màu là tốt nhất 51.75%, nhưng hiệu quả
xử lý COD lại thấp nhất (20%).
3.5 Trả lời câu hỏi
Câu 1: Hệ tác nhân Fenton là gì?
Hệ tác nhân fenton là một hỗn hợp gồm các ion sắt hóa trị II (thông thường dùng muối
FeSO4) và hydrogen peroxide (H2O2,) chúng tác dụng với nhau sinh ra các gốc tự do hydroxyl
(*OH), còn Fe2+ bị oxi hóa thành Fe3+.
Câu 2: Hãy so sánh quá trình Fenton ồng thể và dị thể Fenton ồng thể Fenton dị thể Định nghĩa
Là các hợp chất xúc tác có cùng Là các hợp chất xúc tác ở pha khác
pha với các chất ang i vào pha phản với pha của hỗn hợp phản ứng. ứng. Giai oạn
Chất xúc tác ồng thể có thể ược tìm Chất xúc tác dị thể có thể ược tìm
thấy chủ yếu trong pha lỏng
thấy trong cả ba giai oạn; pha rắn, pha lỏng hoặc pha khí. Ổn ịnh nhiệt
Độ bền nhiệt của các chất xúc tác Độ ổn ịnh nhiệt của các chất xúc tác ồng thể kém. dị thể là tốt.
Phục hồi xúc tác Việc thu hồi các chất xúc tác ồng
Việc thu hồi các chất xúc tác dị thể
nhất là khó khăn và tốn kém
là dễ dàng và rẻ tiền Hoạt ộng
Vị trí hoạt ộng của các chất xúc tác Vị trí hoạt ộng của các chất xúc tác
ồng nhất ược xác ịnh rõ và có tính dị thể không ược xác ịnh rõ và có chọn lọc tốt. ộ chọn lọc kém. Chất xúc tác tái
Việc tái chế các chất xúc tác ồng Việc tái chế các chất xúc tác dị thể chế nhất là khó khăn. rất dễ dàng.
Tách chất xúc tác Việc tách chất xúc tác ồng thể ra Việc tách chất xúc tác dị thể ra khỏi
khỏi hỗn hợp phản ứng là khó hỗn hợp phản ứng rất dễ dàng. khăn. Phụ thuộc nhiệt
Chất xúc tác ồng thể hoạt ộng tốt Chất xúc tác dị thể hoạt ộng tốt hơn ộ
hơn trong iều kiện nhiệt ộ thấp trong iều kiện nhiệt ộ cao (khoảng (dưới 250◦C). 250 ến 500◦C). Sửa ổi chất xúc
Việc sửa ổi các chất xúc tác ồng
Việc sửa ổi các chất xúc tác dị thể nhất là dễ dàng. là khó khăn. tác
Câu 3: Vì sao sử dụng Mn làm chất xúc tác cho quá trình Fenton?
Phản ứng oxy hóa còn ược xúc tác bởi một lượng nhỏ mangan dưới dạng muối sulfate.
Quá trình fenton có chất xúc tác là Mn làm phân hủy H2O2 tạo ra các gốc OH* tương tự như
Fe2+, Mn2+ sẽ bị oxi hóa tạo thành các chất bao quanh các hợp chất hữu cơ. Khi tăng lượng
gốc tự do ược tạo ra nhiều hơn, thúc ẩy nhanh quá trình khoáng hóa các chất hữu cơ. Sau ó
các hợp chất hữu cơ sẽ bị oxy hóa tạo thành các gốc R*. Quá trình oxy hóa từ ó mà ược ẩy
mạnh và hiệu quả hơn trong quá trình xử lý ộ màu.
Vì sự hiện diện của mangan làm tăng hiệu quả phản ứng nhưng chỉ với một tỉ lệ mangan
rất thấp (nếu nhiều mangan quá cũng không tốt). Mangan làm tăng tác dụng hấp phụ của
bông hydroxit và vai trò của mangan chủ yếu thể hiện khi pH ược nâng lên khoảng 7-8. BÀI 4. KHỬ TRÙNG
4.1 Mục ích thí nghiệm
- Giúp sinh viên làm quen với phương pháp khử trùng trong xử lý nước thải.
- Đánh giá khả năng khử trùng bằng hóa chất hay UV.
- Xác ịnh giá trị lượng hóa chất cần thiết.
- Xác ịnh thời gian tiếp xúc của UV.
4.2 Cơ sở lý thuyết
4.2.1 Khử trùng nước bằng Clo và các hợp chất của nó
Clo là một chất oxy hóa mạnh, ở bất cứ dạng nào, nguyên chất hay hợp chất khi tác dụng
với nước ều tạo ra phân tử axit hypoclorit HOCl có tác dụng khử trùng rất mạnh.
Quá trình diệt vi sinh vật xảy ra qua 2 giai oạn. Đầu tiên chất khử trùng khuếch tán xuyên
qua vỏ tế bào vi sinh, sau ó phản ứng với men bên trong tế bào và phá hoại quá trình trao ổi
chất dẫn ến sự diệt vong của tế bào.
Tốc ộ của quá trình khử trùng ược xác ịnh bằng ộng học của quá trình khuếch tán chất
diệt trùng qua vỏ tế bào và ộng học của quá trình phân hủy men tế bào.
Tốc ộ của quá trình khử trùng tăng khi nồng ộ của chất khử trùng và nhiệt ộ nước tăng,
ồng thời phụ thuộc vào dạng không phân ly của chất khử trùng, vì quá trình khuếch tán qua
vỏ tế bào xảy ra nhanh hơn quá trình phân ly.
Tốc ộ khử trùng bị châm i rất nhiều khi trong nước có các chất hữu cơ, cặn lơ lững và các chất khử khác.
Phản ứng ặc trưng là sự thủy phân của clo tạo ra axit hypoclorit và axit clohydric: Cl2 + H2O ⇔ HOCl + HCl
Hoặc ở dạng phương trình phân ly:
Cl2 + H2O ⇔ 2H2+ + OCl− + Cl−
Khi sử dụng clorua vôi làm chất khử trùng, phản ứng sẽ là:
Ca(OCl)2 + H2O ⇔ CaO + 2HOCl 2HOCl ⇔ 2 H+ + 2 OCl−
Khử trùng bằng Chloramine
• Ammonia + Hypochlorous Acid → Monochloramine + nước
NH3 + 𝐇𝐎𝐂𝐥 → NH2Cl + H2O
• Monochloramine+ Hypochlorous → Acid Dichloramine + nước
NH2Cl + 𝐇𝐎𝐂𝐥 → NHCl2 + H2O
• Dichloramine + Hypochlorous → Acid Trichloramine + nước
NHCl2 + 𝐇𝐎𝐂𝐥 → NCl3 + H2O
Chloramines yếu hơn chlorine, nhưng bền hơn nên thường dùng trong hệ thống ường
ống. Chloramines có thể bị phân hủy bởi vi khuẩn, nhiệt, và ánh sáng. Chloramines hiệu quả
ối với những vi khuẩn và một vài loài protozoans, nhưng nó không diệt ược những loài virus nguy hiểm.
Khử trùng bằng Chlorine dioxide
• ClO2 diệt hiệu quả protozoans, Cryptosporidium, Giardia, và viruses
• ClO2 oxi hóa tất cả các kim loại và chất hữu cơ chuyển chất hữu cơ thành CO2 và nước
• ClO2 có thể loại bỏ hợp chất sulfide, mùi
• Sử dụng ClO2 không tạo thành trihalomethanes và quá trình chlorine không chịu ảnh hưởng bởi ammonia.
• ClO2 hiệu quả ở pH cao hơn so với các dạng chlorine khác
• Nhược: giá thành cao, òi hỏi vận hành thành thạo, ClO2 dễ cháy hơn so với khí Chlo.
4.2.2. Khử trùng nước bằng tia UV
Tia cực tím (UV) là tia bức xạ iện từ có bước sóng khoảng 4 – 400nm (nanometer). Độ
dài sóng của tia cực tím nằm ngoài vùng phát hiện, nhận biết của mắt thường. Dùng tia cực
tím ể khử trùng không làm thay ổi tính chất hóa học và lý học của nước.
Tia cực tím tác dụng làm thay ổi DNA của tế bào vi khuẩn, tia cực tím có ộ dài bước
sóng 254nm có khả năng diệt khuẩn cao nhất.
4.3. Quy trình thực hiện thí nghiệm
Chuẩn bị mẫu: Lấy 5 L nước thải từ khu xử lý nước thải KTX Đại học Quốc Gia + pha
bùn và cát vào mẫu nước thải.
Chuẩn bị dụng cụ: ống nghiệm, ống Durham, 4 cốc, pipet, bóp cao su, bông gòn, ũa
thủy tinh và bình tia,...
4.3.1. Thí nghiệm 1: Khử trùng bằng hóa chất NaOCl -
Pha 1 L dung dịch NaOCl nồng ộ 0,2 mL/L.
- Đo Độ ục , pH ban ầu của nước thải.
Chuẩn bị pha loãng mẫu thành ,5 0 L ở các ộ ục 10 100 300 NTU NTU NTU
Cho 1ml dung d ịch NaOCl (0,2g/L) vào 3 cố c, khu ấ y
tr ộn ề u. L ấ y m ẫ u theo th ời gian 30 phút, 1h, 2h.
Đo pH và ộ ục theo thời gian
4.3.3. Thí nghiệm 3: Khử trùng bằng UV -
Chuẩn bị bồn chứa 10 L với ộ ục 10 NTU và nồng ộ E.Coli theo nồng ộ ầu vào, cho
nước vào thiết bị UV với lưu lượng 10 L/h.
Cho vào 2L nước ở ộ ục 10 NTU UV
Lấy mẫu ở phút thứ 15 phút và 30 phút 10 phút 30 phút
Lấy mẫu sau thời gian 15, 30 phút o lại pH, ộ ục và nồng ộ Coliform
Phương Pháp o Coliform: -
Hòa tan 37g EC trong 1 lít nước cất -
Cho 10 ml vào mỗi ống nghiệm chưa ống Durham ảo ngược. Khử trùng bằng nồi hấp ở 121ºC trong 15 phút. -
Mỗi mẫu cần chuẩn bị 9 ống nghiệm tương ứng 3 ộ pha loãng. -
Cho 1 ml mẫu ở các ộ pha loãng tương ứng vào ống nghiệm có chứa môi trường EC -
Đem ủ 24 – 48 giờ ở nhiệt ộ 35OC. -
Đọc kết quả dương tính theo bảng MPN
4.4 Kết quả và nhận xét
4.4.1 Thông số ầu vào của nước thải:
Bảng 4.1 Thông số ầu vào Độ ục pH 500 NTU 6.8
4.4.2 Thí nghiệm 1: Khử trùng bằng hóa chất NaOCl
Tổng số coliforms (CFU/g hoặc CFU/ml) = Số MPN * 10n
N: là số nguyên dương của nồng ộ pha loãng ược nuôi cấy
Bảng 4.2 Kết quả thí nghiệm 1: Khử trùng bằng hóa chất NaOCl Thời gian
Số ống nghiệm dương tính Tổng số coliform pH Độ ục
Mẫu có ộ ục 10 NTU 30ph 0 ; 1 ; 0 3*100 7 9.3 1h 0; 0; 0 3*100 7.2 8.4 2h 0; 0; 0 3*100 7.3 5.6
Mẫu có ộ ục 100 NTU 30ph 3;3;3 2400*100 7.3 80.6 1h 3;2;1 150*100 7.5 65.4 2h 2;1;0 15*100 7.3 38.2
Mẫu có ộ ục 300 NTU 30ph 3;3;3 2400*100 6.9 286 1h 3;3;3 2400*100 6.6 265 2h 3;3;3 2400*100 7.2 215
Hình ảnh thí nghiệm:
Mẫu có ộ ục 10 NTU:
Bảng 4.3 Hình ảnh thí nghiệm 1 ộ ục 10 NTU Độ pha loãng 10 -0 30ph 1h 2h Độ pha loãng 10 -1 30ph 1h 2h
Độ pha loãng 10 -2 30ph 1h 2h
Mẫu có ộ ục 100 NTU
Bảng 4.4 Hình ảnh thí nghiệm 1 ộ ục 100 NTU Độ pha loãng 10 -0 30ph 1h 2h Độ pha loãng 10 -1 30ph 1h 2h
Độ pha loãng 10 -2 30ph 1h 2h
Mẫu có ộ ục 300 NTU
Bảng 4.5 Hình ảnh thí nghiệm 1 ộ ục 100 NTU Độ pha loãng 10 -0 30ph 1h 2h Độ pha loãng 10 -1 30ph 1h 2h
Độ pha loãng 10 -2 30ph 1h 2h Nhận xét:
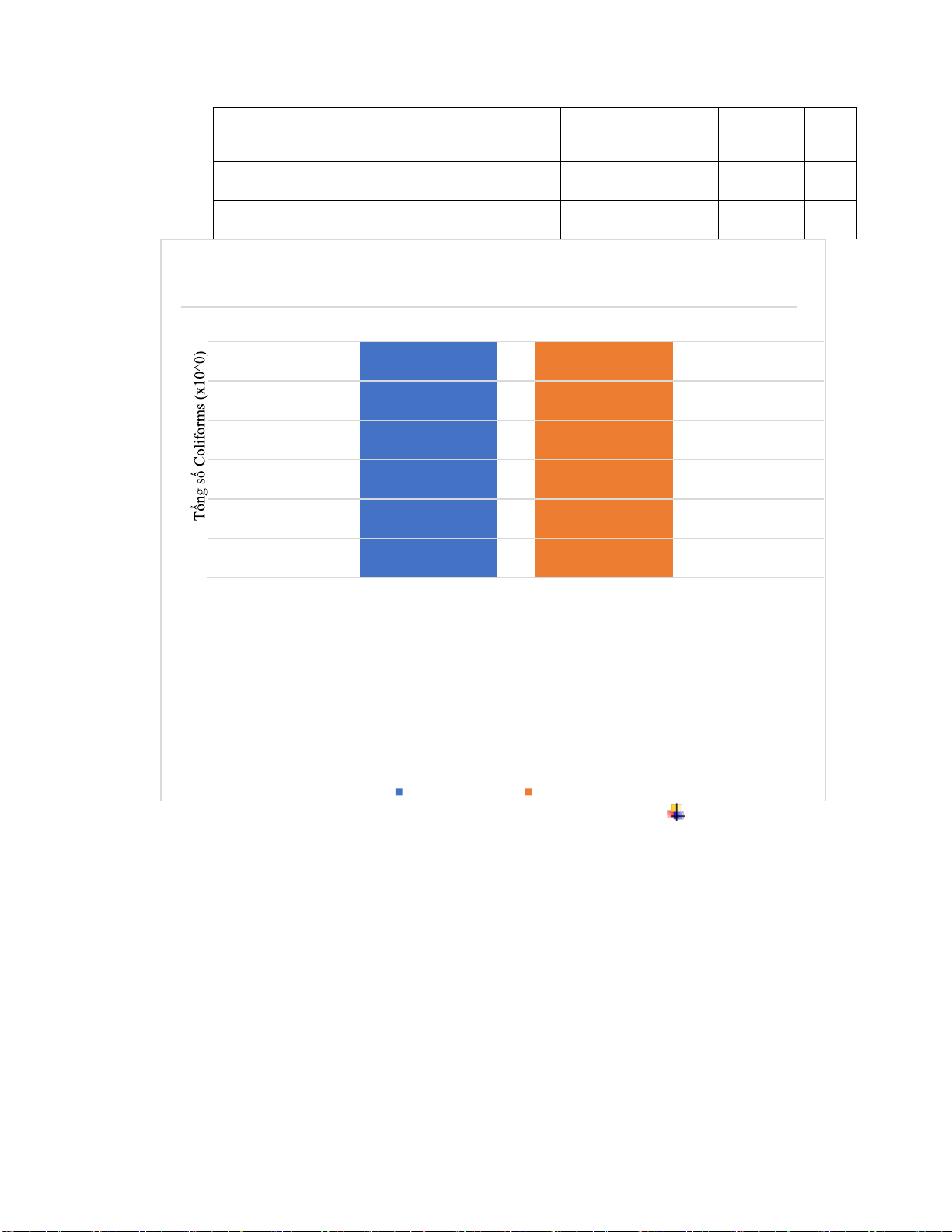
Theo kết quả thí nghiệm kiểm tra Coliforms bằng phương pháp MPN, Coliform tính ược
trong mẫu là rất cao ở ộ ục 300 NTU . Điều ó chứng minh mẫu nước thải ban ầu sẽ có thể
có rất nhiều vi khuẩn gây bệnh.
Hiệu quả xử lý của NaOCl tương ối hiệu quả ở mức tốt ở ộ ục 10 NTU, tuy nhiên chỉ ạt
mức trung binh và kém ở ộ ục 100 và 300 NTU.
Hiệu quả xử lý của NaOCl tỷ lệ thuận với thời gian theo thí nghiệm ở ộ ục 100 NTU, do
ó thời gian phản ứng càng lâu thì hiệu quả xử lý càng cao.
Đưa ra giải pháp là iều chỉnh lại lượng hóa chất cũng như tăng thời gian phản ứng NaOCl
nhằm giải quyết triệt ể lượng colifom .
Tổng Coliforms bằng hóa chất NaOCl 3000 2500 2000 1500 1000 500 0 Mẫu 1 10 NTU Mẫu 2 100 NTU Mẫu 3 300 NTU Thời gian 30 phút Thời gian 1 giờ Thời gian 2 giờ
Hình 4.1 Tổng Coliforms bằng hóa chất NaOCl
4.4.3 Thí nghiệm 2: Khử trùng bằng èn UV
Bảng 4.6 Kết quả thí nghiệm 2: Khử trùng bằng èn UV
Thời gian Số ống nghiệm dương Tổng số Độ ục pH tính coliform 15 phút 0;0;0 3*100 7 7 30 phút 0;0;0 3*100 5 7.2
Lượng Coliform xử lý bằng UV 3.5 3 3 3 2.5 2 1.5 1 0.5 0 Tổng lượng coliform Thời gian 15 phút Thời gian 30 phút
Hình 4.2 Biểu ồ lượng Coliform xử lý bằng UV Nhận xét:
- Hiệu quả xử lý của UV gần như là tuyệt ối khi ở ộ ục 10 NTU.
- Khả năng của UV vượt trội hơn nhiều so với hóa chất NaOCl.
4.5. Trả lời câu hỏi
Câu 1. Trong ba loại hợp chất của clo (Chlor, Chloramine và Chlorine dioxide) chất nào có khả
năng khử trùng mạnh nhất?
Chlorine dioxide. Do ClO2 là chất oxy hóa mạnh, có thể oxi hóa tất cả các kim loại và chất hữu cơ
chuyển chất hữu cơ thành CO2 và nước ồng thời có khả năng tiêu diệt hầu hết các loại vi khuẩn với liều dùng thấp.
Câu 2. Các yếu tố ảnh hướng ến quá trình khử trùng ? - pH - Nhiệt ộ - Thời gian tiếp xúc - Độ ục
- Nồng ộ của chất khử khuẩn - Nồng ộ vi sinh vật
- Loại vật liệu (vô cơ hay hữu cơ)
- Độ cứng pha loãng và chất cặn lắng còn lại sau khi làm sạch Câu 3. Tại sao ộ ục ảnh hưởng
ến quá trình khử trùng?
Các hạt làm tăng ộ ục của nước tạo ra một môi trường lý tưởng ể vi khuẩn ẩn nấp, làm
giảm khả năng hiệu quả của quá trình khử trùng nước. Các chất ô nhiễm như kim loại nặng
hòa tan và mầm bệnh có thể kết tụ trên các hạt lơ lửng, sau ó xâm nhập vào nguồn nước. Điều
này giải thích tại sao sự tăng ộ ục thường i kèm với tiềm năng ô nhiễm cao của nguồn nước
BÀI 5: XỬ LÝ PHOTPHAT BẰNG PHƯƠNG PHÁP HÓA LÝ
5.1 Mục ích thí nghiệm
- Biết ược cách xử lý Photpho bằng phương pháp hóa lý
- Xác ịnh ược liều lượng hóa chất tối ưu cần cho xử lý nước thải bị ô nhiễm.
5.2 Cơ sở lý thuyết
Quá trình xử lý photpho cũng giống như keo tụ tạo bông. Kết dính photpho vào các cặn
lơ lửng trong nước thải, làm cho các hạt rất nhỏ biến thành những hạt lớn lắng xuống. Sau ó
loại bỏ các cặn lơ lửng, bao gồm cả cặn sinh học hay cặn hóa lý.
Để xử lý photphate, người ta sử dụng phương pháp kết tủa hóa học. Hóa chất ược sử
dụng trong quá trình xử lý là vôi Ca(OH)2 và muối kim loại.
Phương trình phản ứng của thí nghiệm: Ca2+ + PO43− → Ca3(PO4)2
Ý nghĩa môi trường
Photpho thường tồn tại ở dạng photphate trong nguồn nước tự nhiên và nước thải.
Photphate ược phân loại và tồn tại dưới 3 dạng: + Orthophosphate + Polyphosphate + Phospho hữu cơ
Các chỉ tiêu photphate ược ứng dụng trong việc kiểm soát mức ộ ô nhiễm của dòng nước.
Việc xác ịnh photphate rất cần thiết trong quá trình vận hành các trạm xử lý nước thải và
trong nghiên cứu ô nhiễm dòng chảy của nhiều vùng. Bởi vì hàm lượng photphate có thể ược
coi là một chất dinh dưỡng trong xử lý nước thải. Nguyên tắc
Sử dụng phương pháp ường chuẩn, so màu ở bước sóng 690nm. Trong môi trường acid
và các chất xúc tác, orthophosphate sẽ phản ứng với molybdate phóng thích ra acid
molybdophosphoric. Sau ó, acid molybdophosphoric sẽ bị khử bởi SnCl2, dung dịch ổi sang màu xanh dương. Phương trình phản ứng:
PO43− + 12(NH4)2Mo24O4 + 24H+ → (NH4)3. PO4. 12MoO3 + 21NH4+ + 12H2O (NH4)3PO4.
12MoO3 + Sn2+ → Molybdenum (xanh dương) + Sn4+
5.3 Quy trình thực hiện thí nghiệm
Chuẩn bị mẫu nước: Lấy 6L nước thải sinh hoạt tại khu vực xử lý nước ở KTX khu B
(mẫu nước giữ nguyên).
5.3.1 Thí nghiệm 1: Xác ịnh giá trị pH tối ưu Bước
1: Định lượng hóa chất iều chỉnh pH
Bước 2: Keo tụ hóa học 400 mL nước thải pH = 5 pH = 5.5 pH = 6 pH = 6.5 pH = 7 pH = 7.5
Thêm thể tích NaOH và H 2 SO 4 ã xác ịnh vào cùng lúc 6 cốc Thêm 0.3 mL vôi loãng
( khi cho hóa chất vào bật máy khuấy chậm Đưa vào giàn Jartest
+ Khuấy nhanh với tốc ộ 100 vòng/ phút
+ Khuấy chậm với tốc ộ 15 vòng/ phút Tắt máy
( Để yên lắng trong 30 phút
Bước 3: Phân tích mẫu Đo lại pH sau lắng, Lấy mẫu dưới lớp Đem i lọc ộ ục, váng bề mặt xác ịnh hàm lượng P
Lưu ý: pH tối ưu ( o sau lắng) là ứng với mẫu có hàm lượng P thấp nhất.
5.3.2 Thí nghiệm 2: Xác ịnh liều lượng vôi Ca(OH)2 tối ưu 400 mL nước thải
Thêm lượng NaOH và H 2 SO 4 vào cốc ể ạt pH
tối ưu (ã xác ịnh ở TN1)
Thêm vào từng cốc ồng thời lượng vôi 0.1 mL 0.2 mL 0.3 mL 0.4 mL 0.5 mL 0.6 mL Đưa vào giàn Jartest
+ Khuấy nhanh với tốc ộ 100 vòng/ phút
+ Khuấy chậm với tốc ộ 15 vòng/ phút Lắng tĩnh 30p Tắt máy
( Để yên lắng trong 30 phút Phân tích mẫu Đo lại pH sau lắng,
Lấy mẫu dưới lớp váng Đem i lọc ộ ục, bề mặt xác ịnh hàm lượng P
Lưu ý: Liều lượng vôi tối ưu là liều lượng vôi với mẫu có ộ ục, hàm lượng P thấp nhất.
5.3.3 Phương pháp xác ịnh hàm lượng Photpho
Nếu nồng ộ quá cao cần phải pha loãng mẫu nước thải 10 lần Đường
chuẩn photpho:
Bảng 5.1 Đường chuẩn photpho STT 0 1 2 3 4 5 6 dd P-PO4 chuẩn (mL) 0 0.5 1 1.5 2 2.5 - Nước cất (mL) 25 24.5 24 23.5 23 22.2 - Mẫu nước (mL) Định mức lên 25mL 25 Molybdate 1mL SnCl2 3 giọt
Photpho ban ầu:
M ẫ u không lọ c 1 giọt pheno lphthalein (Nếu mẫu Để yên 10 phút 25 mL mẫu
chuyển sang hồng thêm từ từ ( không quá 12ph) strong acid ể mất màu) Đi o ộ hấp thu ở bước sóng 690nm
Mẫu lọc: Lọc mẫu sau ó tiến hành các bước như mẫu không lọc.
5.4 Kết quả thí nghiệm
5.4.1. Xác ịnh thông số ầu vào
Bảng 5.2 Thông số ầu vào pH Độ ục (NTU) Hàm lượng P Mẫu lọc Mẫu không lọc 5.28 264 0.827 1.226
5.4.2. Thí nghiệm 1: Xác ịnh lượng pH tối ưu
Bảng 5.3 Xác ịnh lượng hóa chất iều chỉnh pH pH 5 5.5 6 6.5 7 7.5
400mL nước thải + 0.3mL vôi (pH = 10.03) VH2SO4 (mL) 11.55 11.25 10.75 9.85 9.2 8.6 VNaOH (mL) 0 mL
Bảng 5.4 Kết quả của thí nghiệm xác ịnh lượng pH tối ưu Mẫu pH 5 5.5 6 6.5 7 7.5
400mL nước thải + 0.3mL vôi (pH = 10.03) VH2SO4 (mL) 11.55 11.25 10.75 9.85 9.2 8.6
- Khuấy nhanh 100 vòng/phút trong 1 phút - Khuấy chậm 15 –
20 vòng/phút trong 15 phút
- Để yên, lắng tĩnh 30 phút pH sau lắng 4.11 5.22 3.48 3.22 3.35 3.96 Độ ục (NTU) 13.4 26.3 11.75 18.25 11.45 12.1 Lọc 0.65 0.608 0.688 0.754 0.724 0.677 Photpho (Abs) Không lọc 0.674 0.65 0.766 0.734 0.68 0.669
Bảng 5.5 Kết quả của thí nghiệm xác ịnh lượng vôi tối ưu Vôi Ca(OH)2 Mẫu 0.1 0.2 0.3 0.4 0.5 0.6
Chỉnh lại pH (lượng phèn khác nhau) pH 8,64 9,1 9,65 10,2 10,6 10,7 VH2SO4 (mL) 4,5 6,2 9,5 11,2 16,7 22,5
- Khuấy nhanh 100 vòng/phút trong 1 phút
- Khuấy chậm 15 – 20 vòng/phút trong 15 phút
- Để yên, lắng tĩnh 30 phút pH sau lắng 8,66 9,78 10,77 10,88 11,17 11,29 Độ ục 11.3 9.2 10.5 10.9 13.6 11.8 Lọc 0.648 0.669 0.329 0.368 0.417 0.408 Hàm lượng P (Abs)
Không lọc 0.715 0.652 0.498 0.508 0.461 0.437
5.5 Xử lý số liệu
Đường chuẩn photpho: y = 0.2068x + 0.0156 (R2 = 0.994)
Lấy 5mL mẫu ịnh mức lên 25mL → Pha loãng mẫu 5 lần.
5.5.1 Xác ịnh thông số ầu vào
Xử lý hàm lượng Photpho ban ầu:
Bảng 5.6 Xử lý thông số ầu vào pH Độ ục (NTU) Hàm lượng P Mẫu lọc Mẫu không lọc 5.28 264 Photpho (Abs) 0.827 Photpho (Abs) 1.226 Photpho (mg/L) 4 Photpho (mg/L) 6
5.5.2 Thí nghiệm 1: Xác ịnh lượng pH tối ưu
Đo hàm lượng P: Lấy 5mL mẫu ịnh mức lên 25mL → Pha loãng mẫu 5 lần.
Hình 5.1. Mẫu trong quá trình khuấy Jartest
Bảng 5.7 Xử lý kết quả của thí nghiệm xác ịnh lượng pH tối ưu pH Mẫu 5 5.5 6 6.5 7 7.5
400mL nước thải + 0.3mL vôi (pH = 10.03) VH2SO4 (mL) 11.55 11.25 10.75 9.85 9.2 8.6
- Khuấy nhanh 100 vòng/phút trong 1 phút - Khuấy
chậm 15 – 20 vòng/phút trong 15 phút
- Để yên, lắng tĩnh 30 phút pH sau lắng 4.11 5.22 3.48 3.22 3.35 3.96 Độ ục (NTU) 11.75 18.25 13.4 26.3 11.45 12.1 %H ộ ục 95.6 93.1 95 90 95.7 95.4 Lọc 0.65 0.724 0.688 0.754 0.608 0.677 Photpho (Abs) Không lọc 0.674 0.734 0.68 0.766 0.65 0.669 Lọc 3.1 3.4 3.3 3.6 3 3.2
Photpho (mg/L) Không lọc 3.2 3.5 3.2 3.6 3.1 3.2 Lọc 22.5 15 17.5 10 25 20 %H photpho Không lọc 46.7 41.7 46.7 40 48.3 46.7
Hình 5.2. Mẫu Photpho xác ịnh pH tối ưu
Chọn pH tối ưu là: 7
Đồ thị thể hiện mối tương quan giữa ph, hiệu suất xử lý ộ
ục và hiệu suất xử lý phopho mẫu lọc - không lọc 120 100 80 60 40 20 0 5 5.5 6 6.5 7 7.5 pH %H ộ ục %H Pmẫu lọc %H Pmẫu không lọc
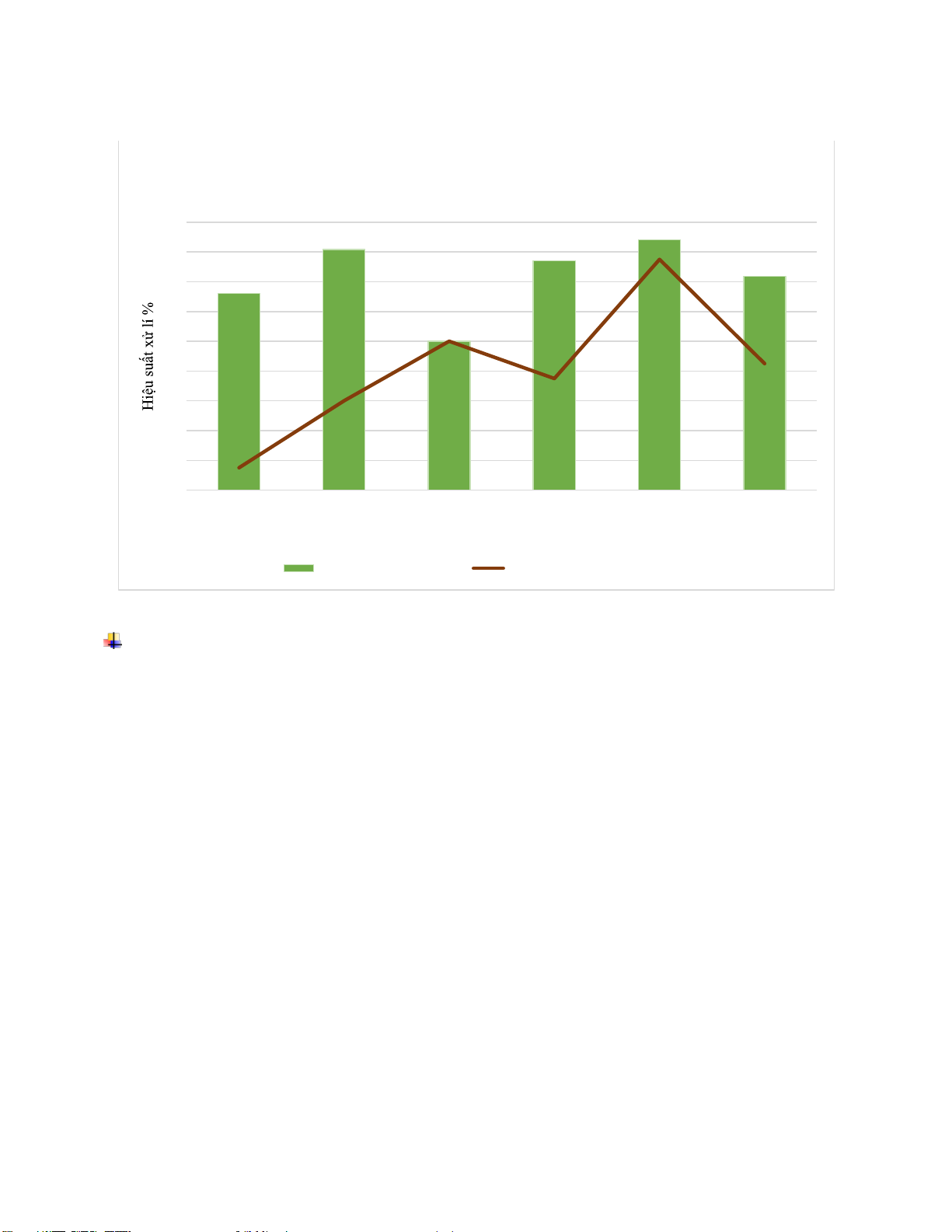
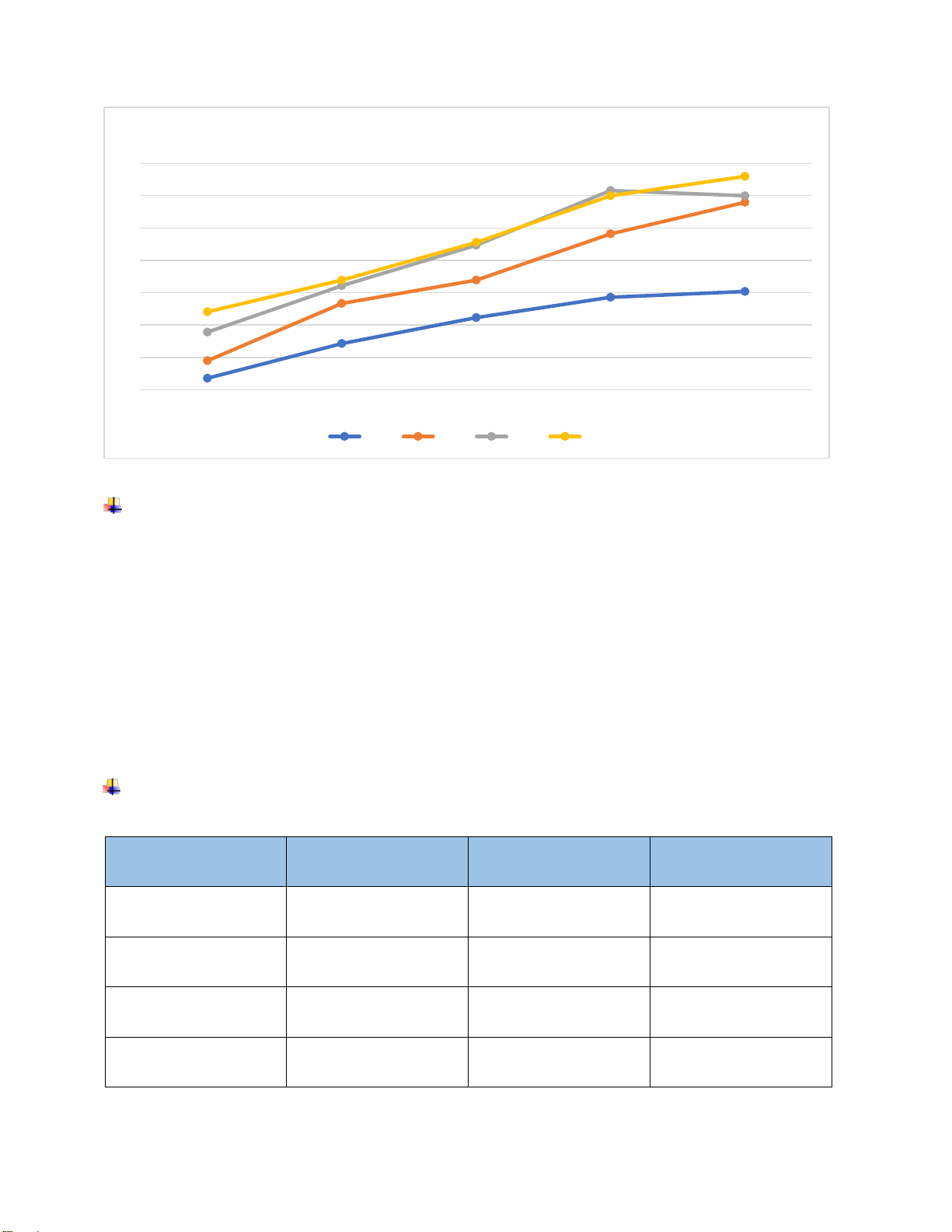
Hình 5.3. Đồ thị mối tương quan giữa pH, hiệu suất xử lý ộ ục và P (lọc, không lọc) Nhận xét:
- Hiệu suất xử lý ộ ục càng cao thì hiệu quả xứ lý P càng cao chứng tỏ khi loại bỏ ược
các cặn lơ lửng bằng phương pháp hóa lý thì P cũng sẽ bị loại bỏ theo. Chứng minh ược rằng
1 phần P tồn tại dưới dạng cặn.
- Tổng quan ta thấy xu hướng của hiệu suất xử lí giống nhau tại mọi iểm pH. Nói lên
chúng có mối liên kết với nhau của ộ ục do SS gây ra và nồng ộ Photpho.
- Hiệu suất xử lý ộ ục và P cao nhất khi ở pH là 7, tại pH này, hiệu quả xử lý P lên ến
25% ối với mẫu lọc, còn mẫu không lọc ến 48.3%. Cũng tại pH = 7, hiệu quả xử lý ộ ục lên
ến 95.7%. Chứng tỏ pH 7 là iều kiện thích hợp ể loại bỏ ược hàm lượng P có trong nước nên
pH tối ưu của quá trình là 7.
- Hiệu suất xử lý thấp nhất là tại pH 6.5. Tại ây, có hiệu suất xử lý: + P ở mẫu lọc:
• pH = 6.5 hiệu suất xử lý là 10% + P ở mẫu không lọc:
• pH = 6.5 hiệu suất xử lý là 40%
+ Hiệu suất xử lý ộ ục là 90%
Tại pH = 5 và 7.5, hiệu suất suất xử lý cũng tương ối cao. Hiệu suất xử lý ộ ục lần lượt là 95.6%
và 95.4% gần như là tương ối. Đối với mẫu P lọc thì hiệu suất xử lý là 22.5% và 20% ( mẫu lọc tại
pH 5 cao hơn tại pH 7.5 khoảng 2.5%). Mẫu P không lọc còn lại cho ra hiệu suất xử lý là như nhau 46.7%.
5.5.3 Thí nghiệm 2: Xác ịnh lượng vôi tối ưu
Đo hàm lượng P: Lấy 5mL mẫu ịnh mức lên 25mL → Pha loãng mẫu 5 lần.
Bảng 5.8 Xử lý kết quả của thí nghiệm xác ịnh lượng vôi tối ưu Vôi Ca(OH)2 Mẫu 0.1 0.2 0.3 0.4 0.5 0.6
Chỉnh lại pH (lượng phèn khác nhau) pH 8,64 9,1 9,65 10,2 10,6 10,7 VH2SO4 (mL) 4,5 6,2 9,5 11,2 16,7 22,5
- Khuấy nhanh 100 vòng/phút trong 1 phút
- Khuấy chậm 15 – 20 vòng/phút trong 15 phút
- Để yên, lắng tĩnh 30 phút pH sau lắng 8,66 9,78 10,77 10,88 11,17 11,29 Độ ục 11.3 10.5 9.2 10.9 13.6 11.8 %H ộ ục 95.7 96 96.5 95.8 94.8 95.5 Lọc Hàm lượng P 0.648 0.669 0.329 0.368 0.417 0.408 (Abs)
Không lọc 0.715 0.652 0.437 0.508 0.461 0.498 Hàm lượng P Lọc 3.1 3.2 1.5 1.7 2 1.9 (mg/L) Không lọc 3.4 3.1 2 2.4 2.2 2.3 Lọc 22.5 20 62.5 57.5 50 52.5
%H photpho Không lọc 43.3 48.3 66.7 60 63.3 61.7
Hình 5.4. Mẫu Photpho xác ịnh liều lượng Ca(OH)2 tối ưu
Chọn Ca(OH)2 tối ưu: 0.3mL
Đồ thị tương quan giữa Ca(OH)2, hiệu suất xử lý ộ ục và
hiệu suất xử lý phopho mẫu lọc - không lọc 120 100 80 60 40 20 0 0.1 0.2 0.3 0.4 0.5 0.6 V Ca(OH)2 %H ộ ục %H Pmẫu lọc %H Pmẫu không lọc
Hình 5.5. Đồ thị mối tương quan giữa lượng Vôi, hiệu suất xử lý ộ ục, P (lọc, không lọc) Nhận xét:
- Mẫu Photpho xác ịnh liều lượng Ca(OH)2 tối ưu, khi thêm vào 1 giọt chỉ thị
Phenolphthalein dung dịch chuyển sang màu hồng chứng tỏ rằng nồng ộ P trong mẫu nước
thải ang rất cao. Trong trường hợp ó, ta cần phải thêm vào 1 giọt H2SO4 ặm ặc ể cho dung
dịch mất màu và thêm vào tiếp tục thêm vào Molybdate và SnCl2 ( ể yên 10 phút, không quá
12 phút) em i o bước sóng.
- Biểu ồ cho ta thấy hiệu suất của mẫu không lọc và mẫu lọc gần tương ối nhau bởi xu
hướng giống nhau qua ó ta có thể ánh giá là lượng SS gây ảnh hưởng ến quá trình xử lí PhotPho.
- Nhìn vào biểu ồ trên ta thấy lượng vôi là 0.3 mL, 0.4 mL, 0.5 mL, 0,6 mL là lượng vôi
cho ra hiệu quả xử lý P và hiệu quả xử lý ộ ục cao nhất khi xấp xỉ 60%.
- Và tại nồng ộ vôi bằng 0,3 mL cho ra kết quả cao hơn so với các nồng ộ còn lại, qua ó
ta có thể kết luận tại nồng ộ vôi 0,3 mL là phù hợp với tính chất của nguồn nước.
5.6 Trả lời câu hỏi
Câu 1. Ý nghĩa của photphorus trong việc kiểm soát ô nhiễm nguồn nước ? Phú nhưỡng hóa
Photpho hiếm khi ược tìm thấy ở dạng nguyên tố của nó mà tồn tại trong nước và nước
thải hầu như ở dạng phosphate. Phosphate rất cần thiết cho sự phát triển của ộng thực vật,
nhưng có nhiều phosphate trong nước có thể góp phần gây ra hiện tượng phú dưỡng.
Phú dưỡng hóa là hiện tượng dư chất dinh dưỡng.
Câu 2. Sự khác nhau giữa orthophosphate, polyphosphate và organic phospho?
Orthophosphate: Đây là dạng phosphate có cấu tạo PO43- có tính tan khi ở trạng thái
hợp chất như Mg(PO4), K3PO4 . Có tính linh ộng cao dễ dàng hấp thụ bởi vi sinh vật và thực vật hơn các dạng khác.
Polyphosphate: ây là hợp chất liên kết vô cơ chứa hơn một nguyên tử phospho như
P2O5, có tính linh ộng kém hơn so với orthophosphate .
Phosphat hữu cơ: dạng này có thành phần cấu trúc từ các phân tử ATP, ADP trong cơ thể sinh vật.