







Preview text:
CÂU HỎI LÝ THUYẾT
1. Hiện tượng khi đốt cháy saccarozơ, benzene nhằm xác định carbon bằng pp carbon hóa:
➢ Có khói đen bay lên bám trên thành chén sứ & hình thành than ở đáy chén
2. Phương trình phản ứng nhận diện carbon khi đốt saccarozơ : ➢ C to 12H22O11 + 12O2 12CO2 + 11 H2O ➢ C12H22O11 to 12C + 11 H2O Thu được C ( Đen) ➢ C12H22O11 + 3O2 to 9C + 3CO2↑ + 11H2O↑
Hiện tượng đường Saccarozơ qua quá trình đun trên bếp điện bị nóng chảy chuyển từ
màu trắng sang màu vàng nâu, tiếp tục đun → chuyển sang màu đen than (C)
3. Phương trình phản ứng nhận diện carbon khi đốt benzen: ➢ 2C6H6 + 15O2 to 12CO2↑ + 6 H2O↑
4. Xác định nguyên tố Nitơ (N) bằng pp Lassaigne: chia 2 trường hợp
➢ Trường hợp riêng: Hợp chất có N liên kết trực tiếp với C & H ➢ Trường hợp chung:
5. Hiện tượng xuất hiện trong trường hợp riêng ( hợp chất có N liên kết trực tiếp
với C & H) trong phản ứng xác định Nitơ (N) bằng pp Lassaigne:
➢ Quan sát thấy có khói trắng bay lên, ngửi thấy có mùi khai đặc trưng của
NH3 thoát ra ở miệng ống nghiệm do: Khi Urea (CH2)2CO tác dụng với
NaOH có chất xúc tác là CaO & nhiệt độ sẽ tạo nên khí NH3↑.
Phương trình Phản ứng: O CaO
NH2-C-NH2 + 2 NaOH → 2NH3↑ + Na2CO3 to CaO Or: CH4N2O + 2NaOH → 2NH3↑ + Na2CO3 to
➢ Thấm ướt giấy quỳ tím, đặt lên ống nghiệm → giấy quỳ chuyển màu xanh
đậm do: Khí NH3↑ có tính bazo yếu khi bị đun nóng bay lên kết hợp với H2O
tạo NH4OH có tính kiềm làm quỳ tím hóa xanh.
Phương trình Phản ứng: NH3↑ + H2O
→ NH4OH ( pH > 7, làm xanh giấy quì)
➢ Kết luận: Hợp chất này có chứa nitơ (N)
6. Phương trình phản ứng xác định nitơ (N) to ➢ + Na
NaCN ( màu đen) + NH3↑ + H2O ➢ to
2NaCN + FeSO4 Fe(CN)2 ( xanh rêu) + Na2SO4 Natri cyanide
➢ Fe(CN)2 ( vừa tạo) + 4NaCN ( dư) to Na4[Fe(CN)6] (vàng nâu) Natri ferroxianua ➢ Na HCl
4[Fe(CN)6] + FeCl3 NaFe[Fe(CN)6] ( xanh phổ) + 3NaCl OR ➢ HCl
3Na4[Fe(CN)6] + 4FeCl3 Fe4[Fe(CN)6]3 ( xanh phổ đậm) + 12NaCl Ferric Ferrocyanide
7. Nêu tác dụng của việc acid hóa hỗn hợp chất hữu cơ:
➢ Trung hòa lượng NH3 sinh ra từ phản ứng Urea với NaOH
➢ Tác dụng với ion OH- trong dung dịch.
➢ Trong môi trường HCl màu của phức bền hơn & đậm hơn
8. Màu của ngọn lửa trong phản ứng xác định các halogen (PP1):
➢ Nếu ngọn lửa có màu xanh → kết luận có halogen & ngược lại
➢ Phương trình phản ứng: Dung dịch + dây đồng to
o Nếu có màu xanh → Kết luận: có Cloroform ( có halogen)
o Nếu không có màu xanh →Kết luận: không có Cloroform ( Ko có halogen)
9. Phản ứng xác định các halogen (PP2): ➢ CHCl to 3 CO2 + H2O + HCl↑ C 2H5OH
➢ HCl + AgNO3 AgCl↓ + HNO3 (khói & tủa trắng ) ➢ AgCl↓ + 2NH3
Ag(NH3)2Cl ( tạo phức tan ) 10.
Chức năng của ethanol ( C2H5OH) rượu:
➢ Rượu ethanol ( C2H5OH) là 1 dung môi linh hoạt, có thể hòa tan trong: o nước
o & các dung môi khác như: • acid acetic ( CH3COOH), • benzene ( C6H6), • chlorofom (CHCl3)…
➢ & là 1 alcol mạch thẳng C2H5OH
➢ Làm nhiên liệu, chất tẩy, chất sát trùng..
➢ Trong phản ứng tìm halogen dùng pp 2: ethanol dùng như chất để tạo phản ứng đốt cháy CHCl3 11.
Hiện tượng xảy ra khi úp phểu có chứa AgNO3: (giấy nhỏ, tẩm CHCl3
và cho ít ethanol 95o vào cốc, Đốt mảnh giấy trong cốc & úp phểu lên trên cốc )
➢ Khi đốt mảnh giấy đã tẩm CHCl3 & ethanol & úp phểu có chứa AgNO3 lên,
ta thấy khói trắng & trên thành trong của phểu xuất hiện tủa . Tủa này tan khi cho NH3đđ vào
➢ Phương trình phản ứng: o CHCl to 3 + O2 CO2 + HCl↑
o HCl + AgNO3 → AgCl↓ + HNO3 ( khói trắng & tủa trắng )
o AgCl + 2NH3đđ → Ag(NH3)2Cl phức tan 12.
Trong môi trường: base, acid, trung tính, số oxy hóa của Mn+7 là bao nhiêu?
➢ Môi trường acid ( H2SO4) ( hồng nhạt→chuyển→ko màu) → Mn+2
➢ Môi trường base (NaOH) ( xanh lá →chuyển→vàng có↓) → Mn+6
➢ Môi trường trung tính (H2O) ( vàng đậm →chuyển→↓ nâu) → Mn+4 13.
Thí nghiệm 5: +7 ➢ KMnO4 o N1 MT acid hồng nhạt → Không màu Mn+2 o N2 MT Base
xanh lá → Vàng, tủa nâu Mn+6 o N3 Trung tính
vàng đậm → Vàng đậm, tủa nâu Mn+4 C. Oxi hóa C. Khử +2
4KMnO4 +5C2H5OH + 6H2SO4 → 2K2SO4 + 4MnSO4 + 5CH3COOH + 11H2O ( xa n h k hô n
g b ền) C. Oxi hóa C. Khử +6
4KMnO4 + 4NaOH + C2H5OH → 2K2MnO4 + 2Na2MnO4 + CH3COOH + 3H2O +4
4KMnO4 + 3CH3CH2OH → 4MnO2↓ + 4KOH + 3CH3COOH + H2O
CH3COOH tác dụng ngược với NaOH mất môi trường base chuyển sang môi
trường trung tính
4KMnO4 + 3CH3CH2OH → 4MnO2↓ + 4KOH + 3CH3COOH + H2O 14.
Khi nào phải lọc dịch bằng giấy không xếp nếp & có xếp nếp?
➢ Mục đích: Lấy tủa & loại tạp lỏng → dùng giấy lọc không xếp nếp
➢ Mục đích: Lấy dịch & loại tạp rắn → dùng giấy lọc xếp nếp 15.
Vì sao dùng glycerin mà không dùng hóa chất khác làm dung môi gia nhiệt
➢ Glycerin gia nhiệt tốt ( dẫn nhiệt tốt) ➢ Nhiệt độ sôi cao ➢ Khó bay hơi 16.
Một số dụng cụ chưng cất phân đoạn ➢ 1. Nguồn nhiệt ➢ 2. Bình cầu
➢ 3. Tháp phân đoạn ( còn gọi là cột phân đoạn) ➢ 4. Nhiệt kế
➢ 5. Ống sinh hàn thẳng (để chưng cất, tác dụng làm lạnh, ngưng tụ hơi thành dạng dung dịch
➢ 6. Đầu ra của nước ( nằm phía trên)
➢ 7. Đầu vào của nước (nằm phía dưới)
➢ 8. Sườn bì: đá bọt làm sôi dd đều hơn, làm dd không trào) ➢ 9. Bình tam giác
➢ ( Vasolin vào mắc ống, bôi 2/3 bên trên để dễ tháo ráp & khít) 17.
Vai trò của K2CO3
➢ Là dung môi trung gian để tách nước và ethanol ( C6H5OH ) ( rượu) → nên
tan trong nước, không tan trong cồn 18.
Phản ứng Zn trong bài 2 – thí nghiệm 5, xác định halogen: (ngọn lửa xanh) – khói trắng ➢ Zn + O to 2 ZnO to ➢ ZnO + NH4Cl → NH3 + Cl2 19.
Phản ứng CHCl3 ( chloroform): to C2H5OH ➢ CHCl3 → CO2 + HCl ➢ HCl + AgNO3
AgCl↓ + HNO3 ( Tủa trắng, khói trắng)
➢ AgCl + NH3 Ag(NH3)2Cl ( phức tan) 20.
Các yếu tố ảnh hưởng đến nhiệt độ nóng chảy ➢ Tạp chất (chính) ➢ Môi trường ➢ Áp suất 21.
Các yếu tố ảnh hưởng đến độ sôi: ➢ Áp suất (chính) ➢ Tạp chất ➢ Môi trường 22.
Vai trò của glycerin là để:
➢ Gia nhiệt, điều nhiệt, giữ nhiệt, ít thất thoát 23.
Kẽm để trong cốc dùng để:
➢ Tạo dòng đối lưu nhiệt cho nóng đều 24.
Để xác định hằng số vật lý ta căn cứ vào yếu tố nào: ➢ Nhiệt nóng chảy ( tạp chất) ➢ Nhiệt sôi ( áp suất ) ➢ Tỉ trọng D ➢ Độ nhớt 𝜂
➢ Chỉ số khúc xạ (chiết suất) → n 25.
Để trung hòa lượng NH3 sinh ra từ phản ứng Urea với NaOH
➢ 2Na + 2H2O → 2NaOH + H2↑ 26.
Giấy lọc xếp nếp:
➢ Lọc lấy dịch, Loại tạp rắn 27.
Giấy lọc không xếp nếp:
➢ Lọc lấy tủa, Loại tạp lỏng 28.
Vì sao phải dùng giấy lọc không xếp nếp khi lọc lấy tủa ( loại tạp lỏng)
➢ Muốn lấy phần chất rắn, bỏ phần dd thì gấp đơn giản để phần lỏng dể chảy
xuống mà phần rắn lại không bị hao hụt nhiều do diện tích tiếp xúc thấp. 29.
Vì sao phải dùng giấy lọc xếp nếp để lọc lấy dịch ( loại tạp rắn)
➢ Muốn lấy phần dd,bỏ phần rắn thì gấp giấy lọc thành nhiều nếp gấp. Để phần
rắn bám nhiều trên những khía của giấy lọc. Dd chảy xuống nhanh & trong hơn. 30.
Công thức ( tổng của giấy lọc và acetamilid)
➢ 𝑚𝑧(𝑡ổ𝑛𝑔) = mg (𝑔𝑖ấ𝑦 𝑙ọ𝑐) + m𝑎(acetamilid)
➢ m𝑎(acetamilid) = 𝑚𝑧(𝑡ổ𝑛𝑔) - mg (𝑔𝑖ấ𝑦 𝑙ọ𝑐) 31.
Tách lớp trong phản ứng về tính tan of cồn:
➢ Ống nghiệm 2 chứa dd cồn & nước, sau khi cho thêm 2g K2CO3 vào thì xảy
ra hiện tượng tách lớp:
➢ Trên: cồn (do KLR Dcồn nhẹ hơn)
➢ Dưới: dd muối ( KLR Dmuối nặng hơn) 32.
Rượu & nước tan hoàn toàn nhưng khi cho muối vào thì:
➢ Muối không tan trong rượu nên xảy ra hiện tượng tách lớp
➢ Trên: rượu (do KLR Dcồn nhẹ hơn)
➢ Dưới: dd muối ( KLR Dmuối nặng hơn) 33.
Khối lượng riêng của rượu & dung dịch
➢ Drượu < Ddung dịch 34.
Vì sao phải bôi vasolin vào mấu các bộ phận chưng cất:
➢ Để các mối nối khít lại không cho hơi thoát ra ngoài ➢ Dễ tháo ráp 35.
Đầu bình bôi vasolin khu vực nào để dễ tháo ráp: ➢ Bôi 2/3 trên 36.
Ống sinh hàn có tác dụng:
➢ Làm lạnh & ngưng tụ hơi 37.
Đá bọt cho vào bình cầu khi chưng cất có công dụng gì?
➢ Để nhiệt độ khuếch tán đều,
➢ hãm nhiệt, tránh hiện tượng quá nhiệt làm dd sôi bùng lên dữ dội & trào ra ngoài gây nguy hiểm. 38.
Công dụng của KMnO4 là chất:
➢ Có tính oxy hóa mạnh có khả năng tiêu diệt vi khuẩn làm cho nước tinh khiết hơn. 39.
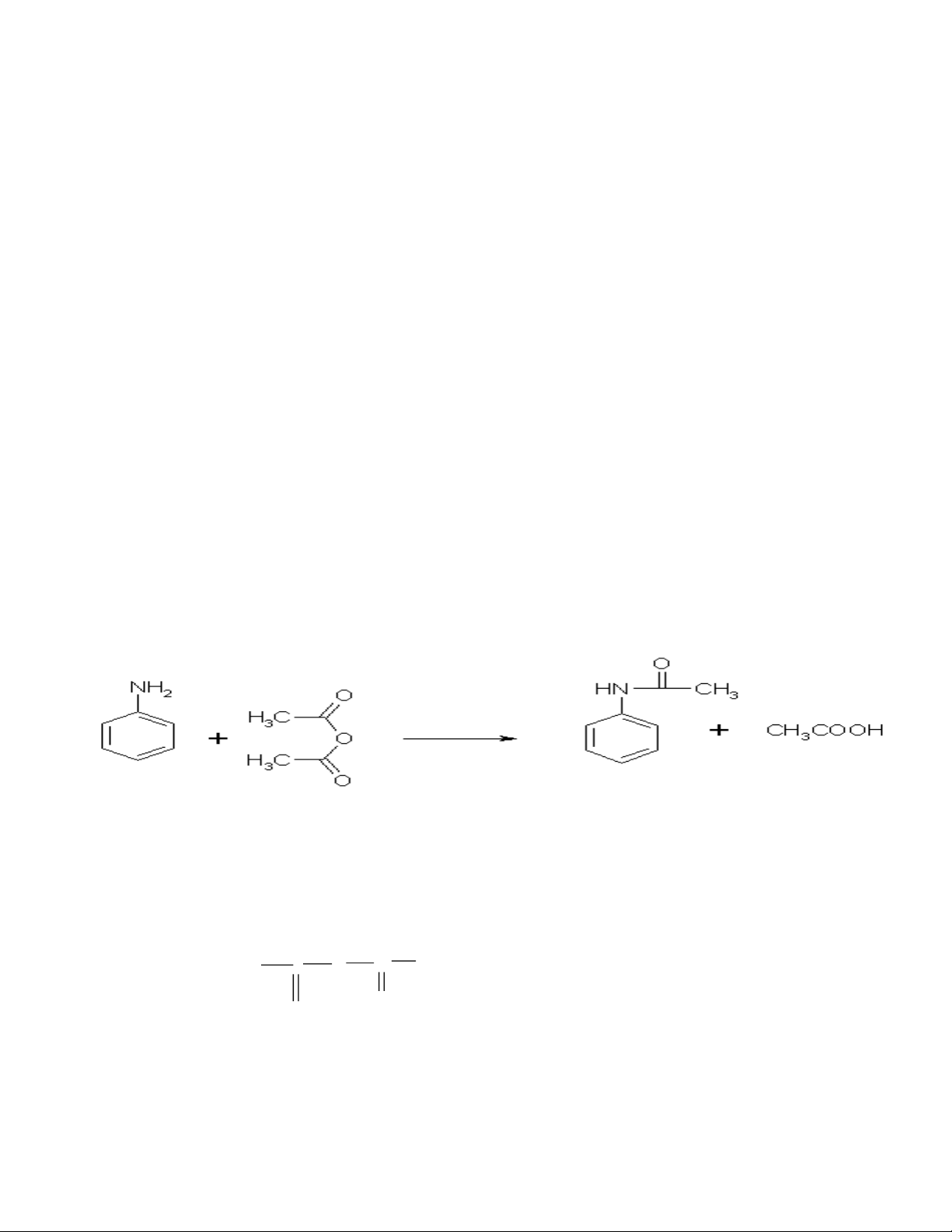
Phản ứng tổng hợp acetanilide là phản ứng gì?
➢ Phản ứng acetyl hóa 40.
Vai trò của alhydrit acetic trong phản ứng tổng hợp acetanilide?
➢ Alhydrit acetic có bản chất là 1 acid mạnh hơn acid carboxylic nên phản
ứng acyl hóa mạnh hơn các acid carboxylic & phản ứng 1 chiều không tái
tạo lại alinin. ➢ Phản ứng: ➢ ACID ACETIC ANILIN ALHYDRIT ACETIC ACETANILID 41.
Công thức cấu tạo của alhydrit acetic: (CH3CO)2O ➢ CH C O C CH 3 3 O O ALHYDRID ACETIC 42.
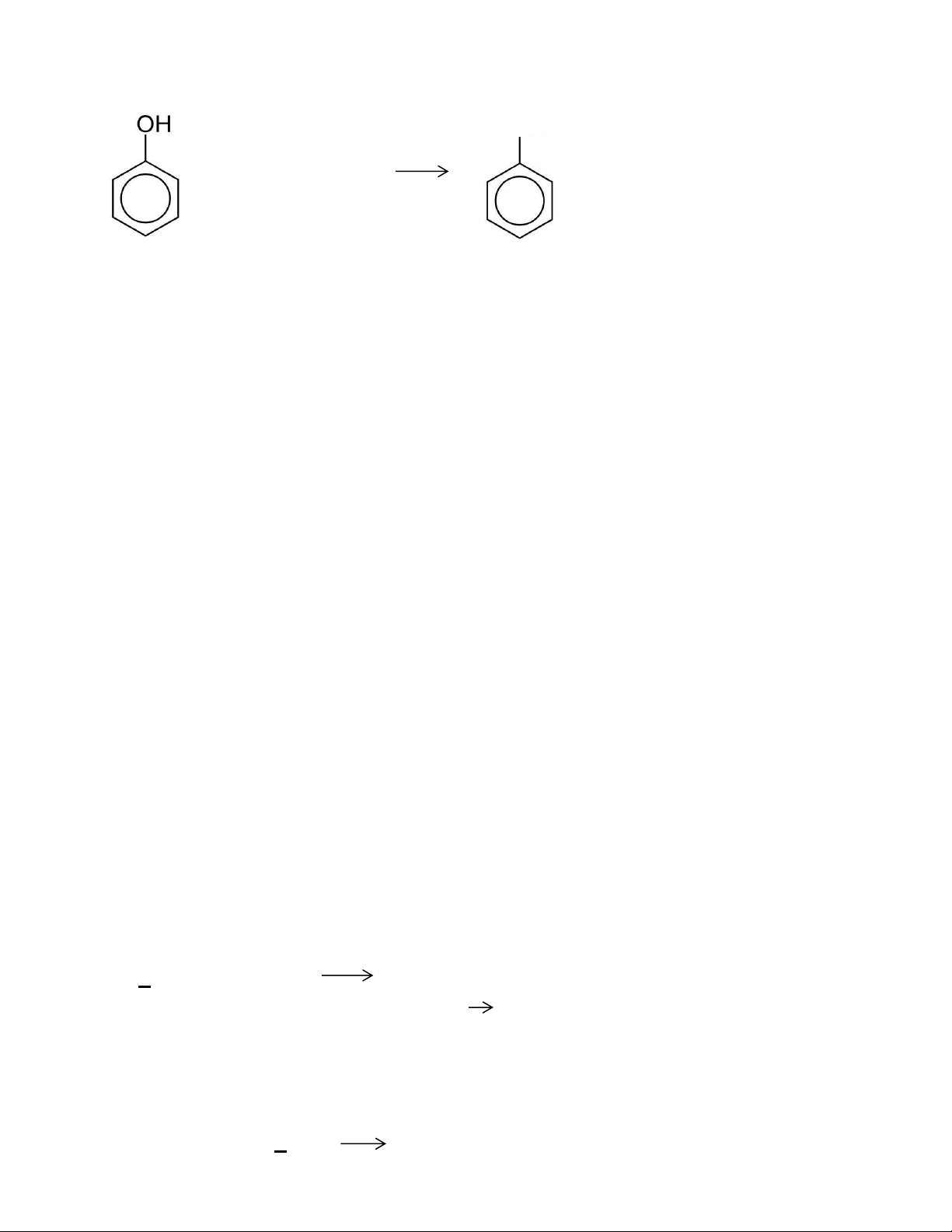
Viết PT phản ứng định tính phenol:
➢ Phương trình phản ứng: OFeCl2 + FeCl3 + HCl 43.
Để nhận biết nước lẫn trong ancol dùng pp gì? CuSO4
➢ Đun CuSO4.5H2O trong chén sứ trên đèn cồn cho đến khi mất màu xanh
➢ Để nguội trong bình làm khô
➢ Cho toàn bộ chất rắn vào ống nghiệm có chứa dd ethanol 95%, lắc đều, đun
nóng nhẹ 1tg, để lắng, xuất hiện màu xanh trở lại→ CuSO4 ngậm nước chuyển màu xanh
➢ KL: ancol có lẫn nước sẽ làm đồng CuSO4 khan ngậm nước & chuyển màu xanh 44.
Natri kim loại được bảo quản như thế nào
➢ Na và các kim loại kiềm hoạt động hóa học mạnh:
o đặc biệt dễ bị oxi hóa nhanh trong không khí
o và có phản ứng mãnh liệt với nước,
Nên cần phải bảo quản chúng trong dầu hỏa khan, trong chân không hoặc
trong khí trơ 45.
Viết PT khi cho NaCN tác dụng với FeSO4. Gọi tên sản phẩm tạo thành: ➢ 2NaCN + FeSO4 Fe(CN)2 ( xanh rêu) + Na2SO4 ➢ Fe(CN) t0
2(sp) + 4NaCN (còn dư) Na4[𝑭𝒆(𝑪𝑵)𝟔] ( vàng nâu ) + 3NaCl
➢ Tên sp: Natri Ferroxianua 46.
Viết PT phản ứng giữa AgCl & NH3
➢ AgCl↓ + 2NH3 Ag(NH3)2Cl ( phức tan) 47.
Khi lọc sp nếu muốn lấy hết tủa or dd thì ta dùng giấy lọc như thế nào? ➢ Lấy dd: → giấy lọc xếp nếp ➢ Lấy tủa:
→ Giấy lọc không xếp nếp 48.
Dùng phản ứng nào để phân biệt ancol đa chức có các nhóm hydroxyl
& ancol đơn chức
➢ Phản ứng của etylenglicol, glycerol với đồng II hydroxyd 49.
Viết PT phản ứng của đồng II oxyd với ethanol
➢ C2H5OH + CuO → CH3CHO + Cu + H2O 50.
Bịt ống nghiệm trong phản ứng thủy phân natriethylat nhằm:
➢ giữ lại khí H2 trong ống nghiệm – đốt khí này trên ngọn đèn cồn để quan sát
phản ứng màu khi cháy của hydro
➢ H hidro cháy có màu xanh lam, kèm tiếng nổ ( người ta gọi đó là phản ứng
nổ và có hơi nước xuất hiện)
➢ Phương trình: 2H2 + O2 → 2H2O 51.
Chưng cất là:
➢ PP dùng nhiệt tách biệt hỗn hợp các chất lỏng hòa tan vào nhau 52.
Chưng cất phân đoạn là:
➢ PP dùng nhiệt tách các chất bay hơi ra khỏi hỗn hợp các chất lỏng hòa tan
vào nhau dựa vào sự khác biệt of nhiệt độ sôi




