




Preview text:
lOMoAR cPSD| 46342985
CÂU HỎI ÔN TẬP THỰC HÀNH HÓA HỮU CƠ
Bài 1: Nhận lọ (phenol, cyclohexane, cyclohexen, cyclohexanol, glucose)
● Ghi hiện tượng, giải thích viết phương trình?
➔ Thêm vào mỗi ống nghiệm 1 giọt dd FeCl3, dd có màu xanh tím, nhận được phenol (C6H5OH)
Muối Fe3+ tạo phức với 6 phối tử phenolat tạo ra dung dịch có màu xanh tím.
Fe3+ + 6C6H5OH → [Fe(C6H5O)6]3- + 3H+
Ngâm lạnh các ống nghiệm trong nước đá, sau đó tiếp tục thêm vào từng ống nghiệm 10
giọt H2SO4 đđ, lắc đều. nhận được cyclohexane, cyclohexen, cyclohexanol
Cyclohexane không tan trong H2SO4 đậm đặc, dd tách lớp
Cyclohexene bị sulfo hóa bởi H2SO4 đậm đặc, dd hóa đen
C6H10 + H2SO4 → C6H11(HSO4)
Cyclohexanol bị H2SO4 đđ khử nước tạo thành cyclohexen sau đó cyclohexen bị sulfo hóa
bởi H2SO4 đậm đặc, dd có màu vàng cam và dần ngả đen do phản ứng chậm hơn so với cyclohexene
Dd còn lại là Glucose
Bài 2: Đồng phân Cis-Tran (điều chế acid fumaric)
● So sánh độ bền của acid maleic và acid fumaric? Giải thích.
➔ Acid fumaric bền hơn acid maleic do đồng phân trans có tính đối xứng cao hơn đồng phân
cis nên mạng tinh thể xếp chặt hơn dẫn đến nhiệt độ nóng chảy cao hơn.
● So sánh độ tan của hai acid trên, làm sao để biết chất kết tinh trong nước cái là acid
fumaric? Giải thích.
➔ Acid maleic tan trong nước nhiều hơn acid fumaric. Do giá trị momen lưỡng cực của acid
maleic lớn hơn nhiều so với của acid fumaric. Acid maleic có 2 nhóm –COOH nằm cùng
phía nên momen lưỡng cực tạo thành theo quy tắc hình bình hành có giá trị µ1>0, còn acid
fumaric có 2 nhóm –COOH khác phía nên tổng hợp momen lực là µ2=0 vì vậy µ1>µ2 nên
acid maleic phân cực hơn acid fumaric vì thế tan tốt hơn trong nước.
● Trình bày cơ chế chuyển hóa từ acid maleic sang acid fumaric trong môi trường acid.
➔ Một phân tử HCl cho phản ứng cộng 1,4 với hệ thống liên hợp để cho ra một chất chuyển
tiếp, cơ cấu của chất chuyển tiếp này không còn rắn chắc như cơ cấu của một acid maleic lOMoAR cPSD| 46342985
và do đó có thể xoay đi để có vị trí trans bền hơn. Sau đó các nguyên tử bị loại ra để nối
đôi tái lập trở lại, cho ra acid fumaric.
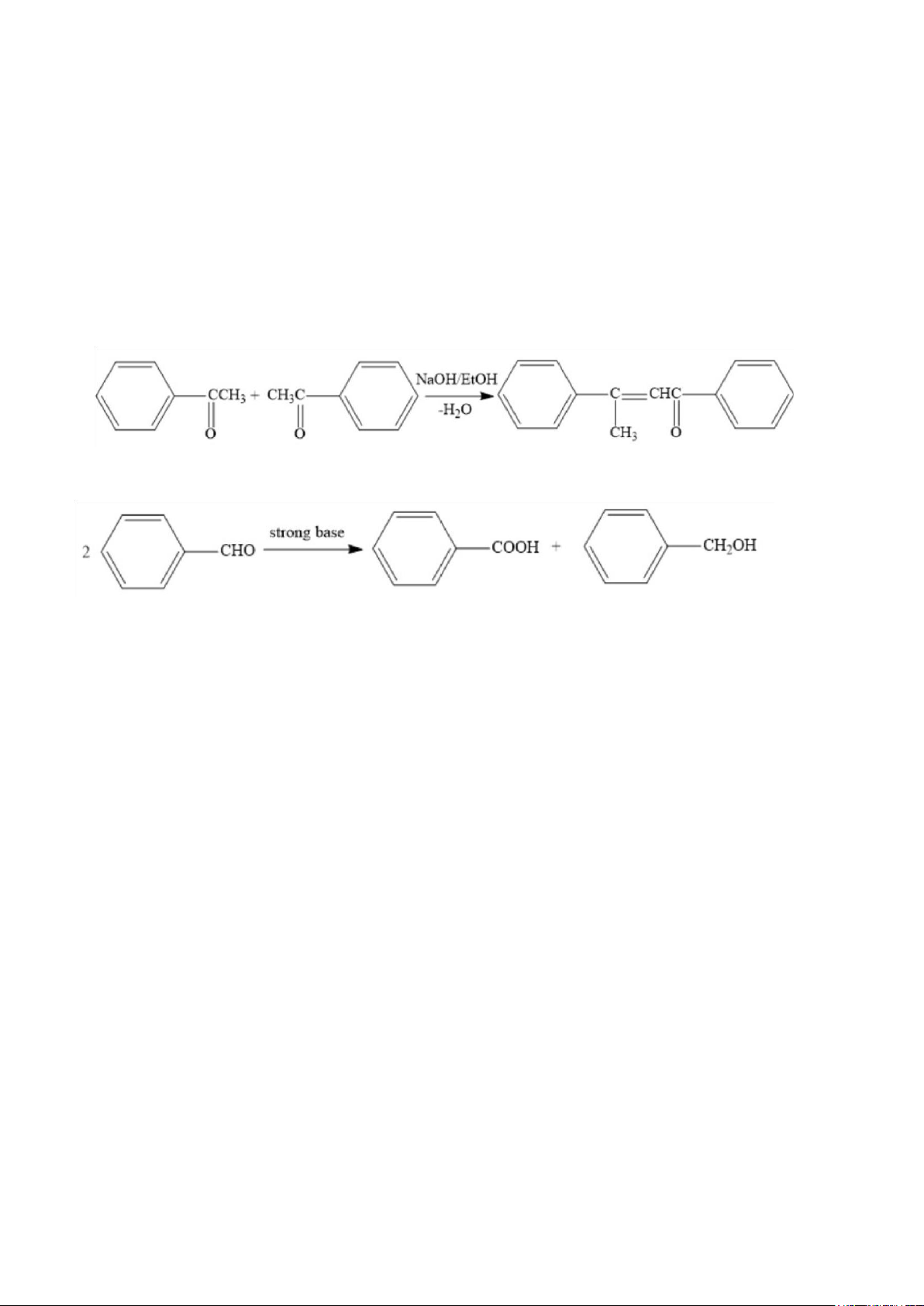
Bài 3: Phản ứng Aldol hóa (điều chế benzalacetophenol)
● Tại sao phải cho acetophenone vào dd NaOH lắc kỹ, rồi sau đó mới cho benzaldehyde?
➔ Để cho OH- có thời gian để deproton (lấy Hα ) acetophenon.
● Cho biết sản phẩm phụ có thể có được.
➔ Tự súc hợp aldol của acetophenone
Phản ứng Cannizzaro của benzaldehyde
● Công dụng của 6ml etanol.
➔ Etanol được dùng làm dung môi để các chất tan vào nhau.
● Tại sao phản ứng khử nước của sản phẩm aldol hóa này lại không dùng xúc tác acid?
Có phải NaOH sử dụng ở đây là chất xúc tác khử nước không?
➔ NaOH là tác nhân deproton hóa. Sản phẩm tạo thành có nối đôi C=C tiếp cách nhân thơm
bền nên không cần dùng xúc tác acid thì quá trình tách nước cũng tự diễn ra được.
● So sánh sự khác nhau của tinh thể kết tinh và tinh thể đông đặc.
➔ Tinh thể kết tinh: vàng nhạt, xốp, lắc nghiêng có dung môi chảy ra, óng ánh hơn. Tinh
thể đông đặc:lắc nghiêng không có dung môi chảy ra, màu vàng đậm
Bài 4: Phản ứng ester hóa (chưng cất acetat n-butyl)
● Dấu hiệu khan nước của ester?
➔ Muối Na2SO4 bám vào đáy erlen.
● Muốn cho hiệu suất phản ứng ester hóa cao phải dựa vào những yếu tố nào?
➔ Tăng nhiệt độ, cho chất xúc tác trước
Lắc đều để tăng diện tích tiếp xúc lOMoAR cPSD| 46342985
Tăng nồng độ ancol, acid, giảm lượng nước (H2SO4 háo nước) để cân bằng chuyển dịch
theo chiều thuận tạo ester theo nguyên lí Le Chatelier.
● Cho biết công dụng của NaHCO3 bão hòa? Có thể thay thế bằng NaHCO3 bằng
Na2CO3 hay NaOH được không?
➔ NaHCO3 dùng để trung hòa acid dư, tạo môi trường trung tính. Không thể dùng Na2CO3
hay NaOH vì chúng tạo môi trường base mạnh.
● Tính hiệu suất quá trình tổng hợp ester.
➔ Cho d: C4H9OH = 0,81 CH3COOH = 1,05 CH3COOC4H9 = 0,88
D = Vm => m = D x V => n(C4H9OH) = DM×V =0,8174×20 =0,219mol nCH3COOH = =0,35mol
⇨ Số mol ester lí thuyết : nester lt =0,219 mol
⇨ Khối lượng ester theo lý thuyết: mester lt =116 x 0,219= 25,404g 25,404
⇨ Thể tích ester lí thuyết: Vester lt = 0,88 =28,8ml
⇨ Thể tích ester thu được thực tế: Vester tt = 3 ml
Hiệu suất phản ứng: H = ×100=10,42%
Bài 5: Điều chế aspirin
● Viết cơ chế phản ứng.
➔ Cơ chế phản ứng điều chế Aspirin là phản ứng este hóa giữa acid salicylic và anhydride
acetic trong môi trường acid (H2SO4 đđ).
Cơ chế phản ứng este hóa giữa Anhydride acetic là SN(CO): Nhóm carbonyl của anhydride
được proton hóa – hình thành cation trung gian. Tiếp theo là giai đoạn tấn công của nguyên
tử oxygen trên phân tử acid salicylic vào cation. Theo sau giai đoạn proton hóa là tạo thành
CH3COOH, sau cùng là giai đoạn tách proton, tái sinh xúc tác, hình thành aspirin.
● Cho biết công dụng của 100ml nước?
● 100ml nước có tác dụng phản ứng hết anhydride acetic dư để tạo ra acid acetic và đồng
thời giúp cho aspirin kết tinh nhanh hơn, vì ở nhiệt độ phòng, aspirin chỉ hòa tan 0,33% trong nước.
● Ta có thể dùng phương pháp nào để nhận biết aspirin tinh khiết? lOMoAR cPSD| 46342985
➔ Rửa sản phẩm bằng nước cất đến khi dịch lọc không cho màu tím với dd FeCl3. Hợp chất
loại phenol có thể tạo phức màu xanh-tím với Fe3+. Acid salicylic cũng thuộc loại hợp chất
đó (có nhóm OH gắn với nhân thơm) nên nó cũng tạo phức màu xanh-tím với Fe3+. Vì vậy
việc rửa sản phẩm thực chất là để nhận biết sản phẩm đã tinh khiết hay còn acid salicylic.
● Có thể thay thế anhydride acetic trong phản ứng trên được không?
➔ Có thể thay thế anhydride acetic trong phản ứng trên bằng acetyl chloride. Tuy nhiên theo
như nghiên cứu, anhydride acetic là chất acetyl hóa tốt hơn, với sản phẩm phụ sinh ra là
acid acetic không có các đặc tính có hại như acid hydrochloric và còn có thể được tái sử dụng.
Bài 6: Phản ứng xà phòng hóa
● Cho biết công dụng của etanol.
➔ Etanol được dùng làm dung môi để các chất tan vào nhau.
● Cho biết công dụng của 100ml dd NaCl bão hòa.
➔ Dd NaCl bão hòa có tác dụng để cho xà phòng kết tinh và tăng tỉ trọng.
● Cho biết sự khác biệt giữa xà phòng thô và xà phòng kết tinh lại
➔ Xà phòng thô: còn lẫn tạp chất như dầu ăn, NaOH dư,...; vẫn còn hơi nhầy.
Xà phòng kết tinh lại: trắng hơn, mịn hơn, khô hơn, độ tinh khiết cao hơn.
● Tại sao phản ứng thủy phân ester với xúc tác acid là phản ứng thuận nghịch, còn
phản ứng savon hóa bằng dd NaOH lại là phản ứng không thuận nghịch?
➔ Phản ứng trung hòa làm giảm nồng độ acid carbocylic làm cho phản ứng ester hóa diễn ra
theo chiều sinh ra acid carbocylic và ancol (chiều thuận), nên phản ứng thủy phân ester
trong môi trường base chỉ diễn ra theo một chiều.
Trong môi trường acid thì phản ứng trung hòa không diễn ra nên phản ứng thủy phân ester
vẫn là phản ứng thuận nghịch.
Bài 7: Phản ứng oxy hóa (điều chế acid benzoic)
● Công dụng của Na2CO3.
➔ Tạo môi trường kiềm cho phản ứng xảy ra.
● Công dụng của H2O2.
➔ Tẩy màu của MnO2 và tác dụng với KMnO4 dư.
PTPƯ: MnO2 + H2O2 → H2O + O2 + MnO
PTPƯ: 2KMnO4 + H2O2 → 2KOH + 2MnO2 + 2O2 lOMoAR cPSD| 46342985
● Tính hiệu suất của sản phẩm so với toluen.
➔ C6H5CH3 + KMnO4 → C6H5COOK + MnO2 + H2O
2C6H5COOK + H2SO4 → 2C6H5COOH + K2SO4
dtoluen = 0,87g/ml → mtoluen = 0,87 x 5 = 4,35g
4,35 ntoluen¿ 92 =¿ 0,05 mol → macid benzoic lt = 0,05 x
122 = 6,1g macid benzoic tt = 3,16g → H% ¿ 36,16,1 ×100=51,80%
Bài 8: Sắc ký cột
● Tại sao hỗn hợp mẫu chất sau khi nạp lên đầu cột cần được giải ly ngay, tránh ngưng
quá trình giải ly một thời gian?
➔ Vì nếu ngưng thì trật tự sắp xếp của các chất trong hỗn hợp sẽ bị xáo trộn làm cho sự tách
không còn hiệu quả nữa.
● Tại sao phải làm khan dịch trích trước khi nạp lên cột sắc ký?
➔ Vì trong quá trình chuẩn bị ta sử dụng rất nhiều dung môi hữu cơ nên cần làm khan để loại
bớt dung môi và đồng thời để thu được một sắc tố đậm đặc.
● Dự đoán thứ tự ra khỏi cột của ba chất A, B, C.
➔ Vì bản chất hóa học của bề mặt silica gel là những nhóm silanol-OH nên những chất phân
cực hơn sẽ bị silica gel giữ chặt lại và giải ly muộn hơn so với những chất khác vì có khả
năng tạo nối hydrogen mạnh.
Thứ tứ ra khỏi cột là: B → A → C.
Bài 9: Sắc ký bản mỏng
● Tại sao phải đặt tờ giấy lọc vào bình sắc ký?
➔ Để kiểm tra độ bão hòa của dung môi trong bình sắc ký.
● Tại sao phải vạch lằn “mức tiền tuyến dung môi”? Để tiết kiệm (nhằm chấm được
nhiều vết) có thể chấm các vết sát lề bản mỏng được không? Tại sao?
➔ Vạch lằn “mức tiền tuyến dung môi” để làm chỗ ta lấy bản sao cho không ảnh hưởng đến
lớp silica gel trên bản, nếu không có mức tiền tuyến ta sẽ chạm vào đường đi của bản mỏng
và vô tình cung cấp tạp chất ảnh hưởng đến hướng di chuyển của các chất.
Không thể chấm các vết sát lề bản mỏng được vì nếu chấm sát lề bản mỏng thì lúc này
diện tích tiếp xúc chính của chất là mặt bên bản mỏng. Nó rất nhỏ nên lực hút các chất vì lOMoAR cPSD| 46342985
vậy cũng nhỏ theo làm cho các chất bên mặt bên cao hơn chất ở trên mặt trước làm cho
giá trị Rf không chính xác.
● Hai hệ dung môi trên, hệ nào tốt hơn? Giải thích.
➔ Hệ dung môi dùng với bản 1 hiện vết bằng cách phun dung dịch FeCl3, còn hệ dung môi
dùng với bản 2 hiện vết bằng cách phun dung dịch H2SO4 đậm đặc và hơ bản trên bếp
nóng. Nên hệ dung môi dùng với bản 1 tốt hơn.



