






Preview text:
CHƯƠNG 1
Câu 1: Đặc điểm của hệ hở là
- có trao đổi chất và có trao đổi năng lượng.
- có trao đổi chất và không trao đổi năng lượng.
- không trao đổi chất và có trao đổi năng lượng.
- không trao đổi chất và không trao đổi năng lượng.
Câu 2: Đặc điểm của hệ cô lập là
- có trao đổi chất và có trao đổi năng lượng.
- có trao đổi chất và không trao đổi năng lượng.
- không trao đổi chất và có trao đổi năng lượng.
- không trao đổi chất và không trao đổi năng lượng.
Câu 3: Khẳng định nào sau đây về nội năng là sai
- nội năng là hàm trạng thái
- kí hiệu là U
- biểu thức: H = U + P.V
- đơn vị là J hoặc Cal.
Câu 4: Cho sơ đồ:
H2
A  B
B
H1 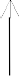
 H3
H3
C  D
D
H4
Theo định luật Hess ta có biểu thức:
- ΔH4 = ΔH1 + ΔH2 + ΔH3
- ΔH1 + ΔH3 = ΔH2 + ΔH4
- ΔH1 + ΔH4 = ΔH2 + ΔH3
- ΔH1 = ΔH2 + ΔH3 + ΔH4
Câu 5: Xét phản ứng: aA + bB  dD + eE
dD + eE
Theo hệ quả của định luật Hess thì:
A. ΔHphản ứng | = | eΔHS, E | + | dΔHS, D | – aΔHS, A | – bΔHS, B |
B. ΔHphản ứng | = | aΔHS, A | + | bΔHS, B | – dΔHS, D | – eΔHS, E |
C. ΔHphản ứng | = | ΔHS, E | + | ΔHS, D | – ΔHS, A | – ΔHS, B |
D. ΔHphản ứng | = | ΔHS, A | + | ΔHS, B | – ΔHS, D | – ΔHS, E |
Câu 6: Xét phản ứng: aA + bB  dD + eE
dD + eE
Theo hệ quả của định luật Hess thì:
| = = | eΔHch, E aΔHch, A | + + | dΔHch, D bΔHch, B |
|
|
C. ΔHphản ứng | = | ΔHch, E | + | ΔHch, D | – ΔHch, A | – ΔHch, B |
D. ΔHphản ứng | = | ΔHch, A | + | ΔHch, B | – ΔHch, D | – ΔHch, E |
Câu 7: Khẳng định nào sau đây về entropi là sai
- Đặc trưng cho mức độ hỗn loạn của hệ.
- Đơn vị thường dùng là J/mol hoặc Cal/mol.
- trong hệ cô lập, quá trình tự diễn biến theo chiều làm tăng entropi của hệ.
- So là entropi của hệ ở điều kiện chuẩn.
298
Câu 8: Khẳng định nào sau đây về thế đẳng nhiệt đẳng áp là sai
- Thế đẳng nhiệt đẳng áp là hàm trạng thái
- kí hiệu thế đẳng nhiệt đẳng áp là G
- một phản ứng tự xảy ra nếu có biến thiên thế đẳng nhiệt đẳng áp > 0.
- Go298 là thế đẳng nhiệt đẳng áp ở điều kiện chuẩn.
Câu 9: Cho sơ đồ:
H2
A  B
B
H1 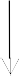
 H3
H3
C  D
D
H4
Theo định luật Hess ta có biểu thức:
- ΔH3 = ΔH2 + ΔH1 + ΔH4
- ΔH1 + ΔH3 = ΔH2 + ΔH4
- ΔH1 + ΔH4 = ΔH2 + ΔH3
- ΔH3 = ΔH2 – ΔH1 + ΔH4
Câu 10: Các yếu tố ảnh hưởng đến biến thiên thế đẳng nhiệt đẳng áp là
- Số mol và áp suất.
- Áp suất và nhiệt độ.
- Nhiệt độ và số mol.
- Nhiệt độ, áp suất, số mol.
Câu 11. Theo quy ước về dấu, phản ứng thu nhiệt là phản ứng có:
- ΔH > 0
- ΔH < 0
- ΔH ≥ 0
- ΔH 0
Câu 12. Thiêu nhiệt (nhiệt cháy) là hiệu ứng nhiệt của phản ứng:
- Phân hủy 1 mol chất thành các đơn chất bền.
- Đốt cháy 1 mol đơn chất bằng oxi để tạo thành các oxit bền.
- Đốt cháy 1 mol chất bằng oxi để tạo thành các oxit bền.
- Đốt cháy 1 chất bằng oxi để tạo thành các oxit bền.
Câu 13. Theo định luật Hess, hiệu ứng nhiệt của một phản ứng hóa học:
- Không phụ thuộc vào bản chất và trạng thái của chất phản ứng và chất sản phẩm, chỉ phụ thuộc vào cách thức tiến hành phản ứng.
- Phụ thuộc vào bản chất và trạng thái của chất phản ứng và chất sản phẩm, phụ thuộc vào cách thức tiến hành phản ứng.
- Không phụ thuộc vào bản chất và trạng thái của chất phản ứng và chất sản phẩm, không phụ thuộc vào cách thức tiến hành phản ứng.
- Chỉ phụ thuộc vào bản chất và trạng thái của chất phản ứng và chất sản phẩm, không phụ thuộc vào cách thức tiến hành phản ứng
Câu 14. Theo hệ quả 1 của định luật Hess thì:
- ΔHthuận = ΔHnghịch
- ΔHthuận > ΔHnghịch
- ΔHthuận < ΔHnghịch
- ΔHthuận = - ΔHnghịch
Câu 15. Khẳng định nào sau đây về nội năng là sai
- nội năng là tổng các dạng năng lượng có sẵn bên trong hệ.
- kí hiệu là U.
- Nội năng của hệ không thay đổi khi hệ thay đổi trạng thái.
- đơn vị là J hoặc Cal.
CHƯƠNG 2
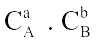
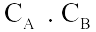
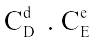 Câu 1. Xét phản ứng đơn giản: aA(k) + bB(k)
Câu 1. Xét phản ứng đơn giản: aA(k) + bB(k)  dD(k) + eE(k) Phương trình động học của phản ứng là
dD(k) + eE(k) Phương trình động học của phản ứng là
A. v | = | k. |
B. v | = | k. |
C. v | = | k. |
D. v | = | k. |
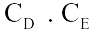
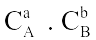
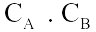 Câu 2. Xét phản ứng aA(r) + bB(k)
Câu 2. Xét phản ứng aA(r) + bB(k)  dD(k) + eE(k) Phương trình động học của phản ứng là
dD(k) + eE(k) Phương trình động học của phản ứng là
A. v | = | k. |
B. v | = | k. |
C. v | = | k. |
D. v | = | k. |
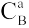
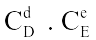 Câu 3. Theo quy tắc Vanhoff về ảnh hưởng của nhiệt độ đến vận tốc phản ứng, thì:
Câu 3. Theo quy tắc Vanhoff về ảnh hưởng của nhiệt độ đến vận tốc phản ứng, thì:
A. Đối với đa số các phản ứng hóa học, trong mọi khoảng nhiệt độ bất kì, tốc độ phản ứng sẽ tăng từ 2 đến 4 lần khi tăng nhiệt độ lên 10 độ.
B. Đối với đa số các phản ứng hóa học, trong một khoảng nhiệt độ không quá lớn, tốc độ phản ứng sẽ tăng từ 2 đến 4 lần khi tăng nhiệt độ lên 10 độ.
C. Đối với đa số các phản ứng hóa học, trong mọi khoảng nhiệt độ không quá lớn, tốc độ phản ứng sẽ tăng lên 2 lần khi tăng nhiệt độ lên 10 độ.
D. Đối với đa số các phản ứng hóa học, trong một khoảng nhiệt độ không quá lớn, tốc độ phản ứng sẽ tăng 4 lần khi tăng nhiệt độ lên 10 độ.
Câu 4. Tác dụng làm tăng tốc độ phản ứng của chất xúc tác là do:
A. Làm giảm năng lượng hoạt hóa của hệ phản ứng.
B. Làm tăng năng lượng hoạt hóa của hệ phản ứng.
C. Làm tăng biến thiên thế đẳng nhiệt đẳng áp của hệ phản ứng.
D. Làm giảm biến thiên thế đẳng nhiệt đẳng áp của hệ phản ứng.
Câu 5. Trong các phản ứng sau, phản ứng nào là phản ứng đồng thể?
A. Zn(r) + H2SO4 loãng (l)  ZnSO4(l) + H2(l)
ZnSO4(l) + H2(l)
B. NaOH(l) + HCl(l)  NaCl(l) + H2O(l)
NaCl(l) + H2O(l)
C. C(r) + O2(k)  CO2(k)
CO2(k)
D. 2Al(r) + Fe2O3(k)  Al2O3 + 2Fe(r)
Al2O3 + 2Fe(r)
Câu 6. Trong các phản ứng sau, phản ứng nào là phản ứng 1 chiều?
A. Fe(r) + 2HCl(l)  FeCl2(l) + H2(k)
FeCl2(l) + H2(k)
 B. 2NO2 N2O4
B. 2NO2 N2O4
 C. H2 + I2 2HI
C. H2 + I2 2HI
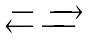 D. N2 + 3H2 2NH3
D. N2 + 3H2 2NH3
Câu 7. Nhận xét nào sau đây về trạng thái cân bằng hóa học là không đúng?
A. Nồng độ các chất không thay đổi.
B. Tốc độ phản ứng thuận và nghịch bằng nhau.
C. Phản ứng dừng lại.
D. Là một trạng thái của phản ứng thuận nghịch.
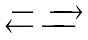 Câu 8. Xét phản ứng N2(k) + 3H2(k) 2NH3(k)
Câu 8. Xét phản ứng N2(k) + 3H2(k) 2NH3(k)
Biểu thức hằng số cân bằng nồng độ của phản ứng là
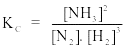
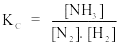
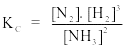
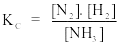
A.
B.
C.
 D.
D.
Câu 9. Xét phản ứng 2A(k) + B(k) 3D(k) + E Biểu thức hằng số cân bằng nồng độ của phản ứng là
A.
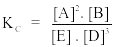
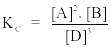
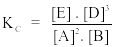
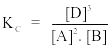
B.
C.
D.
Câu 10. Cho phản ứng thuận nghịch: A(k) + B(r) 2D(k) + E(k). Phương trình biểu diễn mối liên hệ giữa hằng số cân bằng theo áp suất (Kp) với hằng số cân bằng tính theo nồng độ (Kc) của phản ứng trên là:
A. 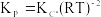
B. 
C. 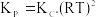
D. 
Câu 11. Tác dụng làm tăng tốc độ phản ứng của chất xúc tác là do:
A. Làm giảm năng lượng hoạt hóa của hệ phản ứng.
B. Làm tăng năng lượng hoạt hóa của hệ phản ứng.
C. Làm tăng biến thiên thế đẳng nhiệt đẳng áp của hệ phản ứng.
D. Làm giảm biến thiên thế đẳng nhiệt đẳng áp của hệ phản ứng.
Câu 12. Năng lượng hoạt hóa của hệ chứa 1 mol chất là:
A. Năng lượng được giải phóng ra khi các phân tử chuyển từ trạng thái hoạt động hóa về trạng thái hoạt động trung bình.
B. Năng lượng cần thiết cung cấp cho các phân tử để chuyển các phân tử từ trạng thái hoạt động trung bình lên trạng thái hoạt động hóa.
C. Năng lượng được giải phóng ra khi các phân tử chuyển từ trạng thái hoạt động trung bình lên trạng thái hoạt động hóa.
D. Năng lượng cần thiết cung cấp cho các phân tử để chuyển các phân tử từ trạng thái hoạt động hóa về trạng thái hoạt động trung bình.
Câu 13. Cho phản ứng: 2A(k) + B(r) C(k) . Phản ứng trên chuyển dịch theo chiều nào nếu giảm áp suất của hệ phản ứng?
A. Phản ứng chuyển dịch theo chiều thuận.
B. Hệ phản ứng không xảy ra sự chuyển dịch cân bằng.
C. Phản ứng chuyển dịch theo chiều nghịch.
D. Không xác định được sự chuyển dịch cân bằng.
Câu 14. Đặc điểm chung của các chất xúc tác là:
A. Có tính chọn lọc, có khả năng làm đổi chiều phản ứng.
B. Không có tính chọn lọc, có khả năng làm đổi chiều phản ứng.
C. Có tính chọn lọc, không làm đổi chiều phản ứng.
D. Có tính chọn lọc, có khả năng làm đổi chiều phản ứng.
Câu 15. Cho phản ứng: 2A(k) + B(r) C(k) (ΔH < 0). Phản ứng trên chuyển dịch theo chiều nào nếu tăng nhiệt độ của phản ứng?
A. Phản ứng chuyển dịch theo chiều thuận.
B. Hệ phản ứng không xảy ra sự chuyển dịch cân bằng.
C. Phản ứng chuyển dịch theo chiều nghịch.
D. Không xác định được sự chuyển dịch cân bằng.




