













Preview text:
CHUYÊN ĐỀ 1. CẤU TẠO NGUYÊN TỬ
THPT CHUYÊN LÊ THÁNH TÔNG - QUẢNG NAM & THPT CHUYÊN BẮC NINH
A/ KIẾN THỨC CƠ BẢN:
A1/ LÝ THUYẾT TÓM TẮT:
I/ LỊCH SỬ TÌM RA CẤU TẠO NGUYÊN TỬ
1. Thí nghiệm khám phá ra electron bởi Thomson
Năm 1897, nhà vật lí người Anh J.J.Thomson thực hiện thí nghiệm phóng điện cho một ống
thủy tinh gần như chân không (gọi là ống tia âm cực). Ông quan sát thấy màn huỳnh quang trong ống
phát sáng do những tia phát ra từ cực âm (gọi là tia âm cực) và những tia này bị hút về cực dương của
điện trường, chúng tỏ chúng mang điện tích âm. Đó chính là chùm các hạt electron.
Hình 1.Thí nghiệm của Thomson
- Tia âm cực có các đặc tính sau:
+ Trên đường đi của nó, nếu đặt một chong chóng nhẹ thì chong chóng bị quay. Điều này cho thấy tia
âm cực là chùm hạt vật chất có khối lượng và chuyển động với vận tốc lớn.
+ Khi không có tác dụng của điện trường và từ trường thì tia âm cực truyền thẳng.
- Khối lượng và điện tích của electron:
+ Electron (kí hiệu là e) có khối lượng và mang điện tích âm.
+ Hạt electron có: Điện tích: q -19 e = -1,602.10 C (coulomb); Khối lượng: m -28 -31 e = 9,11.10 gam = 9,11.10 kg 0,00055u ≃
- Quy ước: 1,602.10-19 C được chọn làm điện tích đơn vị; qe = -1.
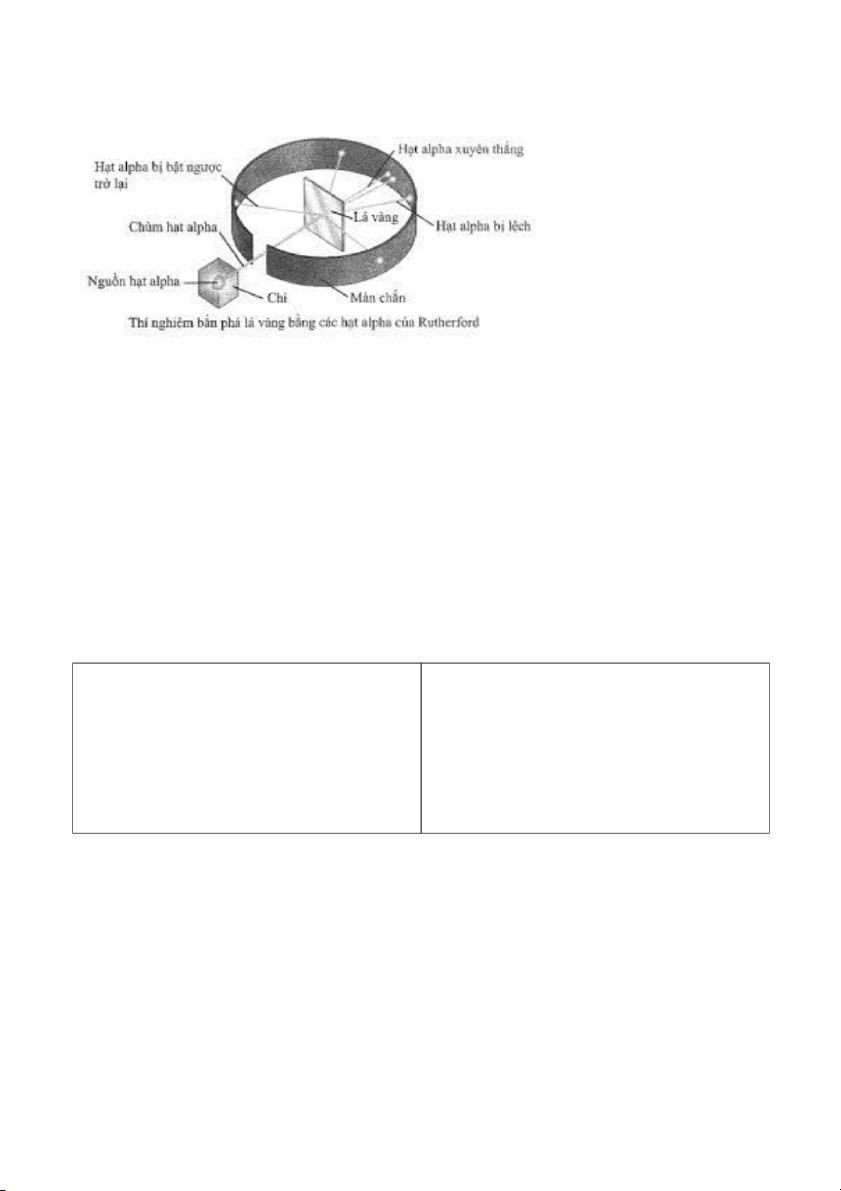
2. Thí nghiệm khám phá ra hạt nhân nguyên tử của Rutherford
Năm 1911, nhà vật lí người New Zealand là E. Rutherford đã tiến hành bắn phá một chùm hạt
alpha (kí hiệu là α, hạt nhân của nguyên tử helium, mang điện tích +2, có khối lượng gấp khoảng 7500
lần khối lượng electron) lên một lá vàng siêu mỏng (Hình 2) và quan sát đường đi của chúng sau khi
bắn phá bằng màn huỳnh quang. Kết quả cho thấy hầu hết các hạt α đều xuyên thẳng qua lá vàng,
nhưng có một số hạt lệch hướng ban đầu và một số rất ít hạt bị bật lại sau khi gặp lá vàng.
Như vậy, nguyên tử phải chứa phần mang điện tích dương có khối lượng lớn để có thể làm các
hạt α bị lệch khi va chạm. Nhưng phần mang điện tích dương này lại có kích thước rất nhỏ so với kích
thước nguyên tử đề phần lớn các hạt α có thể xuyên qua khoảng cách giữa các phần mang điện tích
dương của các nguyên tử vàng mà không bị lệch hướng. Điều đó chứng tỏ nguyên tử có cấu tạo rỗng,
phần mang điện tích dương là hạt nhân.
Hình 2. Thí nghiệm khám phá hạt nhân nguyên tử của Rutherford 0
II/ TÓM TẮT KIẾN THỨC CƠ BẢN
A2- BÀI TẬP CƠ BẢN
1. CẤU TẠO NGUYÊN TỬ. 1. NHẬP MÔN HÓA HỌC.
1.1. Những nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A. Sự vận chuyển của máu trong hệ tuần hoàn.
B. Sự tự quay của Trái Đất quanh trục riêng.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Sự phá hủy tầng ozone bởi freon-12.
1.2. Điền từ/cụm từ thích hợp vào chỗ trống trong những câu sau: 1
a) Hóa học là ngành khoa học thuộc lĩnh vực …(1) …, nghiên cứu về thành phần, cấu trúc, tính chất,
sự biến đổi của các đơn chất, hợp chất và …(2) … đi kèm những quá trình biến đổi đó.
b) Hóa học kết hợp chặt chẽ giữa lí thuyết và …(1) …, là cầu nối giữa các ngành khoa học tự nhiên
khác. Hóa học có …(2) … nhánh chính. Đối tượng nghiên cứu của hóa học là …(3)…
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
1.3. Tinh bột là nguồn dưỡng chất quan trọng cho cơ thể con người. Các nguyên tố tạo nên tinh bột là. A. H, C, O. B. C, O, K. C. O, C, P. D. C, O, N.
2. THÀNH PHẦN CỦA NGUYÊN TỬ.
2.1. Phát biểu nào sau đây không đúng?
A. Tất cả các nguyên tử đều có proton, neutron và electron.
B. Proton và electron là các hạt mang điện, neutron là hạt không mang điện.
C. Electron tạo nên lớp vỏ nguyên tử.
D. Số lượng proton và electron trong nguyên tử là bằng nhau.
2.2. Chọn từ tích hợp điền vào chỗ trống trong mỗi phát biểu sau.
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở …
b) Kích thước hạt nhân rất … so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian … chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là …
2.3. Những phát biểu nào sau đây là đúng?
A. Nếu một nguyên tử có 17 electron thì nguyên tử đó cũng có 17 proton.
B. Nếu một nguyên tử có 17 electron thì nguyên tử đó cũng có 17 neutron.
C. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 proton.
D. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 neutron.
E. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 electron.
2.4. Nguyên tử được tạo nên từ ba loại hạt cơ bản. Hãy hoàn thành bảng mô tả về mỗi loại hạt sau: Loại hạt Khối lượng (amu) Điệ n tch (e0) (1) (2) 0 (3) 0,00055 (4) (5) (6) (7)
2.5. Những phát biểu nào sau đây là không đúng?
A. Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu.
B. Có những nguyên tử không chứa neutron nào.
C. Một số nguyên tử không có bất kì proton nào.
D. Điện tích của proton và neutron có cùng độ lớn nhưng ngược dấu.
E. Trong nguyên tử, số hạt proton luôn bằng số hạt electron.
G. Khối lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng của electron.
2.6. Biết rằng một loại nguyên tử đồng (Cu) có 29 proton và 34 neutron. Những phát biểu nào sau đây là đúng?
A. Nguyên tử đồng có 29 electron.
B. Hạt nhân nguyên tử đồng trên có tổng số hạt là 63. C. Ion Cu+ có 28 electron. D. Ion Cu+ có 30 electron. E. Ion Cu+ có 28 proton.
2.7. Một trong số những phản ứng phổ biến nhất giữa ion và phân tử ở các đám khí trong vũ trụ là: H H H 2 + 2 → H + 3
Biết nguyên tử H có 1 proton và 1 electron. Số proton, neutron và electron của ion H3 lần lượt là: A. 2 p, 1 m và 1 e. B. 2 p, 1 n và 2 e. C. 3 p, 0 n và 1 e. D. 3 p, 0 n và 2 e.
2.8. Một nguyên tử C có 6 proton và 6 neutron. Một nguyên tử O có 8 proton và 8 neutron. Xét các
phân tử CO và CO tạo nên từ các nguyên tử O và C ở trên. Hãy nối một vế ở cột 2 A tương ứng với một
hoặc nhiều vế ở cột B. Cột A Cột B a) Phân tử CO
1. có số proton và số neutron bằng nhau. b) Phân tử CO2
2. có khối lượng xấp xỉ 28 amu. 2
3. có khối lượng xấp xỉ 44 amu. 4. có 22 electron.
5. có số hạt mang điện nhiều gấp hai lần số hạt không mang điện.
2.9. Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron trong ion NH4 là: A. 11 proton và 10 electron B. 11 proton và 11 electron C. 10 proton và 11 electron D. 10 proton và 10 electron.
2.10. Một bạn học sinh muốn xây dựng một mô hình nguyên tử hydrogen cỡ lớn theo đúng tỉ lệ để
trưng bày trong hội chợ khoa học ở trường. Nếu nguyên tử có đường kính 1,00 m thì học sinh đó phải
xây dựng hạt nhân có kích thước là bao nhiêu? Điều đó có dễ dàng thực hiện với các dụng cụ thông
thường hay không? Mô hình đó có phù hợp để quan sát bằng mắt thường không? Biết rằng kích thước
hạt nhân bằng 10-5 lần kích thước nguyên tử.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
2.11. Bán kính của hạt nhân nguyên tử carbon và bán kính của nguyên tử carbon lần lượt là khoảng
2,7 fm (femtômét) và khoảng 70 pm (picômét). Tính thể tích của hạt nhân và thể tích của loại nguyên
tử carbon đó theo đơn vị m . Hãy cho biết phần trăm thể tích nguyên tử carbon bị chiếm bởi hạt nhân. 3
Biết rằng 1 fm = 10-15 m; 1 pc = 10-12 m.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
2.12. Trái Đất có bán kính khoảng 6371 km, được coi như gồm x nguyên tử hình cầu sắp xếp chặt khít
cạnh nhau. Bán kính của Trái Đất sẽ thay đổi như thế nào nếu giả thiết chỉ còn x hạt nhân nguyên tử
sắp xếp chặt khít cạnh nhau trong một khối cầu? Coi kích thước hạt nhân bằng 10-5 lần kích thước nguyên tử.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
2.13. Sao neutron là một dạng trong một số khả năng kết thúc của quá trình tiến hóa sao. Sao neutron
được hình thành khi một ngôi sao lớn hết nhiên liệu và sụp đổ. Các ngôi sao neutron trong vũ trụ được
cấu tạo chủ yếu từ các hạt neutron. Giả sử bán kính của neutron là khoảng 1,0.10-13 cm.
a) Tính khối lượng riêng của neutron, coi neutron có dạng hình cầu.
b) Giả sử một ngôi sao neutron có cùng khối lượng riêng với neutron, hãy tính khối lượng (theo kg)
của một mảnh ngôi sao neutron có kích thước bằng một hạt cát hình cầu với bán kính 0,1 mm.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
2.14. Vào những ngày hanh khô, cơ thể chúng ta có thể tích tự điện khi đi bộ trên một số loại thảm
hoặc khi chải tóc. Giả sử cơ thể chúng ta tích một lượng điện tích là -10 μC (micrôculông).
a) Hãy cho biết trong trường hợp này, cơ thể chúng ta đã nhận thêm hay mất đi electron.
b) Tổng khối lượng của các electron mà cơ thể đã nhận thêm hoặc mất đi là bao nhiêu kilôgam? Cho
khối lượng của 1 electron là 9,1.10-31 kg. biết rằng 1 μC = 10-6 C.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------- 3
2.15. Trong thí nghiệm của Rutherford, khi sử dụng hạt alphat (ion 2
He , kí hiệu là α) bắn vào lá vàng thì:
- Hầu hết các hạt α xuyên thẳng qua lá vàng.
- Một số ít hạt α bị lệch quỹ đạo so với ban đầu.
- Một số rất ít hạt α bị bật ngược trở lại.
Từ kết quả này, em có nhận xét gì về cấu tạo nguyên tử?
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
BÀI 3. NGUYÊN TỐ HÓA HỌC.
3.1. Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về A. tính chất hóa học
B. khối lượng nguyên tử C. số proton D. số electron. 1 2 3
3.2. Trong tự nhiên, hydrogen có ba đồng vị ( H H H 1
, 1 , 1 ). Nguyên tử khối trung bình của hydrogen
bằng 1,008. Hãy cho biết đồng vị nào của hydrogen chiếm tỉ lệ nhiều nhất trong tự nhiên. 1 2 3 A. H H H 1 B. 1 C. 1
D. Không thể xác định được. A
3.3. Hãy nối các mô tả trong cột A với các kí hiệu đồng vị X Z trong cột B cho phù hợp. Cột A Cột B
a) Một đồng vị đồng có 34 neutron. 65Cu
b) Một đồng vị đồng có 36 neutron. 1. 29 63
c) Một đồng vị potassium có 21 neutron. 2. Cu 29
d) Một đồng vị argon có 22 neutron. 40 3. Ar 18 40 4. K 19 40 5. K 18
3.4. Cặp nguyên tử nào sau đây có cùng số neutron? 11 12 7 9 A. B C Li Be 5 và 6 B. 3 và 4 24 28 14 16 C. Mg Si N O 12 và 14 D. 7 và 8
3.5. Deuterium (D) là một đồng vị của hydrogen, được ứng dụng trong các lĩnh vực hạt nhân. Ion nào sau 1 2
đây có số electron nhiều hơn số proton và số proton nhiều hơn số neutron (Biết H = H H 1 , D = 1 , O = 16O 8 )? A. D-. B. H - - 3O+. C. OD . D. OH .
3.6. Phổ khối lượng của một mẫu lithium cho thấy nó chứa hai đồng vị là Li và 6
Li với tỉ lệ phần trăm 7
số nguyên tử mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium
này (kết quả tính đến hai chữ số thập phân) là A. 6,07. B. 6,50. C. 6,90. D. 6,93. 4
3.7. Neon có ba đồng vị bền trong tự nhiên. Tỉ lệ phần trăm số nguyên tử mỗi đồng vị được thể hiện trong bảng sau: Số khối A 21 22 Tỉ lệ (%) 90,9 0,3 8,8
Biết rằng nguyên tử khối trung bình của Neutron là 20,18. Giá trị số khối A của đồng vị đầu tiên là A. 19,00. B. 20,00 C. 20,01.
D. Không xác định được.
3.8. Trong tự nhiên, carbon có hai đồng vị bền là C và 12
C, oxygen có ba đồng vị bền là 13 O, 16 O và 17
18O. Số lượng tối đa loại phân tử CO2 có thể tạo ra từ các đồng vị này là A. 6 B. 9 C. 12 D. Vô số.
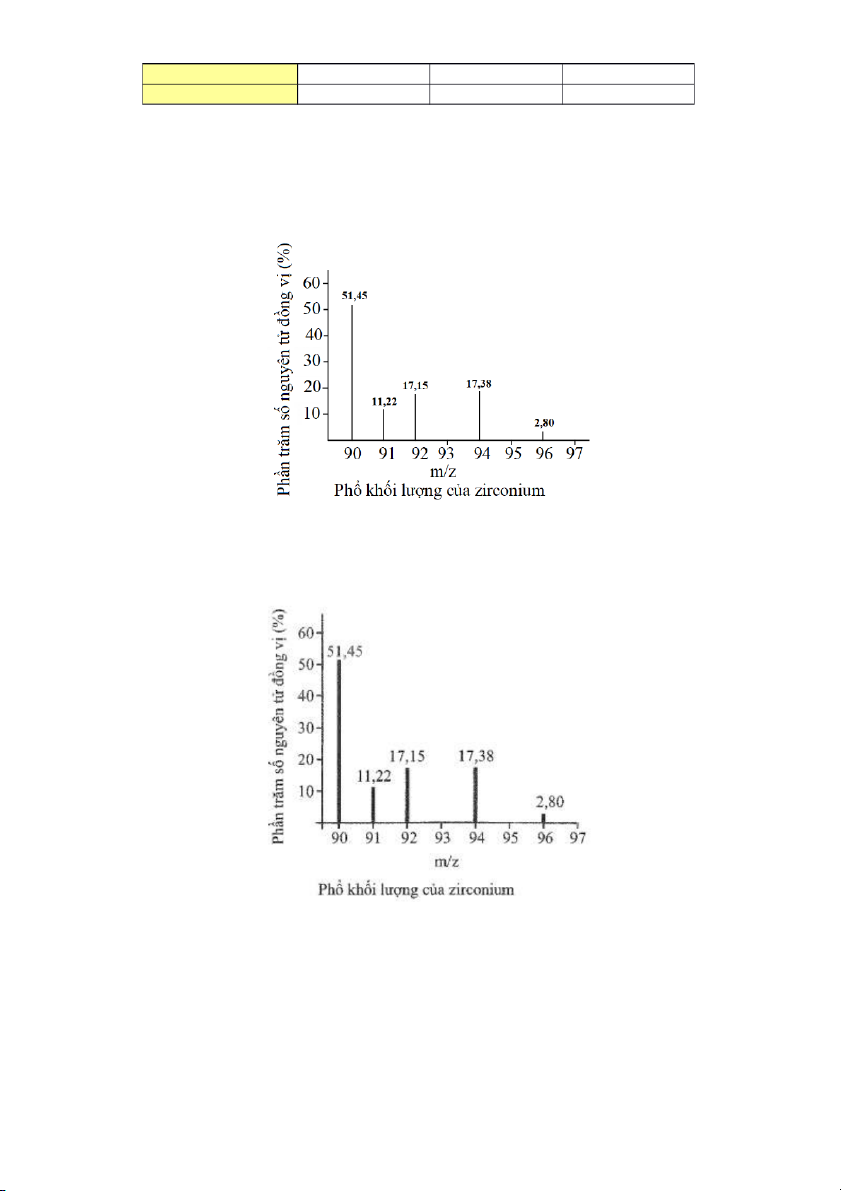
3.9. Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích Z của các ion đồng vị zirconium đều bằng 1+).
Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium là:
A. 5 đồng vị, nguyên tử khối trung bình bằng 92,60.
B. 5 đồng vị, nguyên tử khối trung bình bằng 91,32.
C. 4 đồng vị, nguyên tử khối trung bình bằng 91,18.
D. 4 đồng vị, nguyên tử khối trung bình bằng 92,00.
3.10 .* Bạc có hai đồng vị bền trong tự nhiên: Ag có hàm lượng tương đối là 51,8%; 107 109Ag có hàm
lượng tương đối là 48,2%. Hãy vẽ phổ khối lượng của bạc và tính nguyên tử khối trung bình của Ag.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
3.11 .* Đồng có hai đồng vị bền trong tự nhiên là Cu và 63
Cu. Nguyên tử khối trung bình của đồng là 65
63,55 (điện tích Z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng? 5
3.12 .* Đồng vị được sử dụng rộng rãi để nghiên cứu phản ứng hoá học. Cho biết vai trò của D (đồng 2 3 vị H H 1
) và T (đồng vị 1 ) là như nhau trong các phản ứng hoá học. Trong điều kiện thích hợp, xảy ra phản ứng sau: CH =CH-CH 2 -CH 2 2-CH=CHD CH =CH-CH 2 -CHD-CH=CH 2 2 (1)
Vậy cũng trong điều kiện đó, phản ứng sau đây có xảy ra hay không? CD =CD-CD 2 -CD 2 2-CD=CDT CD2=CD-CD -CDT 2 -CD=CD2 (2)
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
BÀI 4. MÔ HÌNH NGUYÊN TỬ VÀ ORBITAL NGUYÊN TỬ
4.1. Dựa vào mô hình nguyên tử Rutherford - Bohr, hãy cho biết phát biểu nào sau đây là đúng
A. Số lượng electron tối đa trên các lớp là như nhau.
B. Năng lượng của các electron trên các lớp khác nhau có thế bằng nhau.
C. Khi quay quanh hạt nhân theo một quỹ đạo xác định, năng lượng của eleetron là không đổi
D. Eleetron ở gần hạt nhân nhất có năng lượng cao nhất.
4.2. Theo mô hình Rutherford - Bohr, khi một nguyên tử H hấp thụ một năng lượng đủ lớn, electron sẽ
A. chuyển từ lớp electron gần hạt nhân sang lớp xa hạt nhân hơn.
B. chuyển từ lớp electron xa hạt nhân về lớp gần hạt nhân hơn.
C. không thay đổi trạng thái.
D. có thể chuyển sang lớp khác bắt ki.
4.3. Phát biểu nào sau đây
khi nói về mô hình Rutherford – Bohr? không đúng
A. Eleetron trên lớp K có năng lượng cao hơn trên lớp L.
B. Eleetron trên lớp M có năng lượng cao hơn trên lớp K.
C. Electron ở lớp K gần hạt nhân hơn so với electron ở lớp L.
D..Electron ở lớp M xa hạt nhân hơn so với electron ở lớp L.
4.4. Nguyên tử F có 9 electron. Theo mô hình Rutherford - Bohr, tỉ lệ số lượng electron trên lớp thứ
hai so với số lượng electron trên lớp thứ nhất là A. 2:12. B. 7:2 C. 5:2 . D. 2:7.
4.5. Điền từ/ cụm từ thích hợp vào chỗ trồng trong mô tả sau đây về mô hìnhhành tỉnh nguyên tử theo Rutherford — Bohr.
Khối lượng nguyên tử tập trung ở....(1)... Electron quay xung quanh hạt nhân theo những ...(2)... xác
định. Electron ở càng xa hạt nhân thì có năng lượng càng ...(3)... Khi nguyên tử hấp thụ năng lượng
phù hợp, electron sẽ chuyển ... (4)... hạt nhân hơn.
4.6. Nguyên tử O có 8 electron. Theo mô hình Rutherford - Bohr, nguyên tử O có số electron có cùng
năng lượng ở lớp thứ nhất là A.2. B.4. C. 6. D.8. 6
4.7. Theo mô hình nguyên tử hiện đại, xác suất tìm thấy electron lớn nhất là ở
A. bên ngoài các orbital nguyên tử.
B. trong các orbital nguyên tử.
C. bên trong hạt nhân nguyên tử.
D. bất kì vị trí nào trong không gian.
4.8. Vùng nào sau đây ứng với xác suất tìm thấy electron trong nguyên tử bằng 100%?
A. Bên ngoài các orbital nguyên tử.
B. Trong các orbital nguyên tử.
C. Trong toàn bộ khoảng không gian xung quanh hạt nhân. D. Ở bên trong hạt nhân.
4.9. Mỗi phát biểu sau đây về mô hình nguyên tử hiện đại là đúng hay sai?
(1) Theo mô hình nguyên tử hiện đại, electron chuyển động không theo những quỹ đạo xác định trong
cả khu vực không gian xung quanh hạt nhân.
(2) Tất cả các AO nguyên tử đều có hình dạng giống nhau.
(3) Mỗi AO nguyên tử chỉ có thể chứa được 1 electron.
(4) Các electron s chuyển động trong các AO có hình số tám nổi.
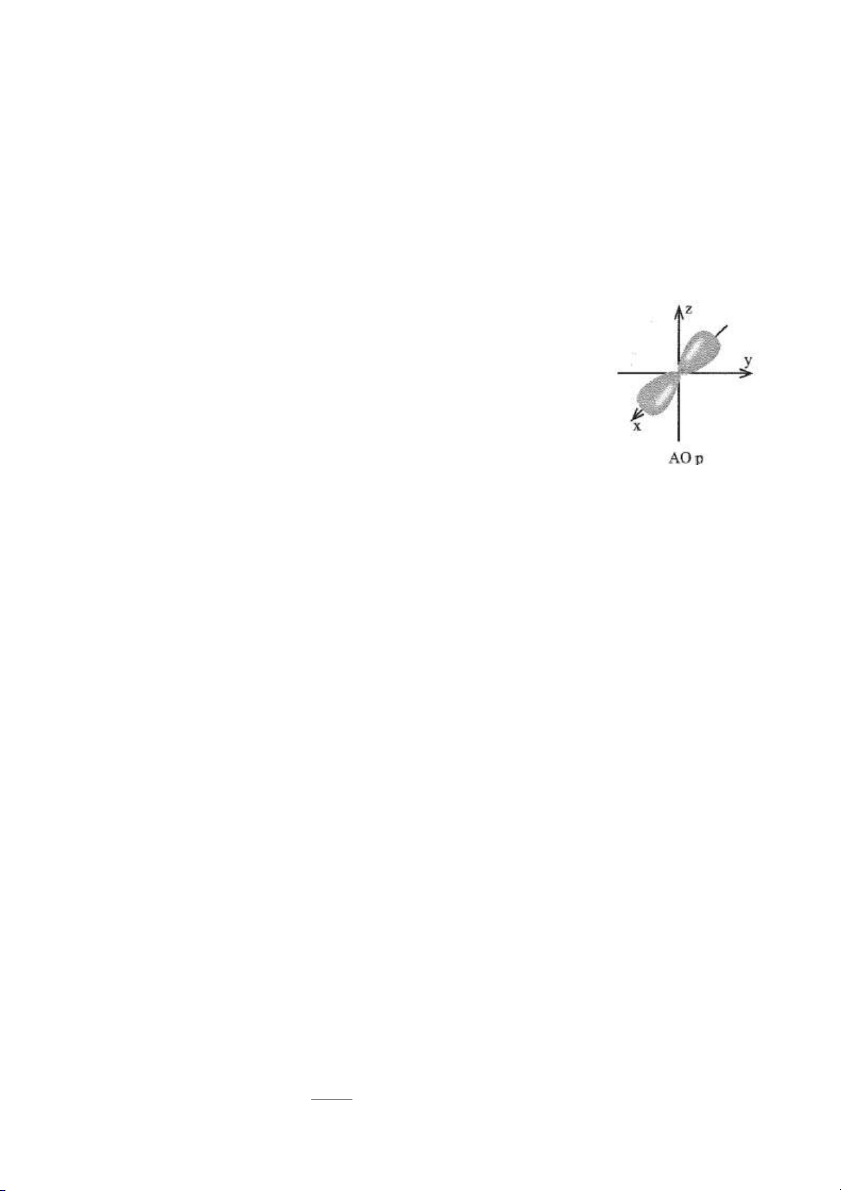
4.10. Hình ảnh bên mô tả AO p với hai thuỳ.
Những phát biểu nào sau đây là đúng?
A. Xác suất tìm thấy electron ở mỗi thuỳ là khoảng 45%.
B. Xác suất tìm thấy electron ở mỗi thuỳ là khoảng 90%.
C. Xác suất tìm thấy electron trong AO p là khoảng 90%.
D. Xác suất tìm thấy electron trong AO p là khoảng 45%.
4.11. Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là A. 0. B. 1. C. 2 D. 5.
4.12. Fluorine là nguyên tố hoá học có mặt trong nhiều hợp chất được ứng dụng trong nha khoa, y tế.
Nguyên tử F có 9 electron. Hãy đề xuất phương án sắp xếp những electron này vào 5 orbital nguyên
tử. Cho biết số cặp electron ghépđôi và sô lượng electron độc thân trong trường hợp đó.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
4.13. Cần ít nhất bao nhiêu orbital nguyên tử để chứa được: 2, 8, 18 electron?
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
4.14*, Theo mô hình Rutherford - Bohr, electron trong nguyên tử hydrogen chuyên động trên các quỹ
đạo xác định xung quanh tâm là hạt nhân nguyên tử. Mỗi quỹ đạo được đặc trưng bởi một giá trị n (n
= 1, 2, 3,...). Giá trị của n cũng chính là số thứ tự của lớp electron. Bán kính của quỹ đạo thứ n (kí hiệu
là r ) của nguyên tử hydrogen có thể tính theo công thức: r 2 n = n n
x 0,529 (Ä). Hãy tính bán kính quỹ
đạo thứ nhất và thứ hai (tương ứng với n = l và n = 2) của nguyên tử hydrogen.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
4.15 .* Bán kính của quỹ đão thứ n (r ) của ccs ion chỉ chứa 1 electron như He+ 2+ 3+ n , Li , Be có thể tính theo công thức: o 2 0,529 r n (A) n 2 Z
, trong đó Z là điện tích hạt nhân. 7
Hãy so sánh (có giải thích) bánh kính quỹ đạo thứ nhất của các ion He+, Li2+, Be3+.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
4.16 .* Năng lượng của electron trong hệ gồm 1 electron và 1 hạt nhân (như H, He+,…) theo mô hình
Rutherford – Bohr cũng như mô hình hiện đại đều phụ thuộc vào số thứ tự của lớp (n) và điện tích hạt nhân (Z) như sau: 2 Z 18 E 2,18 10 (J) n 2 n
Trong đó Z là điện tích hạt nhân; n = 1, 2, 3,… là số thứ tự của lớp electron. Hãy tính và so sánh (có
giải thích) năng lượng của electron ở lớp thứ nhất của H, He+, Li2+.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
BÀI 5 - LỚP, PHÂN LỚP VÀ CẤU HÌNH ELECTRON
5.1. Phát biểu nào sau đây là đúng?
A. Electron trong cùng một lớp có năng lượng băng nhau.
B. Electron trong cùng một phân lớp có năng lượng bằng nhau,
C. Electron ở các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
D. Electron ở lớp bên ngoài có năng lượng thấp hơn electron ở lớp bên trong.
5.2. Phát biểu nào sau đây ? không đúng
A. Electron cảng ở xa hạt nhân thì có năng lượng càng thấp.
B. Số lượng electron tối đa trong một phân lớp luôn là một số chẵn,
C. Phân lớp p có nhiều orbital hơn phân lớp s.
D. Số electron tối đa trên phân lớp p gấp ba lần số electron tôi đa trên phân lớp s.
5.3. Mỗi phát biểu sau đây là đúng hay sai?
(1) Số lượng orbital trong các phân lớp 1s, 2s, 3s là bằng nhau.
(2) Số lượng orbital trong các phân lớp 3s, 3p, 3đ là bằng nhau.
(3) Các electron trên các phân lớp 1s, 2s, 3s có năng lượng bằng nhau,
(4) Các clectron trên các phân lớp 3s, 3p, 3đ có năng lượng bằng nhan.
(5) Số lượng electron tối đa trong một lớp là 2n .2
(6) Số lượng các orbital trong một phân lớp (s, p, d, f) luôn là một số lẻ.
5.4. Điền từ/ cụm từ hoặc số thích hợp vào chỗ trống trong mỗi phát biểu sau:
a) Các electron trong lớp vỏ nguyên tử được phân bố vào các …(1)... và ...(2)... dựa theo năng lượng
của chúng. Các electron thuộc cùng một lớp có năng lượng ...(3)..., các electron thuộc cùng một phân
lớp có năng lượng ...(4).... Các electron ở ...(5)... có vai trò quyết định đến tính chất hoá học đặc trưng của nguyên tố.
b) Magnesium được sử dụng nhiều trong công nghiệp để chế tạo các bộ phận của máy bay, ô tô.
Nguyên tử magnesium có 12 eleetron, được phân bố vào ..(1)... lớp. Lớp ngoài cùng của magnesium có ...(2)... clectron.
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------
5.5. Số phân lớp bão hoà trong các phân lớp: 1s , 2s 2 , 3d 2 , 3p 10 là 4 A. 1. B. 2. C. 3. D .5.
5.6. Ghép mỗi biểu diễn ô orbital của phân lớp p ở cột A với mô tả thích hợp ở cội B. 8 Cột A Cột B 1. Phân lớp bão hoà
2. Phân lớp bán (nửa) bão hoà
3. Phân lớp chứa các AO trống
5.7. Nguyên tử Q có 8 electron. Biển điễn sự sắp xếp electron trong nguyên tử theo orbital nào sau đây là đúng?
5.8. Các nguyên tử Ne, Na và F có Z lần lượt là 10, 11 và 9. Cầu hình electron của Ne, Na+ và F- tương ứng là: A. 1s22s 2p 2 ; 1s 6 22s 3s 2 và 1s 1 22s 2p 2 .5
B. đều có cấu hình 1s22s 2p 2 .6 C. 1s22s22p ; 1s 6 22s 2p 2 và 1s 5 22s 2p 2 .4 D. 1s22s 2p 2 ; 1s 6 22s 2p 2 và 1s 5 12s 2p 2 .3
5.9. Biết rằng điện tích hạt nhân của C, N, O và F lần lượt là 6, 7, 8 và 9. Ghép mỗi
cầu hình electron ở cột A với nguyên tử/ ion thích hợp ở cột B. Cột A Cột B a) 1s22s2 1. O b) 1s22s22p4 2. C2+ c) 1s22s 2p 2 5 3. N3- d) 1s22s22p6 4. F 5. C2-
5.10. Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = I0), nguyên
tử có nhiều electron độc thân nhất là A.N. B. O. C. F. D. Ne.
5.11. Nối mỗi cấu hình electron của nguyên tử ở cột A với loại nguyên tô hoá học thích hợp ở cột B. Cột A Cột B a) 1s22s 2p 2 6 1. Kim loại b) 1s22s22p5 2. Phi kim c) 1s22s 2p 2 63s1 3. Khí hiếm d) 1s22s22p 3s 6 23p3
Bài tập về bán kính nguyên tử
Bài 1: Vàng (Au) là một kim loại quý đã được sử dụng làm chất phản xạ neutron trong vũ khí hạt
nhân. Trong đời sống hàng ngày vàng còn được dùng để đúc tiền, đồ trang sức và nhiều bức tranh nghệ thuật, … 9
Hình 1.6.a Vàng miếng. Hình 1.6.b Tinh thể vàng
Giả thiết rằng trong tinh thể vàng các nguyên tử là những hình cầu có bán kính 1,44Ǻ; khối
lượng mol nguyên tử Au là 197g/mol; khối lượng riêng của Au là 19,36 g/cm .
3 Tính thể tích chiếm bởi
các nguyên tử Au trong tinh thể? Đáp án: Đổi 1,44Å = 1,44.10-8 cm 1 mol = 6,02.10 nguyên tử 23 Au nặng 197 gam
=> Khối lượng của 1 nguyên tử Au = m = 197 / (6,02.10 ) gam 23 4 3 4 R 8 3 (1.44.10 )
Thể tích 1 nguyên tử Au=V= 3 = 3
Nếu coi nguyên tử là một khối cầu đặc khít thì khối lượng riêng của nguyên tử là m =>d= V =26,179 gam/cm3
Gọi x là phần trăm thể tích nguyên tử Au chiếm chỗ, khối lượng riêng thực tế của Au = 19,36 g/cm 3 19,36 =>x =26,179 .100 = 73,95%
Bài 2: Giả thiết rằng trong tinh thể sodium các nguyên tử là những hình cầu với không gian trống giữ
các nguyên tử là 26%. Biết khối lượng riêng của Sodium bằng 0,97g/cm 3 và khối lượng mol của
Sodium là 22,99 g/mol. Tính bán kính gần đúng của nguyên tử Sodium. Đáp án:
Khối lượng của mol nguyên tử Sodium là 22,99 gam. Thể tích của 1 mol nguyên tử Sodium là 22,99 100 26 3 . 17,539 cm 0,97 100
Thể tích của 1 nguyên tử Sodium là 17,539 23 3 V 2,912.10 (cm ) 23 6,022.10 4 3 10 V r r 1,9.10 m 3
Bài 3: Iron là một nguyên tố có trong cơ thể con người, nó tham gia vào quá trình tổng hợp
hemoglobin và myoglobin. Iron cũng có nhiệm vụ quan trọng trong
việc tổng hợp DNA, đóng vai trò trong việc vận chuyển oxygen, sản
xuất ra năng lượng oxy hóa và bất hoạt các gốc tự do gây hại. Trong
tinh thể iron, các nguyên tử iron là những hình cầu chiếm 75% thể
tích toàn khối tinh thể, phần còn lại là các khe rỗng giữa các quả cầu.
Khối lượng nguyên tử của iron là 55,85 g/mol. Tính bán kính nguyên
tử gần đúng của iron ở 20 C
o biết khối lượng riêng của iron tại nhiệt độ này là 7,87 g/cm .3 Hình 1.7. Sắt Đáp án: Xét 1 mol Fe
Thể tích thực của Fe là 55,85 3 6 3 V .0,75 5,336cm 5,336.10 m 7,85
Thể tích 1 nguyên tử Fe là 6 5,336.10 30 3 1 V nt 8,86.10 m 23 6.022.10 Bán kính nguyên tử Fe là 3V 3 1nt 10 n r t 1.28.10 m 4 10
B/ KIẾN THỨC NÂNG CAO B1/ LÝ THUYẾT
I. NHỮNG CƠ SỞ THỰC NGHIỆM CHO BIẾT SỰ SẮP XẾP ELECTRON TRONG NGUYÊN TỬ
1. Bản chất của ánh sáng. a. Ánh sáng và sóng:
Ánh sáng lan truyền trong không gian tương tự như sự chuyển động của sóng trên mặt nước. Sóng ánh
sáng có nhiều tính chất tương tự như sóng nước. Khi làm gợn sóng trong 1 hộp đựng nước có các mặt
ghép bằng thủy tinh ta sẽ quan sát được mặt cắt của sóng nước.
+ Khoảng cách giữa hai ngọn sóng (hay hõm sóng) liên tiếp gọi là độ dài sóng hay bước sóng (Kí hiệu: - đọc là lamda).
+ Tần số là số ngọn sóng qua một điểm nào trong một đơn vị thời gian (Kí hiệu: - đọc là nuy) (Đơn
vị thời gian là giây thì đơn vị tần số là Hec hay s-1).
Ví dụ: Nếu có 4 ngọn sóng đi qua một điểm nào đó trong thời gian một giây thì có tần số là 4Hz (hay 4s-1).
+ Tốc độ truyền sóng là tốc độ chuyển dời của một ngọn sóng (hay hõm sóng). Nếu bước sóng bằng
= 1,0cm, tần số là 4s-1 thì ngọn sóng chuyển dời 4cm/s. Tức là:
Vận tốc độ truyền sóng = .
Đối với cùng tốc độ chuyền sóng thì càng ngắn thì càng lớn và ngược lại.
Tốc độ ánh sáng trong chân không (c).
c = . ≈ 3,00 . 10 m/s = 300.000km/s 8
(Chính xác 2,9979249.10 m/s) 8
+ Khi chiếu một chùm ánh sáng trắng (có c = 3.10 m/s) 8
qua lăng kính thuỷ tinh, nó sẽ bị phân thành
một giải liên tục đủ các màu từ đỏ đến tím. Các màu khác nhau do khác nhau (có cùng c) do đó có khác nhau (c = . ). (đỏ) = 7000 - 6200A 0 Một chùm tia sáng (da cam) = 6200 - 5900A 0 (vàng) = 5900 - 5800A 0 (lục) = 5800 - 5100A 0 (da trời) = 5100 - 4800A 0 (lam) = 4800 - 4500A 0 (tím) = 4500 - 4000A . 0 L
Dãy bước sóng của ánh sáng Không nhìn thấy ược Không nhìn thấy Tia tử ngoại 4000A 7500A Tia hồng ngoại tím đỏ
Ví dụ: Tần số của ánh sáng tím là 7,31.1014s-1 và tần số của ánh sáng đỏ là 4,57.1014s-1. Tính bước sóng của một màu. Trả lời: Theo công thức c = . Ta có:
ánh sáng tím: = = 4,1.10-7m = 4100A 0
ánh sáng đỏ: = = 6,56.10-7 = 6560A 0
b. Bản chất hạt của ánh sáng:
+ Trong một số trường hợp người ta coi ánh sáng gồm các hạt gọi là photon. Theo Max Planck đề ra
từ năm 1900 cho rằng mỗi photon mang một năng lượng riêng (gọi là một lượng tử năng lượng)
được tính theo biểu thức: E = h . = h.
(h là hằng số Plăng: h = 6,63. 10-34J.s) 11
Theo phương trình trên tính được năng lượng của mỗi hạt photon ở các màu khác nhau. Ví dụ:
Biết tần số của ánh sáng tím 7,31.10
14 s-1, của ánh sáng đỏ là 4,57.1014s-1. Tính năng lượng của mỗi
photon trong mỗi màu ánh sáng trên. Trả lời: Theo biểu thức E = h .
ánh sáng tím: E = 6,64. 10-34 14 1 . 7.31.10 = 4,58. 10 - 19J.
ánh sáng đỏ: E = 6,63. 10-34 14 -19 2 . 4,57. 10 = 3,03.10 J. Như vậy E > E 1 .2
2. Quang phổ nguyên tử:
Khi phóng điện với hiệu điện thế cao qua một chất khí trong ống chân không có áp suất rất thấp (cỡ 1
mmHg), khí sẽ phát ra ánh sáng có màu đặc trưng. Cho ánh sáng đó đi qua một lăng kính, nó sẽ bị
phân giải thành một số vạch tương đối đơn giản. Mỗi vạch trong quang phổ phát xạ ứng với ánh sáng
có bước sóng riêng. Bước sóng và màu sắc của một số vạch rõ nhất trong vùng quang phổ nhìn thấy
của một số nguyên tử được ghi như sau:
Mỗi nguyên tử của nguyên tố có một số vạch nhất định, ở mỗi vạch màu khác nhau có khác nhau.
Ví dụ: Quang phổ Nguyên tử H có 4 vạch sáng nhất ở vùng nhìn thấy là: đỏ, lục, chàm, tím. Quang
phổ nguyên tử Na chủ yếu gồm hai vạch vàng.
Vậy dựa vào số vạch nhất định của nguyên tử mỗi nguyên tố ta có thể xác định được một mẫu vật có
chất gì dù chất đó chỉ là một dấu vết.
(Vạch quang phổ giống như vân tay của con người)
Ví dụ: Trong quang phổ phát xạ của ng/tử H vạch lục có bước sóng là 4,86.10-7m. Tính năng lượng
của một photon của ánh sáng màu lục đó và năng lượng phát ra bởi 1mol nguyên tử H (1 nguyên tử phát ra 1 photon). Trả lời:
Theo công thức: c = . và E = h. .
E = h. = 6,63.10-34 (J.s). = 4,09.10-19 J/Photon
1mol (H) phát ra ánh sáng lục với năng lượng là :
E = 6,022 .1023.4,09.10-19 = 2,46.10 (J/mol) = 246 kJ/mol 5 .
(E = 246 kJ/mol tương đương với năng lượng của một bóng đèn 100W/40 phút)
- Giải thích sự tạo thành vạch quang phổ: Ở điều kiện thường các e trong nguyên tử chiếm mức năng
lượng thấp nhất. Khi nhận được năng lượng bên ngoài kích thích (như đốt, phóng điện…) thì e bị đẩy
lên mức năng lượng cao, e ở mức năng lương cao không bền (chỉ tồn tại trong thời gian 10-8s), lập tức
e giải phóng năng lượng dư dưới dạng 1 photon và trở về mức năng lượng thấp hơn. Các năng lượng
giải phóng ở các mức khác nhau nên có các vạch màu khác.
- Tại sao mỗi nguyên tử chỉ phát ra ánh sáng có bước sóng xác định :
Mỗi một nguyên tử của nguyên tố e nhảy từ mức năng lượng cao (không bền) về mức năng lượng thấp
(bền) đều có năng lượng thoát ra khác nhau (do E = h.v) nên có tần số (v) khác nhau vì vậy sẽ có bước
sóng khác nhau (c = .v). Cho nên mỗi nguyên tố chỉ phát ra ánh sáng có bước sóng xác định.
- Trong một nguyên tử tạo ra nhiều vạch màu khác nhau, chứng tỏ các e có thể chiếm một số năng
lượng xác định được hình thành một lớp e. Chính vì vậy mỗi e nhảy từ mức năng lượng cao (lớp
ngoài) đến mức năng lượng thấp (lớp trong) ở các lớp khác nhau sẽ tạo ra cạnh màu khác nhau. 12
2.1. Quang phổ vạch của hydrogen
Nguyên tử chỉ có thể phát ra bức xạ khi electron được chuyển từ mức năng lượng cao về mức
năng lượng thấp. Năng lượng hν của quang tử được phát ra bằng hiệu số năng lượng của hai trạng thái
trên (hν = Ec – Et). Ứng với mỗi quang tử được phát ra ta được một vạch trên quang phổ phát xạ. Nếu
gọi nc là số lượng tử đặc trưng cho trạng thái năng lượng cao và nt là
số lượng tử đặc trưng cho trạng
thái năng lượng thấp ta sẽ có hệ thức: 2 4 2 me 1 1 2 4 h E E 1 2 me 1 1 hc c t 2 2 2 h n n 2 2 2 h n n t c hay t c 1 và từ đó số sóng
của bức xạ phát ra hay của vạch quang phổ thu được sẽ được tính theo hệ thức: 2 4 2 me 1 1 1 1 R 3 2 2 h c n n H 2 2 n n t c hay t c 2 4 2 me R Trong đó: H 3 h c với R 7 -1
H được gọi là hằng số Rydberg; RH = 1,0973731.10 m
e nhảy từ mức n = 3 về mức n = 2 thấy phát ra vạch đỏ.
e nhảy từ mức n = 4 về mức n = 2 thấy phát ra vạch xanh. 2.1.1. Dãy Lymann
Khi nghiên cứu quang phổ nguyên tử hydrogen, Lymann phát hiện ra một số vạch quang phổ sắp xếp
thành một dãy nằm trong vùng tử ngoại có bước sóng xác định theo công thức: 1 1 1 R 1 1 R 1 H 2 2 1 n H 2 hay n (10)
Trong đó, RH là hằng số Rydberg; λ là bước sóng của dãy Lymann;
là số sóng; n là số nguyên lớn hơn 1 (n = 2, 3, 4, 5,….) 2.1.2. Dãy Balmer
Dãy quang phổ của nguyên tử hydrogen nằm trong miền ánh sáng nhìn thấy do Balmer phát
hiện từ thực nghiệm. Bước sóng được xác định theo công thức: 1 1 1 RH (11) 2 2 2 n
Trong đó, RH là hằng số Rydberg.; λ là bước sóng của dãy Balmer;
là số sóng ; n là số nguyên lớn hơn 2 (n = 3, 4, 5,…)
Những vạch quang phổ thu được ứng với những bước nhảy lượng tử với nc = 3, 4, 5, 6 được
gọi là những vạch H , H , H , H . Vạch quang phổ Bước nhảy lượng tử Bước sóng (Å) Màu sắc của vạch nc nt quang phổ H 3 2 6562,8 Đỏ H 4 2 4861,3 Xanh da trời H 5 2 4340,5 Tím H 6 2 4101,7 Tím 2.1.3. Dãy Paschen 13
Dãy Paschen là dãy quang phổ gồm các vạch quang phổ nằm trong miền hồng ngoại gần, có
bước sóng xác định từ công thức thực nghiệm: 1 1 1 R (12) H 2 2 3 n
Trong đó, RH là hằng số Rydberg.; λ là bước sóng của dãy Paschen;
là số sóng ; n là số nguyên lớn hơn 3 (n = 4, 5, 6,…) 2.1.4. Dãy Brackett
Dãy Brackett là dãy quang phổ gồm các vạch quang phổ nằm trong miền hồng ngoại xa, có
bước sóng xác định từ công thức thực nghiệm: 1 1 1 R (13) H 2 2 4 n
Trong đó, RH là hằng số Rydberg.; λ là bước sóng của dãy Brackett;
là số sóng ; n là số nguyên lớn hơn 4 (n = 5, 6, 7,…) 2.1.5. Dãy Pfum
Dãy Pfum là dãy quang phổ gồm các vạch quang phổ nằm trong miền hồng ngoại rất xa, có
bước sóng xác định từ công thức thực nghiệm: 1 1 1 RH (14) 2 2 5 n
Trong đó, RH là hằng số Rydberg.; λ là bước sóng của dãy Pfum;
là số sóng ; n là số nguyên lớn hơn 5 (n = 6, 7, 8,…)
2.2. Công thức tổng quát của Balmer
Từ các công thức thực nghiệm (10), (11), (12), (13), (14), năm 1885, Balmer đã xây dựng được
một công thức cho phép xác định bước sóng của vạch quang phổ nguyên tử Hydrogen bất kì. Công
thức đó được gọi là công thức Balmer tổng quát: 1 1 1 RH (15) 2 2 n n i k
Trong đó, RH là hằng số Ridberg; λ là bước sóng của dãy quang phổ; là số sóng.
ni là số nguyên nhận các giá trị 1, 2, 3, 4, 5 ứng với các dãy quang phổ Lyman, Balmer, Paschen, Brackett, Pfum. nk là số nguyên, n > n k i.
- Từ công thức (15), có thể tính được khoảng cách bước sóng ứng với các dãy quang phổ Hydrogen.
Bước sóng sẽ có giá trị lớn nhất khi n = n k
i + 1, có giá trị nhỏ nhất khi n = k Số thứ tự Dãy quang phổ
Khoảng bước sóng (μm) 1 Dãy Lymann 0,091 0,122 2 Dãy Balmer 0,365 0,656 3 Dãy Paschen 0,821 1,876 4 Dãy Brackett 1,459 4,052 5 Dãy Pfum 2,279 7,460
Từ kết quả trên cho thấy có miền quang phổ giao nhau, chẳng hạn như dãy Brackett và dãy
Pfum có một miền khá rộng bước sóng các vạch phổ giao nhau.
2.3. Công thức tổng quát của Rydberg
Năm 1888, Rydberg đã xây dựng công thức xác định một cách định lượng bước sóng của các
photon trong chuỗi Balmer và có thể được sử dụng cho các chuỗi của nguyên tử khác. 1 1 1 2 Z .R (16) H 2 2 n n i k
Trong đó, Z là số hiệu nguyên tử.; RH là hằng số Rydberg
λ là bước sóng của dãy quang phổ; là số sóng
ni là số nguyên nhận các giá trị 1, 2, 3, 4, 5,… n là số nguyên, n k > n k i. 14
Tuy nhiên, độ chính xác của dự đoán do phương trình Rydberg đưa ra nhanh chóng giảm khi
nguyên tử trở nên lớn hơn. Do đó, nó thường chỉ được sử dụng cho nguyên tử hydrogen (Z = 1). Khi 1 1 1 RH 2 2 đó, có công thức: n n i k
, giống công thức tổng quát của Balmer.
II. MÔ HÌNH CẤU TẠO NGUYÊN TỬ CỦA BOHR
1. Các tiên đề của Bohr
- Tiên đề 1: Trong nguyên tử, các electron không thể chuyển động trên bất kì quỹ đạo nào mà chỉ
được phép chuyển động trên những quỹ đạo xác định với điều kiện là momen động lượng M của h
electron đối với các quỹ đạo đó bằng một số nguyên lần 2 : h
M = mυr = n. 2 (n = 1, 2, 3,…)
Đây là điều kiện lượng tử hóa quỹ đạo hay điều kiện lượng tử hóa moment động lượng: n được h
gọi là số lượng tử và
2 được gọi là đơn vị lượng tử của moment động lượng.
- Tiên đề 2: Khi chuyển động theo những quỹ đạo lượng tử trên, electron không bức xạ, nghĩa là
không mất năng lượng. Quỹ đạo hay trạng thái mà năng lượng của electron có một giá trị xác định
không đổi gọi là quỹ đạo dừng hay trạng thái dừng.
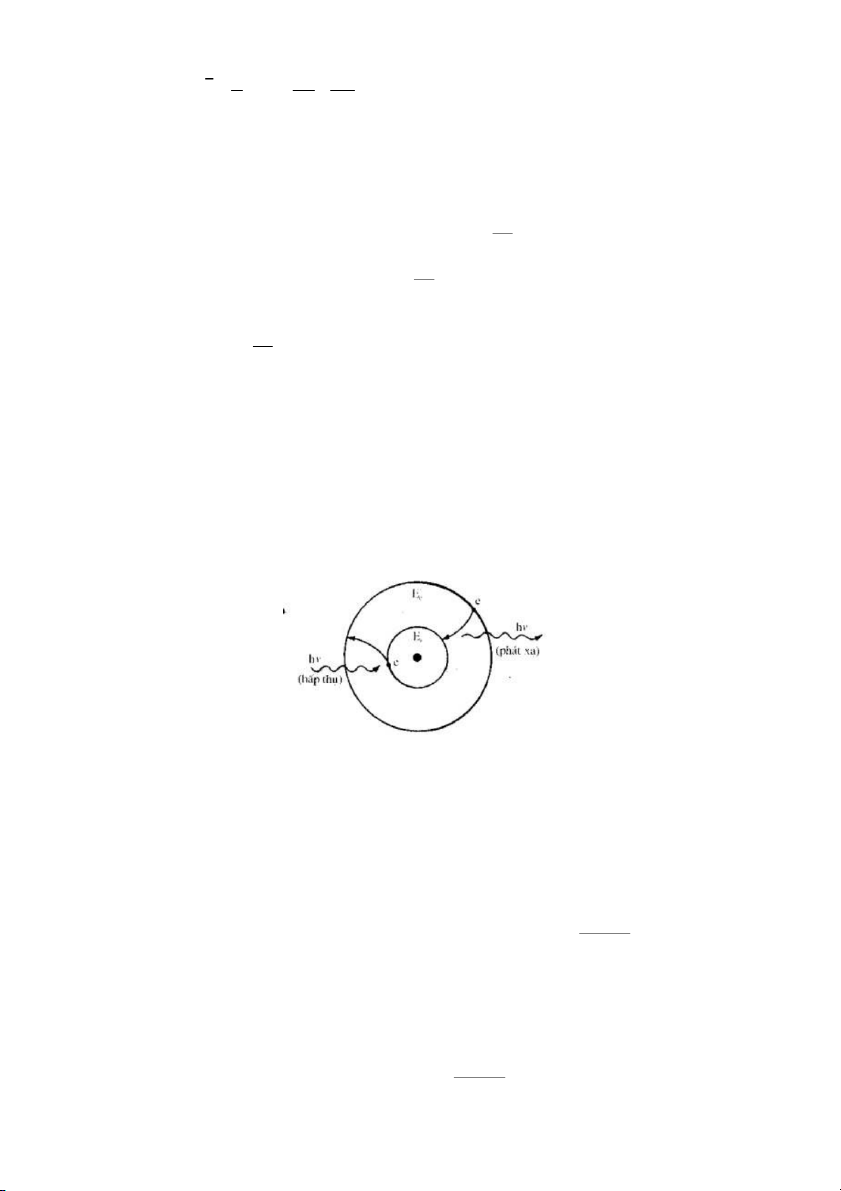
- Tiên đề 3: Nguyên tử (hay electron) chỉ phát xạ hay hấp thụ bức xạ khi nguyên tử (hay electron)
chuyển từ trạng thái dừng này sang trạng thái dừng khác.
Năng lượng hν của quang tử được phát ra hay hấp thụ bằng hiệu số năng lượng tương ứng với hai trạng thái trên. ΔE = Ec – Et = hν
(Ec là năng lượng của điện tử ở trạng thái năng lượng cao; Et là
năng lượng của điện tử ở trạng thái năng lượng thấp).
Hình 3. Sự xuất hiện quang phổ hấp thụ và phát xạ
Tiên đề 3 cho phép giải thích nguồn gốc của quang phổ phát xạ và hấp thụ nguyên tử cũng như cấu tạo
vạch của quang phổ nguyên tử.
Bình thường nguyên tử ở trạng thái có năng lượng thấp (trạng thái cơ bản). Khi cung cấp năng
lượng (như do sự va chạm nguyên tử, sự va chạm điện tử, do sự hấp thụ bức xạ,…) nguyên tử chuyển
tử trạng thái năng lượng thấp lên trạng thái năng lượng cao (trạng thái kích thích). Trạng thái kích
thích là trạng thái không bền vững. Nguyên tử có xu hướng chuyển về trạng thái cơ bản. Nếu giữa hai
mức năng lượng trên còn có những mức năng lượng khả dĩ khác trước khi trở về trạng thái cơ bản,
nguyên tử có thể chuyển về những trạng thái trung gian. Ứng với mỗi “bước nhảy” trên, nguyên tử E E c t
phát ra một quang tử có một tần số xác định, tính theo hệ thức trên: h . Ứng với một quang
tử này ta được một vạch trên quang phổ phát xạ nguyên tử. Vì năng lượng nguyên tử được lượng tử
hóa nên các tần số của bức xạ phát ra cũng nhận được những giá trị gián đoạn. Điều này dẫn đến cấu
tạo vạch của quang phổ phát xạ nguyên tử.
Ngược lại, khi chiếu một chùm bức xạ liên tục qua nguyên tử thì nguyên tử có thể hấp thụ chọn
lọc những quang tử khi chuyển từ trạng thái năng lượng thấp lên trạng thái năng lượng cao. Tần số của E E c t
bức xạ hấp thụ này cũng được tính theo hệ thức h
. Ứng với một tần số này ta được một
vạch trên quang phổ hấp thụ nguyên tử. 15
2. Năng lượng, vận tốc electron và bán kính nguyên tử theo mô hình Rutherford–Bohr
2.1. Tính năng lượng electron
Trong nguyên tử nói chung, trong nguyên tử Hydrogen nói riêng, lực tĩnh điện (lực Coulumb)
đóng vai trò làm lực hướng tâm (lực hấp dẫn vô cùng bé nên có thể bỏ qua). 2 2 ke m .v 2 2 m .v ke (17) e F f e hd ht 2 r r => 2 2r 2 m .v e
Vì năng lượng của hạt electron trong nguyên tử bao gồm động năng E = 2 đ và thế năng tĩnh điện 2 ke E r t =
nên có thể tính năng lượng electron theo công thức: 2 m .v 2 ke 2 ke 2 ke 2 ke (18) e E = E + E 2 r 2r r 2r đ t = = = - < 0
Công thức (17) cho thấy năng lượng electron trong nguyên tử là âm, chứng tỏ nguyên tử tồn tại bền vững.
2.2. Tính bán kính quỹ đạo dừng
Theo điều kiện lượng tử hóa của Bohr ta có: 2 2 n . (19) 2 L = m 2 m .r e.υ.r = n. => me. υ = e Kết hợp (17) và (19) 2 ke 2 2 n . 2 2 n . r 2 m .r 2 k.m .e e => r e
Như vậy, bán kính quỹ đạo ứng với các giá trị n khác nhau là 2 2 n . (20) 2 r k.m .e n e
Công thức (20) cho thấy, bán kính quỹ đạo dừng không thể nhận giá trị liên tục mà chỉ có khả
năng nhận một số giá trị gián đoạn, rời rạc.
+ Khi n=1, ứng với giá trị nhỏ nhất và được gọi là bán kính quỹ đạo Bohr thứ nhất. Giá trị bán kính
của quỹ đạo Bohr thứ nhất là 2 34 2 1 .(1,055.10 ) 11 r a 5,3.10 m 0,53 1 9 31 19 2 9.10 .9,1.10 .(1,6.10 ) Å
2.3. Tính vận tốc của electron trên quỹ đạo dừng n. n L = m m . e.υn.r = n. n => e n Thay (19) vào ta có: 2 2 n. n. .k.m .e k.e (21) e n 2 2 m . m .n . n. e n e
Công thức (21) là công thức xác định vận tốc electron trên quỹ đạo dừng. Vận tốc cũng bị lượng
tử hóa. Trên một quỹ đạo xác định thì vận tốc electron hoàn toàn xác định và không hề thay đổi theo
thời gian, điều đó có nghĩa là nguyên tử tồn tại bền vững. Vận tốc của electron trên quỹ đạo Bohr thứ
nhất là lớn nhất. Càng nhảy lên cao vận tốc của electron càng giảm (tỷ lệ nghịch với số nguyên n). Từ
công thức (21) có thể tính vận tốc electron trên quỹ đạo bất kỳ.
Ví dụ: Trên quỹ đạo cơ bản, vận tốc của electron là: 9 19 2 9.10 .(1,6.10 ) 2183886 (m / s) 1 34 1.1,055.10
Như vậy, vận tốc này rất lớn. Thay (20) vào (18) có: 2 2 2 2 4 ke ke .k.m .e k .m .e (22) e e E 13,6 n 2 2 2 2 2r 2n . 2n . 2 n hay E = n n (eV) 16
Công thức này, chứng tỏ năng lượng cũng bị lượng tử hóa.
֍ Nhận xét: Vận tốc, bán kính quỹ đạo, năng lượng đều bị lượng tử hóa và đều phụ thuộc vào số
nguyên dương n, nên n được gọi là số lượng tử chính.
III. MÔ HÌNH HIỆN ĐẠI VỀ NGUYÊN TỬ
1. Biểu thức tính bước sóng vật chất de Broglie và nguyên lí bất định Heisenberg
1.1. Giả thuyết của De Broglie
Chuyển động tự do của một hạt vi mô có năng lượng E, xung lượng p m. được biểu diễn bởi
một sóng phẳng lan truyền theo phương chuyển động của hạt với tần số ν và bước sóng λ được xác định theo hệ thức: E = h.ν (23) h (24) p
1.2. Cỡ bước sóng De Broglie của hạt electron
Thí nghiệm: Cho hạt electron tăng tốc trong điện trường có hiệu điện thế U để nó thu được năng
lượng (động năng) E, từ đó áp dụng các hệ thức của De Broglie tính ra bước sóng của nó. 2 m 2eU e eU Ta có: 2 me
Theo công thức De Broglie tính được bước sóng: 34 10 h h 6,625.10 12,28.10 12,28 m 31 19 m 2m Ue 2.9,1.10 .U.1,6.10 U U e e Å
+ Nhận xét: Bước sóng De Broglie của electron có giá trị cỡ bước sóng của tia X (Rơnghen).
1.3. Hệ thức bất định Heisenberg
Heisenberg (nhà vật lý người Đức, 1901-1976), cho rằng không thể xác định chính xác đồng
thời vận tốc và vị trí của một vật, đặc biệt là các vật nhỏ như electron. h (25) Δυ 4 m x. Δx ≥
Trong đó: Δυ : sai số tuyệt đối của vận tốc theo phương x. x
Δx: sai số tuyệt đối của vị trí trên phương x.
h là hằng số Planck (h = 6,62607095.10-34 J.s)
m là khối lượng của hạt.
Hay hệ thức bất định Heisenberg có thế viết dưới dạng: (26) . p h . p x x 2 hay x x 4
Hằng số Planck (h) rất bé nên độ bất định Δυ của vận tốc chỉ đáng kể với những hạt có khối
lượng m rất bé có nghĩa là đối với hạt vi mô.
Nguyên lý trên có ý nghĩa nếu sai số về tốc độ càng nhỏ (vận tốc càng biết chính xác, Δυ → 0)
thì sai số về vị trí càng lớn (tức càng không xác định chính xác vị trí của hạt, Δx → ) và ngược lại,
nếu biết chính xác vị trí thì không biết chính xác vận tốc.
Người ta có thể xác định được năng lượng (động lượng p = m υ) của electron, tức biết được vận
tốc của electron, nếu theo nguyên lý bất định Heisenberg ta không thể biết chính xác được vị trí của
electron. Thực tế electron có kích thước quá nhỏ và di chuyển với tốc độ rất lớn nên ta khó xác định
đúng vị trí của electron trong nguyên tử. Các mẫu nguyên tử của Rutherford, Bohr đã vi phạm nguyên
lí bất định Heisenberg vì xác định được cả năng lượng lẫn vị trí của electron.
Tổng quát, nguyên lí bất định Heisenberg đúng cho mọi vật chuyển động. Tuy nhiên, đối với
những vật vĩ mô, có khối lượng m lớn, di chuyển không quá nhanh, có thể xác định được vận tốc và vị trí của vật. h Δυ 4 m x. Δx ≥
→ 0 (do h có trị số nhỏ và nếu m có trị số lớn thì tỉ số này → 0) nghĩa là sai số
của vật không đáng kể so với kích thước của vật, có thể bỏ qua. Người ta, có thể xác định được tọa độ
lẫn vận tốc, tức vẽ được quỹ đạo chuyển động của vật. Nhưng đối với các hạt có kích thước quá nhỏ
và di chuyển rất nhanh như electron thì không thể xác định chính xác quỹ đạo của electron. 17
2. Hàm sóng orbital nguyên tử và biểu thức năng lượng cho hệ một hạt nhân – một electron
Hàm sóng toàn phần (r, , ) mô tả chuyển động của điện tử trong nguyên tử hiđro là tích của
hai hàm, hàm góc và hàm bán kính. (r, , ) R(r)Yl ,m( , )
Những hàm này là nghiệm của phương trình Schroedinger: 2 (29) 2 U(r) (r) E (r) 2m 2 Ze U(r) Với r
Từ việc giải phương trình Schroedinger xuất hiện ba số nguyên n, l và ml (n = 1, 2, 3,…; l = 0,
1, 2,…n-1; m = -l, 0, …, +l) được gọi là những số điện tử. Trong đó:
- Số lượng tử chính n xác định những mức năng lượng trong nguyên tử: 4 2 1 me Z (30) En 2 2 n 2
- Số lượng từ từ m xác định hình chiếu của moment động lượng trên một phương nào đó: Mz = m.
- Số lượng tử phụ l hay số lượng tử moment động lượng orbital xác định moment động lượng orbital: M l(l 1) (31)
Hàm sóng toàn phần phụ thuộc vào ba số lượng tử trên. Ứng với những tổ hợp khác nhau của
giá trị của n, l và ml ta có những hàm riêng khác nhau. Mỗi hàm mô tả một trạng thái chuyển động của
điện tử trong nguyên tử hydrogen và được gọi là những orbital nguyên tử.
Ta có: Ứng với mỗi giá trị n có n giá trị l, ứng với mỗi giá trị l có 2l+1 giá trị của ml. Như vậy,
ứng với mỗi giá trị của n, ta có n orbital với các giá trị của 2 l và ml khác nhau.
Giải phương trình Schroedinger cho biết các giá trị năng lượng E trong nguyên tử hydrogen và những ion giống hydrogen: 4 2 me Z En 2 2 2n
Như vậy, những giá trị của E thu được chỉ phụ thuộc vào số lượng tử n nên ứng với mỗi mức
năng lượng này có n trạng thái khác nhau. Do đó, có sự suy biến năng lượng bậc n 2 .2
Trong cơ học lượng tử, người ta không nói đến quỹ đạo điện tử mà chỉ nói đến xác suất khám
phá ra điện tử tại một vị trí nào đó. Mỗi trạng thái điện tử được xác định bằng một hàm sóng và
ứng với mỗi hàm sóng này có một sự phân bố xác suất của điện tử trong không gian chung quanh. Mật 2
độ xác suất này được xác định bằng phương trình bình phương môđun của hàm sóng . Bằng hình
tượng, người ta dùng khái niệm đám mây điện tử để chỉ sự phân bố xác suất của điện tử trong không
gian và biểu diễn bằng hình vẽ sự phân bố đó hay hình dạng đám mây điện tử bằng cách giới hạn
khoảng không gian mà trong đó bao gồm phần lớn (khoảng 90%) xác suất của điện tử.
Orbital là các hàm sóng mô tả những trạng thái của điện tử, sự phân bố xác suất của điện tử hay
đám mây điện tử ứng với những hàm sóng trên.
Hình dạng của những đám mây điện tử tương ứng được trình bày ở Hình 4. 18
Hình 4. Hình dạng của orbital s, p, d.
3. Bốn số lượng tử n, l, ml, ms và ý nghĩa.
3.1. Số lượng tử chính n
Số lượng tử n được gọi là số lượng tử chính, là một số nguyên dương n = 1, 2, 3,…
Theo thuyết Bohr-Sommerfeld thì số lượng tử chính n đặc trưng cho các lớp quỹ đạo hay các
lớp điện tử trong nguyên tử. Ứng với những giá trị của n = 1, 2, 3, 4, 5, … ta có các lớp K, L, M, N,
O,… Số lượng tử n xác định kích thước quỹ đạo của các lớp: a = n2.r1. Trong đó, a là bán kính của quỹ
đạo tròn hay nửa trục lớn của các quỹ đạo elip thuộc lớp n; r 1(hay a )
o là bán kính quỹ đạo tròn thứ nhất của Bohr.
Số lượng tử n còn xác định mức năng lượng “trung bình” của các điện tử thuộc lớp n. Số lượng
tử n đặc trưng cho sự lượng tử hóa năng lượng toàn phần của nguyên tử. 2 4 2 k .m .e .Z (32) e En 2 2 2n .
Khi nguyên tử tồn tại ở một trạng thái có số lượng tử chính n xác định thì năng lượng của nó
cũng xác định. Các năng lượng này chỉ nhận những giá trị gián đoạn, nghĩa là bị lượng tử hóa. Trạng
thái như vậy của nguyên tử được gọi là trạng thái dừng, còn năng lượng của nguyên tử tương ứng với
trạng thái dừng thì được gọi là năng lượng trạng thái dừng của nguyên tử.
Trong cơ học lượng tử, người ta cũng nói đến những lớp orbital K, L, M, N,… để chỉ những
hàm sóng đặc trưng bằng số lượng tử n = 1, 2, 3, 4,… ở những trạng thái dừng, electron không có tọa
độ xác định. Vì vậy, người ta chỉ có thể nói đến khoảng cách trung bình của electron đến hạt nhân. Đối
với nguyên tử H hay những ion giống H, ta có: a 1 l(l 1) (33) 2 o r n . 1 1 2 Z 2 n
Như vậy, r phụ thuộc chủ yếu vào số lượng tử n và gần tỉ lệ với n .
2 Do đó, người ta cũng có thể
nói số lượng tử n xác định khoảng cách trung bình của điện tử đến hạt nhân.
3.2. Số lượng tử quỹ đạo l (số lượng tử phụ l)
Biểu thức tính moment xung lượng (L) của electron: (ll 1). (34) L =
Trong đó, l là số lượng tử quỹ đạo chỉ nhận các giá trị gián đoạn l = 0, 1, 2, …, n-1.
Người ta quy ước biểu diễn các trạng thái của các electron trong nguyên tử ứng với moment quỹ
đạo (số lượng tử quỹ đạo l) như sau: l 0 1 2 3 4 5 Kí hiệu s p d f g h
Kết hợp số lượng tử chính n với số lượng tử quỹ đạo l, có thể kí hiệu trạng thái khả dĩ của nguyên tử theo bảng sau: 19




