








Preview text:
lOMoARcPSD| 49598967
CHƯƠNG 1. CÁC KHÁI NIỆM CƠ BẢN VỀ VẬT LIỆU Phần 1. Cấu tạo nguyên tử và liên kết
Sự hiểu biết của chúng ta về sự tương tác giữa các nguyên tử ã ạt ến mức cho
phép có thể giải thích ược các tính chất vĩ mô của vật chất dựa trên cơ lượng tử và
tương tác tĩnh iện giữa các iện tử và nhân trong vật chất. Tuy nhiên, nhiều tính chất
của vật chất có thể ược giải thích dựa vào các khái niệm cổ iển. Trong chương này,
chúng ta sẽ tìm hiểu về các tương tác trong vật chất dưới góc nhìn cổ iển và xem xét
một số khái niệm cơ bản.
1.1. Cấu trúc nguyên tử
Mô hình nguyên tử mà cho phép chúng ta tìm hiểu rõ về các tính chất của
nguyên tử cần dựa trên cơ lượng tử (quantum mechanics). Trong chương này, chúng
ta tìm hiểu một mô hình ơn giản hơn ược gọi là mô hình lớp (shell model) dựa trên mô hình Bohr.
Khối lượng của nguyên tử (atom) tập trung ở nhân (nucleus) ược cấu tạo từ
proton và neutron. Proton là hạt mang iện tích dương, còn neutron thì trung hòa về
iện. Proton và neutron có khối lượng bằng nhau. Mặc dù có lực ẩy (repulsive force)
giữa các proton nhưng các proton và neutron ều ược giữ trong nhân bởi lực mạnh
hay tương tác mạnh (strong force/interaction), là một lực tương tác tự nhiên mạnh
giữa các hạt. Lực này có tầm ảnh hưởng rất nhỏ, thông thường nhỏ hơn 10−15m. Khi
proton và neutron ược ưa lại rất gần nhau, lực mạnh sẽ thắng lực ẩy tĩnh iện
(electrostatic force/interaction) giữa các proton và giữ cho nhân thành một khối
nguyên vẹn. Số lượng proton trong nhân còn ược gọi là số nguyên tử (atomic number) Z.
Đối với mô hình lớp, các iện tử (electron) quay xung quanh nhân trên các quỹ
ạo (orbit) có bán kính lớn hơn kích thước của nhân rất nhiều lần. Số lượng iện tử
bằng với số lượng proton có trong nhân. Một giả sử rất quan trọng của mô hình Bohr
cho rằng, chỉ có một số quỹ ạo với bán kính xác ịnh là bền vững. Ví dụ, quỹ ạo gần
nhất của iện tử trong nguyên tử Hydro có bán kính 0.053 nm. Do iện tử liên tục dịch
chuyển theo quỹ ạo với bán kính xác ịnh trong một khoảng thời gian dài (khoảng
10−12 s theo tỉ lệ thời gian nguyên tử) nên iện tử ược xem như một ám mây iện tích
âm hình cầu (spherical negative-charge cloud) bao xung quanh nhân thay vì một hạt
hữu hạn. Chính vì vậy, chúng ta có thể xem iện tử như một hạt iện tích ược chứa
trong một lớp cầu với bán kính xác ịnh. lOMoARcPSD| 49598967
Do yêu cầu về tính bền vững của quỹ ạo, các iện tử không chiếm toàn bộ vùng
không gian xung quanh nhân một cách ngẫu nhiên. Thay vào ó, chúng chiếm các
vùng cầu với giá trị bán kính xác ịnh. Các iện tử ược phân bố trên các lớp (shell) và
phân lớp (subshell) trong một lớp theo một quy tắc xác ịnh. Hình 1.1 là một ví dụ cho nguyên tử Carbon.
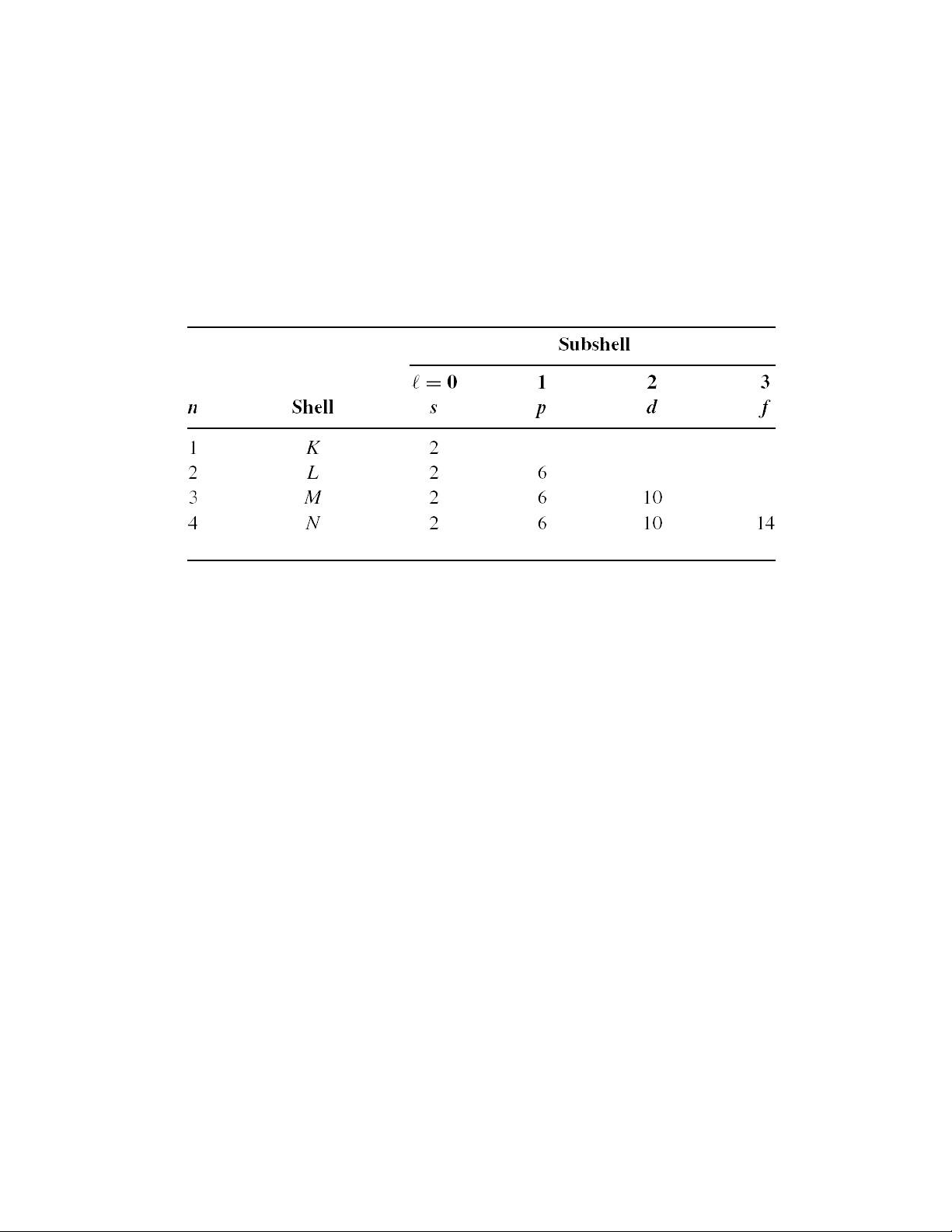
Lớp và phân lớp xác ịnh nơi tồn tại của iện tử ược ký hiệu bởi hai bộ số 𝑛 và 𝑙.
Hai bộ số này lần lượt ược gọi là số lượng tử chính (principal quantum number) và
số lượng tử quỹ ạo (orbital quantum number). Trong ó, 𝑛 =
1, 2, 3, … và 𝑙 = 0, 1, 2, …, và 𝑙 < 𝑛. Đối với mỗi giá trị của 𝑛, ta có 𝑛 giá trị của 𝑙,
có nghĩa là các lớp càng cao thì càng chứa nhiều phân lớp. Các lớp tương ứng với 𝑛
= 1, 2, 3, 4, … còn ược ký hiệu bởi các chữ cái viết hoa 𝐾, 𝐿, 𝑀, 𝑁, …, và các phân
lớp thì ược ký hiệu bởi 𝑠, 𝑝, 𝑑, 𝑓, … Phân lớp với 𝑙 = 1 trong lớp 𝑛 = 2 ược ký hiệu
là phân lớp 2𝑝 theo quy tắc ký hiệu 𝑛𝑙.
Hình 1.1. Mô hình lớp của nguyên tử, trong ó các iện tử nằm trong các lớp và phân lớp xác ịnh
Việc sắp xếp các iện tử vào các phân lớp cần phải tuân thủ theo quy tắc. Số
lượng iện tử tối a mà một phân lớp có thể chứa ược xác ịnh bởi 2(2𝑙 + 1). Ví dụ,
phân lớp 𝑠 (𝑙 = 0) có thể chứa tối a 2 iện tử, phân lớp 𝑝 có thể chứa tối a 6 iện tử,…
Bảng 1 cho biết số lượng iện tử các phân lớp và lớp có thể chứa. Có thể thấy rằng,
các lớp càng cao thì càng chứa nhiều iện tử vì chúng có nhiều phân lớp hơn. Các iện
tử ược sắp xếp bắt ầu từ các lớp và phân lớp gần nhân nhất.
Số lượng iện tử trong một phân lớp ược biểu diễn bởi chỉ số trên của từng ký
hiệu phân lớp. Như vậy, cấu hình iện tử của nguyên tử Carbon (Hình 1.1) ược biểu lOMoARcPSD| 49598967
diễn như sau 1𝑠22𝑠22𝑝2. Các iện tử chiếm các phân lớp ngoài cùng nằm xa nhân nhất
và óng một vai trò quan trọng trong tương tác giữa các nguyên tử vì các iện tử này
sẽ tương tác ầu tiên với các iện tử ngoài cùng của các nguyên tử lân cận. Các iện tử
ngoài cùng này ược gọi là iện tử hóa trị (valence electron). Hình 1.1 cho thấy Carbon
có 4 iện tử hóa trị trong lớp 𝐿.
Bảng 1.1. Số lượng iện tử tối a trong lớp và phân lớp của nguyên tử
Khi một phân lớp ược lấp ầy iện tử, nó không thể nhận thêm iện tử và ược gọi
là ạt ược cấu hình bền vững. Đây là các trường hợp tương ứng với các nguyên tố trơ
(hiếm) nằm ở cột ngoài cùng bên phải của Bảng hệ thống tuần hoàn. Các nguyên tố
này ều có các phân lớp ược lấp ầy bởi iện tử và hiếm khi tham gia vào các phản ứng
hóa học. Phần lớn các nguyên tố này là khí do các nguyên tử không liên kết với nhau
ể tạo nên chất lỏng hay rắn.
Các nguyên tử như Li có 2 iện tử trong phân lớp 1𝑠 và 1 iện tử trong phân lớp
2𝑠. Cấu hình iện tử (electron configuration) của Li là 1𝑠22𝑠1. Điện tử thứ ba nằm
trong phân lớp 2𝑠 thay vì trong các phân lớp khác vì cách sắp xếp này có mức năng
lượng thấp nhất cho cả nguyên tử. Các iện tử cần ược cung cấp năng lượng ể dịch
chuyển từ 2𝑠 lên 2𝑝 hoặc các phân lớp cao hơn. Theo quy ước, mức năng lượng tham
chiếu (reference energy) có giá trị quy ước bằng 0 tương ứng với iện tử nằm ở xa vô
cùng, tức là cô lập khỏi nguyên tử. Khi iện tử nằm bên trong nguyên tử, năng lượng
của chúng là âm do lực hút với nhân mang iện tích dương. Điện tử gần nhân hơn sẽ
có năng lượng thấp hơn. Các iện tử gần nhân hơn sẽ liên kết với nhân mạnh hơn và
có năng lượng liên kết cao hơn. Cấu hình 1𝑠22𝑠1 có mức năng lượng thấp nhất ối với
Li và ồng thời tuân theo quy tắc sắp xếp iện tử cho phân lớp. Nếu iện tử ở phân lớp
2𝑠 bị kích thích lên phân lớp cao hơn thì năng lượng của nguyên tử sẽ tăng và nguyên
tử ược gọi là bị kích thích (excited). lOMoARcPSD| 49598967
Mức năng lượng thấp nhất cần thiết ể tách một iện tử ra khỏi nguyên tử trung
hòa, tạo nên ion dương (cation) và một iện tử cô lập ược gọi là năng lượng ion hóa
(ionization energy) của nguyên tử. Nguyên tử Na chỉ có một iện tử hóa trị trong lớp
ngoài cùng và là iện tử dễ tách ra khỏi nguyên tử nhất. Năng lượng cần thiết ể tách
iện tử này là 5.1 eV và chính là năng lượng ion hóa của nguyên tử Na. Ái lực iện tử
(electron affinity) là năng lượng cần thiết hoặc ược giải phóng (released) khi ưa một
iện tử vào một nguyên tử trung hòa ể tạo thành ion âm (anion). Lưu ý rằng khái niệm
ion hóa ể chỉ việc tạo thành ion dương, trong khi khái niệm ái lực iện tử tương ứng
với việc tạo thành ion âm. Một số nguyên tử như F, Cl, Br, I có thể hấp thụ một iện
tử ể trở thành ion âm. Ái lực iện tử của chúng là âm. Khi nguyên tử Cl hấp thụ một
iện tử, một mức năng lượng 3.6 eV ược giải phóng. Ion âm 𝐶𝑙− có mức năng lượng
thấp hơn nguyên tử Cl, có nghĩa là dạng ion âm 𝐶𝑙− phổ biến hơn.
Động năng (kinetic energy) trung bình ̅𝐾𝐸̅̅̅̅̅̅, thế năng (potential energy) trung
bình 𝑃𝐸̅̅̅̅̅̅̅, và năng lượng toàn phần (total energy) 𝐸̅̅̅̅ của một iện tử trong nguyên tử
có mối liên hệ theo các biểu thức sau:
𝐸̅̅̅̅ = ̅𝐾𝐸̅̅̅̅̅̅ + 𝑃𝐸̅̅̅̅̅̅̅ và 𝐾𝐸̅̅̅̅̅̅̅ = − 𝑃𝐸̅̅̅̅̅̅̅.
Ví dụ, nếu ta quy ước mức năng lượng 0 ối với nguyên tử H khi ion dương 𝐻+
và iện tử bị tách ra xa vô cùng thì năng lượng của iện tử trong nguyên tử H là
−13.6 eV. Như vậy, cần có 13.6 eV ể ion hóa H. Thế năng trung bình 𝑃𝐸̅̅̅̅̅̅̅ của iện
tử do sự tương tác lực Coulomb với nhân mang iện tích dương là −27.2 eV.
Do ó, ộng năng trung bình ̅𝐾𝐸̅̅̅̅̅̅ bằng 13.6 eV.
Bài tập ví dụ: lOMoARcPSD| 49598967 lOMoARcPSD| 49598967 1.2. Liên kết
1.2.1. Phân tử và các nguyên tắc liên kết chung
Khi hai nguyên tử ược ưa ến gần nhau, các iện tử hóa trị tương tác với nhau và
với nhân của nguyên tử khác. Kết quả của sự tương tác này thường là sự hình thành
liên kết giữa các nguyên tử, và sinh ra phân tử (molecule). Sự hình thành liên kết có
nghĩa rằng năng lượng của hệ hai nguyên tử liên kết với nhau phải nhỏ hơn năng
lượng của hai nguyên tử tách rời. Do ó, sự hình thành phân tử bền vững hơn. Nguyên
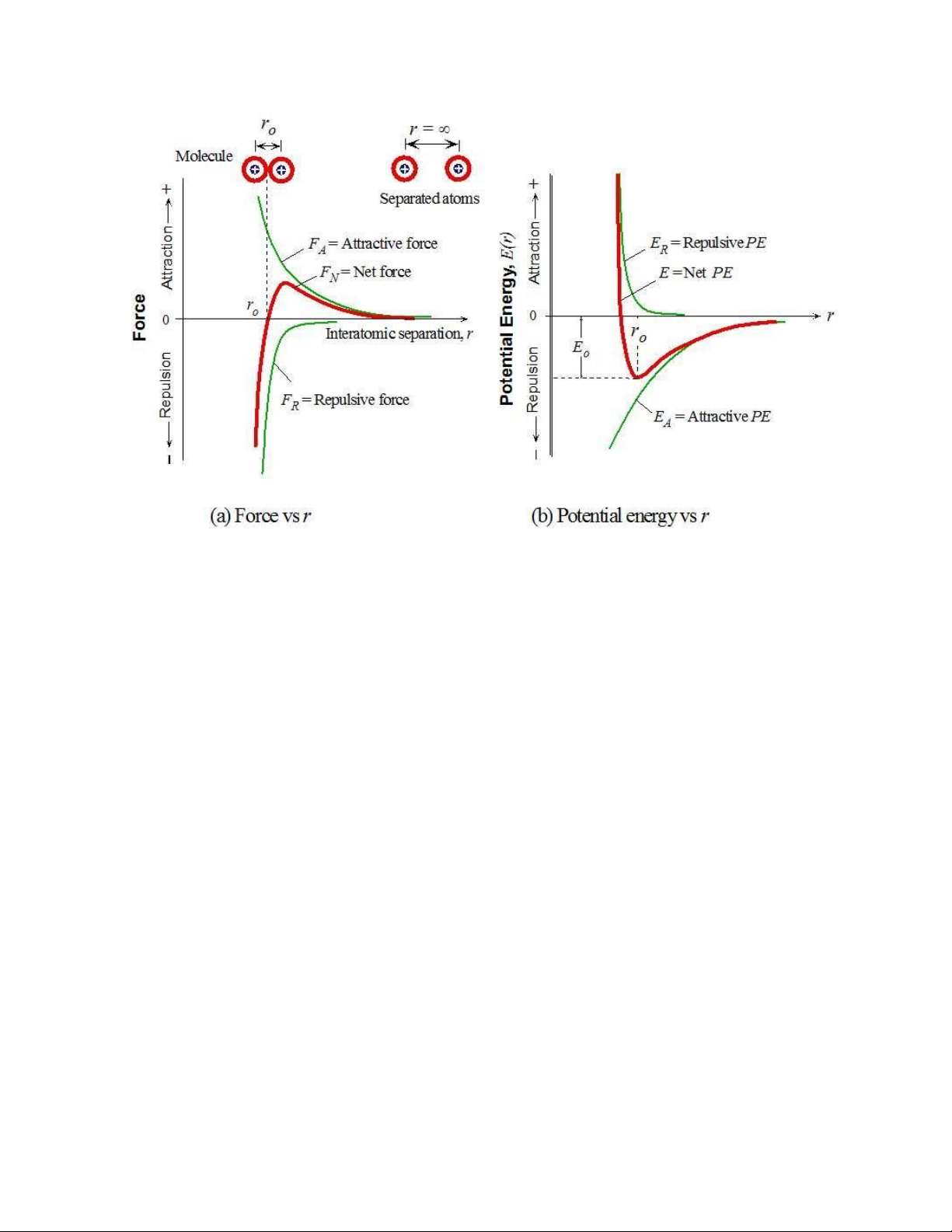
lý chung của sự hình thành phân tử ược mô tả ở Hình 1.2a, trong ó hai nguyên tử ược
ưa lại gần nhau từ xa vô cùng. Khi hai nguyên tử ược ưa lại gần nhau, các nguyên tử
tác dụng lực hút (attractive force) và lực ẩy (repulsive force) lên nguyên tử còn lại
theo tương tác tĩnh iện. Ban ầu, lực hút 𝐹𝐴 chiếm ưu thế so với lực ẩy 𝐹𝑅. Tổng lực
(net force) 𝐹𝑁 là tổng của hai thành phần này
𝐹𝑁 = 𝐹𝐴 + 𝐹𝑅,
và ban ầu sẽ là lực hút như biểu diễn ở Hình 1.3a.
Thế năng 𝐸̅̅̅(𝑟) của hai nguyên tử ược xác ịnh từ biểu thức sau 𝑑𝐸̅̅̅ 𝐹𝑁 = , 𝑑𝑟
bằng cách lấy tích phân của tổng lực 𝐹𝑁. Hình 1.3a và b cho thấy sự thay ổi của
tổng lực 𝐹𝑁(𝑟) và thế năng 𝐸̅̅̅(𝑟) theo khoảng cách 𝑟 giữa hai nguyên tử khi các
nguyên tử ược ưa lại gần nhau từ xa vô cùng. Sự giảm của năng lượng tương ứng
với sự tương tác hút giữa các nguyên tử. lOMoARcPSD| 49598967
Hình 1.2. (a) Sự thay ổi của các lực tương tác theo khoảng cách giữa hai nguyên tử;
và (b) sự thay ổi của các thế năng theo khoảng cách giữa hai nguyên tử.
Sự thay ổi của 𝐹𝐴 và 𝐹𝑅 theo khoảng cách là khác nhau. Lực 𝐹𝐴 thay ổi chậm,
trong khi lực 𝐹𝑅 thay ổi mạnh theo khoảng cách và mạnh nhất khi hai nguyên tử ở
rất gần nhau. Khi các lớp iện tử của hai nguyên tử trở nên chống lấp (overlapped) thì
sẽ xuất hiện lực ẩy rất mạnh giữa các lớp iện tử và lực 𝐹𝑅 óng vai trò là lực chính.
Trạng thái cân bằng (equilibrium) ạt ược khi lực hút vừa cần bằng với lực ẩy và tổng lực bằng 0, hay
𝐹𝑁 = 𝐹𝐴 + 𝐹𝑅 = 0.
Ở trạng thái này, các nguyên tử cách nhau một khoảng 𝑟𝑜 (Hình 1.2). Khoảng
cách này ược gọi là khoảng cách cân bằng (equilibrium separation) và là chiều dài
liên kết (bond length). Trên giản ồ năng lượng, 𝐹𝑁 = 0 tương ứng với 𝑑𝐸̅̅̅ 𝑑𝑟⁄ = 0,
tức là trạng thái cân bằng của hai nguyên tử tương ứng với thế năng của hệ ạt giá trị
cực tiểu. Như vậy, phân tử chỉ ược hình thành nếu năng lượng của hai nguyên tử khi
chúng tiến lại gần nhau ạt giá trị nhỏ nhất. Mức năng lượng nhỏ nhất này cũng xác
ịnh năng lượng liên kết của phân tử (Hình 1.2b). Năng lượng 𝐸̅̅̅𝑜 là mức năng lượng
cần thiết ể tách rời hai nguyên tử và ược gọi là năng lượng liên kết (bond energy).
Mặc dù chúng ta chỉ xem xét trường hợp liên kết giữa 2 nguyên tử nhưng các
lập luận tương tự có thể ược áp dụng ối với các trường hợp liên kết giữa nhiều nguyên
tử hoặc giữa hàng triệu nguyên tử trong chất rắn. Các lực 𝐹𝐴 và 𝐹𝑅 có thể thay ổi tùy lOMoARcPSD| 49598967
theo vật liệu, tuy nhiên nguyên lý chung về sự tồn tại của năng lượng liên kết 𝐸̅̅̅𝑜 và
khoảng cách cân bằng 𝑟𝑜 vẫn ược áp dụng.
1.2.2. Liên kết cộng hóa trị
Hai nguyên tử có thể hình thành liên kết với nhau bằng cách chia sẻ một vài
hoặc tất cả iện tử hóa trị, và nhờ ó làm giảm thế năng toàn phần của hệ. Liên kết cộng
hóa trị (covalent bond) ược hình thành bằng cách chia sẻ iện tử hóa trị ể lấp ầy phân
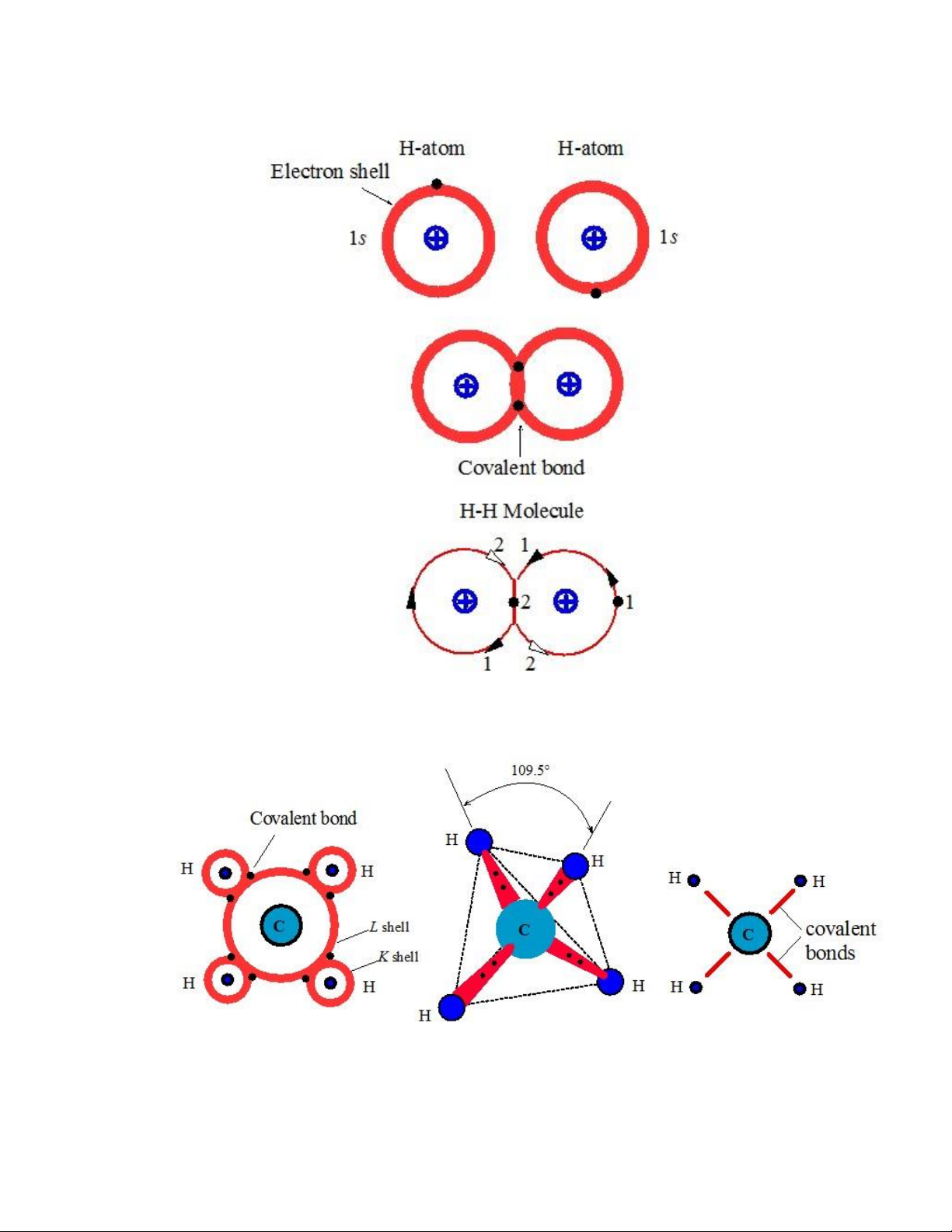
lớp của mỗi nguyên tử. Hình 1.3 biểu diễn sự hình thành liên kết cộng hóa trị giữa
hai nguyên tử Hydro ể tạo thành phân tử 𝐻2. Khi các phân lớp 1𝑠 chồng lấp, các iện
tử ược chia sẻ bởi cả 2 nguyên tử và mỗi nguyên tử sẽ có phân lớp ược lấp ầy. Như
minh họa ở Hình 1.3, các iện tử 1 và 2 phải quay quanh cả 2 nguyên tử; chúng i qua
vùng chồng lấp thường xuyên hơn (gấp ôi thông thường). Do ó, sự chia sẻ iện tử hình
thành nên vùng chồng lấp, trong ó tập trung nhiều iện tích âm ở vùng giữa hai nhân,
giúp cho hai nhân liên kết với nhau. Ngoài ra, nhờ vào sự ồng bộ trong chuyển ộng,
iện tử 1 và 2 không di chuyển qua vùng chồng lấp vào cùng thời iểm. Ví dụ, khi iện
tử 1 ở ngoài cùng phía bên phải (hoặc trái) thì iện tử 2 sẽ nằm trong vùng chồng lấp.
Cấu hình iện tử của nguyên tử Carbon là 1𝑠22𝑠22𝑝2 với 4 vị trí trống ở phân lớp
2𝑝. Các phân lớp 2𝑠 và 2𝑝 rất gần nhau. Khi hai nguyên tử tiến lại gần nhau, do
tương tác giữa các iện tử, hai phân lớp trở nên không phân biệt và ược xem như là
một lớp 𝐿 với khả năng chứa 8 iện tử. Rõ ràng rằng, nguyên tử C với 4 vị trí trống
(vacancy) trong lớp 𝐿 có thể chia sẻ iện tử với 4 nguyên tử H (Hình 1.4) ể tạp thành
phân tử 𝐶𝐻4, giúp cho nguyên tử C và mỗi nguyên tử H có thể lấp ầy các lớp. Lực
ẩy giữa các iện tử trong từng liên kết và các iện tử trong các liên kết lân cận khiến
cho các liên kết bị ẩy ra xa khỏi nhau. Như vậy, trong không gian 3 chiều, các nguyên
tử H chiếm các góc của tứ diện và các liên kết CH tạo thành các góc 109.5𝑜 với các
liên kết khác (Hình 1.4). lOMoARcPSD| 49598967
Hình 1.3. Sự hình thành liên kết cộng hóa trị giữa hai nguyên tử H.
Hình 1.4. Liên kết cộng hóa trị trong phân tử 𝐶𝐻4.
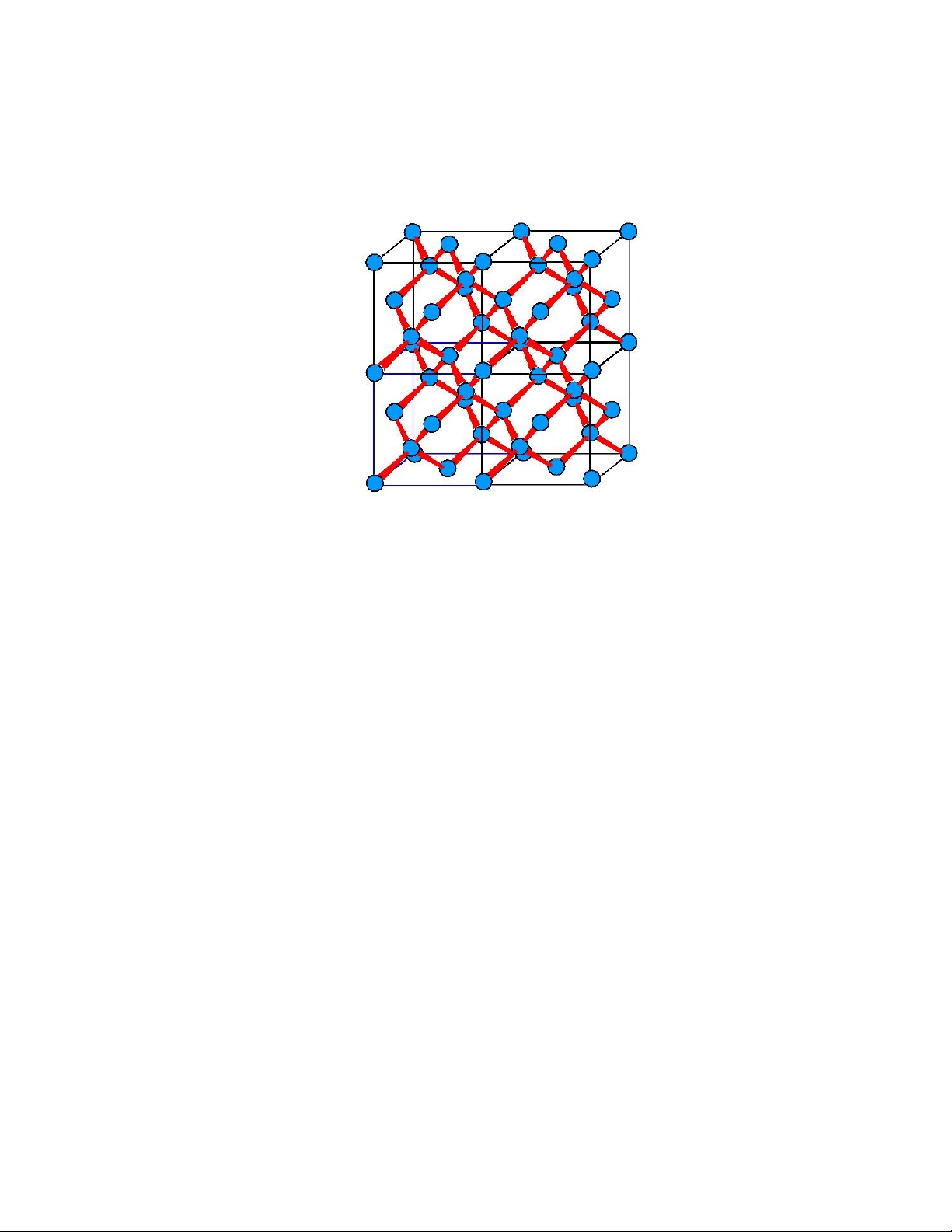
Nguyên tử C cũng có thể chia sẻ iện tử với các nguyên tử C khác (Hình 1.5).
Mỗi nguyên tử C lân cận có thể chia sẻ iện tử với các nguyên tử C khác, hình thành
nên một mạng 3 chiều của cấu trúc liên kết cộng hóa trị. Đây chính là cấu trúc của
tinh thể (crystal) kim cương, trong ó tất cả các nguyên tử C liên kết cộng hóa trị với lOMoARcPSD| 49598967
nhau (Hình 1.6). Số phối trí (coordination number), ký hiệu là CN, là số nguyên tử
gần nhất ối với một nguyên tử trong chất rắn. Theo Hình 1.5, số phối trí của nguyên
tử C trong cấu trúc tinh thể kim cương là 4.
Hình 1.5. Tinh thể kim cương.
Do lực hút mạnh giữa các iện tử chia sẻ và các nhân, năng lượng liên kết cộng
hóa trị thường là mạnh nhất trong các loại liên kết, dẫn ến nhiệt ộ nóng chảy cao và
ộ rắn lớn. Kim cương là một trong những vật liệu rắn nhất ược biết ến hiện nay.
Các chất rắn có liên kết cộng hóa trị thường không hòa tan (insoluble) trong
dung môi. Lực liên kết cộng hóa trị mạnh có thể làm cho các vật liệu này không dẻo
(nonductile). Dưới tác dụng của lực mạnh, chúng bị vỡ do giòn. Ngoài ra, do các iện
tử hóa trị bị khóa trong các liên kết giữa các nguyên tử, các iện tử không thể dịch
chuyển tự do trong tinh thể khi có mặt của iện trường. Do ó, khả năng dẫn iện
(electrical conductivity) của các vật liệu này rất kém.
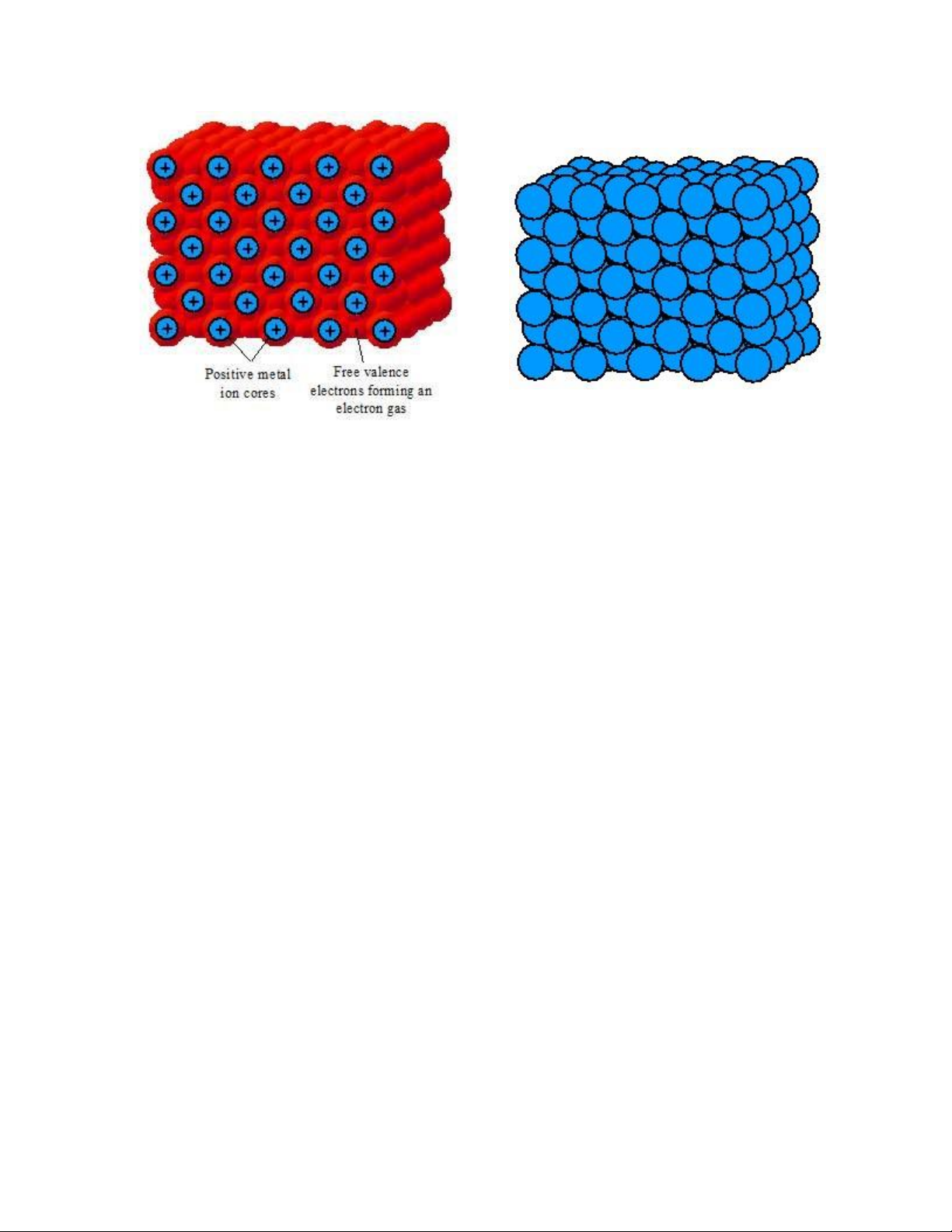
1.2.3. Liên kết kim loại
Các nguyên tử kim loại (metal) chỉ có vài iện tử hóa trị dễ bị tách khỏi nguyên
tử. Khi nhiều nguyên tử kim loại ược ưa lại gần nhau ể hình thành nên chất rắn,
những iện tử hóa trị tách khỏi các nguyên tử và ược chia sẻ chung bởi tất cả các ion.
Các iện tử hóa trị bị phân tán và tạo nên ám mây iện tử (electron cloud) hay còn gọi
là khí iện tử (electron gas), chiếm các khoảng trống giữa các ion (Hình 1.6). Tương
tác hút giữa các ám mây iện tử mang iện tích âm và các ion kim loại bù trừ với năng
lượng cần thiết ể tách các iện tử hóa trị ra khỏi các nguyên tử. Do ó, liên kết trong
kim loại chủ yếu là do lực hút giữa các ion kim loại và các iện tử dịch chuyển tự do giữa chúng. lOMoARcPSD| 49598967
Hình 1.6. Liên kết kim loại.
Liên kết kim loại (metal bonding) là sự chia sẻ tập thể (collective sharing) của
các iện tử nên có tính không ịnh hướng. Do ó, các ion kim loại có xu hướng tiến lại
gần nhau nhiều nhất có thể, hình thành nên cấu trúc tinh thể ặc khít (close-packed
crystal) với số phối trí lớn so với các chất rắn có liên kết cộng hóa trị khác. Theo
Hình 1.6, ion 𝐶𝑢+ ược sắp xếp ặc khít nhất có thể thông qua hiệu ứng liên kết của
các iện tử giữa các ion, hình thành nên cấu trúc tinh thể lập phương tâm diện (face-
centered cubic), ký hiệu là FCC.
Tính không ịnh hướng của liên kết kim loại có nghĩa là dưới tác dụng của lực,
các ion kim loại có thể dịch chuyển tương ối với nhau, ặc biệt khi có khiếm khuyết
(defect) trong tinh thể. Do ó, kim loại thường dễ uốn. Quan trọng nhất là các iện tử
hóa trị tự do trong ám mây iện tử dễ dàng chịu tác dụng của iện trường và dịch chuyển
theo chiều của lực iện trường, khiến cho kim loại có khả năng dẫn iện cao. Ngoài ra,
nếu có sự biến thiên nhiệt ộ trong một thanh kim loại, các iện tử tự do có thể tham
gia vào việc truyền năng lượng từ vùng nóng sang vùng lạnh do chúng thường xuyên
va chạm với các ion kim loại ể truyền năng lượng. Do vậy, kim loại có tính dẫn nhiệt tốt.
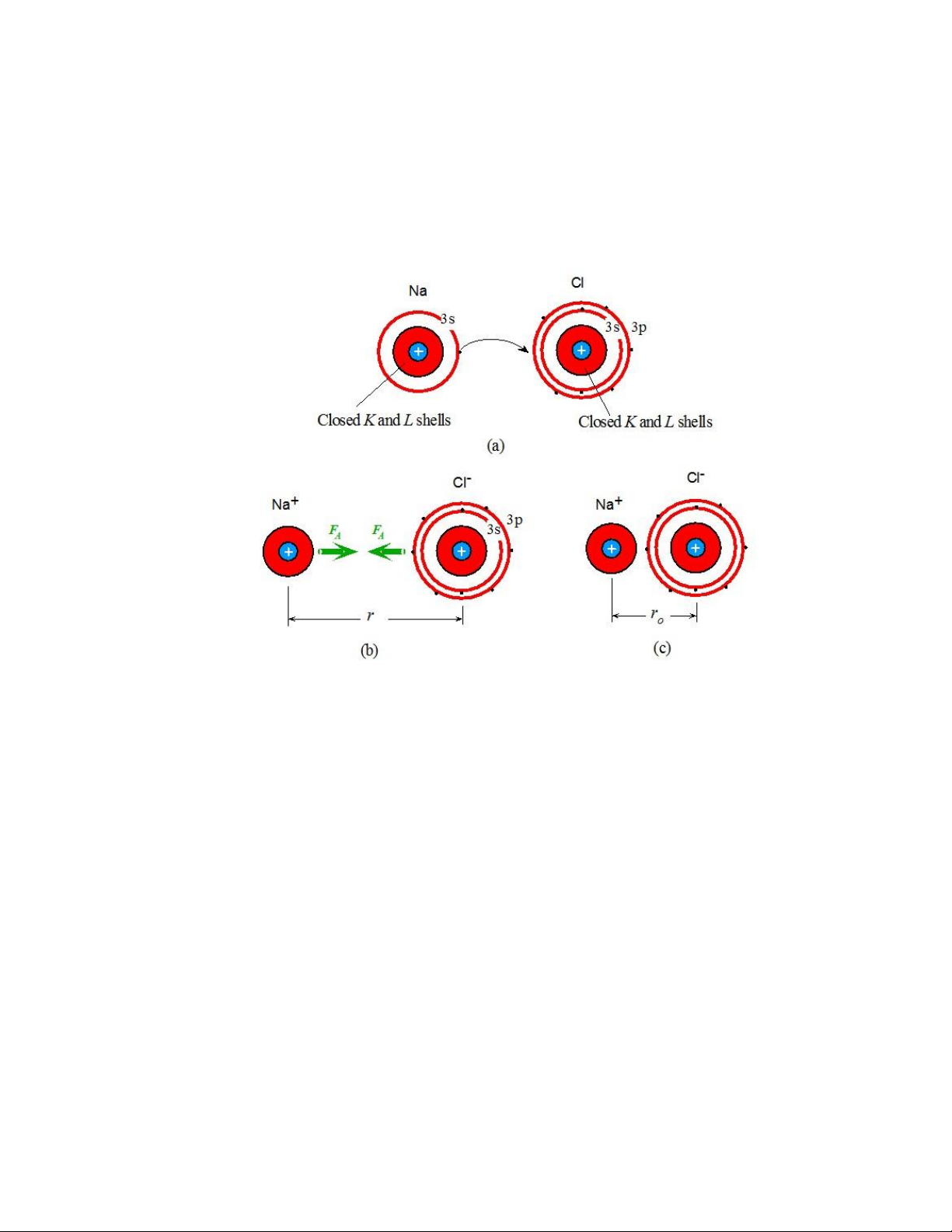
1.3.4. Liên kết ion
Liên kết ion (ionic bonding) thường có trong các vật liệu ược cấu tạo từ kim
loại và phi kim. Ví dụ như NaCL. Na là kim loại kiềm (alkali metal) với một iện tử
hóa trị có thể dễ dàng tách ra khỏi nguyên tử ể tạo thành ion 𝑁𝑎+ với phân lớp ược
lấp ầy. Trong khi ó, Cl có 5 iện tử trong phân lớp 3𝑝 và có xu hướng nhận thêm một
iện tử ể lấp ầy phân lớp này. Bằng cách lấy iện tử cho i bởi Na, nguyên tử Cl trở
thành hạt mang iện tích âm. Do ó, hình thành nên 2 ion tích iện trái dấu 𝑁𝑎+ và 𝐶𝑙− lOMoARcPSD| 49598967
(Hình 1.7). Dưới lực tác dụng Coulomb, các ion bị hút lại gần nhau ến khi lực hút
cân bằng với lực ẩy giữa các lớp iện tử. Ban ầu, cần có năng lượng cần thiết ể tách
iện tử ra khởi nguyên tử Na; quá trình này ược gọi là ion hóa. Tuy nhiên, năng lượng
này ược bù trừ bởi năng lượng của lực hút giữa 2 ion trái dấu, và làm giảm thế của
cặp ion 𝑁𝑎+ và 𝐶𝑙−.
Hình 1.7. Sự hình thành liên kết ion của NaCl.
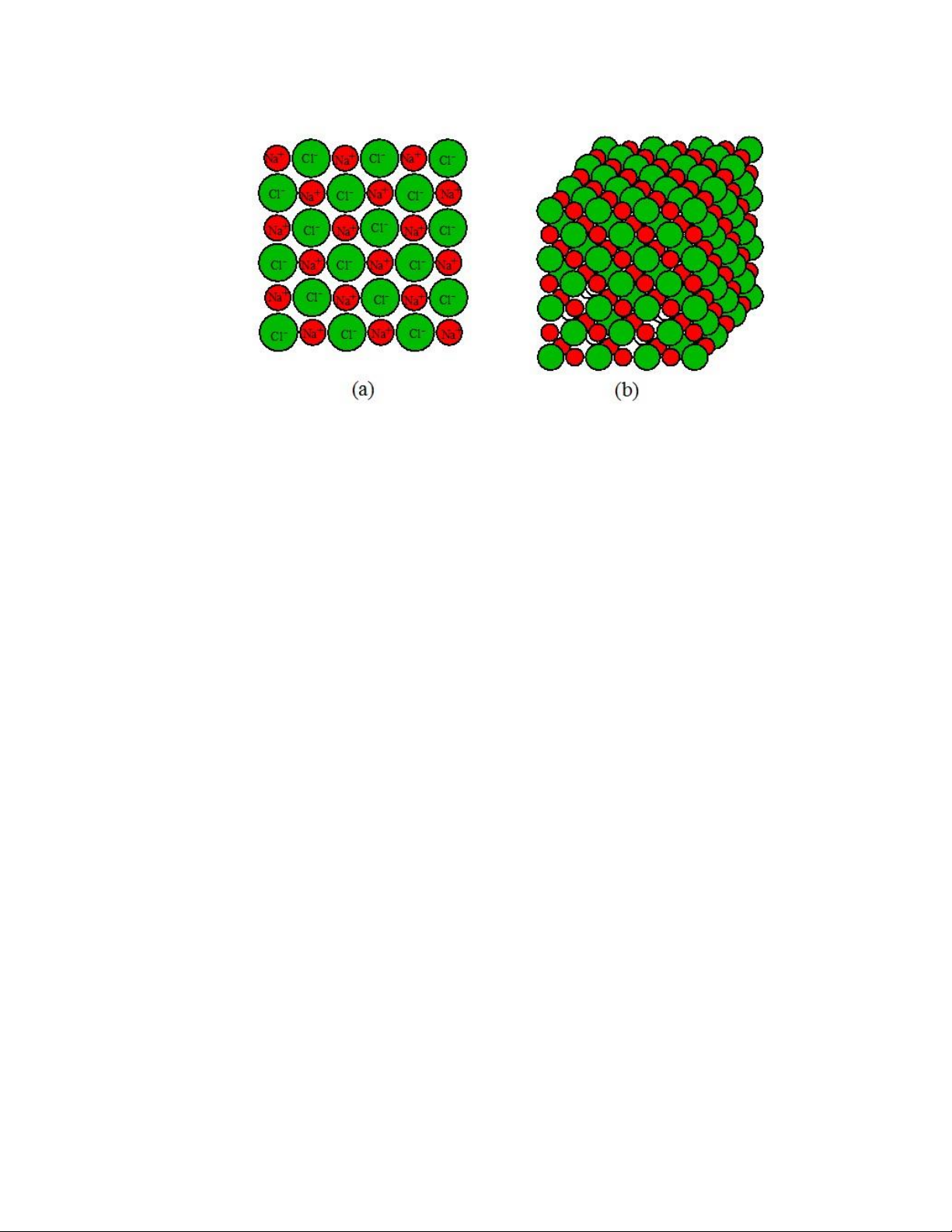
Khi nhiều nguyên tử Na và Cl bị ion hóa và ưa lại gần nhau, các ion sẽ liên kết
với nhau thông qua lực hút Coulomb giữa 𝑁𝑎+ và 𝐶𝑙− (Hình 1.8). Ngoài ra, cũng có
lực ẩy giữa các ion 𝑁𝑎+, cũng như giữa các ion 𝐶𝑙−. Để chất rắn bền vững, mỗi ion
𝑁𝑎+ cần có các ion 𝐶𝑙− bao xung quanh và ngược lại sao cho các ion cùng loại không
nằm gần nhau. Do kích thước của các ions 𝑁𝑎+ và 𝐶𝑙− khác nhau nên ể có cấu trúc
bền vững thì mỗi ion chỉ có thể có 6 ion trái dấu lân cận (Hình 1.8b). Do vậy, số phối
trí của các ion dương và âm trong tinh thể NaCl là 6. lOMoARcPSD| 49598967
Hình 1.8. (a) Mặt cắt của chất rắn NaCL; và (b) biểu diễn 3 chiều của chất rắn NaCl.
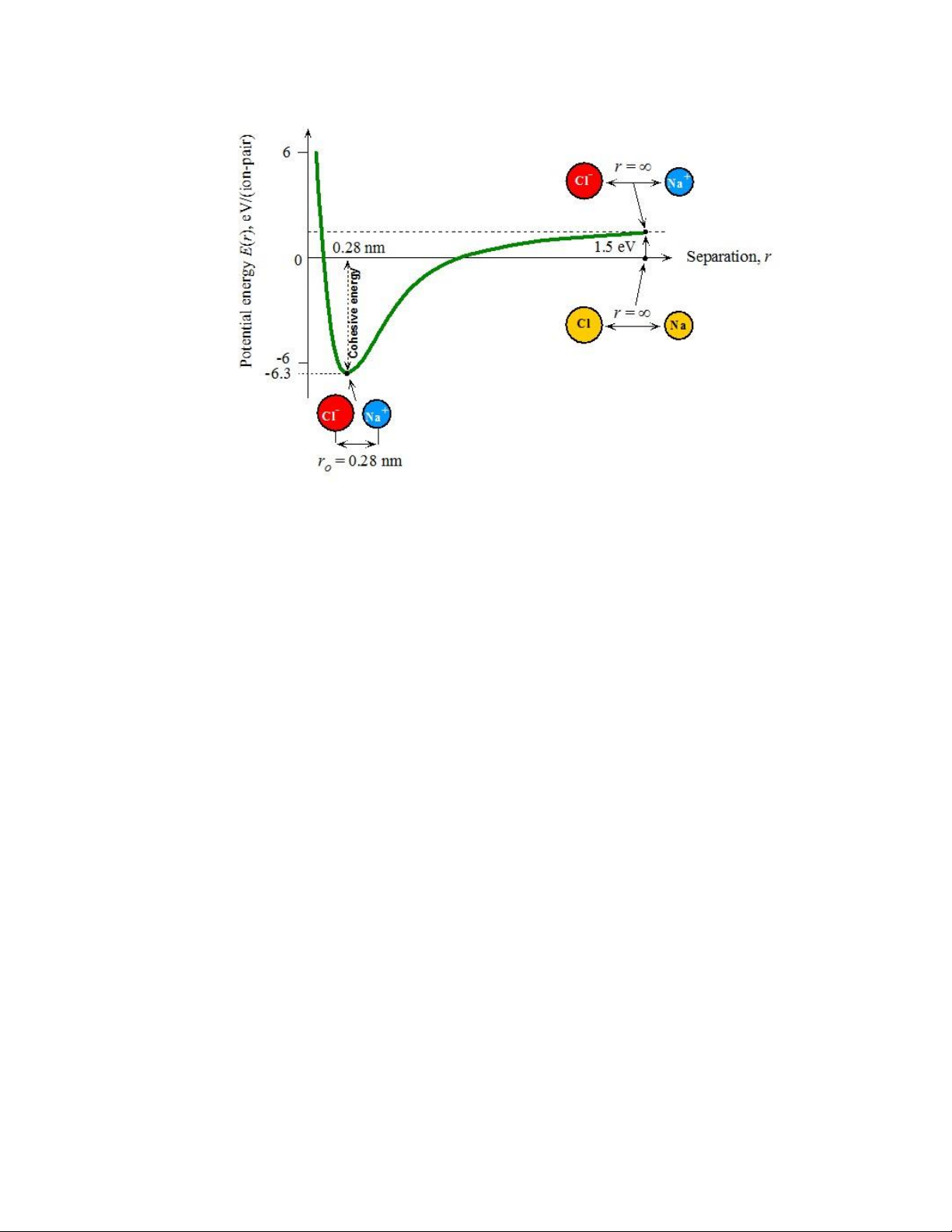
Các ion ạt trạng thái cân bằng và chất rắn trở nên bền vững khi thế năng toàn
phần ạt giá trị nhỏ nhất, tương ứng với 𝑑𝐸̅̅̅ 𝑑𝑟⁄ = 0. Hình 1.9 mô tả sự thay ổi của
thế năng toàn phần của cặp ion theo khoảng cách 𝑟 từ xa vô cùng ến nhỏ hơn khoảng
cách cân bằng. Mức năng lượng 0 tương ứng với hai nguyên tử tách biệt nhau. Ban
ầu, mức năng lượng khoảng 1.5 eV là cần thiết ể chuyển một iện tử từ nguyên tử Na
sang nguyên tử Cl, và tạo thành các ion 𝑁𝑎+ và 𝐶𝑙−. Sau ó, khi các ion tiến lại gần
nhau, năng lượng của hệ giảm ến khi ạt giá trị cực tiểu khoảng 6.3 eV, thấp hơn năng
lượng của 2 nguyên tử Na và Cl tách biệt. Khi 𝑟 = 0.28 nm, năng lượng ạt giá trị cực
tiểu và các ion ạt trạng thái cân bằng. Năng lượng liên kết tính theo một ion trong
chất rắn NaCl bằng 6.3 2 = 3.15⁄ eV (Hình 1.9). Năng lượng cần có ể tách NaCl
thành 2 nguyên tử Na và Cl tách biệt ược gọi là năng lượng liên kết nguyên tử (atomic
cohesive energy) và bằng 3.15 eV. lOMoARcPSD| 49598967
Hình 1.9. Sự thay ổi của thế năng toàn phần của cặp ion theo khoảng cách.
Nhiều chất rắn ược cấu tạo từ các cặp kim loại-phi kim (như NaCl) có liên kết
ion. Chúng ược gọi là tinh thể ion (ionic crystal) và có những tính chất vật lý chung.
Các chất rắn này thường cứng, giòn và có nhiệt ộ nóng chảy cao hơn kim loại. Đa
phần có thể hòa tan trong chất lỏng như nước. Do tất cả các iện tử ều nằm trong các
ion bị ràng buộc trong mạng tinh thể nên không có các iện tử tự do hoặc iện tử liên
kết yếu với ion ể dịch chuyển trong tinh thể như ối với kim loại. Chính vì vậy, các
chất rắn có liên kết ion thường có khả năng cách iện cao. So với kim loại và chất rắn
với liên kết cộng hóa trị, các chất rắn với liên kết ion có khả năng dẫn nhiệt yếu hơn
do các ion không thể truyền ộng năng dao ộng cho các ion lân cận.
Bài tập ví dụ: lOMoARcPSD| 49598967 lOMoARcPSD| 49598967
1.3.5. Liên kết thứ cấp
Liên kết cộng hóa trị, liên kết ion, và liên kết kim loại là các liên kết chính
(primary bond). Có thể có suy nghĩ rằng, không thể có liên kết giữa các nguyên tử
của các nguyên tố trơ (hiếm) do các lớp của chúng ã ược lấp ầy và không thể nhận
thêm hay loại bỏ iện tử cũng như chia sẻ iện tử. Tuy nhiên, thực nghiệm cho thấy sự
tồn tại ở thể rắn của Argon tại nhiệt ộ thấp dưới −189𝑜𝐶. Điều này có nghĩa là phải
tồn tại một cơ chế tạo liên kết nào ó giữa các nguyên tử Ar. Lực liên kết này sẽ không
mạnh vì ở nhiệt ộ trên −189𝑜𝐶 chất rắn Ar bị nóng chảy. Một quan sát khác cho thấy
mặc dù các phân tử nước 𝐻2𝑂 trung hòa nhưng chúng lại có thể hút lẫn nhau ể tạo
thành trạng thái lỏng ở nhiệt ộ dưới 100𝑜𝐶 và trạng thái rắn ở nhiệt ộ dưới 0𝑜𝐶. Như
vậy, giữa các nguyên tử và phân tử tồn tại một lực hút yếu và lực này ược gọi là lực
van der Waals. Lực này sinh ra do lực hút tĩnh iện giữa phân bố iện tử của một
nguyên tử và nhân của nguyên tử khác.
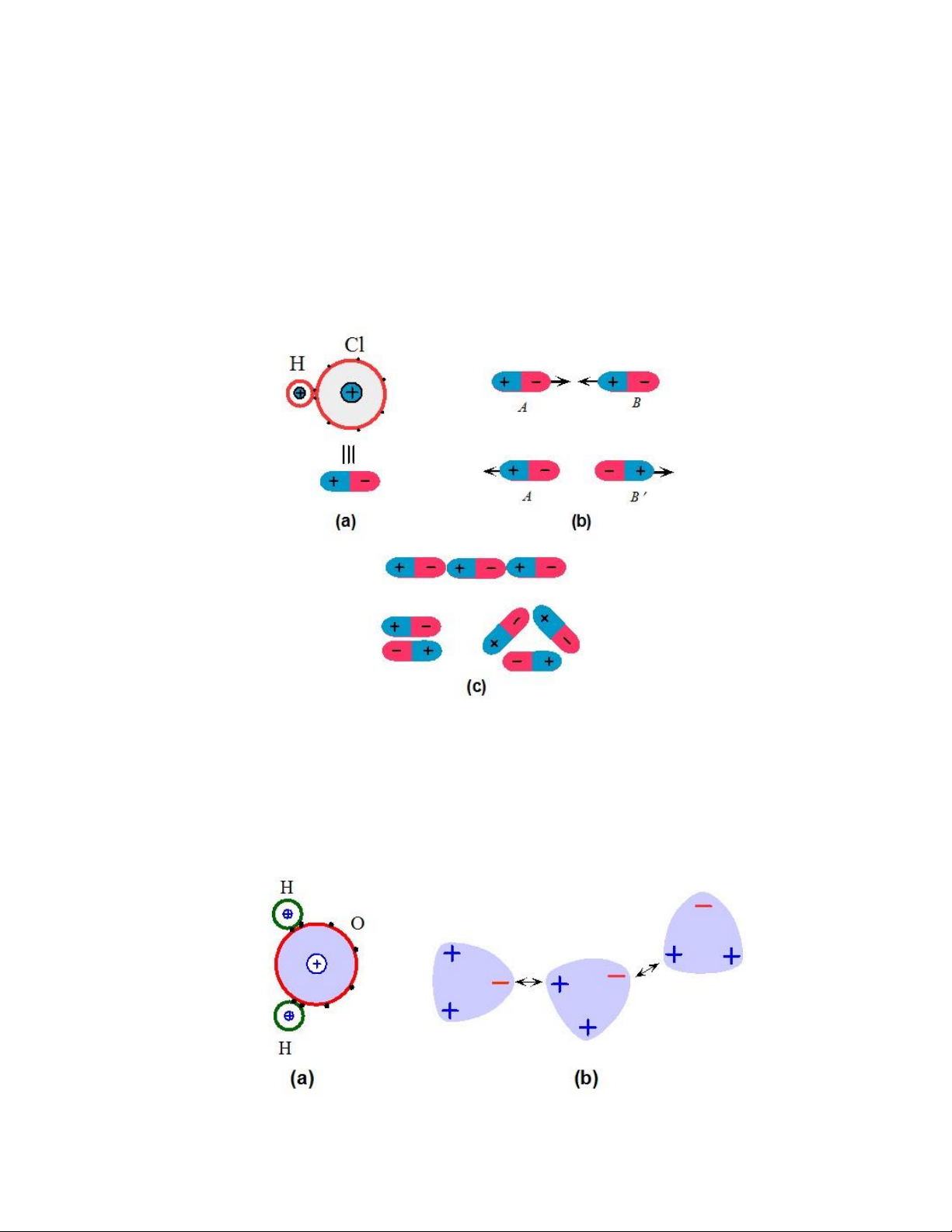
Trong nhiều phân tử, sự phân bố của iện tích dương và âm không trùng nhau.
Ví dụ như ối với phân tử HCl ở Hình 1.10a, các iện tử tập trung chủ yếu quanh nhân
của Cl nên vùng quanh Cl tập trung nhiều iện tích âm hơn vùng quanh H. Điều này
dẫn ến sự hình thành của moment lưỡng cực iện (electric dipole moment), tương ứng
với các iện tích dương và âm có ộ lớn bằng nhau nằm cách nhau một khoảng. Ví dụ
như ối với phân từ 𝐻+ − 𝐶𝑙− ở Hình 1.10a. Những phân tử như vậy ược gọi là phân
cực (polar), và phụ thuộc vào hướng tương ối giữa chúng, các phân tử này có thể hút
hoặc ẩy các phân tử khác (Hình 1.10b). Hai lưỡng cực có sắp xếp nối uôi sẽ hút lẫn
nhau vì khoảng cách gần nhất giữa các iện tích của lưỡng cực A và B là giữa iện tích
âm của A và iện tích dương của B nên tổng lực là lực hút tĩnh iện. Độ lớn của tổng
lực giữa hai lưỡng cực A và B không phụ thuộc vào khoảng cách 𝑟 theo tỉ lệ 1⁄𝑟2 lOMoARcPSD| 49598967
(mà là 1⁄𝑟4) bởi vì ều có lực hút và ẩy giữa các iện tích của A và các iện tích của B
và tổng lực chỉ là lực hút yếu. Còn nếu các lưỡng cực ược sắp xếp ối ầu thì hai lưỡng
cực sẽ ẩy lẫn nhau. Như vậy, việc sắp xếp các lưỡng cực hợp lý sẽ tạo ra lực hút giữa
chúng và tạo nên liên kết van der Waals (Hình 1.10c). Năng lượng ể sắp xếp các
lưỡng cực sẽ nhỏ hơn tổng năng lượng của các lưỡng cực riêng lẻ, do ó có xu hướng
hình thành liên kết. Liên kết loại này yếu hơn các liên kết chính và ược gọi là liên
kết thứ cấp (secondary bond).
Hình 1.10. Liên kết van der Waals.
Phân tử nước 𝐻2𝑂 cũng phân cực và có moment lưỡng cực (Hình 1.11a). Lực
hút giữa các iện tích dương của phân tử này và iện tích âm của phân tử lân cận tạo
nên liên kết van der Waals giữa các phân tử 𝐻2𝑂 (Hình 1.11b).
Hình 1.11. Liên kết van der Waals giữa các phân tử nước. lOMoARcPSD| 49598967
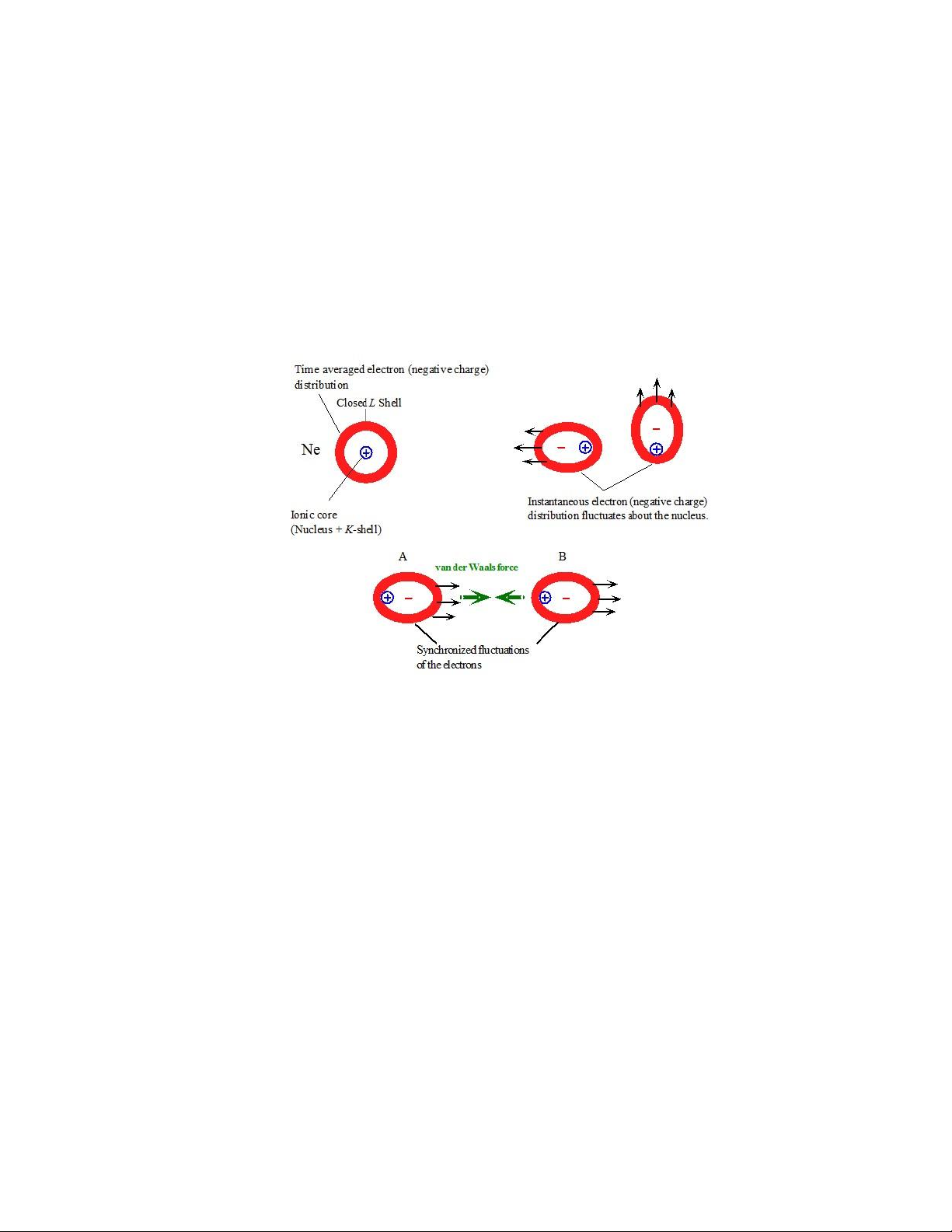
Lực hút van der Waals cũng ược hình thành giữa các nguyên tử trung hòa và
các phân tử không phân cực. Ta xem xét liên kết giữa nguyên tử Ne tại nhiệt ộ thấp.
Mỗi nguyên tử ều có lớp ược lấp ầy iện tử. Tính trung bình thì khối tâm của các iện
tử nằm trong các lớp trùng với tâm của nhân. Tại thời iểm bất kỳ, khối tâm có thể
dịch chuyển khỏi nhân do ảnh hưởng của các loại chuyển ộng khác nhau của iện tử
xung quanh nhân (Hình 1.12). Thực tế, khối tâm của các iện tử dao ộng theo thời
gian xung quanh nhân. Do ó, sự phân bố iện tích của các iện tử không cố ịnh quanh
nhân mà dao ộng bất ối xứng, hình thành nên moment lưỡng cực.
Hình 1.13. Tương tác lưỡng cực cảm ứng - lưỡng cực cảm ứng.
Khi các nguyên tử Ne, A và B, tiến lại gần nhau, phân bố iện tích âm của một
nguyên tử dao ộng rất nhanh sẽ ảnh hưởng lên chuyển ộng của phân bố iện tích âm
của nguyên tử khác. Một cấu hình năng lượng thấp hơn (tức tương tác hút) ược hình
thành khi các dao ộng ược ồng bộ sao cho phân bố iện tích âm của A ược nằm gần
với nhân của B, còn phân bố iện tích âm của B sẽ cách xa phân bố iện tích âm của A
tại thời iểm ó (Hình 1.13). Khi ó, tổng lực sẽ là lực hút giữa hai nguyên tử và làm
giảm năng lượng toàn phần của hệ, dẫn ến tạo liên kết.
Loại liên kết nêu trên sinh ra do sự ồng bộ cảm ứng (induced synchoronization)
trong chuyển ộng của iện tử quanh nhân, và ược gọi là liên kết lưỡng cực cảm ứng-
lưỡng cực cảm ứng. Loại liên kết này yếu hơn so với tương tác giữa các lưỡng cực
vĩnh cửu và nhỏ hơn một bậc so với các liên kết chính.
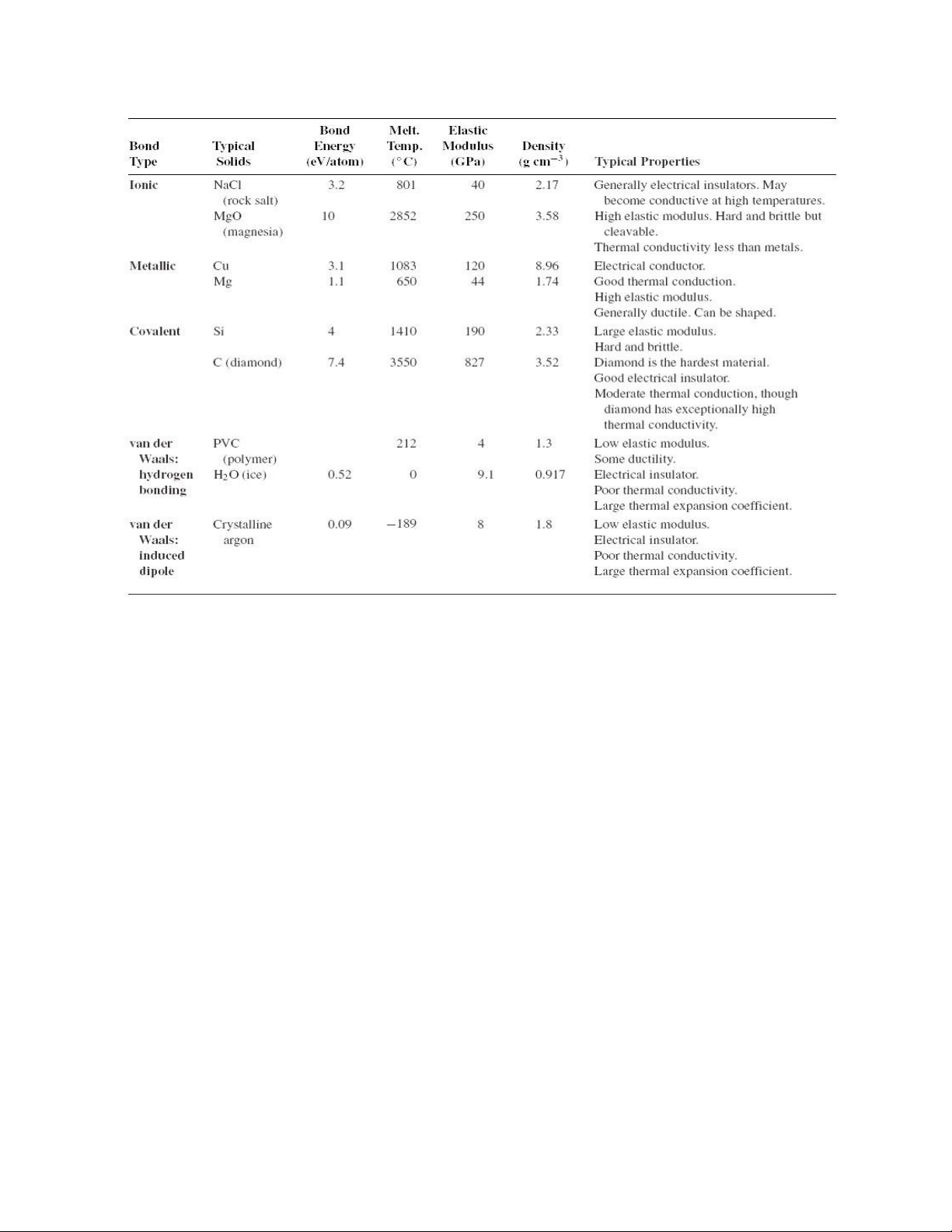
Bảng 1.2. So sánh các loại liên kết. lOMoARcPSD| 49598967
Liên kết van der Waals óng vai trò liên kết các chuỗi Carbon với nhau trong
polyme. Mặc dù liên kết C-C trong chuỗi Carbon là liên kết cộng hóa trị nhưng tương
tác giữa các chuỗi Carbon bắt nguồn từ lực van der Waals. Do ó, liên kết giữa các
chuỗi mang bản chất của lực thứ cấp. Các liên kết này yếu và dễ bị phá vỡ hay kéo giãn.
Bảng 1.2 so sánh năng lượng của 5 loại liên kết trong vật liệu. Bảng 1.2 cũng
liệt kê một số tính chất quan trọng của các vật liệu ể cho thấy mối tương quan với
loại liên kết và năng lượng liên kết. Ví dụ, năng lượng liên kết càng cao thì nhiệt ộ nóng chảy càng lớn.
1.3.6. Liên kết hỗn hợp
Trong nhiều chất rắn, liên kết giữa các nguyên tử thường không chỉ ược hình
thành từ một loại liên kết mà là hỗn hợp của các loại liên kết. Biết rằng, liên kết trong
tinh thể Silicon hoàn toàn là liên kết cộng hóa trị bởi vì các iện tử chia sẻ trong các
liên kết gắn kết như nhau với các ion dương lân cận. Khi có liên kết cộng hóa trị giữa
hai nguyên tử khác nhau, các iện tử ược chia sẻ không như nhau vì các ion lân cận
khác nhau nên có lực hút iện tử không bằng nhau. Khi ó, liên kết sẽ không là liên kết
cộng hóa trị thuần mà mang thêm tính chất của liên kết ion vì các iện tử dùng chung
sẽ tập trung nhiều hơn ở một ion. Liên kết cộng hóa trị mà có tính chất ion ược gọi
là liên kết phân cực (polar bond). Nhiều vật liệu bán dẫn quan trọng như GaAs có lOMoARcPSD| 49598967
liên kết cộng hóa trị phân cực. Trong GaAs, các iện tử trong liên kết cộng hóa trị sẽ
tập trung nhiều hơn quanh ion As so với ion Ga.
Ceramic (gốm) là hợp chất của kim loại và phi kim. Ceramic có tính giòn, nhiệt
ộ nóng chảy cao, và khả năng cách iện. Liên kết trong ceramic có thể là cộng hóa trị,
ion, hoặc là hỗn hợp của hai loại này, trong ó liên kết giữa các nguyên tử bao gồm
các iện tử chia sẻ và các ion dương và âm; các iện tử chia sẻ tập trung nhiều hơn
quanh một nguyên tử, tạo thành ion âm, trong khi nguyên tử còn lại thành ion dương.
Một số ví dụ về vật liệu ceramic như 𝑆𝑖3𝑁4, 𝑀𝑔𝑂, và 𝐴𝑙2𝑂3. Bài tập ví dụ:




