

Preview text:
lOMoAR cPSD| 59416725
CẤU TẠO VÀ HÓA LÝ ĐẶC TRƯNG CỦA DIAZOIC VÀ AZOIC A. Cấu tạo -
Hợp chất Azoic và Diazoic là những hợp chất hữu cơ mà trong
phân tử có nhóm chức azo. Đó là 2 nguyên tử nito liên kết với nhau
bằng liên kết bội( đôi hoặc ba). - - N = N - là nhóm azo -
Ar- N=N-X là hợp chất diazoic -
Ar- N=N-Ar là hợp chất azo Ar: gốc hydrocarbon thơm ( or R) X: Cl-, HSO - - 4 , NO3 , -OH, -OR
B. Hóa Lý đặc trưng I.
Hợp chất Diazoic 1. Cấu tạo
Hợp chất Diazoic thường được biểu diễn dưới 2 dạng công thức:
- Dạng hợp chất Diazoic: Ar-N=N-X ( cộng trị)
- Dạng muối Diazoic: [Ar-N+≡N¿X- (có cực) 2. Danh pháp
-Tên của muối dazoni được gọi theo tên của gốc hydrocarbon rồi thêm tiếp
vĩ diazonid cuối cùng là tên của anion X.
Tên hợp muối diazoni: [R- N+ ≡N]X-
H.C thơm + diazonid + tên anion
[C6H5-N+]Br- Benzendiazoni bromid
[C6H5-N+≡N]Cl- Benzendiazoni clorid
Tên hợp chất diazoic R-N=N-OH H.C + diazo + tên anion
[C6H5-N=N-OH Benzendiazo hydroxyd [C6H5-N=N-
SO3Na Natribenzendiazo sulfonat 3. Tính chất hóa học.
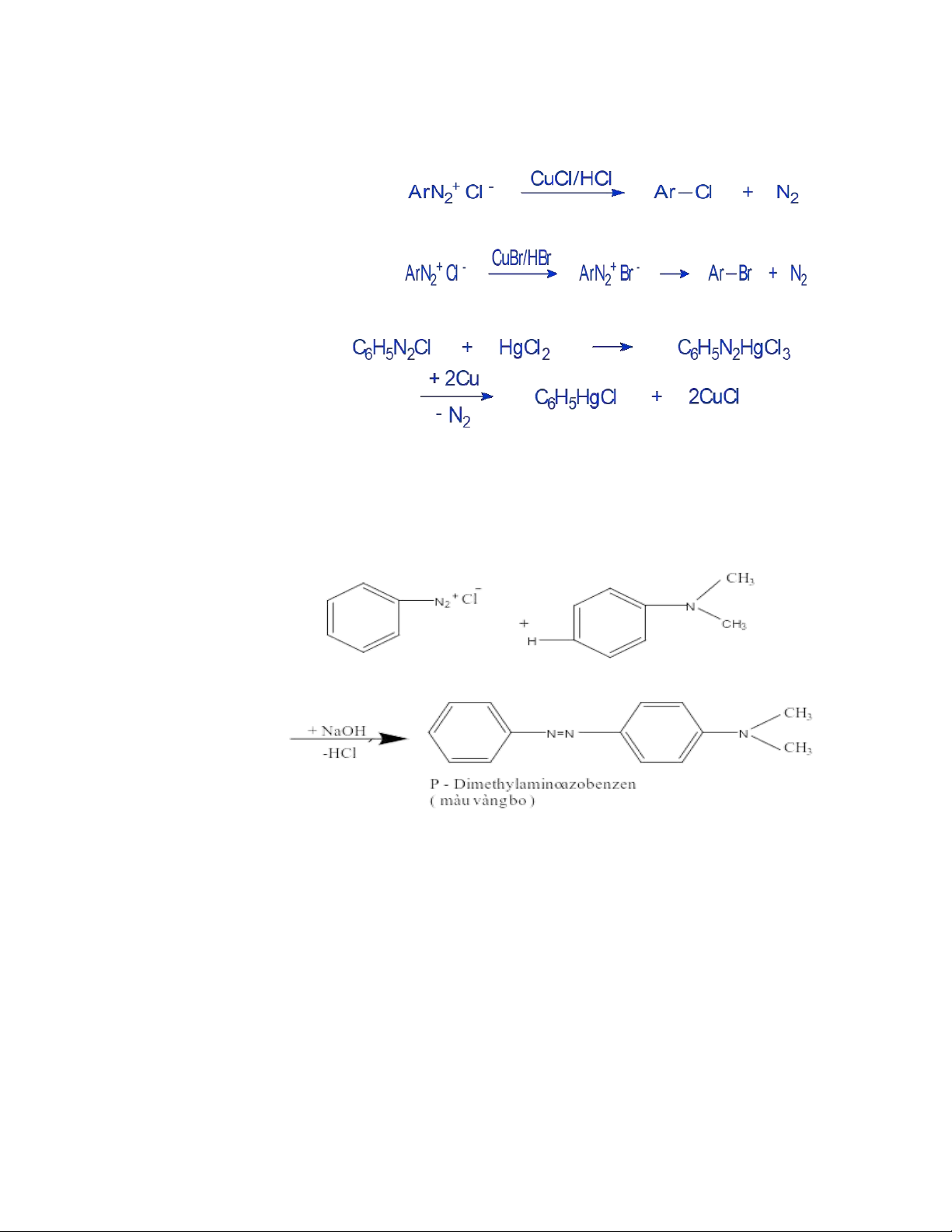
3.1Các phản ứng loại bỏ Nito a. Thế nhóm Diazo = -OH
Ứng dụng: điều chế phenol, không dung muối Diazoni clorid vì có sản phẩm phụ. b. Thế nhóm Diazo = H lOMoAR cPSD| 59416725 c. Thế nhóm Diazo = X
- Thế nhóm diazo = Cl (P/Sandmayer – Gattermann) - Thế nhóm diazo = Br
d. Thế nhóm diazo = kim loại (p/A.N. Nes-me-ianop)
3.2Phản ứng không loại Nito
a. Phản ứng ghép đôi azo tạo phẩm màu.+ Với amin thơm bậc 3
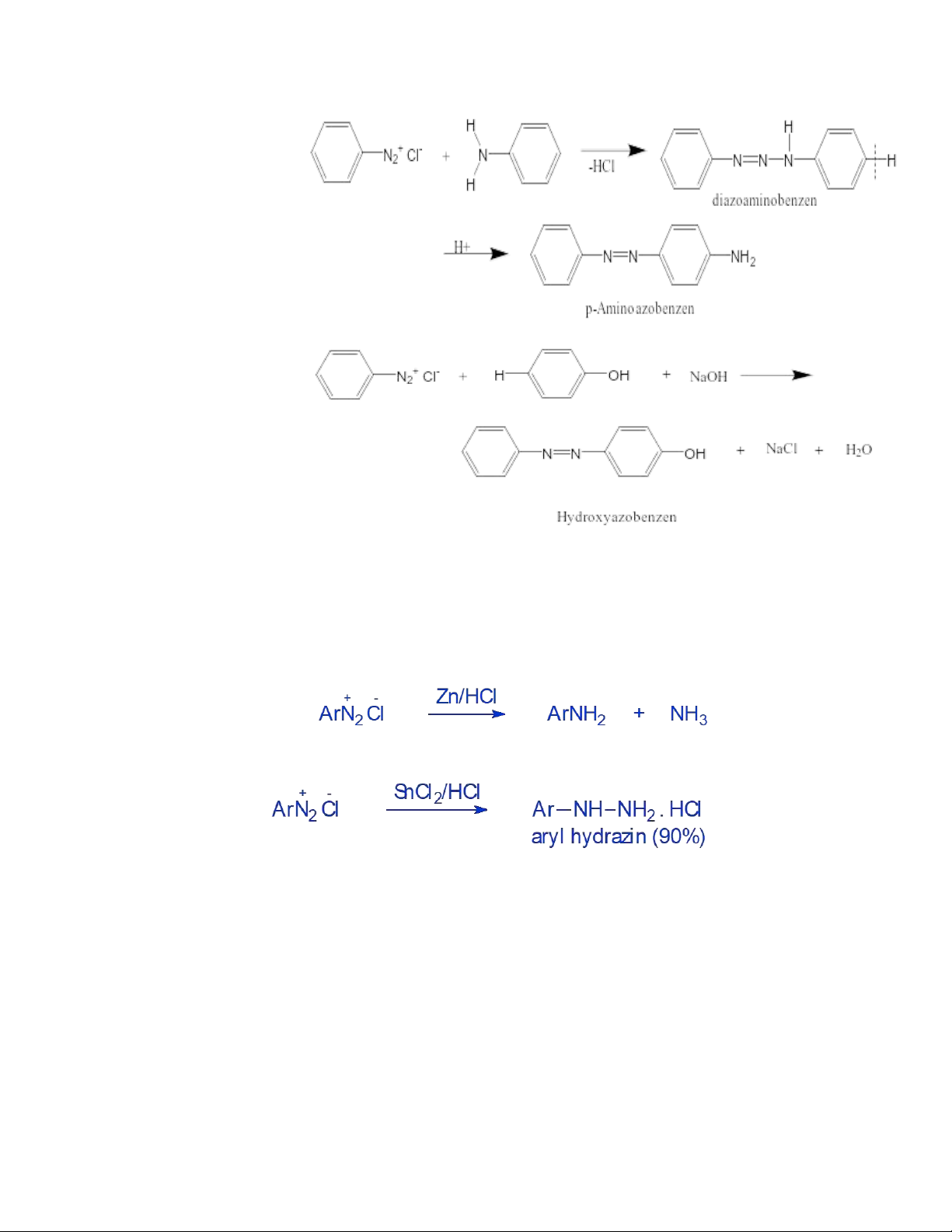
+ Với amin thơm bậc 1,2 tạo diazoamino, chất này không bền/acid chuyển ra aminoazoic. lOMoAR cPSD| 59416725 + Với phenol
P/thường diễn ra ở pH=9-10 để chuyển phenol → phenolat có tính electronphin mạnh hơn. b. Phản ứng khử hóa
+ Với tác nhân khử mạnh Fe/HCl, Zn/HCl có thể khử muối diazonid thành amin.
+ Với tác nhân khử yếu SnCl2/HCl, Na2S có thể tạo thành aryl hydrazin. II.
Hợp chất Azoic 1. Cấu tạo
- Các hợp chất azoic có công thức tổng quát: Ar-N=N-Ar 2. Tính chất hóa học 2.1 Hydro hóa
- Các azoic tác dụng với Zn trong môi trường kiềm sẽ cho hydrazobenzen không màu.
C6H5-N=N-C6H5 + 2[H] → C6H5-NH-NH-C6H5
- Khi phản ứng trên trong môi trường acid sẽ bị khử thành amin. C6H5-N=N-
C6H5 + 4[H] → 2C6H5-NH2 lOMoAR cPSD| 59416725 2.2 Oxy hóa
- Tác nhân oxy hóa nhẹ ( như H2O2 trong OH-) azobezen bị oxy hóa thành azo oxy benzen.
- Các tác nhân oxy hóa mạnh như KMnO4, có thể tạo thành nitro benzen.



