




Preview text:
BÀI: CHIẾT SUẤT, CHỈ SỐ ACID CHỈ SỐ XÀ PHÒNG HÓA TRONG DẦU MỠ
I. Ý nghĩa
- Chỉ số xà phòng hóa là một chỉ tiêu đánh giá chất béo được biểu diễn bằng số miligam KOH dùng để xà phòng hóa hoàn toàn 1 gam chất béo. Chỉ số xà phòng hóa xác định thành phần tổng cộng các acid béo. Chỉ số acid béo lớn chứng tỏ trong chất béo có các acid phân tử khối nhỏ và ngược lại, chỉ số xà phòng hóa bé chứng tỏ có những acid béo phân tử khối lớn hoặc có chứa những chất không xà phòng hóa đc.
III. Nguyên tắc
3.2. Chỉ số acid
- Định nghĩa: Chỉ số acid là số milligram KOH cần thiết để trung hoà lượng acid béo tự do có trong 1 gam chất béo.
- Nguyên tắc: Mẫu được hoà tan trong hỗn hợp dung môi etanol + dietyl eter, và tiến hành chuẩn độ acid béo có trong mẫu bằng dung dịch chuẩn KOH với chỉ thị phenolphthalein
RCOOH + KOH → RCOOK + H2O
3.3. Chỉ số xà phòng hoá
- Định nghĩa: Chỉ số xà phòng hoá là số milligram KOH cần thiết để trung hoà các acid tự do và xà phòng hoá các este chứa trong 1 gam chất béo.
- Nguyên tắc: Đun hoàn lưu mẫu với một lượng thừa chính xác dung dịch chuẩn KOH trong môi trường etanol. Sau đó, tiến hành chuẩn phần KOH thừa bằng dung dịch acid chuẩn HCl, với chỉ thị phenolphthalein.
RCOOH + KOH RCOOK + H2O
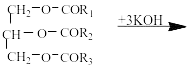
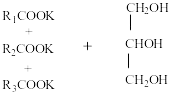
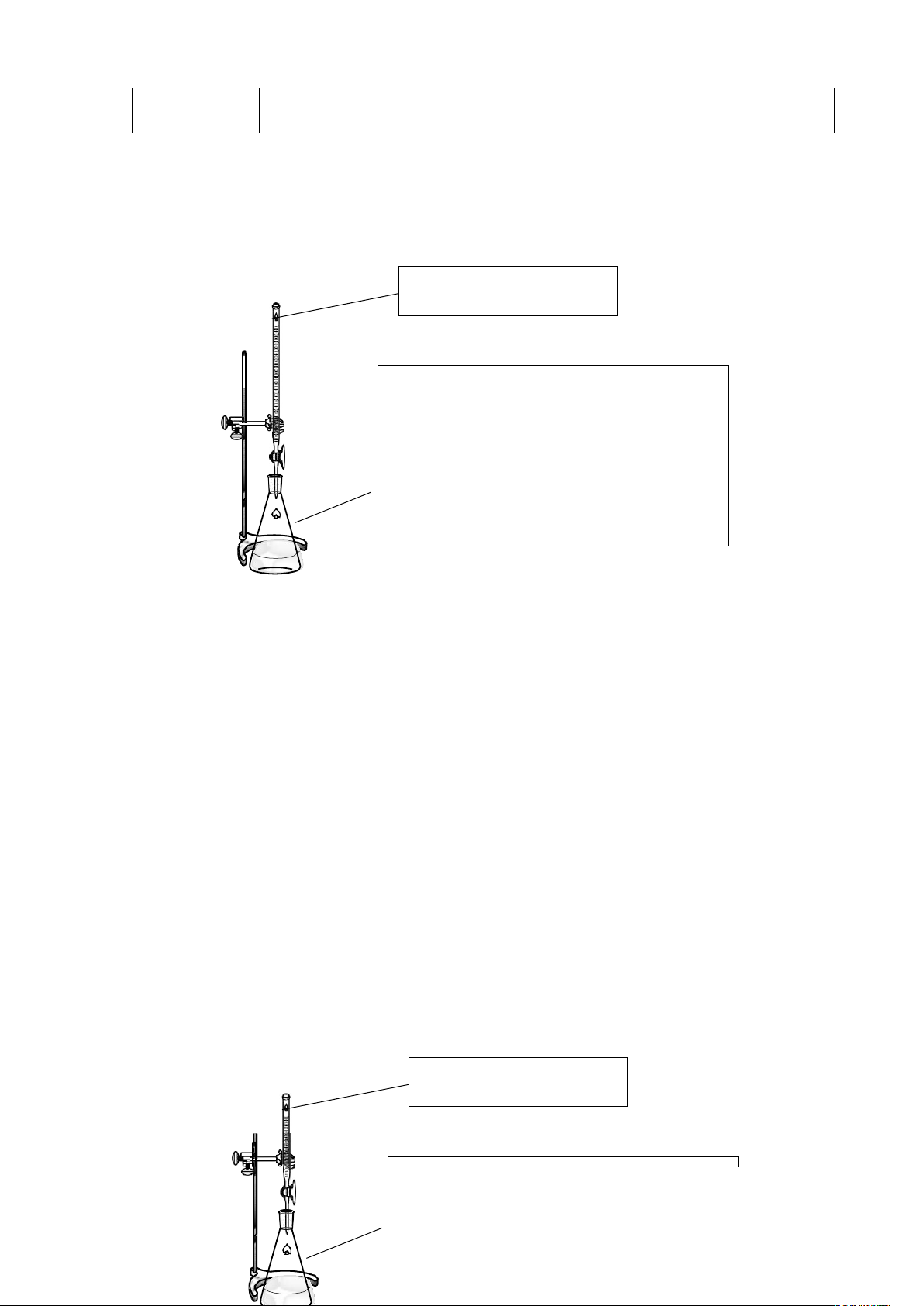
IV. Dụng cụ, thiết bị và hoá chất
Hóa chất
Hóa chất | Cách pha | Vai trò |
Dung dịch KOH 0.5N trong etanol | Đun hoàn lưu 1 lít etanol với 8g KOH và vài viên đá bọt trong một giờ, sau đó chưng cất thu etanol và hòa tan lượng KOH cần thiết trong dung dịch etanol vừa chưng cất. Pha loãng và định mức đến 1 lít | Dung dịch chuẩn |
Dung dịch HCl 0.5N | Pha V (mL) HCl 1N có C% = 36,5%, d = 1,18 g/mL C ×V×Đ×100 C ×V×M V= N = N = 0.5×100×36. C %×d×1000 C %×d×10×z 36×1.18×10 | Chất chuẩn để chuẩn độ lại KOH × |
Dung dịch KOH 0.1N trong etanol | Pha loãng từ KOH 0.5N CV = CV | Trung hòa acid tự do, xà phòng hóa este |
Hỗn hợp dung môi dietyl eter và etanol (1:1) | Dung dịch này cần được trung hòa trước khi sử dụng bằng KOH 0.1N với chỉ thị phenolphtalein | |
Dung dịch Na2B4O7 0.5N | Pha V (mL) Na2B4O7 0.5N từ Na2B4O7.10H2O (Rắn), p = 99%, z = 2 | Chất chuẩn gốc chuẩn lại HCl |
C ×V mL×Đ×100 C ×V mL mcân(g)= N 1000×p = N10×p×z×M=0.5100×10×90 | ||
V. Tiến hành thí nghiệm
5.2. Xác định lại nồng độ của dung dịch HCl 0.5N bằng dung dịch chuẩn gốc Na2B4O7 0.5N

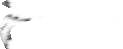








-
Hút chính xác 10 mL Na
2
B
4
O
7
0.5
N
-
10 mL nước cất
-
3 giọt chỉ thị MR
HCl 0.5N
Điểm dừng chuẩn độ: Dung dịch chuyển từ màu vàng sang màu đỏ cam. Ghi nhận
VHCl tiêu tốn. Thực hiện 3 lần. Tính VHCl trung bình. Từ VHCl trung bình ta sẽ tính được nồng độ của HCl.
Phương trình chuẩn độ:
B4O27−¿+5H2O+2 H+¿→4H3BO3¿¿
Bước nhảy chuẩn độ: 6.24 - 4.0 (Độ chính xác 99.9%)
5.3. Xác định lại nồng độ của dung dịch KOH 0.5N bằng dung dịch chuẩn HCl 0.5N










HCl 0.5N
Điểm dừng chuẩn độ: Nhỏ từ từ dung dịch HCl đến khi toàn bộ dung dịch chuyển từ màu hồng sang không màu Thực hiện 3 lần. Tính VHCl trung bình. Từ VHCl trung bình ta sẽ tính được nồng độ của KOH.
Phương trình chuẩn độ: KOH + HCl → KCl + H2O
Bước nhảy chuẩn độ: 4.3 - 9.7
6.4. Xác định chỉ số acid
mgKOH/gmẫu=¿¿
6.5. Xác định chỉ số xà phòng hóa
►Ta có:
Blank M ẫu
mgKOH/g mẫu=CN ×(V ¿¿HCl m−mẫuV HCl )×ĐKOH =0.5×(21.052.0352−8.08)×56=178.4395¿
(mg/g)
lOMoARcPSD|40651217
. Ghi nhận VHCl tiêu tốn. |
VII. Trả lời câu hỏi
-
Hút chính xác 10 mL KOH
7.2. Tại sao thường sử dụng KOH hơn NaOH khi xác định các chỉ số acid và xà phòng hoá?
- KOH có tính bazo mạnh hơn NaOH nên phản ứng xà phòng hóa sử dụng KOH sẽ xảy ranhanh hơn sử dụng NaOH. Thời gian thực nghiệm giảm đáng kể. Do KOH tan tốt trong ethanol hơn NaOH vì liên kết ion trong KOH yếu hơn trong NaOH, nên KOH dễ bị solvate hóa hơn là NaOH.
- Do KOH an toàn hơn NaOH trong mức độ an toàn cháy nổ.
7.3. Để xác định chỉ số este của mẫu dầu mỡ ta cần tiến hành như thế nào?
- Chỉ số este là số mg KOH cần thiết để xà phòng hóa các este chứa trong chất béo.
- Chỉ số este = chỉ số xà phòng hóa - chỉ số acid
7.4. Chứng minh công thức tính chỉ số acid?
lOMoARcPSD|40651217
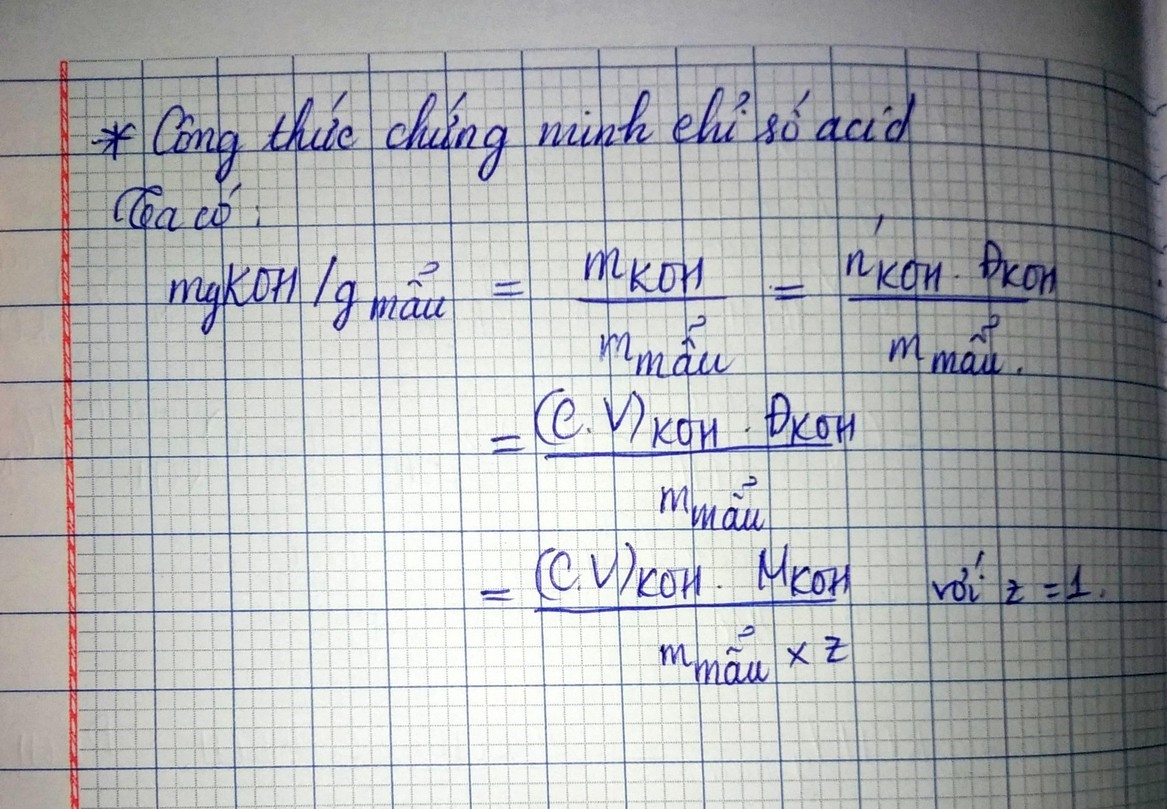
7.4. Chứng minh công thức tính chỉ số acid?

lOMoARcPSD|40651217





