






Preview text:
HẤP PHỤ - HÓA KEO
Chương I. CÁC HIỆN TƯỢNG BỀ MẶT
I. Lớp phân tử bề mặt 1. Sức căng bề mặt
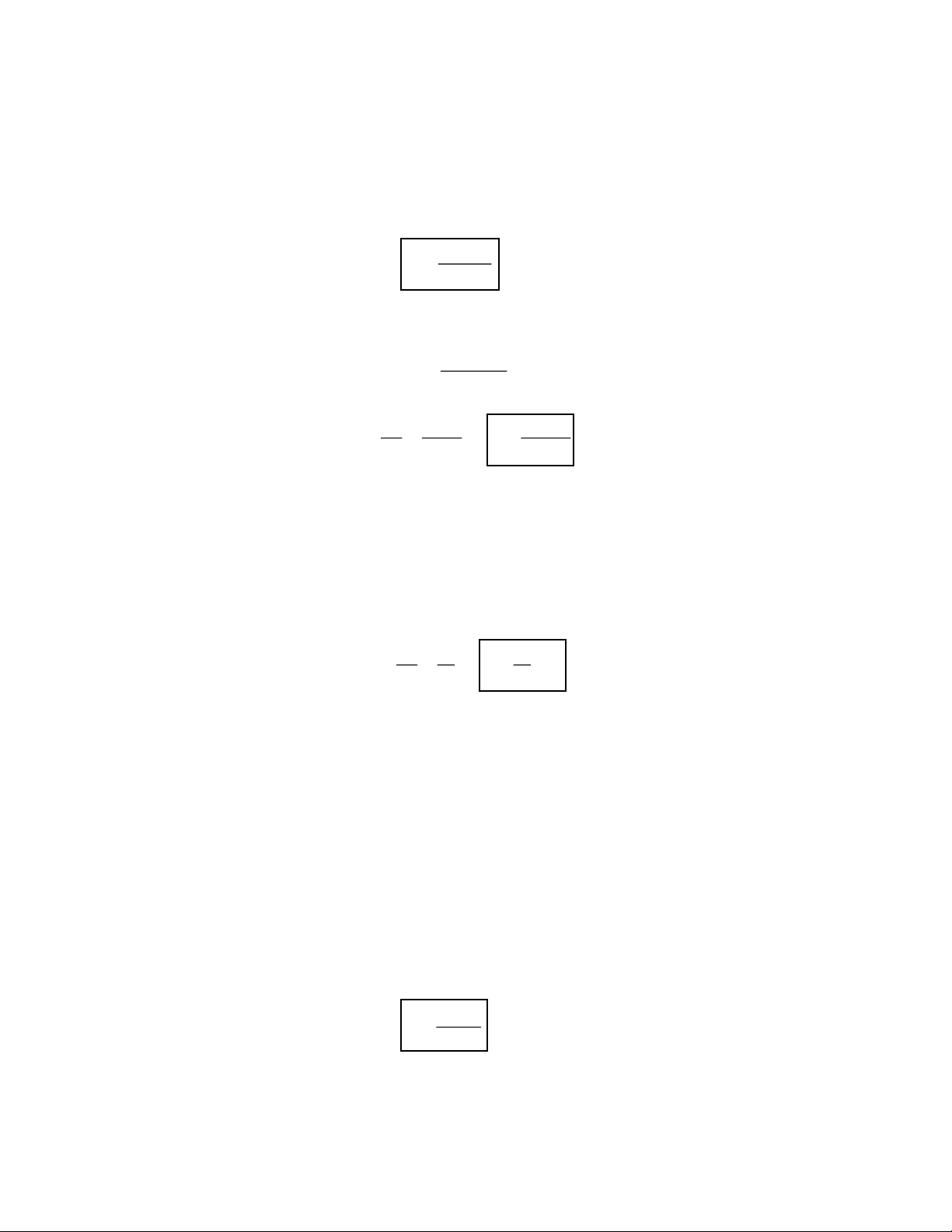
Lớp bề mặt tồn tại một năng lượng dư, năng lượng dư ấy chính là thế nhiệt động đẳng nhiệt
đẳng áp kí hiệu là Gs, toàn bộ bề mặt có 1 năng lượng tự do bề mặt và tỉ lệ thuận với diện tích bề mặt S. G = .S s
→ toàn bộ bề mặt gây ra một sức nén, muốn cho phân tử trong pha lỏng lên trên bề mặt ta cần tiêu
tốn để thắng lực kéo vào một đơn vị công A chính bằng Gs. Giả sử có bề mặt S =
1 thế đẳng áp đẳng nhiệt là Gs1: G
.S , nếu bề mặt là S 1 s 1 2 thì : G = .S s 2 2 G A G
= G − G = (S − S ) hay G . s S − = → = = s s 2 1 s 2 1 s S S
Định nghĩa: Sức căng bề mặt là công cần thiết để tạo ra một đơn vị bề mặt.
Như vậy σ chính là thế đẳng nhiệt đẳng áp trong một đơn vị diện tích bề mặt hay chính là
năng lượng tự do bền mặt ứng với một đơn vị bề mặt
Thứ nguyên (đơn vị): [σ] dyn/cm hoặc N/m hoặc J/m2 hoặc erg/cm2.
Mối liên hệ giữa các đơn vị: 1 J = 107 erg 1 N = 105 dyn 1 N/m = 103 (dyn/cm) Nhận xét:
- Giá trị của sức căng bề mặt phụ thuộc vào bản chất 2 pha tiếp xúc, thường hay đo σ
của hai pha lỏng – khí. Sức căng bề mặt của một chất ở T, P xác định là xác định khi
bề mặt tiếp xúc với chất đó là chân không.
- Nếu T tăng thì tương tác giữa các phân tử yếu đi → SCBM giảm.
- Lực tương tác giữa các phân tử càng lớn thì sức bề mặt càng lớn.
- Khi đo sức căng bề mặt σ của hai pha lỏng không tan lẫn: = − − − − 1 L 2 L 1 L K 2 L K
Các quá trình bề mặt tự xảy ra khi G 0 mà G = .S + S . s s
Nếu σ = const thì = 0 → G = S . 0 → S
0 , khi đó quá trình xảy ra sẽ làm s
giảm diện tích bề S.
Nếu S = const thì S = 0 → G =
.S 0 → 0, khi đó quá trình xảy ra sẽ làm s
giảm sức căng bề mặt σ bằng cách hợp thu các chất khác lên bề mặt.
2. Các phương pháp xác định sức căng bề mặt:
a, Phương pháp đếm giọt:
Cho chất lỏng chảy từ từ trong mao quản ra sau đó đếm số giọt P = F = 2.π.σ.r
r: bán kính của mao quản
Sử dụng một dung dịch chuẩn đã biết sức căng bề mặt σo P0 = 2.π.σo.r P = (I-1) P o o
Lấy một thể tích chung là V (m3) cho vào mao quản, đếm số giọt
Gọi n là số giọt của dung dịch cần đo scbm.
no là số giọt của dung dịch chuẩn.
ρ, ρo là tỷ khối của dung dịch cần đo và dung dịch chuẩn (kg/m3) .
n P = V ..g P n → = . o (I-2)
n P = V . .g P n o o o o o Từ (I-1) và (I-2): n ..n = . o o o → = n . n o o o
b. Phương pháp dâng mao quản Khi cân bằng 2
P = F = 2. . .r → . m g = .r . .
h .g = 2. . .r r h g
Sức căng bề mặt của dung dịch cần đo: . . . = (I − 3) 2
r: bán kính của mao quản
r.h . .g
Sức căng bề mặt của dung dịch chuẩn: o o = (I – 4) o 2 . h . . h o = = h . h . o o o o o
c. Phương pháp lớn nhất tạo ra bọt khí P − P = , h h = k. kk he
Bằng phương pháp đo độ chênh lệch chiều cao h của dung dịch cần đô và chiều cao ho
của dung dịch chuẩn đã biết sức căng bề mặt. h h = = . o h h o o o d. Phương pháp tách vòng
Lấy vòng mỏng bằng kim loại sau đó nhúng vào dung dịch cần đo, rồi kéo lên mặt
thoáng. Khi đáy vòng vừa được nâng lên mặt thoáng, nó không bị bứt ngay ra khỏi chất lỏng:
một màng chất lỏng xuất hiện, bám quanh chu vi ngoài và chu vi trong của vòng, có khuynh
hướng kéo vòng vào chất lỏng. Do vòng chất lỏng bị dính ướt hoàn toàn, nên khi kéo lên khỏi
mặt thoáng và có một màng chất lỏng căng giữa đáy vòng và mặt thoáng, thì lực căng f có cùng
phương chiều với trọng lực P của vòng. Giá trị lực F đo được trên lực kế bằng tổng hai lực này: F = P + f f =
R: là bán kính của vòng 4.. .R F − P = , P = mg 4. .R
Nhược điểm: độ chính xác chưa cao.
II. Chất hoạt động bề mặt 1. Định nghĩa:
Khi hòa tan một chất tan vào dung dịch => chất tan đó có ảnh hưởng đến sức căng bề mặt của dung dịch.
• Nếu chất tan làm giảm scbm σ của dung dịch => chất hoạt động bề mặt.
VD: các chất hữu cơ như rượu, axid và các muối của axit hữu cơ.
• Nếu cho chất tan vào làm tăng sức căng bề mặt => chất đó gọi là chất không hoạt động bề mặt.
VD: axit, bazơ hoặc muối vô cơ. Các chất hydrat hóa càng mạnh => không hoạt động bề mặt.
• Nếu hòa tàn vào dung môi không làm thay đổi scbm ( hay scbm của dung dịch xấp xỉ
bằng scbm của dung môi ban đầu)
Đ/n: Chất hoạt động bề mặt là chất khi hòa tan vào dung dịch làm giảm scbm σ của dung dịch.
2. Cấu tạo của các chất hoạt động bề mặt - Cấu tạo gồm 2 phần:
• Phần phân cực: bao gồm các gốc rượu (-OH), các nhóm chức của axit hữu cơ (-COOH),
các nhóm chức muối của axit hữu cơ (-COONa, -COOK, …) hoặc các nhóm thế: -Cl, - SO3H, -NH2, -NHR, -NR2.
• Phần không phân cực: gốc hydrocacbon no.
3. Đặc điểm của các chất hoạt động bề mặt.
• Gốc R thường kị nước và ưa dầu (nó là không phân cực hòa tan tốt dung môi kém phân
cực như dầu, hòa tan kém dung môi phân cực như nước)
• Nhóm phân cực ngược lại ưa nước, kị dầu.
Trong dung dịch có chứa dung môi thường là nước: khi đó gốc R của các chất hoạt động bề mặt
thường dài (mạch carbon dài) => tương tác giữa các gốc R với nhau lớn hơn tương tác giữa R và
dung môi => chất hoạt động bề mặt có xu hướng đẩy lên trên.
Mặt khác tương tác giữa các phân tử dung môi với nhau lớn hơn R => đẩy các chất hoạt động bề
mặt lên trên bề mặt và gốc R thường hướng về môi trường (dung môi) không phân cực.
VD: khi hòa tan acid béo C17H35COOH vào trong nước thì do tương tác giữa các gốc – C17H35
với nhau và các phân tử nước với nhau lớn hơn tương tác giữa các gốc này với nước nên chúng
đẩy nhau, chất hđbm bị đẩy lên trên, phần phân cực (COOH) nằm trong nước, phần hydrocacbon
(C17H35) hướng ra ngoài => tạo thành lớp phân tử bao phủ bề mặt => giảm lực hút => giảm scbm σ.
Chất hoạt động bề mặt thường có σ nhỏ hơn σ dung môi và có độ tan tương đối nhỏ. Lực
tương tác giữa các chất hoạt động bề mặt với nhau nhỏ hơn của dung môi với nhau.
III. Các yếu tố ảnh hưởng đến sức căng bề mặt của dung dịch.
1. Ảnh hưởng của nhiệt độ.
- Khi tăng nhiệt độ => lực tương tác phân tử giảm => giảm σ.
Gọi a là hệ số nhiệt độ d a = − dT
Khi tăng nhiệt độ T và a giảm thì scbm σ giảm. 2 2 T d = −adT
, trong khoảng nhiệt độ nhỏ a = const. 1 1 T
= − a(T −T ) T T 2 1 2 1
2. Ảnh hưởng của chất hoạt động bề mặt.
a, Ảnh hưởng của cấu tạo chất hoạt động bề mặt hay ảnh hưởng của độ dài gốc hydrocarbon (R)
Trau-be tìm ra ảnh hưởng của độ dài gốc R đến sức căng bề mặt.
Khi tăng độ dài lên 1 nhóm -CH2 => hoạt tăng bề mặt tăng 3-3,5 lần. Trong cùng 1 dãy
đồng đẳng của axit béo thì hoạt tính bề mặt tănng từ 3-3,5 lần khi tăng 1 nhóm CH2.
Lưu ý: Quy tắc chỉ đúng cho trường hợp dung môi là nước.
b, Ảnh hưởng của nồng độ chất hoạt động bề mặt – Phương trình Shiscovsky
= − a ln(1+ bC) c 0
σC: sức căng bề mặt của dung dịch có nồng độ chất hoạt động bề mặt C (mol/L)
σ0 : sức căng bề mặt của dung môi nguyên chất ( chưa có chất hoạt động bề mặt).
a, b: hệ số đặc trưng cho bản chất của chất hoạt động bề mặt và dung môi.
Khi C tăng => σC giảm
VD: Xác định sức căng bề mặt của dung dịch rượu butylic C = 1 mol/L biết scbm của dung môi
ở cùng điều kiện là 72,53.10-3 (N/m). Cho a = 14,4.10-3, b = 6,6. (đáp số σC = 43,3.10-3)
IV. Áp suất hơi trên các hạt có kích thước rất nhỏ. Phương trình Kelvin-Thompson
• Bằng thực nghiệm đã thiết lập được phương trình: 2. .V R.T . = . r P P e 0
Trong đó: P0: áp suất hơi bão hòa trên mặt phẳng chất lỏng (r →∞)
P: áp suất hơi bão hòa trên mặt phẳng giọt chất lỏng có bán kính r. M
V: thể tích mol của chất. V = , M là khối lượng, ρ là khối lượng riêng.
σ là sức căng bề mặt của pha lỏng, r: bán kính của giọt chất lỏng.
Nhận xét: Áp suất hơi bão hòa P tỉ lệ nghịch với bán kính giọt lỏng r và nhiệt độ T.
- r càng nhỏ thì P càng lớn (giọt càng nhỏ thì áp suất hơi càng lớn)
Với bề mặt khum lồi (r > 0): Pkhum lồi > P0
Với bề mặt khum lõm (r < 0): Pkhum lõm < P0
Vậy: Pkhum lồi > Pmặt phẳng > Pkhum lõm.
• Xét áp suất hơi trong mao quản của vật xốp tiếp xúc với pha lỏng.
Nếu không thấm ướt => trong mao quản tạo ra mặt khum lồi là Pkhum lồi > Pmp
Nếu mao quản thấm ướt => trong mao quản tạo ra mặt khum lõm Pmp > Pkhum lõm.
V. Sự thấm ướt và ứng dụng.
1. Khái niệm về sự thấm ướt và góc thấm ướt a. Sự thấm ướt
• Nhỏ một giọt chất lỏng lên bề mặt 1 vật rắn thì xảy ra 3 trường hợp sau:
- Giọt chất lỏng loang toàn bộ bề mặt → chất lỏng thấm ướt tốt chất rắn
- Giọt lỏng co thành giọt → chất lỏng không thấm ướt chất rắn.
- Giọt lỏng loang thành hình bán cầu → chất lỏng thấm ướt có giới hạn.
→Thấm ướt là sự bám dính của chất lỏng lên bề mặt rắn.
Nguyên nhân: Do lực tương tác L-L (fL-L), L-R (fL-R)
• Nếu fL-R >> fL-L thì xuất hiện lực kéo giọt lỏng lên bề mặt chất rắn gây ra sự thấm ướt tốt chất rắn.
• Nếu fL-R << fL-L khi đó lực tương tác có xu hướng kéo các phân tử lỏng lại với nhau một
cách tối đa gây hiện tượng không thấm ướt. b. Góc thấm ướt.
Định nghĩa: là góc tạo bởi bề mặt rắn tiếp xúc với giọt chất lỏng và tiếp tuyến của mặt cong giọt
chất lỏng tới điểm tiếp xúc 3 pha rắn lỏng khí. 0 180o
= 0 => chất lỏng thấm ướt hoàn toàn chất rắn.
< 90o => chất lỏng thấm ướt chất rắn
> 90o => chất lỏng không thấm ướt chất rắn.
= 180o => chất lỏng hoàn toàn không thấm ướt chất rắn.
Hoặc dùng giá trị cos
cos 0 => chất lỏng thấm ướt chất rắn.
cos 0 => chất lỏng không thấm ướt chất rắn.
cos càng lớn thì độ thấm ướt của chất lỏng lên chất rắn càng tốt. Nhận xét:
• Những chất lỏng có sức căng bề mặt càng bé thì càng dễ thấm ướt. Vì lực tương tác fL-L càng nhỏ.
• Quá trình thấm ướt chỉ xảy ra khi năng lượng tự do của hệ giảm xuống. Gs giảm càng
nhiều thì thấm ướt càng tốt.
2. Mối quan hệ giữa khả năng thấm ướt và sức căng bề mặt của các chất
Phân tử A chịu tác dụng của 3 lực: σR-K, σL-K, σR-L. F = 0 = cos. + R−K L−K R−L − cos R−K R−L = ( Phương trình Young) L−K Nhận xét:
cos 0 : chất lỏng thấm ướt chất rắn R−K R−L
cos 0 : chất lỏng không thấm ướt chất rắn R−K R−L =
cos = 0 : Giới hạn thấm ướt. R−K R−L
• Muốn tăng khả năng thấm ướt, điều chỉnh sao cho cos 0 ( điều chỉnh R− và L L− ) K
- Giảm R− : giảm sức căng bề mặt của R-L có thể dùng các chất hấp phụ lên bề L mặt rắn – lỏng.
- Giảm L− : chọn các chất có sức căng bề măt nhỏ → khả năng thấm ướt cao. K
3. Ứng dụng của hiện tượng thấm ướt: nhuộm, giặt, công nghiệp tuyển khoáng.
Quặng được nghiền nhỏ trộn với nước tạo thành huyền phù kích thước 10-6 →10-7 (m).
Sau đó thổi khí từ dưới lên tạo ra các bọt. Các hạt quặng thấm ướt kém được các bong bóng khí
dâng lên bề mặt => có thể thu góp trên bề mặt.
Các dạng thấm ướt tốt, tạp chất => lắng xuống tạo thành bùn nhão và tách ra.
• Điều kiện để các hạt quảng nổi:
+ Khối lượng của các hạt nhỏ (tán mịn)
+ Bề mặt quặng phải kị nước tức là lớn hay cos nhỏ.
Cho thêm các chất hoạt động bề mặt để tăng tính kị nước.




