








Preview text:
TRƯỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI
VIỆN KỸ THUẬT HOÁ HỌC BỘ MÔN HOÁ LÝ
GIỚI THIỆU MÔN HỌC Tên học phần: HOÁ LÝ Mã học phần: CH3081
Giảng viên: Nghiêm Thị Thương- BM Hoá lý
Email: thuong.nghiemthi@hust.edu.vn Văn phòng: 422-C1
Mục tiêu học phần
1. Nắm vững khái niệm, điều kiện và các quy tắc cân bằng pha, cân bằng điện ly
2. Áp dụng lý thuyết cân bằng pha, cân bằng điện ly vào các hệ
3. Có khả năng ứng dụng cân bằng pha, cân bằng điện ly trong
công nghệ, tính toán độ dẫn điện và các đại lượng nhiệt động
4. Hiểu bản chất và quy luật của các hiện tượng bề mặt, các hệ
phân tán. Giải thích được các hiện tượng, tính chất này. Giáo trình
1. Đào Văn Lượng (2000). Nhiệt động hóa học. NXB KH-KT.
2. Nguyễn Hữu Phú (2003). Hóa lý và Hóa keo. NXB KH-KT.
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.1 Các khái niệm mở đầu
* Hệ là phần vật chất vĩ mô giới hạn để nghiên cứu, phần còn lại là môi trường
- Hệ cô lập: không trao đổi chất và năng lượng
- Hệ mở: trao đổi chất và trao đổi năng lượng
- Hệ kín: trao đổi năng lượng, không trao đổi chất
- Hệ đoạn nhiệt: không trao đổi nhiệt với MT bên ngoài
* Trạng thái: là tập hợp các thông số trạng thái mô tả tính chất của hệ (T, P, d, m, V…)
* Hàm trạng thái: là hàm của thông số trạng thái
Ví dụ: U (nội năng), H (entanpy), S (entropy)…
* Quá trình: hệ chuyển từ trạng thái này sang trạng thái khác. Môi trường Quá trình thuận nghịch
# quá trình bất thuận nghịch Hệ # quá trình 2 chiều
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.1 Các khái niệm mở đầu * Nhiệt và Công
Nhiệt Q: hình thức truyền năng lượng có liên quan sự thay đổi chuyển động hỗn loạn của các phần tử trong hệ
Công A: hình thức truyền năng lượng có kèm theo chuyển dịch có hướng của một khối
lượng vĩ mô dưới tác dụng của một lực.
Công toàn phần A = công thể tích (công vô ích) + công có ích (A’)
Công thể tích = phần công nhường hoặc nhận khi thay đổi V δA = PdV
Công có ích = phần công chuyển thành các dạng năng lượng có ích (công điện, công bề mặt)
Quy ước dấu: Hệ nhận nhiệt Q>0; hệ toả nhiệt Q<0
Hệ sinh công A>0, hệ nhận công A<0
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.1 Các khái niệm mở đầu
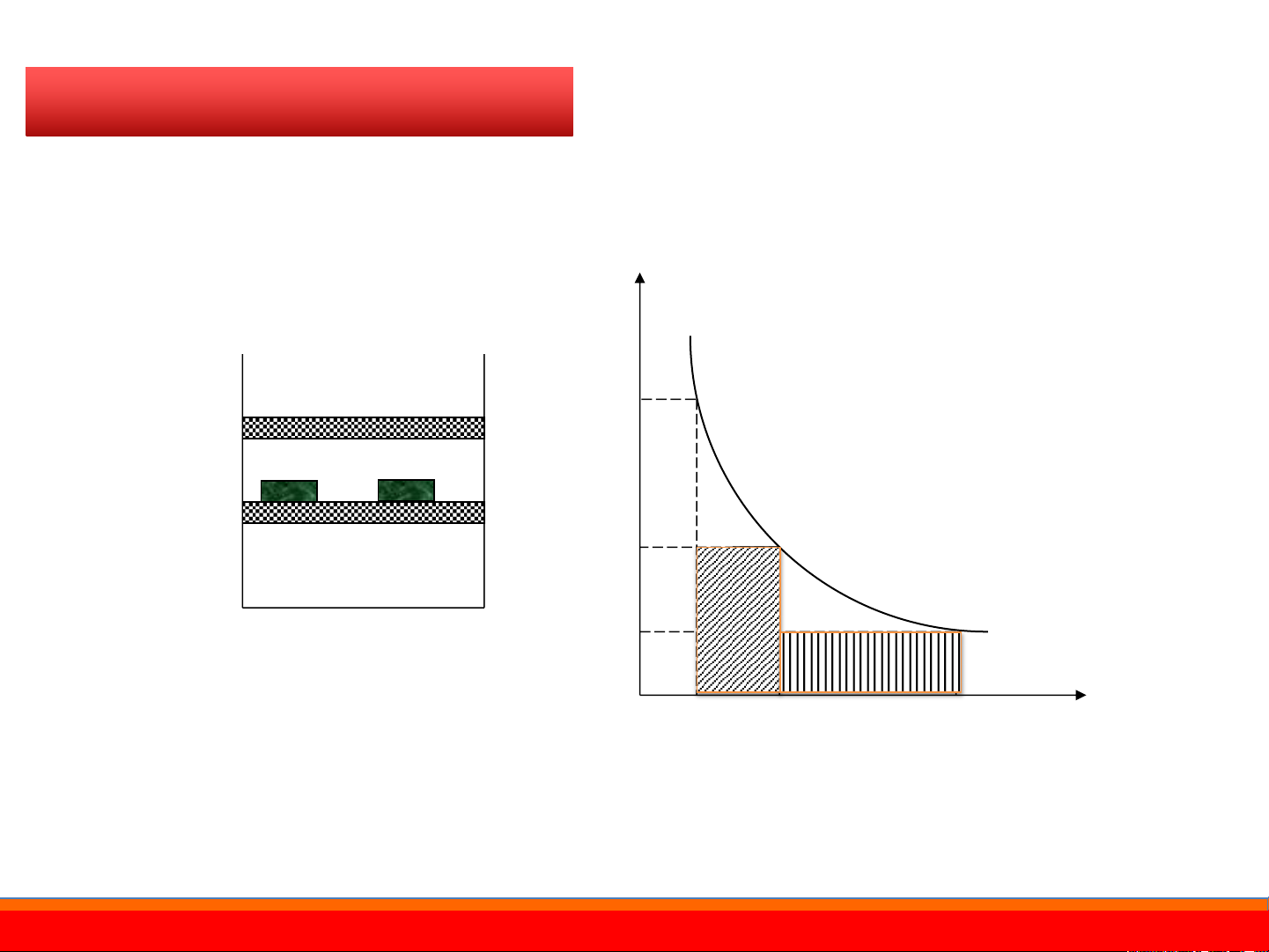
Công sẽ đạt giá trị cực đại khi tiến hành quá trình thuận nghịch P (1) P P 1 2V2 PV=const P1V1 Piston Khí Pi P2 V1 Vi V2 V
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.1 Các khái niệm mở đầu
* Nội năng (U): là tập hợp tất cả các dạng năng lượng bên trong của hệ. Gồm 2 dạng năng lượng
- Động năng chuyển động của nguyên tử, phân tử - Thế năng liên kết
Phân biệt nội năng với các dạng năng lượng bên ngoài của vật (động năng chuyển động và thế năng)
Nội năng của khí LT thì phụ thuộc chủ yếu vào nhiệt độ * Pha: (đã học)
* Nhiệt chuyển pha (ΔH hay λ) là nhiệt toả ra hay thu vào khi hệ chuyển từ pha này sang pha khác.
Nhiệt chuyển pha mol: cal/mol hoặc J/mol
Nhiệt chuyển pha g: cal/g hoặc J/g
Lưu ý: Cách đổi đơn vị J, cal; mol và gam
Ví dụ: 1 (g) thực hiện quá trình nóng chảy ở 0oC, 1 atm có nhiệt chuyển pha ΔHnc=79,7
(cal/g)=79,7x18 = 1434,6 (cal/mol)
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.2 Nguyên lý I
Phát biểu: trong một quá trình bất kỳ, biến thiên nội năng của hệ bằng lượng nhiệt mà hệ
nhận được trừ đi công mà hệ sinh ra trong 1 quá trình bất kỳ Δ Q U = Q − A 1, A1 dU = δQ − δA 1 2 U1 Q U dU = δQ − PdV − δA′ 2, A2 2 dU = δQ − PdV
ΔU = Q − A = Q − A = U − U 1 1 2 2 2 1
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.2 Nguyên lý I
Áp dụng NL I vào các quá trình đơn giản không sinh công có ích (A’=0)
a) Quá trình đẳng tích (V=const hay dV=0) dU = δQ − PdV = δQ ΔU = Q V V V
Nhận xét: Nhiệt mà hệ nhận được trong qt đẳng tích dùng để làm tăng nội năng của hệ
b) Quá trình đẳng áp (P=const) dU = δQ − PdV = δQ − dPV d(U + PV) = δQP P P Đặt H=U+PV: hàm entanpy dH = δQ ΔH = Q P P
c) Quá trình giãn nở đẳng áp của khối khí LT dU = δQ − dPV
Với PV=nRT, suy ra d(PV)=nRdT P dU = δQ − nRdT hay ΔU = Q − nRΔT P P
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.3 Định luật Hess
Nội dung: Nhiệt đẳng áp, đẳng nhiệt hoặc đẳng tích, đẳng nhiệt của một phản ứng hóa học
chỉ phụ thuộc vào các trạng thái đầu và trạng thái cuối mà không phụ thuộc vào các trạng
thái trung gian (nói cách khác không phụ thuộc vào cách tiến hành quá trình). Q1 Q2 Chu trình Hess Q Q = Q + Q 1 2 1 2 = Q + Q + Q 3 4 5 Q3 Q5 Q4
Nhiệt đẳng áp, đẳng nhiệt còn gọi là hiệu ứng nhiệt đẳng áp
Nhiệt đẳng tích, đẳng nhiệt còn gọi là hiệu ứng nhiệt đẳng tích
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.3 Định luật Hess v Mối liên hệ Qp và Qv?
Q = ΔH = Δ(U + PV) = ΔU + ΔPV P
v Nếu quá trình chỉ có chất rắn, chất lỏng ΔPV ≈ 0 → Q = ΔU = Q P V
v Nếu quá trình chỉ có khí Δ(PV) = Δ(nRT) = Δn.RT
Δn là biến thiên số mol khí của phản ứng hoá học
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.3 Định luật Hess
Các hệ quả của định luật Hess: (1) ΔHthuận = ΔHnghịch
(2) ΔHphản ứng = (ΣΔHs)cuối – (ΣΔHs)đầu
(3) ΔHphản ứng = (ΣΔHch)đầu – (ΣΔHch)cuối Chứng minh (2)
ΔHs: Nhiệt sinh của 1 chất là hiệu ứng nhiệt của phản ứng tạo thành 1
mol chất đó từ các đơn chất bền vững nhiệt động Áp suất P=1 atm ΔH0 (CO ) = −94052cal / mol 298,s 2 Nhiệt độ 298K C + O (k) = CO (k) Tại 298K và 1 atm gr 2 2
Chú ý: nhiệt sinh của đơn chất bền vững nhiệt động bằng 0
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.3 Định luật Hess
Các hệ quả của định luật Hess: (1) ΔHthuận = ΔHnghịch
(2) ΔHphản ứng = (ΣΔHs)cuối – (ΣΔHs)đầu
(3) ΔHphản ứng = (ΣΔHch)đầu – (ΣΔHch)cuối Chứng minh (2) Ví dụ: CO (k) + CaO(r) = CaCO (r) 2 3
Ta có: ΔH = ΔH (CaCO ) − ΔH (CaO) − ΔH (CO ) pu s 3 s s 2 Chu trình Hess: ΔHpu CO (k) + CaO(r) → CaCO (r) 2 3 ΔH (CO ) ΔH (CaO) s 2 s ΔH (CaCO ) s 3 C ,O ,Ca gr 2
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.3 Định luật Hess
Các hệ quả của định luật Hess: (1) ΔHthuận = ΔHnghịch
(2) ΔHphản ứng = (ΣΔHs)cuối – (ΣΔHs)đầu
(3) ΔHphản ứng = (ΣΔHch)đầu – (ΣΔHch)cuối Chứng minh (3)
Nhiệt cháy: của 1 chất là hiệu ứng nhiệt của phản ứng đốt cháy 1 mol
chất đó với oxy để tạo thành oxit có hoá trị cao nhất. ΔH0 (C ) = −94052cal / mol 298,ch gr C + O (k) = CO (k) Tại 298K và 1 atm gr 2 2
Chú ý: nhiệt cháy của oxit cao nhất bằng 0 ΔH Các chất tham gia pu Chu trình Hess Chất sản phẩm ∑ΔH (tg) ∑ΔH (sp) ch ch
Các oxit hoá trị cao nhất
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.3 Định luật Hess
Mở rộng áp dụng định luật Hess:
1. Tính nhiệt hoà tan, nhiệt pha loãng
2. Tính nhiệt phản ứng từ năng lượng liên kết
Nhiệt hoà tan là lượng nhiệt toả ra hay thu vào của quá trình hoà tan
- Nhiệt hoà tan tích phân: n có giá trị xác định
- Nhiệt hoà tan vô cùng loãng: n có giá trị rất lớn
- Nhiệt hoà tan vi phân: hoà tan 1 mol chất tan trong một lượng lớn dung dịch
sao cho nồng độ dung dịch không thay đổi
Nhiệt pha loãng: là nhiệt toả ra hay thu vào của quá trình pha loãng dung dịch
từ nồng độ C1 đến nồng độ C2. ΔH Dung dịch C pha loãng 1 Dung dịch C2 ΔHhoàtan Δ 2 Hhoàtan 1 Chất tan
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.4 Ảnh hưởng của nhiệt độ đến hiệu ứng nhiệt
Phản ứng hoá học: A+ B = C+ D ΔHphản ứng = f(T)?
Khái niệm nhiệt dung: nhiệt dung của 1 vật (1 chất) là nhiệt lượng cần thiết
cung cấp cho vật để nâng nhiệt độ của nó lên 1 độ C (hay 1 độ K) C = δQ dT
q Nhiệt dung riêng: J/K.g; cal/K.g
q Nhiệt dung mol: J/K.mol; cal/K.mol
(*) Đối với khí lý tưởng: Cp= Cv + R
q Nhiệt dung đẳng áp: Cp = dH/dT
q Nhiệt dung đẳng tích: Cv = dU/dT
Nhiệt dung là hàm của nhiệt độ
C = a + a T + a T2 + a T−1 + ... p 0 1 2 −1
Trong đó: a0, a1, a2, a-1… là các hằng số thu được từ thực nghiệm.
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.4 Ảnh hưởng của nhiệt độ đến hiệu ứng nhiệt
Phản ứng hoá học: A+ B = C+ D 1 C = dH 1 phản ứng: ΔC = dΔH dΔH = ΔC dT p p dT p dT chất: Xét 3 trường hợp sau: v ΔCp=0 thì ΔH= const T2 v ΔCp=const thì ΔH − ΔH = ΔC ∫ dT (a) T2 T1 p T1 ĐL Kirchhoff T2 v ΔCp=f(T) thì ΔH − ΔH = f(T) ∫ dT (b) T2 T1 T1
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.4 Ảnh hưởng của nhiệt độ đến hiệu ứng nhiệt
Dựa vào định luật Kirchhoff có thể tính đươc:
ü Nhiệt phản ứng ở nhiệt độ bất kỳ nếu biết nhiệt phản ứng ở một nhiệt độ nào đó
ü Tìm sự phụ thuộc của hiệu ứng nhiệt vào nhiệt độ: ΔH=f(T)
Ta chọn T1 là nhiệt độ tại đó đã biết nhiệt phản ứng ΔHT1 còn nhiệt độ
T2 là biến nhiệt độ T. T ΔH − ΔH = f(T) ∫ .dT → ΔH = g(T) T T T 1 T1
Ví dụ 1: Tính ΔHhh của H2O (l) ở 1000C biết ở 250C có nhiệt hoá hơi bằng 9700
cal/mol; Cp(H2O,l)= 18 cal/mol.K; Cp (H2O,h)=7,2+ 2,7.10-3 T (cal/K.mol).
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC
1.4 Ảnh hưởng của nhiệt độ đến hiệu ứng nhiệt Ví dụ 2
Giá trị ΔHo500 của các phản ứng (1): C + CO2 = 2CO và
phản ứng (2): C + H2O(h) = CO + H2 lần lượt là 41501 và 31981 calo.
a. Tính ΔHo500 của phản ứng: (3): CO + H2O(h) = CO2 + H2
b. Tìm sự phụ thuộc của ΔH của phản ứng (3) vào T.
c. Tính giá trị ΔHo1000 của phản ứng (3) Biết: Cp(CO) = 6,60 + 1,2.10-3T cal/(mol.K)
Cp(H2O,h) = 8,22 + 0,15.10-3T + 1,34.10-6T2 cal/(mol.K)
Cp(CO2) = 6,25 + 2,09.10-3T - 0,459.10-6T2 cal/(mol.K) Cp(H2) = 6,62 + 0,81.10-3T cal/(mol.K)
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.5 Nguyên lý II 1. Một số khái niệm
ü Quá trình tự xảy ra và không tự xảy ra
- Quá trình tự xảy ra không cần tác động từ bên ngoài
- Quá trình không tự xảy ra muốn xảy ra phải có tác động từ bên ngoài.
ü Quá trình thuận nghịch và bất thuận nghịch
Có thể thực hiện theo chiều ngược lại 3 đặc điểm của QTTN
Chiều nghịch hệ đi qua đúng và đủ các
trạng thái như chiều thuận
Hoàn thành 1 chu trình thuận nghịch,
không để lại biến đổi gì cho môi trường
Một quá trình tự xảy ra là quá trình bất thuận nghịch
CHƯƠNG 1. NHIỆT ĐỘNG HOÁ HỌC 1.5 Nguyên lý II 1. Một số khái niệm
Một số quá trình coi như gần thuận nghịch
ü Các quá trình tăng hay giảm nhiệt độ vô cùng chậm T ……. 1 T1+dT1 T1+dT1 T1+2dT1 T2
ü Quá trình chuyển pha xảy ra ở điều kiện nhiệt độ và áp suất chuyển pha.
(VD: quá trình nước nguyên chất bay hơi ở 373K, áp suất 1 atm).
Lưu ý: Công hệ sinh ra trong quá trình thuận nghịch là cực đại ATN>ABTN





