











Preview text:
LOGO HÓA LÝ I
TS. Nguyễn Thị Tuyết Mai
Bộ môn Hóa lý, Viện Kỹ thuật Hóa học
Trường Đại học Bách Khoa Hà Nội
Email: mai.nguyenthituyet1@hust.edu.vn 1
Chương 2. CÂN BẰNG PHA HÓA LÝ I
I. Lý thuyết về cân bằng pha ▪ Cân bằng pha
▪ Sự chuyển pha và các loại chuyển pha
II. Giản đồ pha và các quy tắc của giản đồ pha ▪ Giản đồ pha
▪ Các quy tắc giản đồ pha
TS. Nguyễn Thị Tuyết Mai 2 Hóa Lý, ĐHBKHN
I. Lý thuyết về CB pha HÓA LÝ I
CHƯƠNG 2. CÂN BẰNG PHA - Pha:
tập hợp các phần đồng nhất về thành phần hóa học và các tính chất nhiệt động
của một hệ và tách biệt khỏi các phần khác trong hệ bằng 1 bề mặt phân cách mà
qua bề mặt phân cách đó, các tính chất của hệ biến thiên đáng kể. - Số pha: = 1 = 2 = 3
TS. Nguyễn Thị Tuyết Mai 3 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA -
Trạng thái tập hợp: rắn, lỏng, khí, plasma -
Pha ≠ Trạng thái tập hợp VD: CaCO (r) = CaO(r) + CO (k) 3 2 Hệ phenol – nước
He(l) ở điều kiện xác định có thể tồn tại ở 2 pha
S(r) có 2 dạng thù hình: 2 pha
TS. Nguyễn Thị Tuyết Mai 4 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA -
Dạng thù hình: cùng 1 đơn chất nhưng có thể tồn tại ở nhiều dạng khác nhau -
Một chất có thể tồn tại ở nhiều dạng khác nhau: Đa hình -
Trong 1 hệ cân bằng bất kỳ:
▪ Trạng thái khí: Số pha = 1 ▪ Trạng thái lỏng:
• Hệ 1 cấu tử → số pha = 1 (trừ He lỏng có 2 pha)
• Hệ nhiều cấu tử → số pha = số dung dịch lỏng không tan lẫn
▪ Trạng thái rắn: Số pha rắn = số tinh thể khác nhau (số pha của hợp kim = 1)
TS. Nguyễn Thị Tuyết Mai 5 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA -
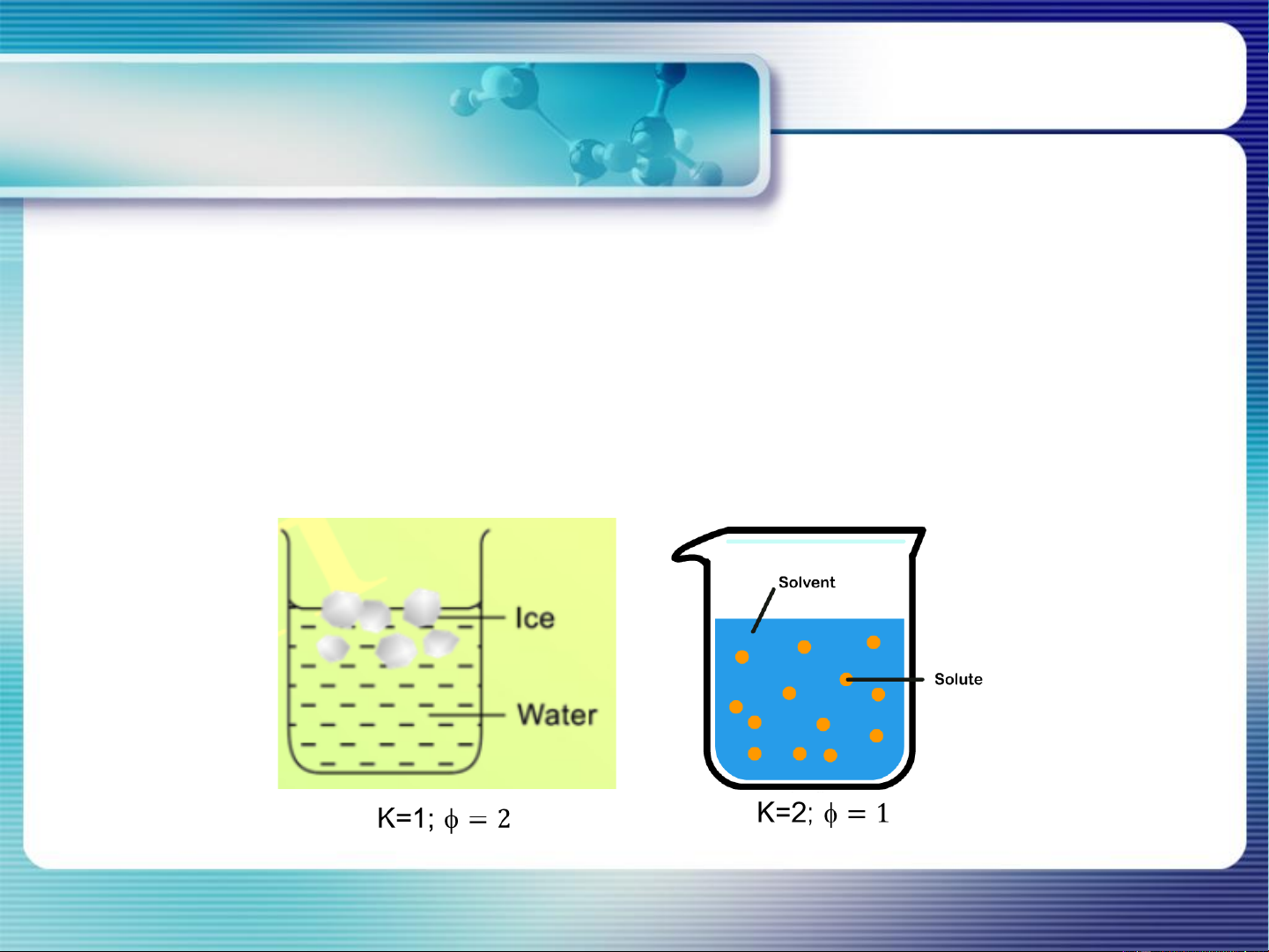
Cấu tử của 1 hệ: là chất có nồng độ biến thiên độc lập với các chất khác
trong hệ (hợp phần mà nồng độ của nó xác định thành phần các pha của hệ ở trạng thái CB) - Số cấu tử: K
TS. Nguyễn Thị Tuyết Mai 6 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA - Ví dụ: Hệ K (max)
Nước (điều kiện thường) Lưu huỳnh Hỗn hợp khí N và O 2 2 Dung dịch NaCl Dung dịch NaCl bão hòa
TS. Nguyễn Thị Tuyết Mai 7 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA - Ví dụ: Hệ K (max)
Nước (điều kiện thường) 1 3 (rắn, lỏng, hơi) Lưu huỳnh 1 4 (rhombic, monoclinic, lỏng, hơi) Hỗn hợp khí N và O 2 1 2 2 Dung dịch NaCl 2 1 Dung dịch NaCl bão hòa 2 2 (lỏng và rắn)
TS. Nguyễn Thị Tuyết Mai 8 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA -
Bậc tự do (C): là số tối thiểu các thông số trạng thái cần thiết đủ để
xác định trạng thái cân bằng của hệ
(Số thông số nhiệt động vĩ mô có thể thay đổi tùy ý mà không làm
thay đổi số pha của hệ)
C = Số thông số trạng thái – số PT liên hệ
C = 0 → Các thông số được giữ không đổi
C = 1 → Chỉ có 1 thông số biến đổi tùy ý; VD: T biến đổi, P = f(T) và x = f(T)
C = 2 → Có 2 thông số được biến đổi tùy ý: T và P
TS. Nguyễn Thị Tuyết Mai 9 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA Quy tắc pha Gibb: C = K - + n C : số bậc tự do K : số cấu tử : số pha
n : số các thông số bên ngoài tác động lên hệ.
T, P → n = 2 C = K - + 2
T hoặc P = const → n = 1 C = K - + 1
T và P = const → n = 0 C = K -
TS. Nguyễn Thị Tuyết Mai 10 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA
Quy tắc pha Gibb: C = K - + 2 Hệ K C 1 khí nguyên chất Hỗn hợp 2 khí
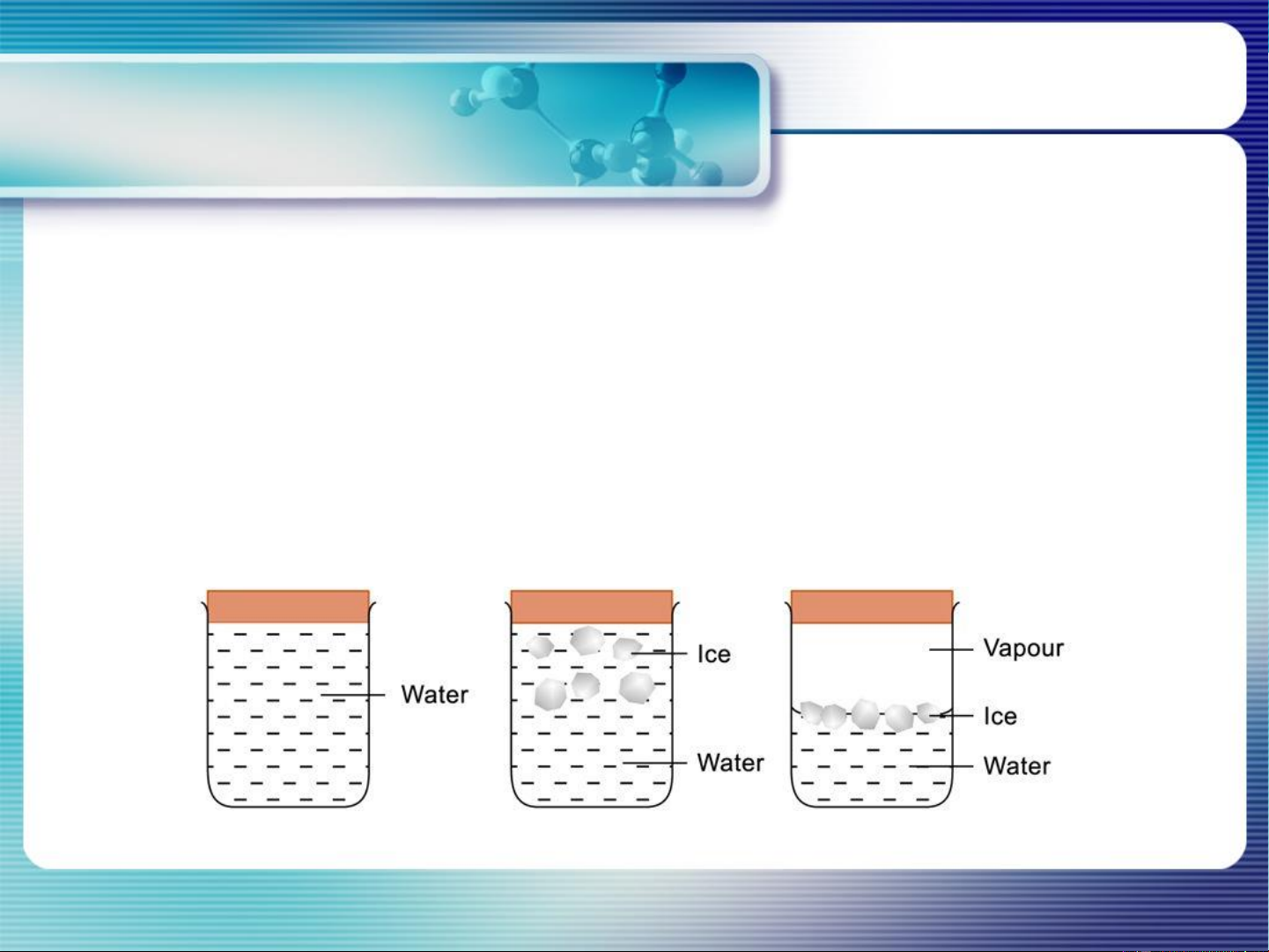
Nước lỏng nước hơi
Hệ nước đá-nước lỏng-hơi nước
TS. Nguyễn Thị Tuyết Mai 11 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA
Quy tắc pha Gibb: C = K - + 2 Hệ K C 1 khí nguyên chất 1 1 2 (T, P) Hỗn hợp 2 khí 2 1 3 (T, P, thành phần)
Nước lỏng nước hơi 1 2 1 (P=f(T))
Hệ nước đá-nước lỏng-hơi nước 1 3 0 (T và P cố định)
TS. Nguyễn Thị Tuyết Mai 12 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
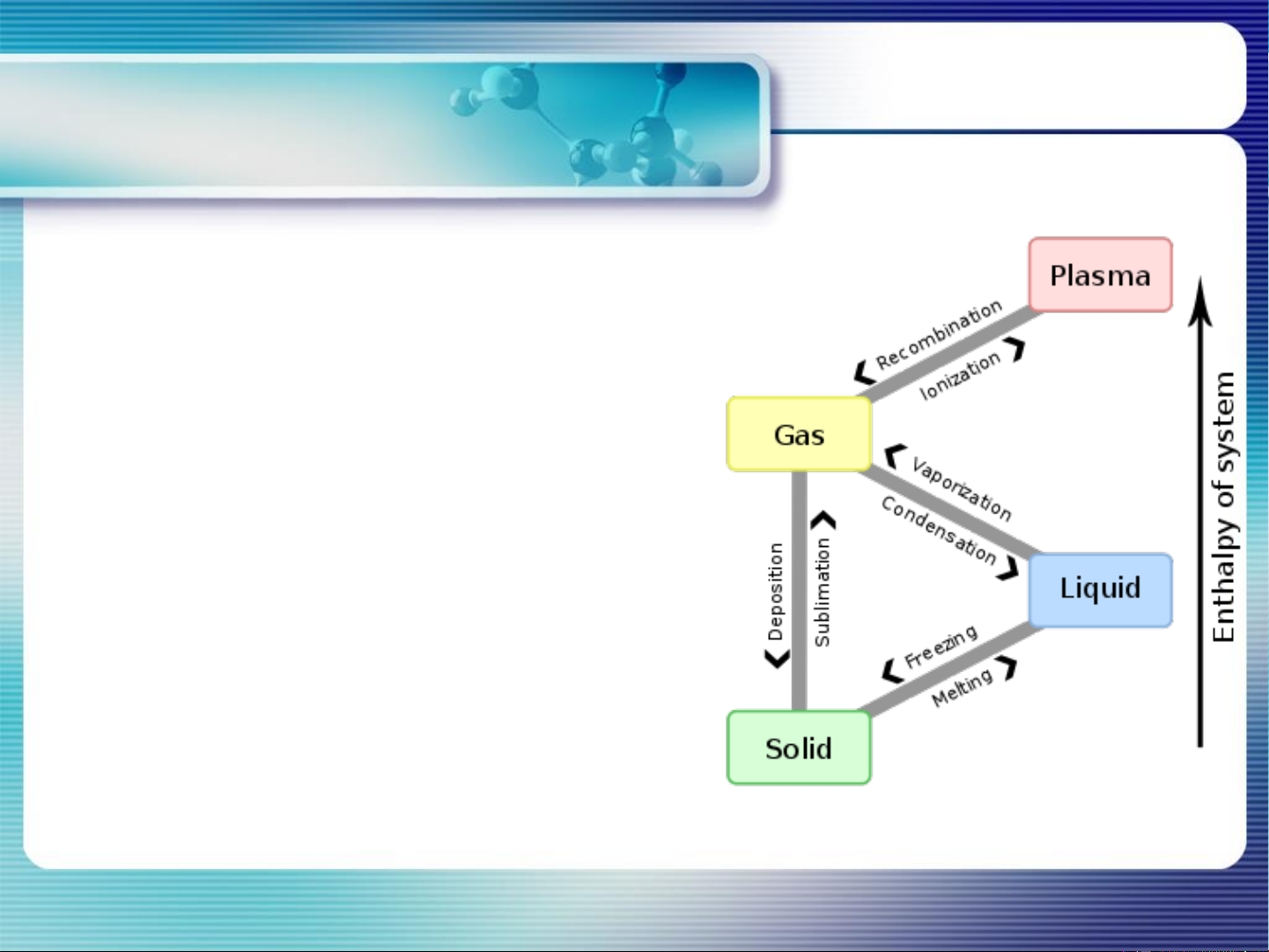
CHƯƠNG 2. CÂN BẰNG PHA - Sự chuyển pha:
• là quá trình vận chuyển chất từ pha này
sang pha khác → biến đổi các tính chất
nhiệt động của hệ (khối lượng riêng,
nhiệt dung, thể tích, hiệu ứng nhiệt…)
• Hiệu ứng nhiệt của quá trình chuyển pha: H =
VD: Nóng chảy, đông đặc, hóa hơi,
ngưng tụ, thăng hoa, ngưng kết, biến đổi dạng thù hình…
TS. Nguyễn Thị Tuyết Mai 13 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA
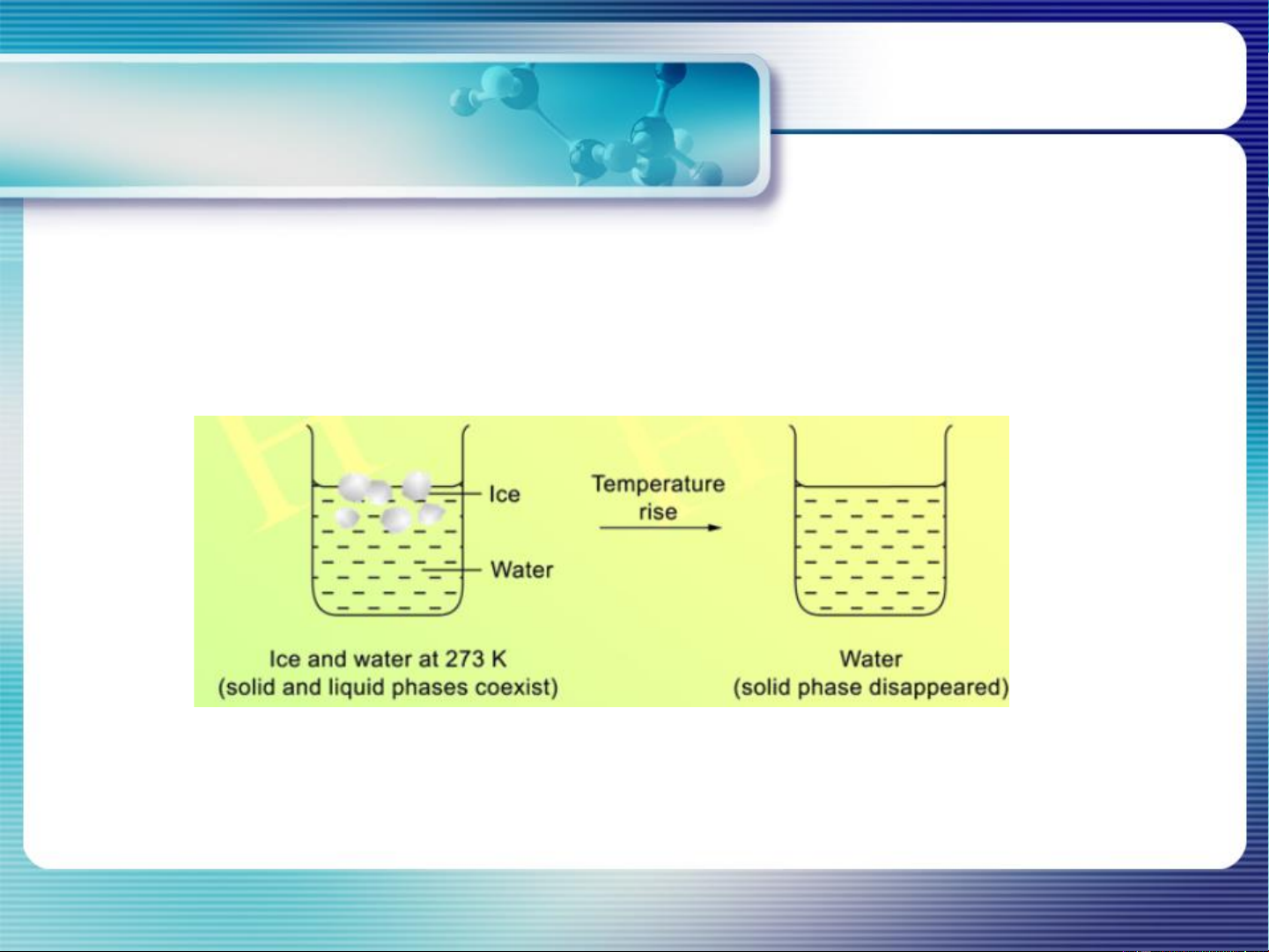
- Các chất sẽ tự di chuyển từ vùng có cao tới vùng có thấp cho tới
khi đạt cân bằng → Cân bằng pha
TS. Nguyễn Thị Tuyết Mai 14 Hóa Lý, ĐHBKHN HÓA LÝ I
I. Lý thuyết về CB pha
CHƯƠNG 2. CÂN BẰNG PHA
Giả thiết trong hệ có pha: , , …; Mỗi pha có k cấu tử
Điều kiện cân bằng của các pha:
Nhiệt độ: T = T = T = …= T
Áp suất (T, V = const): P = P = P = …= P Hóa học:
= = = …= 1 1 1 1
= = = …= 2 2 2 2 …
= = = …= k k k k
TS. Nguyễn Thị Tuyết Mai 15 Hóa Lý, ĐHBKHN BT
Dung dịch bão hòa của Na SO , với lượng chất rắn dư, được 2 4 chứa trong bình kín.
(a) Cho biết số pha và số cấu tử có mặt trong hệ tại TTCB
(b) Tính bậc tự do của hệ? ĐS: =3; K=2; C= 1 16 BT
Nước nguyên chất có thể tồn tại ở 9 pha: khí, lỏng và 7 dạng thù hình của nước đá.
Tính số pha tối đa của nước có thể đồng thời nằm CB với nhau
(gợi ý: dựa vào quy tắc pha Gibbs) 17
II. Giản đồ pha và HÓA LÝ I
các quy tắc của GĐ Pha
CHƯƠNG 2. CÂN BẰNG PHA
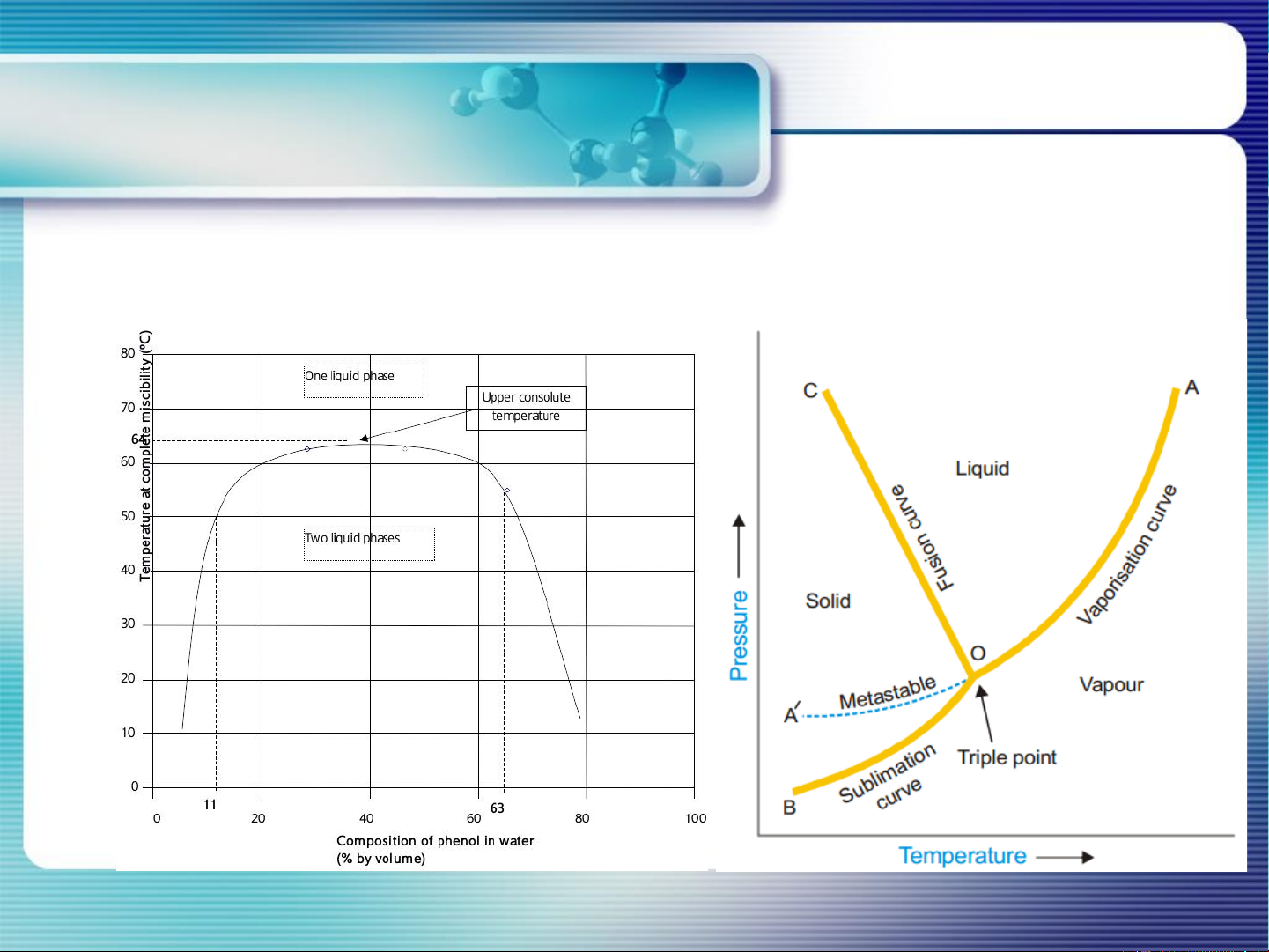
Giản đồ pha: là đồ thị mô tả sự phụ thuộc của các thông số trạng thái
(T, P, V, thành phần…) của 1 hệ nằm trong cân bằng pha. 18
II. Giản đồ pha và HÓA LÝ I
các quy tắc của GĐ Pha
CHƯƠNG 2. CÂN BẰNG PHA A
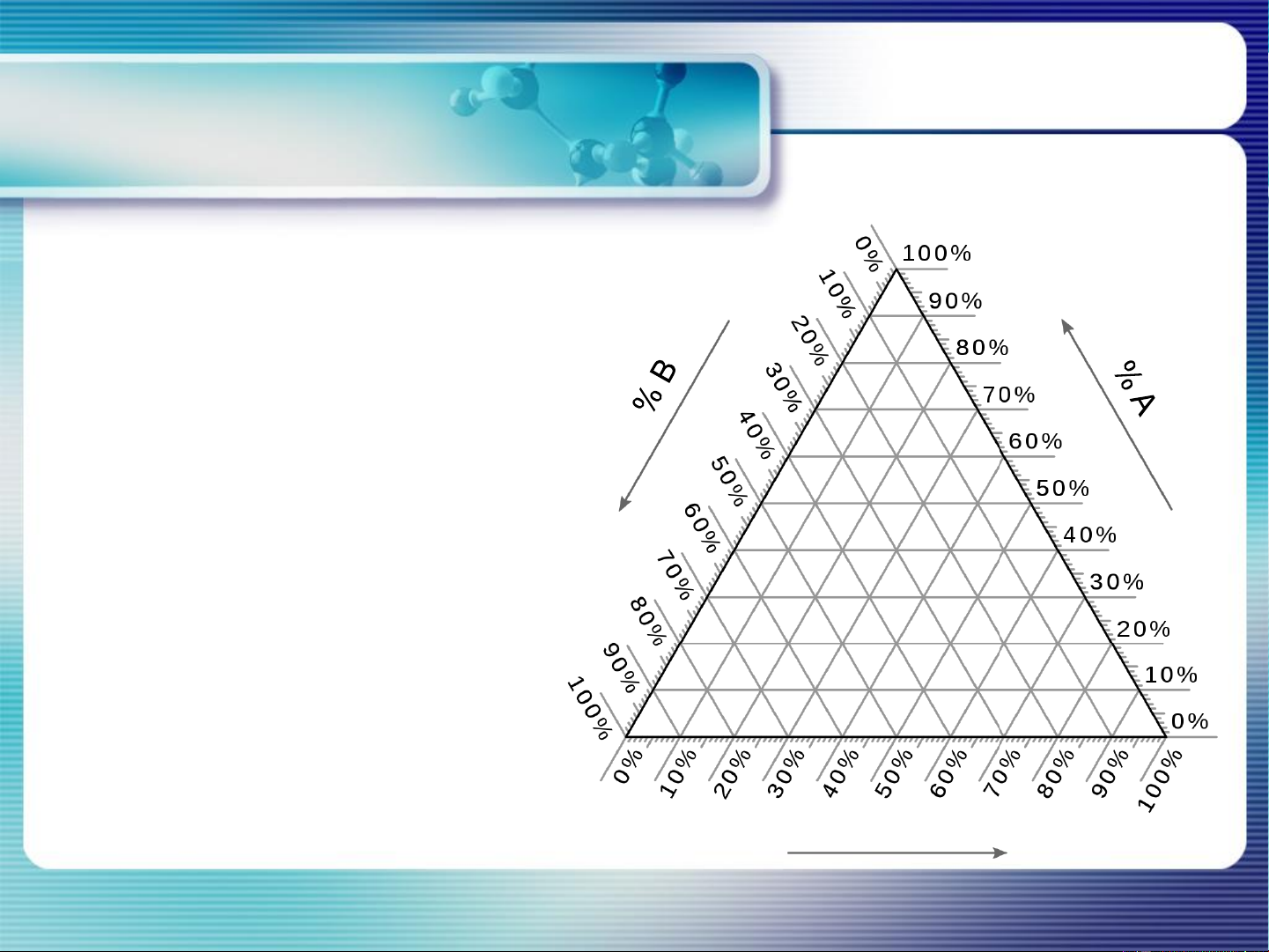
- Giản đồ biểu diễn thành phần hệ 3 cấu tử:
• Biểu diễn trên hình tam giác đều
• 3 đỉnh của tam giác biểu diễn
thành phần của 3 cấu tử A, B, C (100%)
• 3 cạnh của tam giác biểu diễn
thành phần của 3 hệ gồm 2 cấu tử tương ứng
• Mỗi điểm trong tam giác biểu
diễn thành phần hệ 3 cấu tử. B C % C 19 II. Giản đồ pha và
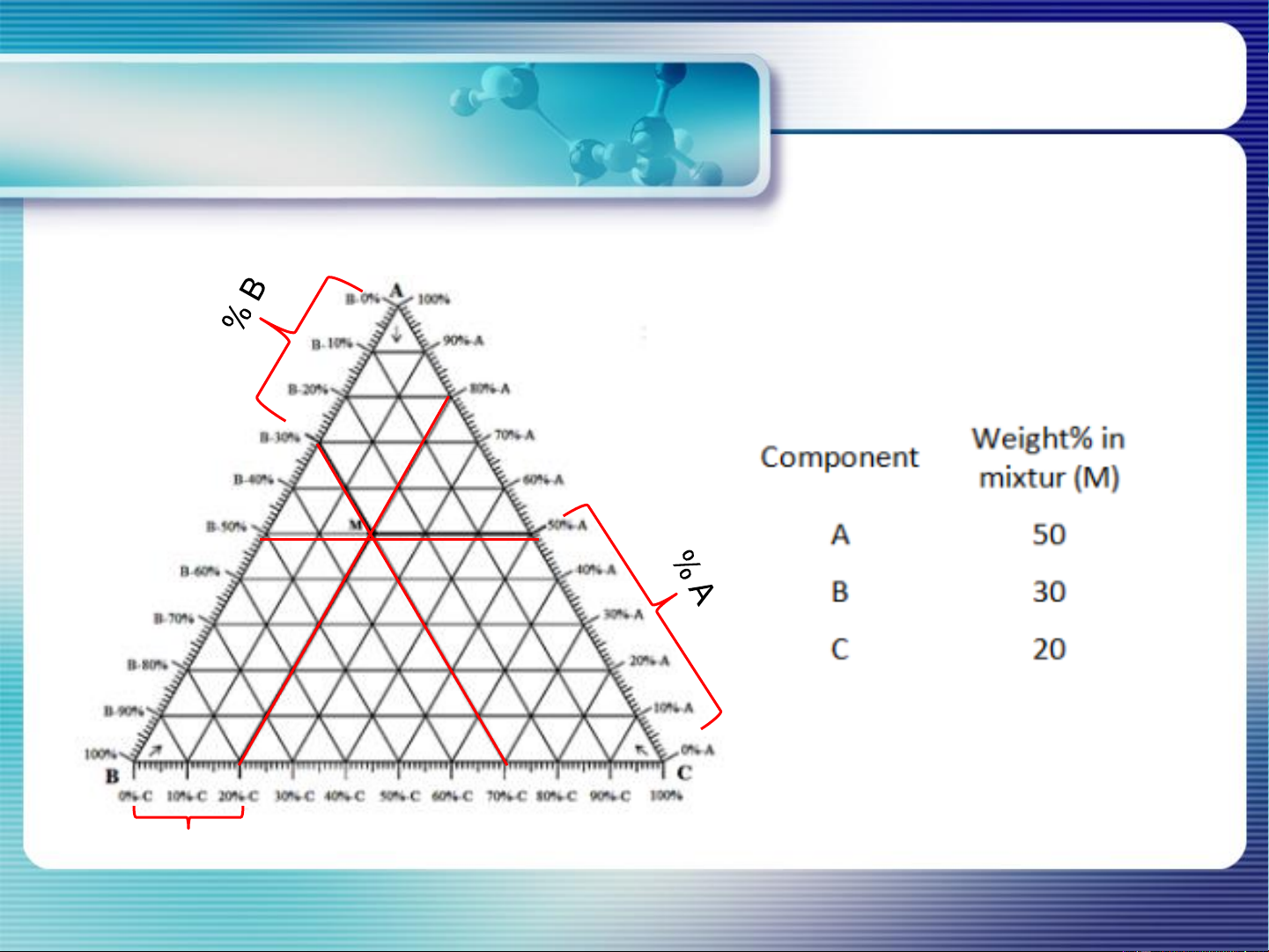
các quy tắc của GĐ Pha
- Xác định thành phần trên giản đồ hệ 3 cấu tử: % C 20




