
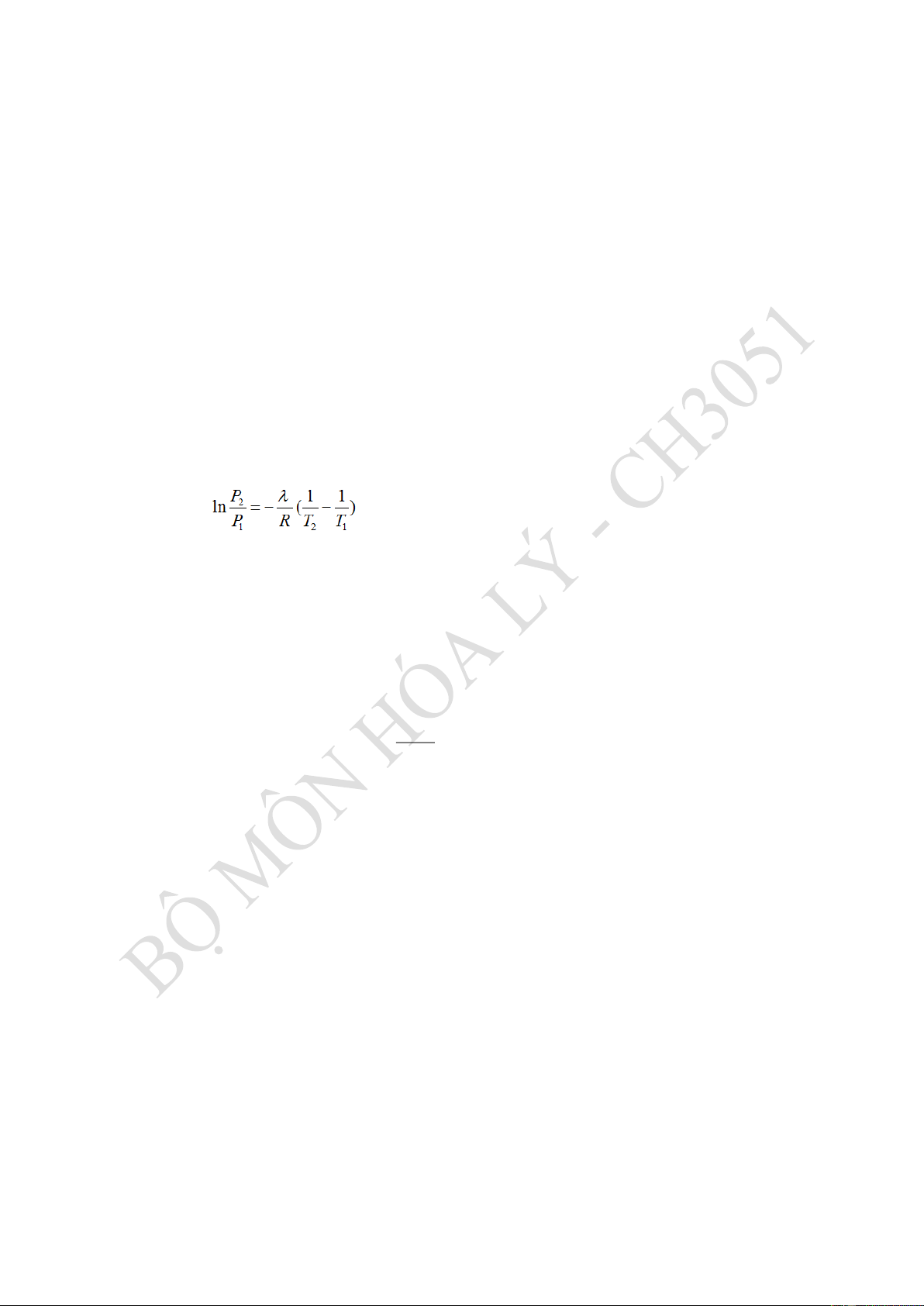
Preview text:
CHƯƠNG II. CÂN BẰNG PHA
CHƯƠNG III. SỰ CHUYỂN PHA TRONG HỆ CHẤT NGUYÊN CHẤT
Câu 1: Các phát biểu sau đúng hay sai?
a) Tại cân bằng, nếu một chất có trong cả hai pha thì nồng độ của nó trong hai pha sẽ bằng nhau.
b) Hai pha tại cân bằng phải có nhiệt độ giống nhau.
c) Phương trình Clapeyron chỉ được áp dụng cho quá trình chuyển pha có sự tham gia của pha hơi.
d) Phương trình Clausius - Clapeyron là 1 phương trình nhiệt động hoàn toàn chính xác.
e) Phương trình Clausius -Clapeyron có thể sử dụng cho trường hợp chuyển pha rắn -lỏng.
f) Phương trình Clapeyron không thể sử dụng cho quá trình chuyển pha lỏng - hơi.
Câu 2: Cho vào bình kín (giữ nhiệt độ áp suất không đổi) một hỗn hợp khí NO và O2 có tỉ lệ số
mol ban đầu là 2:1. Xảy ra phản ứng 2NO + O2 ⇌ 2NO2. Khi đạt cân bằng, trong hệ có số cấu tử là bao nhiêu? ĐS: 1
Câu 3: Một dung dịch KCl bão hòa, để trong bình kín. Khi cân bằng, trong hệ có số cấu tử k, số
pha f và bậc tự do C bằng bao nhiêu ? ĐS: 0
Câu 4: Khối lượng riêng của phenol dạng rắn và dạng lỏng lần lượt là 1,072 và 1,056 g/ml; nhiệt
nóng chảy của phenol là 24,93 cal/g; nhiệt độ kết tinh ở 1 atm là 41oC. Xác định nhiệt độ nóng
chảy của phenol ở 500 atm. (Biết 1 cal = 41,3 ml.atm) ĐS: 43,15 oC
Câu 5: Tính nhiệt nóng chảy của 1 mol diphenylamin nếu 1kg diphenylamin nóng chảy làm tăng
thể tích lên 9,58.10-5 m3 cho biết dT/dP = 2,67.10-7 K.m2/N. Nhiệt độ nóng chảy của
diphenylamin là 540C, khối lượng mol của chất này là 169.
ĐS: nc = 19850,2 J/mol
Câu 6: Nước có áp suất hơi bão hòa ở nhiệt độ 60 oC gấp 2,7 lần áp suất hơi bão hòa ở nhiệt độ
40oC. Biết khối lượng riêng của nước ở trạng thái rắn và lỏng tương ứng là 0,911 và 0,999 g/ml;
hệ số T/P = -0,0081 (K/atm); 1 cal=41,3 (ml.atm). Tính nhiệt hóa hơi, nhiệt nóng chảy và
nhiệt thăng hoa của nước.
ĐS: hh = 10285,3 cal/mol; nc = 1419,96 cal/mol; th = 11705,26 cal/mol
Câu 7: Ở 0oC nhiệt nóng chảy của nước đá là 1434,6 cal/mol. Thể tích riêng của nước đá và
nước lỏng lần lượt là 1,098 và 1,001 ml/g. Xác định hệ số ảnh hưởng của áp suất đến nhiệt độ
nóng chảy của nước đá và tính nhiệt độ nóng chảy của nước ở 4 atm. 1
ĐS: Tnc(4atm) = -0,0243 oC
Câu 8: Khi đun nóng, S(romic) chuyển thành S(đơn tà) kèm theo biến thiên thể tích riêng là V
= 0,0138 ml/g; nhiệt độ chuyển pha của quá trình chuyển đổi giữa 2 dạng thù hình này ở áp suất
1 atm và 10 atm tương ứng là 95,5 oC và 95,8 oC. Tính nhiệt chuyển pha của quá trình chuyển
đổi giữa S(romic) chuyển thành S(đơn tà) (coi nhiệt chuyển pha này là hằng số trong điều kiện
đề bài). Biết khối lượng nguyên tử của S là 32 g/mol; 1 cal = 41,3 ml.atm.
ĐS: cp = 111,2 cal/mol
Câu 9: Axeton có áp suất hơi bão hòa ở các nhiệt độ 306 K và 320 K lần lượt là 346 mmHg và
556 mmHg. Hãy xác định nhiệt hóa hơi và nhiệt độ sôi của axeton. (Coi nhiệt hóa hơi là hằng số
trong điều kiện đề bài).
ĐS: Ts = 326 K = 56 oC Hướng dẫn: Áp dụng PT:
Trong đó: P1=346 mmHg; P2=566 mmHg; T1=306K; T2=320K
Thay vào tính được hh
Để tính Ts ta cho P = 760 mmHg
Câu 10: Áp suất hơi bão hòa của axit xyanhydric HCN phụ thuộc vào nhiệt độ theo phương trình: 1237
lgP(mmHg) = 7,04 − T
Hãy xác định nhiệt độ sôi và nhiệt hóa hơi của chất này ở điều kiện thường.
ĐS: 297,4K; 23,678 (kJ/mol)
Câu 11: Ở áp suất thường, nhiệt độ sôi của nước và cloroform lần lượt là 1000C và 600C, nhiệt
hóa hơi tương ứng là 12,0 và 7,0 kcal/mol. Tính nhiệt độ mà ở đó 2 chất lỏng trên có cùng áp suất ? ĐS: 175,4oC
Câu 12: Ở 46oC, áp suất hơi bão hòa của chất A dạng lỏng là 50mmHg, của chất A dạng rắn là
49,5 mmHg. Ở 45oC, áp suất hơi bão hòa của A lỏng lớn hơn của A rắn là 1 mmHg. Tính nhiệt
nóng chảy, nhiệt thăng hoa và nhiệt độ nóng chảy của chất A; biết rằng nhiệt hóa hơi của nó là 9
Kcal/mol và xem thể tích riêng của dạng A lỏng và A rắn xấp xỉ nhau.
ĐS: nc = 2,32 kcal.mol–1; th = 11,32 kcal.mol–1; Tonc = 46,9oC. 2




