





Preview text:
Chương II: HẤP PHỤ
I. Những khái niệm cơ bản
1. Khái niệm về hấp phụ:
- Định nghĩa: hấp phụ là quá trình tích lũy, thu hút các phân tử, nguyên tử, ion của chất tan vào
lớp bề mặt phân chia pha làm cho nồng độ ở đó lớn hơn trong thể tích mỗi pha, làm sức căng bề mặt giảm.
- Chất hấp phụ: là các chất rắn hoặc lỏng có tác dụng thu hút các chất khác lên bề mặt của nó.
- Chất bị hấp phụ: thường là các chất lỏng hoặc khí được chất hấp phụ thu hút lên bề mặt.
VD: silica gel hấp phụ hơi nước => nó là chất hấp phụ, hơi nước là chất bị hấp phụ.
- Hấp phụ là quá trình tự xảy ra. Giải thích:
G = .S dG = .dS + S.d s s
S = const dG = S.d , do quá trình hấp phụ giảm sức căng bề mặt nên: s
d 0 dG 0 , vì vậy quá trình hấp phụ tự xảy ra s
- Độ hấp phụ: độ hấp phụ là lượng chất bị hấp phụ trên 1 đơn vị bề mặt hay một đơn vị khối lượng chất hấp phụ. g g a = ; a = m S
Trong đó: g: là lượng chất bị hấp phụ (mol hoặc gam, hoặc mol/L)
m: là khối lượng chất hấp phụ (g)
S: là diện tích bề mặt chất hấp phụ (m2).
Đây là đại lượng đặc trưng cho khả năng hấp phụ của chất hấp phụ
- Độ hấp phụ a phụ thuộc vào:
• Bán kinh của chất hấp phụ và chất bị hấp phụ • Nhiệt độ
• Nồng độ và áp suất chất bị hấp phụ
• Môi trường xảy ra hấp phụ.
- Phương trình hấp phụ: là phương trình biểu diễn sự phụ thuộc của độ hấp phụ vào thành phần
chất bị hấp phụ ở điều kiện T = const (Phương trình đẳng nhiệt hấp phụ).
Đo độ hấp phụ a ứng với các thành phần chất bị hấp phụ (C, P) khác nhau rồi thiết lập liên hệ a =
f(C), hoặc a = f(P) ta được phương trình đẳng nhiệt hấp phụ. Biểu diễn phương trình đăng nhiệt
hấp phụ lên đồ thị được Đường dẳng nhiệt hấp phụ.
- Nhiệt hấp phụ: thông thường quá trình hấp phụ có kèm theo tỏa nhiệt. Chứng minh: ở T = const: G = H −T. S H = G +T. S hp hp hp hp G
0 (vì hấp phụ là quá trình tự xảy ra), S
0 (do mức độ hỗn độn của hệ giảm). hp hp T. S 0 H 0 hp hp
Lượng nhiệt tỏa ra có thể vài kJ.mol-1 cũng có thể đến hàng trăm kJ.mol-1.
2. Phân loại hấp phụ a. Phân loại:
- Có 2 loại: hấp phụ vật lý và hóa học.
Hấp phụ vật lý là hấp phụ khi lực tương tác giữa chất hấp phụ và chất bị hấp phụ là tương tác vật lý (lực VanderVaals)
Hấp phụ hóa học là hấp phụ khi lực tương tác giữa chất hấp phụ và chất bị hấp phụ là tương tác
hóa học (lực liên kết hóa học). b. So sánh 2 loại: Hấp phụ vật lý Hấp phụ hóa học
Lực vật lý: lực tương tác giữa Lực hấp phụ các phân tử hấp
phụ Lực tương tác hóa học (vandervaals)
Thường nhỏ khoảng 4 – 8 Thường lớn khoảng 200 Nhiệt hấp phụ kcal/mol kcal/mol Năng lượng hoạt hóa Nhỏ Lớn: 10 – 30 kcal/mol Lớp hấp phụ Nhiều lớp hấp phụ Hấp phụ đơn lớp Có tính thuận nghịch Bất thuận nghịch Tương đối dễ Tương đối khó
Một số đặc trưng khác Ít có tính chọn lọc Có tính chọn lọc cao
Xảy ra ở nhiệt độ thấp
Xảy ra ở nhiệt độ cao
3. Sự ngưng tụ mao quản
- Theo phương trình kelvin thì Pkhum lõm < Pmp của chất lỏng đó
→ Trong những mao quản hẹp, nếu chất lỏng làm thấm ướt tốt thành mao quản → tạo ra khum
lõm thì lúc đó áp suất hơi bão hòa trên khum lõm < mặt phẳng.
→ do vậy mà khi hơi chưa đạt được áp suất hơi bão hòa đối với bề mặt phẳng nhưng đã có thể bão
hòa hoặc quá bão hòa đối với chất lỏng nằm trong mao quản nhỏ, do đó có thể ngưng tụ trong
những ống đó và làm đầy dần ống. Hiện tượng này gọin là sự ngưng tụ mao quản hay sự hấp phụ hơi của chất lỏng.
II. Hấp phụ trên bề mặt lỏng – khí. Phương trình đẳng nhiệt hấp phụ Gibbs
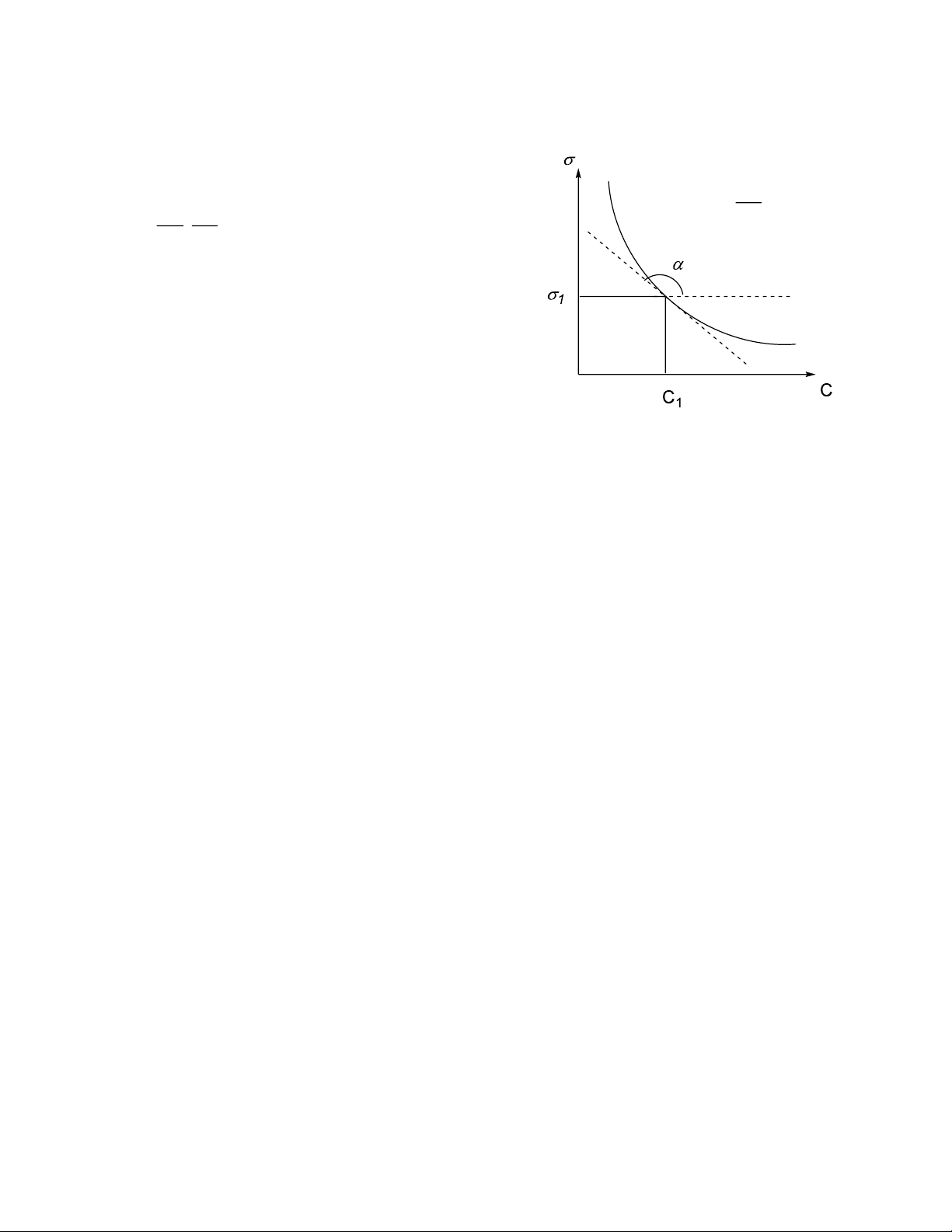
- ở nhiệt độ không đổi: d tan = C d dC a = − .
; phương trình đẳng nhiệt hấp phụ Gibbs. RT dC a: độ hấp phụ C: nồng độ chất tan
σ: sức căng bề mặt của dung dịch.
Vẽ đường đẳng nhiệt sức căng bề mặt. = f (C)
III. Hấp phụ trên bề mặt rắn - khí
1. Bản chất bề mặt và cấu trúc của chất hấp phụ rắn.
- Tất cả các chất rắn đều có khả năng hấp phụ. Nhưng độ hấp phụ chỉ đáng kể khi có độ phân tán
cao, dạng bột hay xốp. Nói cách khác là phải có bề mặt riêng lớn.
- Bề mặt riêng S0: chỉ có giá trị thực đối với chất hấp phụ xốp chứa các mao quản lớn và trung
bình. Đôi với các vi mao quản chỉ có giá trị hình thức.
- Phân biệt vật xốp thành xốp tinh và xốp thô.
• Xốp tinh: những hạt rắn mang sẵn lỗ bên trong khi tồn tại riêng biệt hoặc cả khi ép dính
vào nhau tạo ra vật xốp tinh
• Xốp thô: những hạt không chứa lỗ xốp khi ép dính vào nhau cũng tạo ra lỗ xốp.
VD: Chất xốp tinh: than hoạt tính 300 – 1000 m2/g. Silica gel, 400 – 500 mm2/g Zeolit 700 – 800 mm2/g.
Zeolit: Mx/n[(Al2O3)x(SiO2)y].H2O. Có hệ mao quản nhỏ và đồng nhất, đường kính của cửa sổ cỡ phân tử.
- Bề mặt riêng thường được xác định bằng phương pháp thực nghiệm từ việc xây dựng phương
trình đẳng nhiệt hấp phụ và xác định các thông số.
2. Thuyết hấp phụ đơn phân tử Langmuir.
a. Những luận điểm cơ bản của thuyết Langmuir
- Trên bề mặt chất hấp phụ rắn tồn tại những trung tâm hấp phụ: mỗi trung tâm chỉ hấp phụ 1 phân
tử khí (hoặc chất bị hấp phụ)
- Bề mặt chất rắn chỉ hấp phụ 1 lớp phân tử.
- Bề mặt chất hấp phụ là đồng nhất, các trung tâm hấp phụ có khả năng hấp phụ và nhiệt như nhau.
Khi một trung tâm đã hấp phụ không ảnh hưởng đến khả năng hấp phụ của các trung tâm lân cận khác.
- Các phân tử chất bị hấp phụ không tương tác với nhau. b. Phương trình Langmuir:
S0: tổng diện tích bề mặt
S: phần bề mặt bị chiếm chỗ.
a, am lần lượt là độ hấp phụ và độ hấp phụ cực đại θ: S
phần bề mặt bị hấp phụ; = So
Khp: hằng số cân bằng của quá trình hấp phụ R – K:
Quá trình hấp phụ R – K xảy ra: K + R( . c .
h p) → [K − R] ; Khp []: p (1− ) K . p Có hp K = = hp . p (1− ) 1+ K .p hp
Mặt khác: S tỉ lệ với a, S0 tỉ lệ với am S a = = S a 0 m S a K .p → Phương trình Langmuir: hp = = = S a 1+ K .p 0 m hp V a K . p
Nếu độ hấp phụ đo theo thể tích khí: hp = = = V a 1+ K .p m m hp
Trong đó: V, Vm lần lượt thể tích khí ứng với áp suất p và thể tích khí ứng với bề mặt đã hấp phụ tối đa. Nhận xét:
- Khi có thêm các chất hấp phụ vào thì độ hấp phụ của hệ giảm đi.
Xét ở vùng áp suất thấp: K .p 1, thay vào phương trình Langmuir suy ra: a a .K .p , suy hp m hp
ra độ hấp phụ tỉ lệ thuận với áp suất.
Xét ở vùng áp suất cao: K .p 1 thì a a . Độ hấp phụ đạt tới độ hấp phụ cực đại và không hp m
phụ thuộc vào áp suất p. c. Đồ thị
d. Những hạn chế của thuyết hấp phụ Langmuir:
- Sự hấp phụ có thể xảy ra là đa phân tử (mâu thuẫn với giả thiết)
- Bề mặt chất hấp phụ không đồng nhất về năng lượng, các tâm hấp phụ có nhiệt hấp phụ khác nhau.
- Thực tế có tương tác giữa các chất bị hấp phụ với nhau.
3. Sự hấp phụ trên bề mặt không đồng nhất.
4. Thuyết hấp phụ đa phân tử Bruneur – Emmet – Teller (BET)
IV. Sự hấp phụ trong dung dịch
1. Đặc điểm của sự hấp phụ trong dung dịch.
- Chất khí được hấp phụ tốt hơn chất lỏng.
- Ngoài chất tan bị hấp phụ thì dung môi cũng bị hấp phụ, đó là sự hấp phụ hỗn hợp và hấp phụ
cạnh tranh. Nếu độ hấp phụ của chất tan lớn hơn độ hấp phụ của dung môi thì đó là hấp phụ
dương, ngược lại là hấp phụ âm.
- Độ hấp phụ trong dung dịch được xác định theo công thức sau:
(C − C).V 0 a = m
Trong đó: a là độ hấp phụ (mol/g)
C0, C nồng độ dung dịch trước và khi hấp phụ đạt cân bằng (mol/L)
V: thể tích dung dịch (L)
m: khối lượng chất hấp phụ (g)
- Trong dung dịch sự hấp phụ của chất tan trong dung dịch có thể sử dụng phương trình sau: K . p K .C a = a . hp ; a = a . hp m 1+ K .p m 1+ K .C hp hp
- Trong dung dịch có thể xảy ra hấp phụ phân tử hoặc ion.
• Nếu chất bị hấp hụ không điện ly là hấp phụ phân tử.
• Nếu chất bị hấp phụ là chất điện ly, quá trình hấp phụ đặc biệt hoặc hấp phụ trao đổi ion.




