
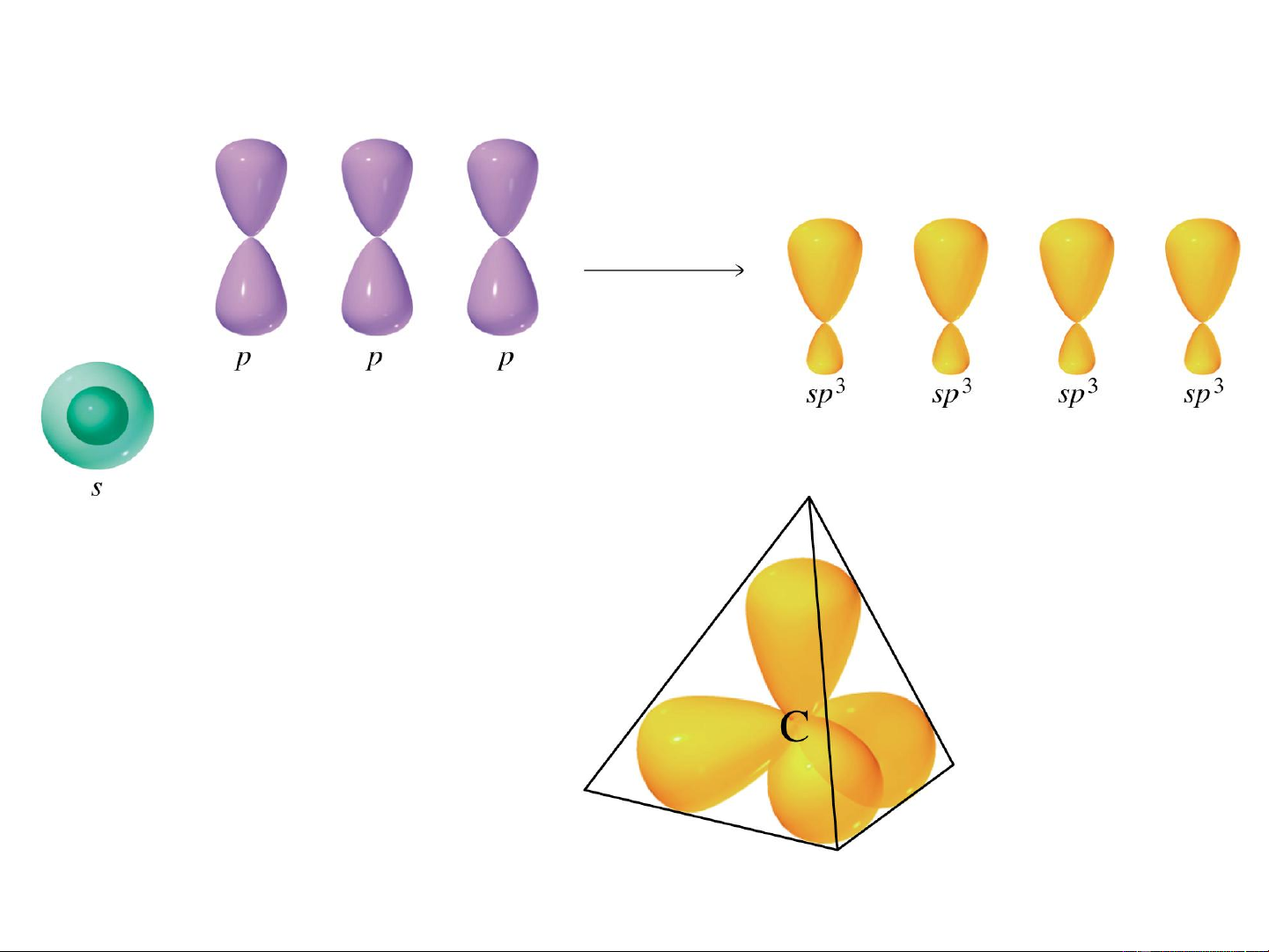
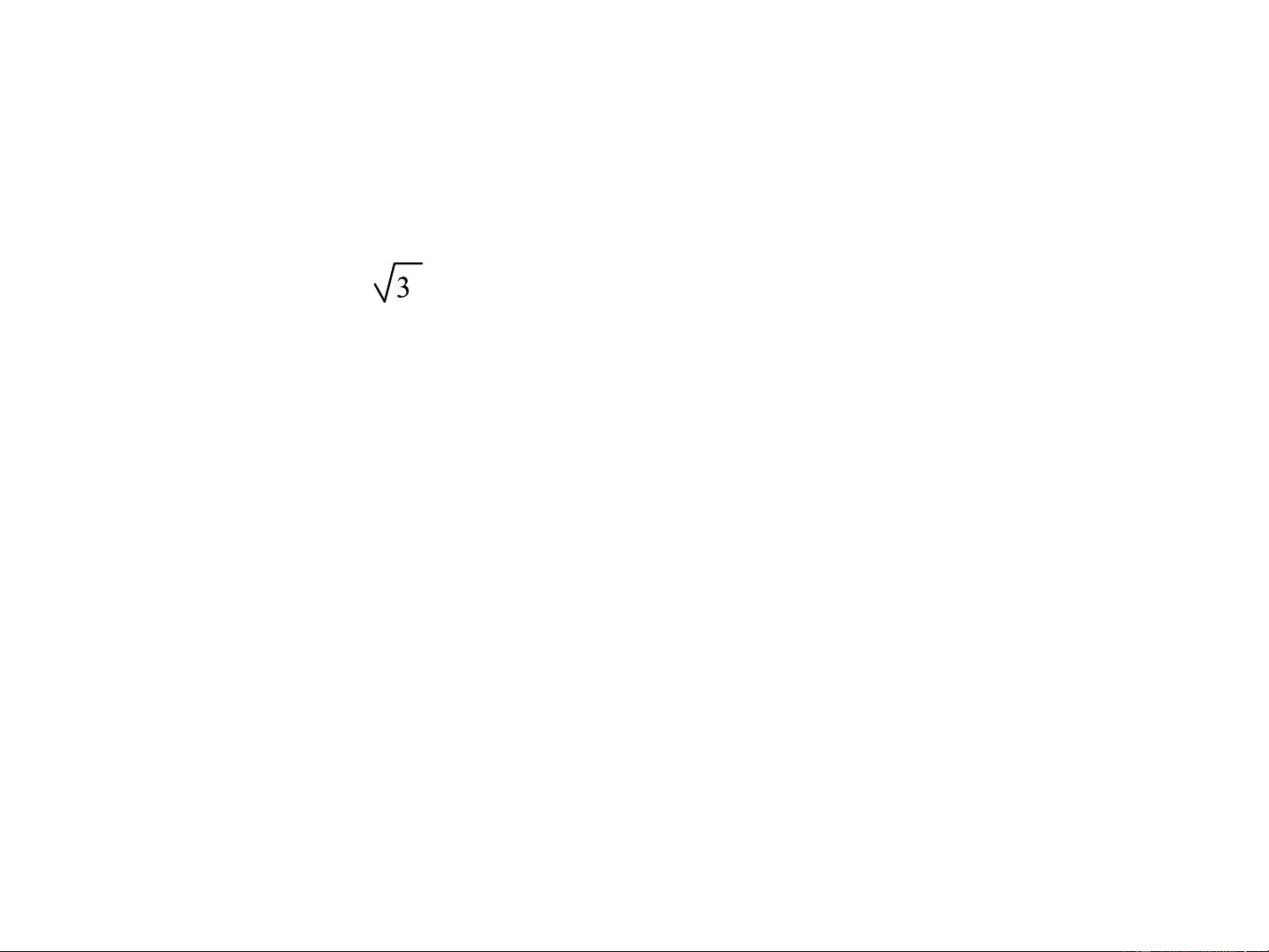
Preview text:
Chương 2
Liên kết hóa học trong Hóa Hữu cơ
2.1. Thuyết xen phủ cực đại
● Liên kết hóa học hình thành theo các
hướng xác định, xen phủ cực đại giữa
các đám mây điện tử liên kết, lk bền
nhất khi sự xen phủ lớn nhất.
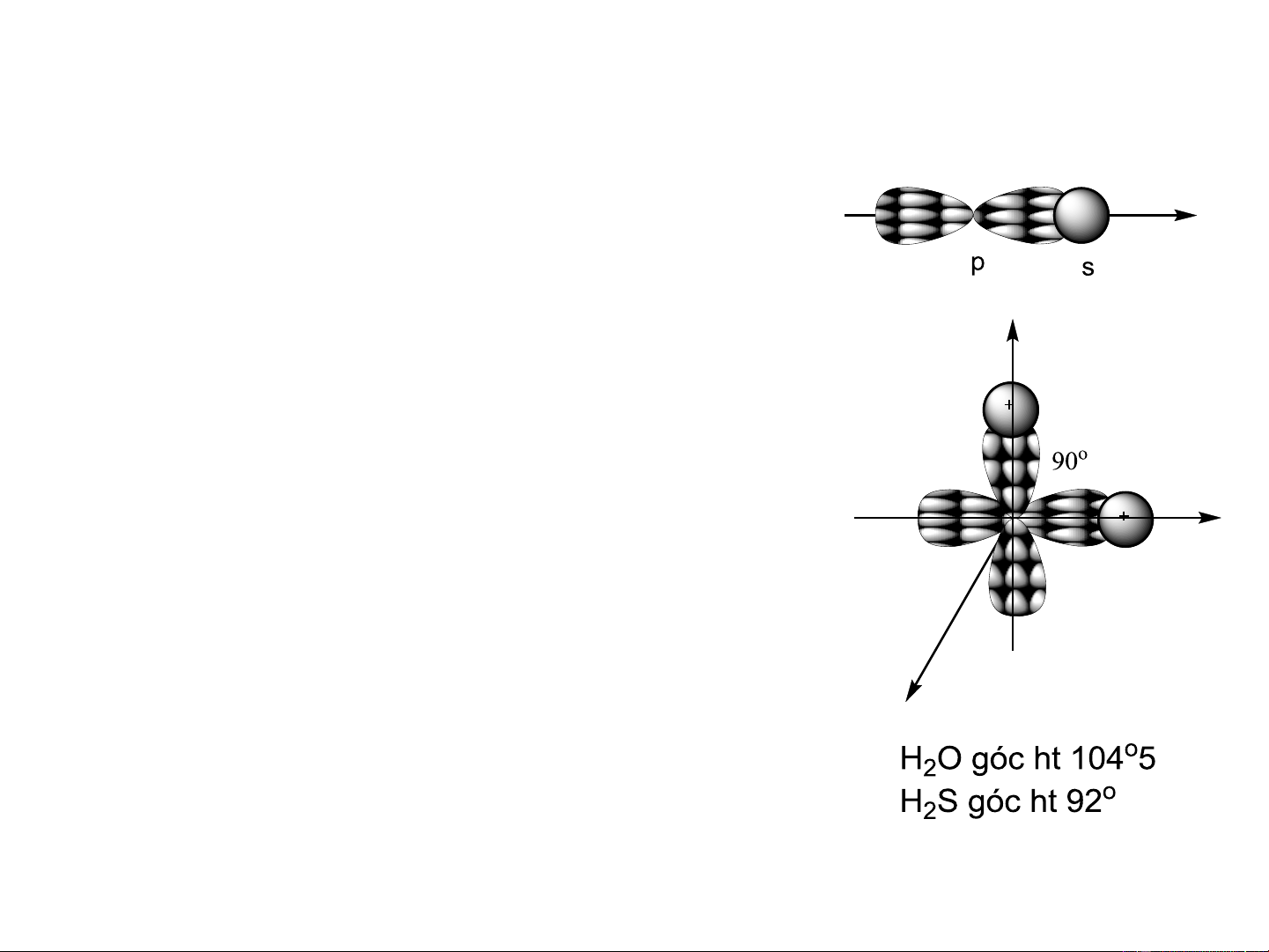
Giải thích được hóa trị của hầu hết các ngt trong phân tử.
Một số phân tử có góc hóa trị biến dạng
so với lý thuyết là do lực đẩy tĩnh điện
giữa các điện tích cùng dấu.
Không giải thích được sự tạo thành liên
kết và góc liên kết của CH . 4
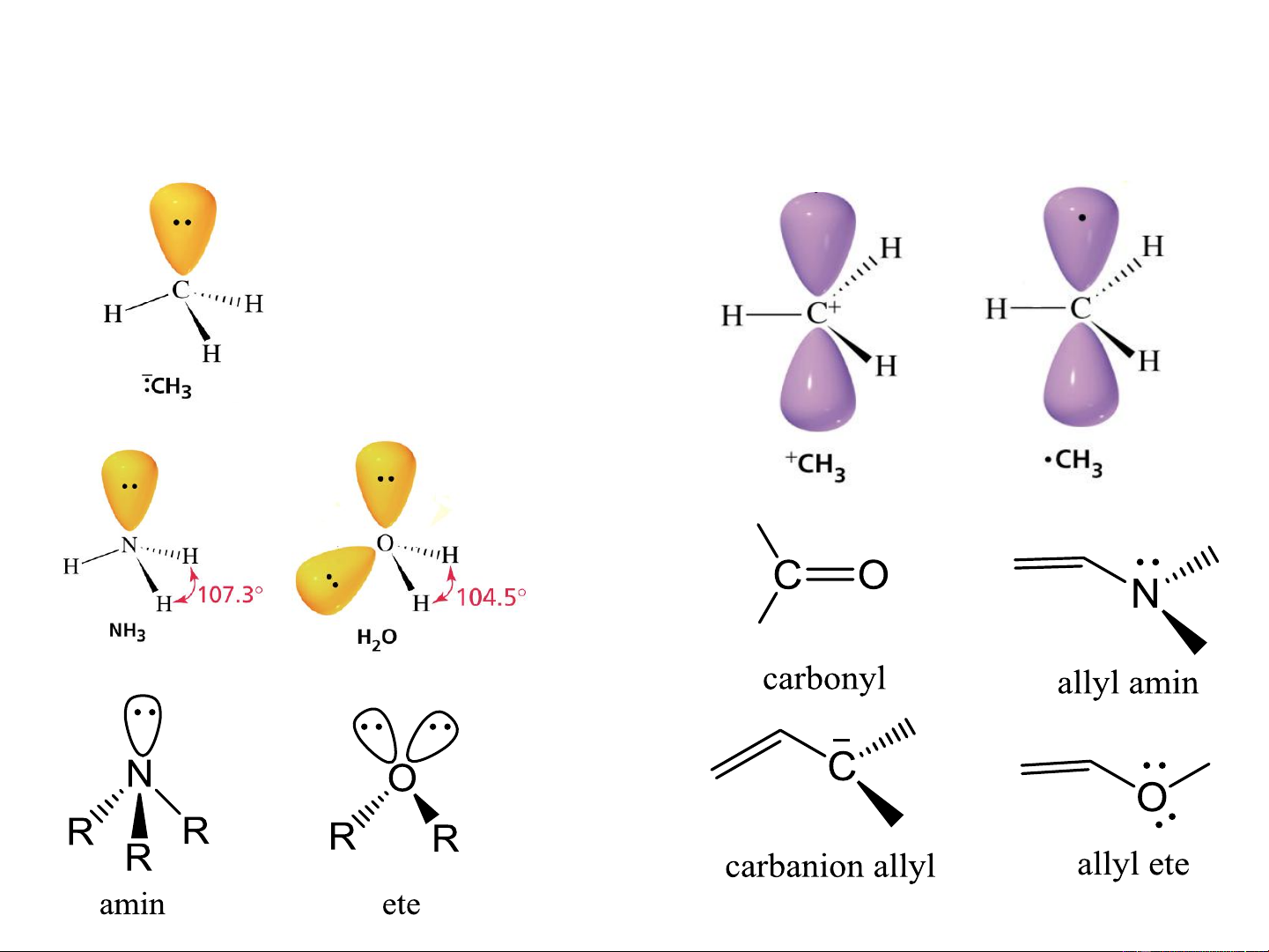
2.2. Sự lai hóa liên kết 1. Đặt vấn đề
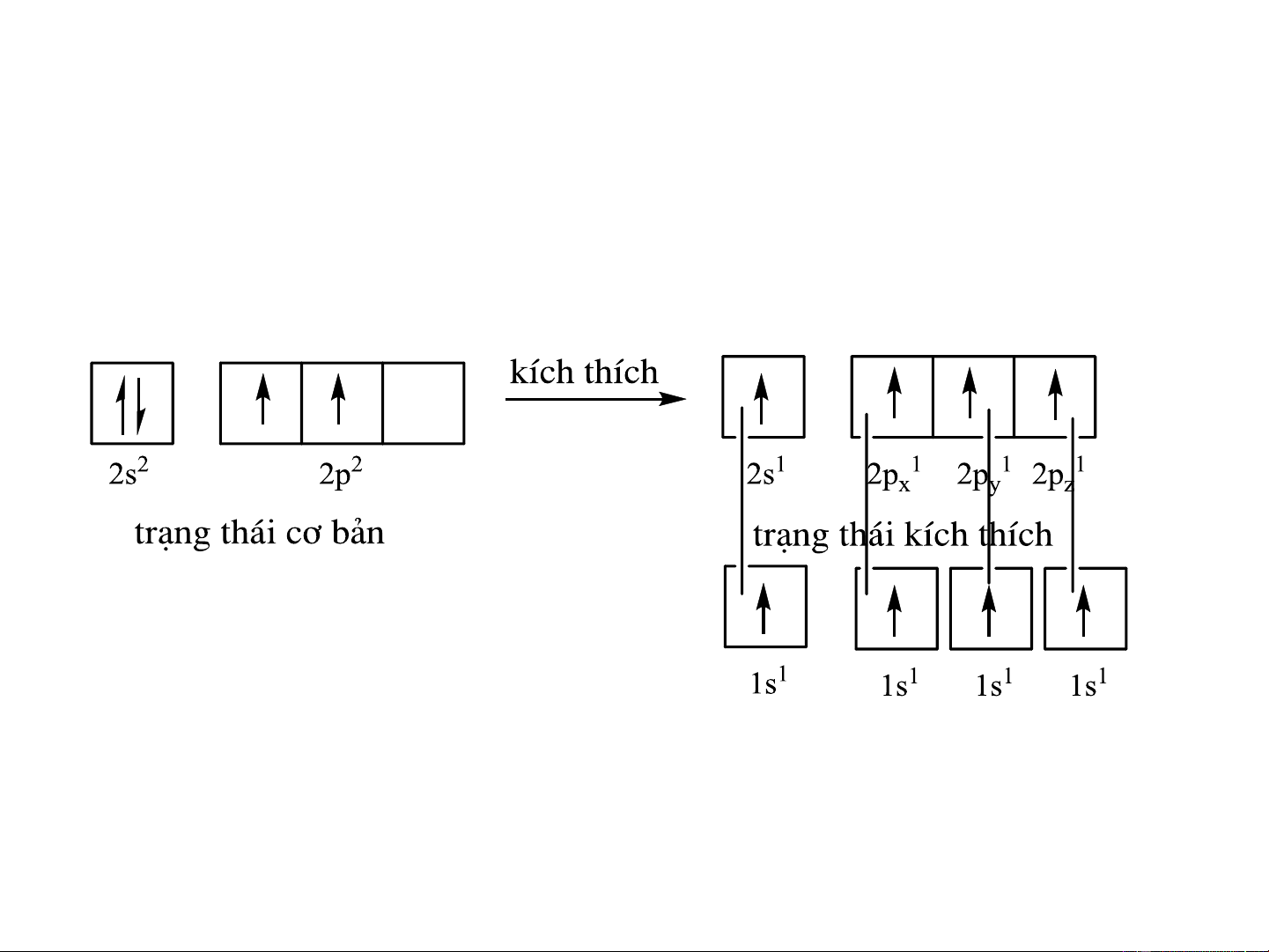
Xét phân tử CH 4 C: 1s2 2s2 2p2 H: 1s1
- 4 liên kết C-H khác nhau về độ dài, hướng không xác định. Mâu thuẫn với
thuyết hóa trị định hướng và thực nghiệm. Thuyết lai hóa
2. Định nghĩa về lai hóa:
Lai hóa là sự tổ hợp tuyến tính của các orbital (AO) khác nhau, mức
năng lượng gần nhau, tạo các orbital mới giống hệt nhau (năng
lượng, hình dạng), khả năng xen phủ cao hơn, liên kết hình thành bền hơn.
Sau khi hình thành các AO lai hóa, các AO này mới tham gia xen
phủ để hình thành liên kết.
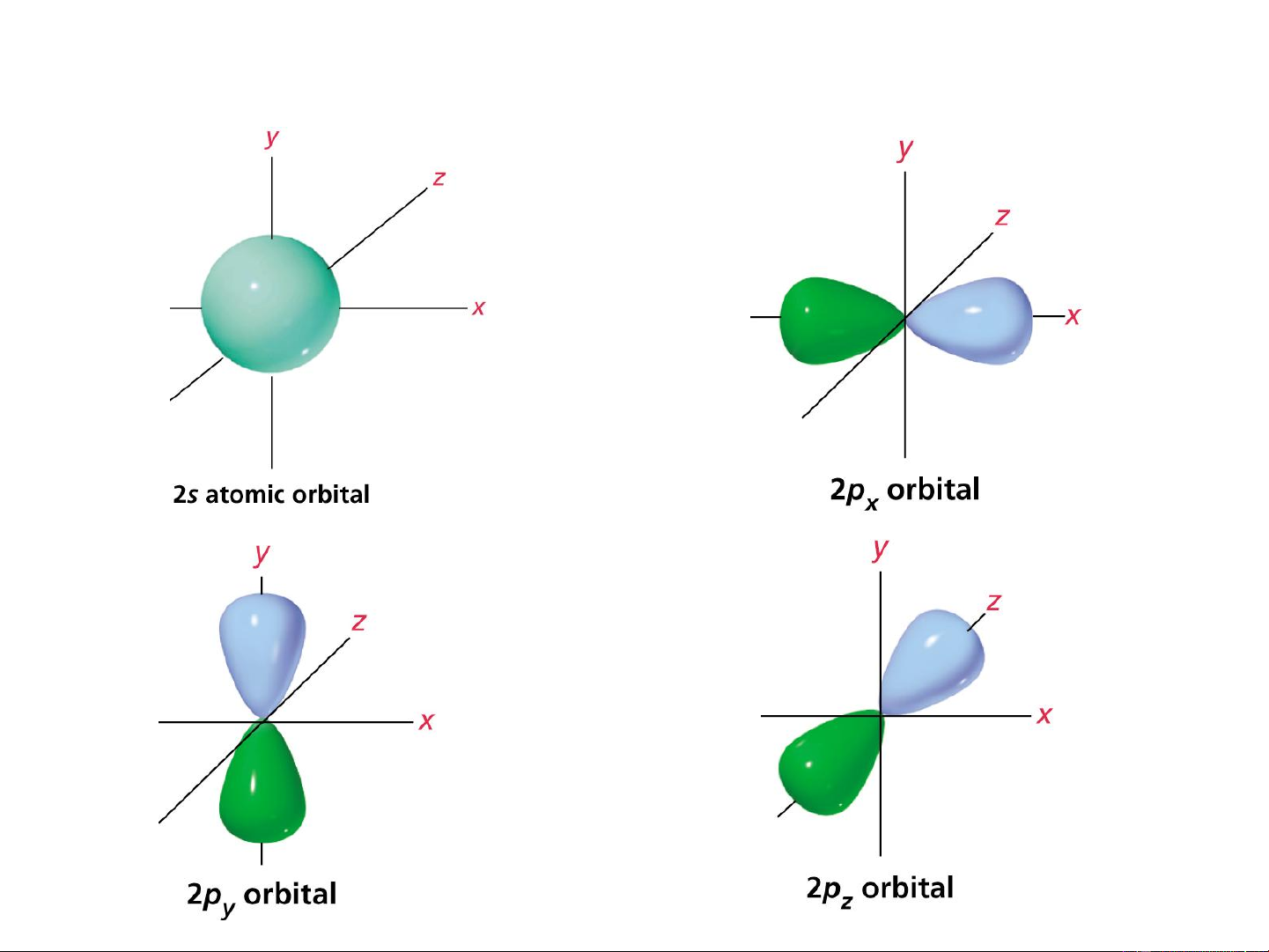
Các orbital s, p thuần khiết
3. Các trạng thái lai hóa của nguyên tử carbon
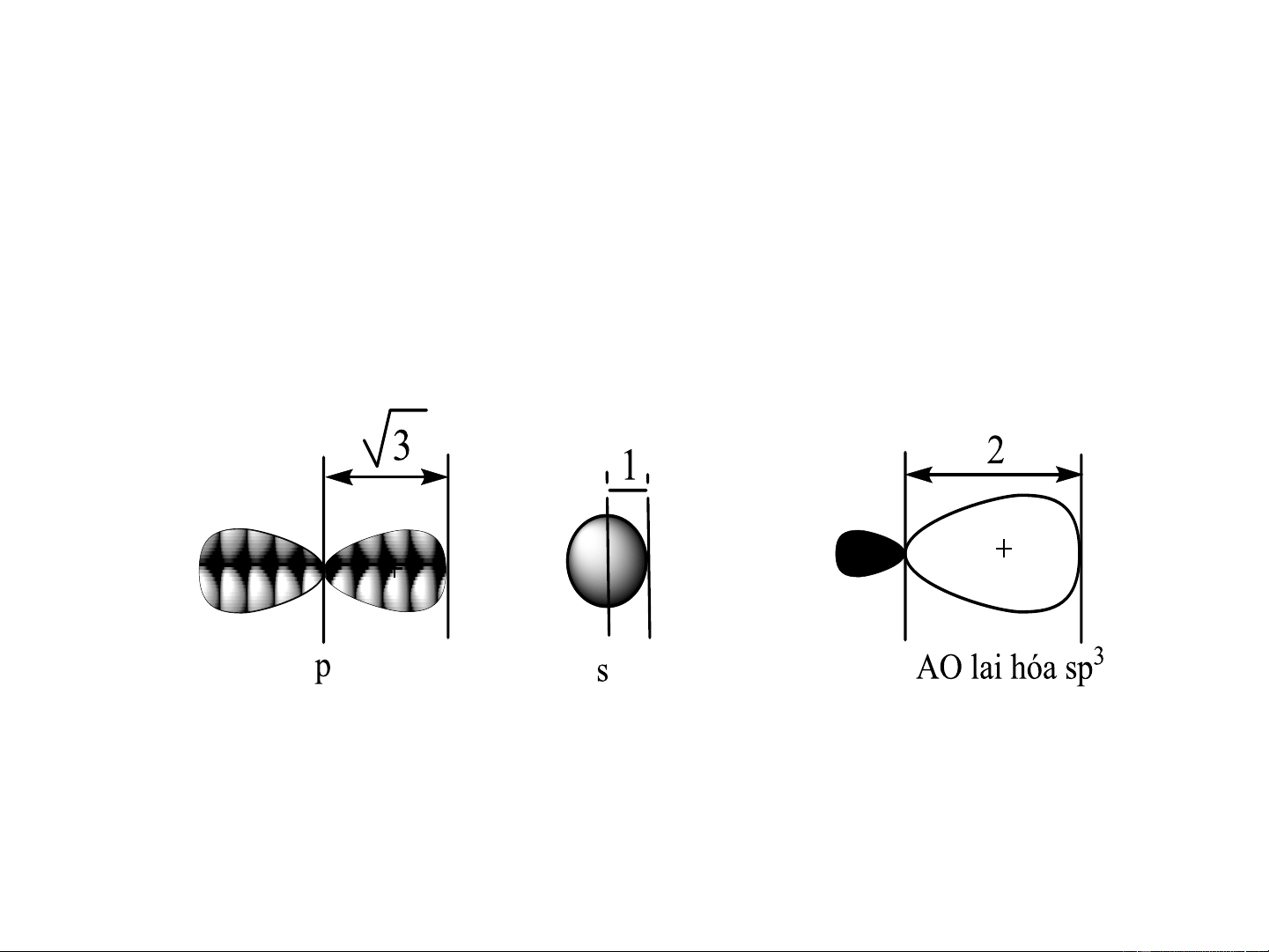
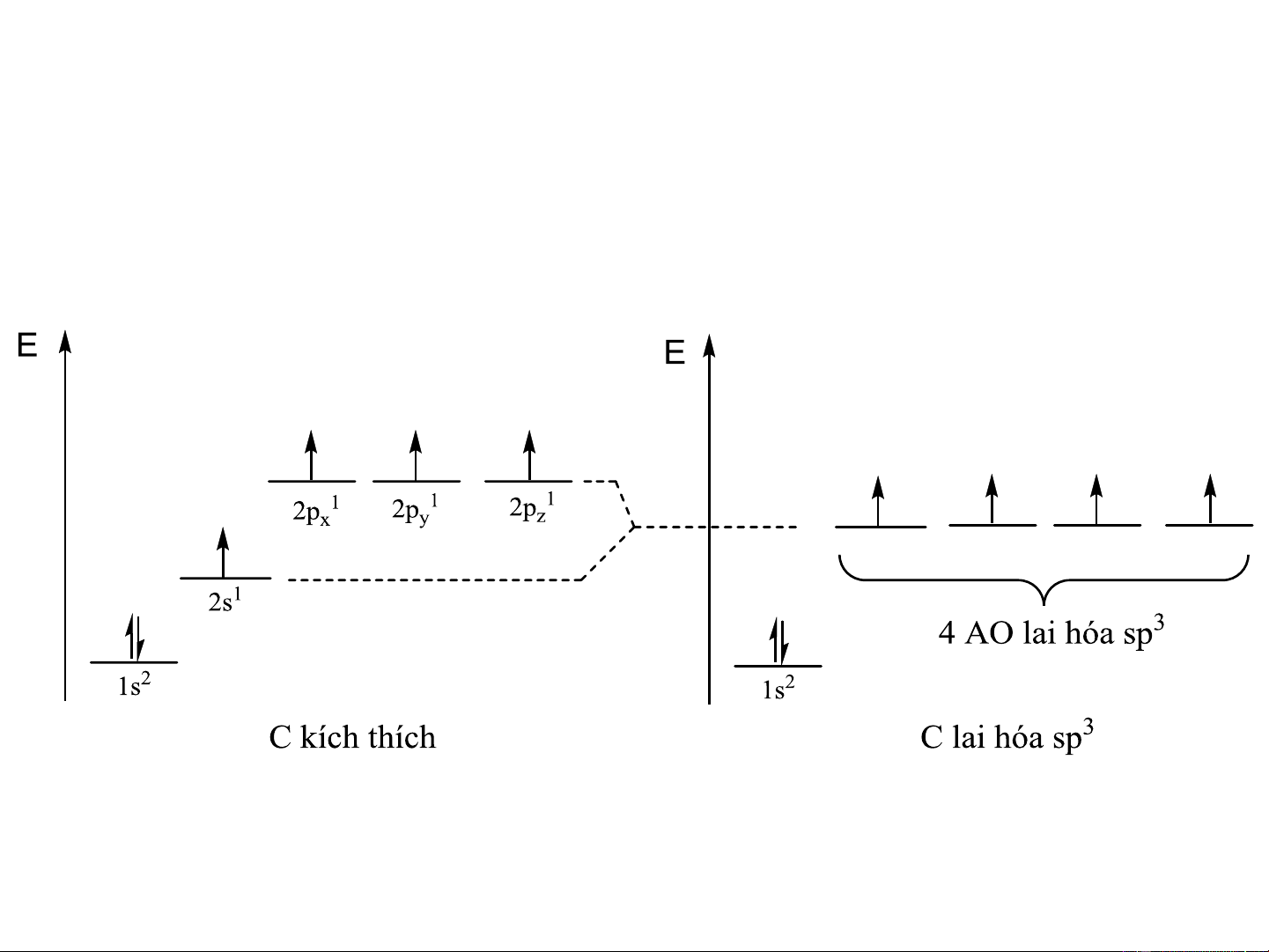
a. Lai hóa sp3 (lai hóa tứ diện-tetragonal)
1AOs + 3AO p , p , p 4AO lai hóa sp3 hướng từ tâm tới 4 đỉnh x y z
của hình tứ diện, góc liên kết 109,5o
Hàm sóng thật của các AO lai hóa sp3: = a + b + c + d i i s i px i py i pz
Độ lớn cực đại: = = = = 2 1 2 3 4 Carbon lai hóa sp3 Lai hóa
C trạng thái kích thích C lai hóa sp3 Lai hóa tứ diện
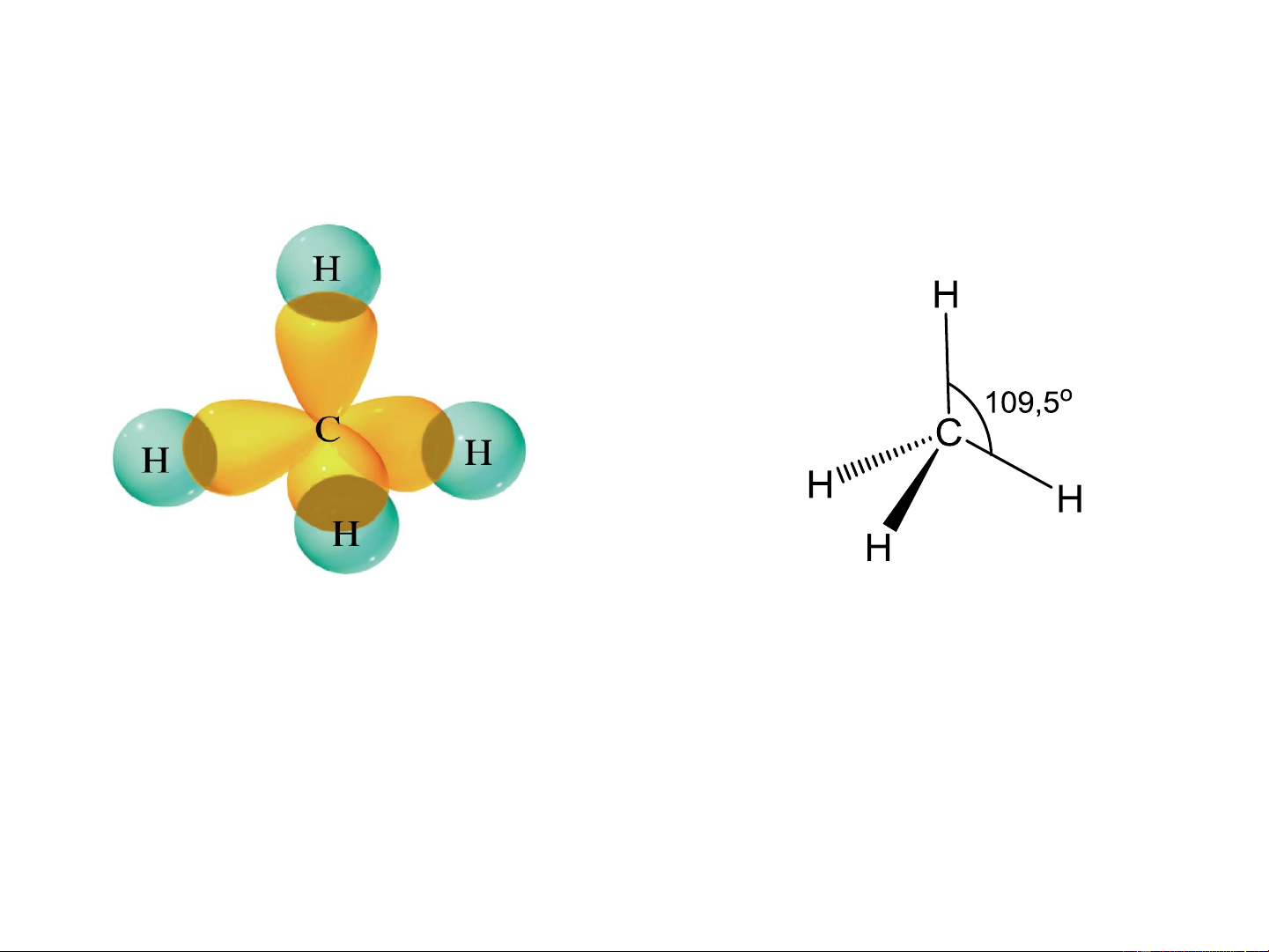
Ví dụ 1: Lai hóa sp3 trong phân tử CH4
Xen phủ tạo liên kết trong CH
Công thức tứ diện CH 4 4
- Hàm lượng AO s đóng góp trong lai hóa sp3 25%
- Đặc trưng cho các hợp chất no (C bão hòa)
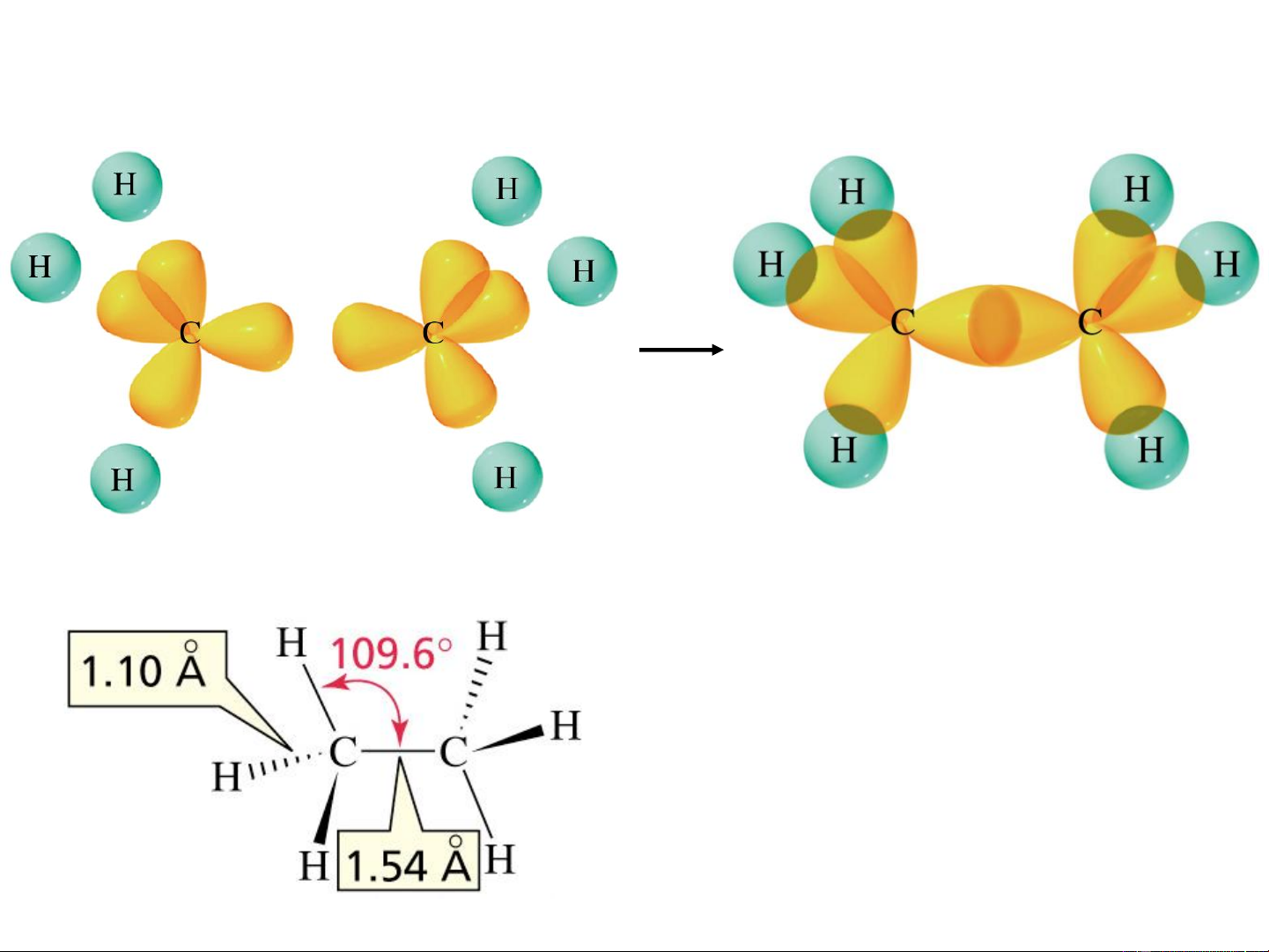
Ví dụ 2: Lai hóa sp3 trong phân tử C H 2 6
Xen phủ tạo liên kết
Công thức tứ diện C H 2 6
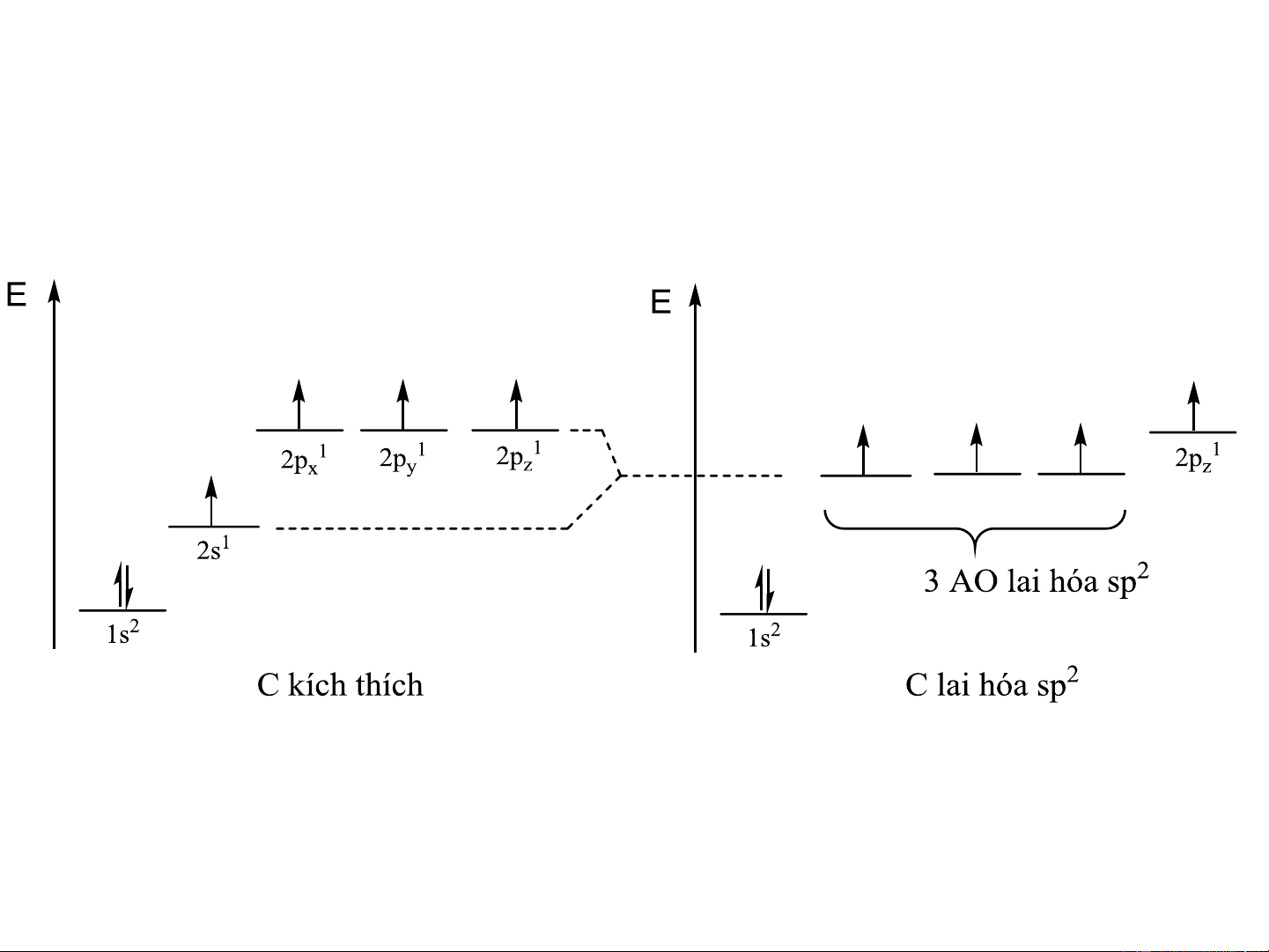
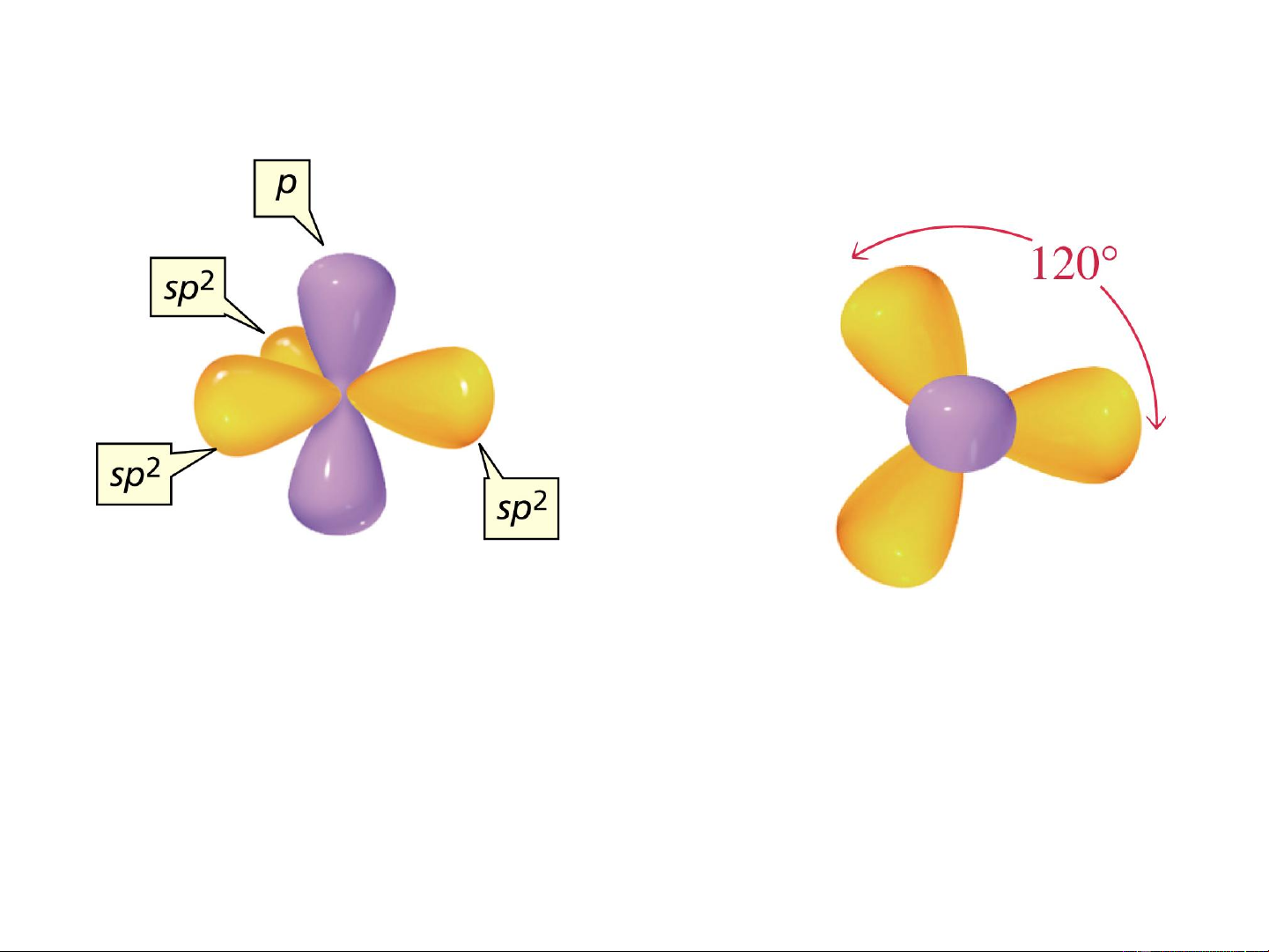
b. Lai hóa sp2 (Lai hóa tam giác - trigonal)
1AOs + 2AO p , p tạo 3AO lai hóa sp2 nằm trên cùng một mặt phẳng, x y
hướng từ tâm tới 3 đỉnh của 1 tam giác đều, góc tạo thành 120o
Hàm sóng thật của các AO lai hóa sp2: = a + b + c i i s i px i py
Độ lớn cực đại: = = = 1,991 1 2 3 Carbon lai hóa sp2
- Hàm lượng AOs đóng góp 33,33%
- Đặc trưng cho các hợp chất hữu cơ không no (ngt C mang
liên kết đôi); các hợp chất kiểu BX , AlX (hợp chất vô cơ) 3 3
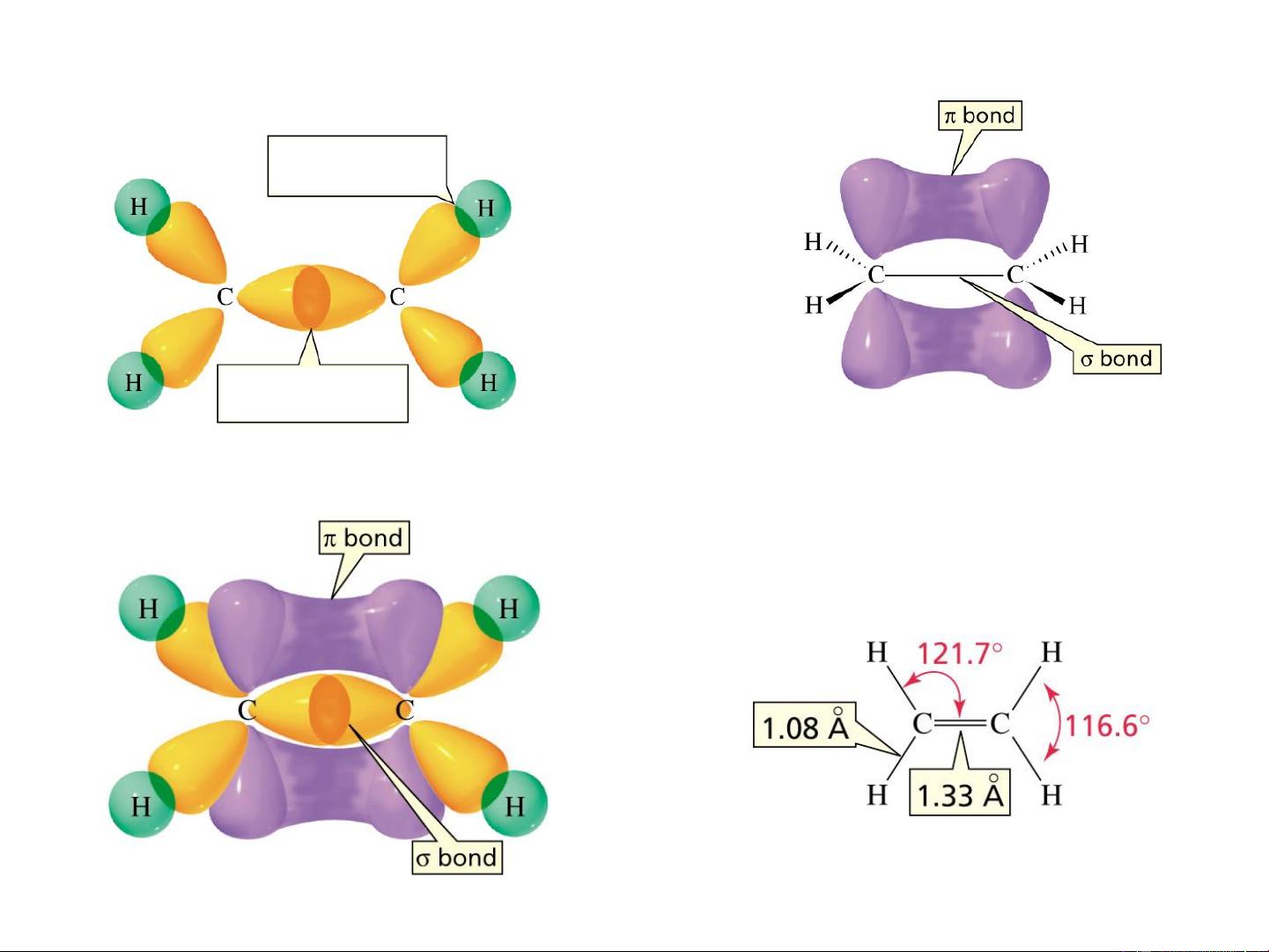
Ví dụ 3: Lai hóa sp2 trong phân tử C H 2 4
Liên kết hình thành do sự xen phủ của sp2 - s
Liên kết hình thành do
sự xen phủ của sp2 – sp2
Hình thành lk
Hình thành lk
Xen phủ hình thành liên kết trong C H 2 4
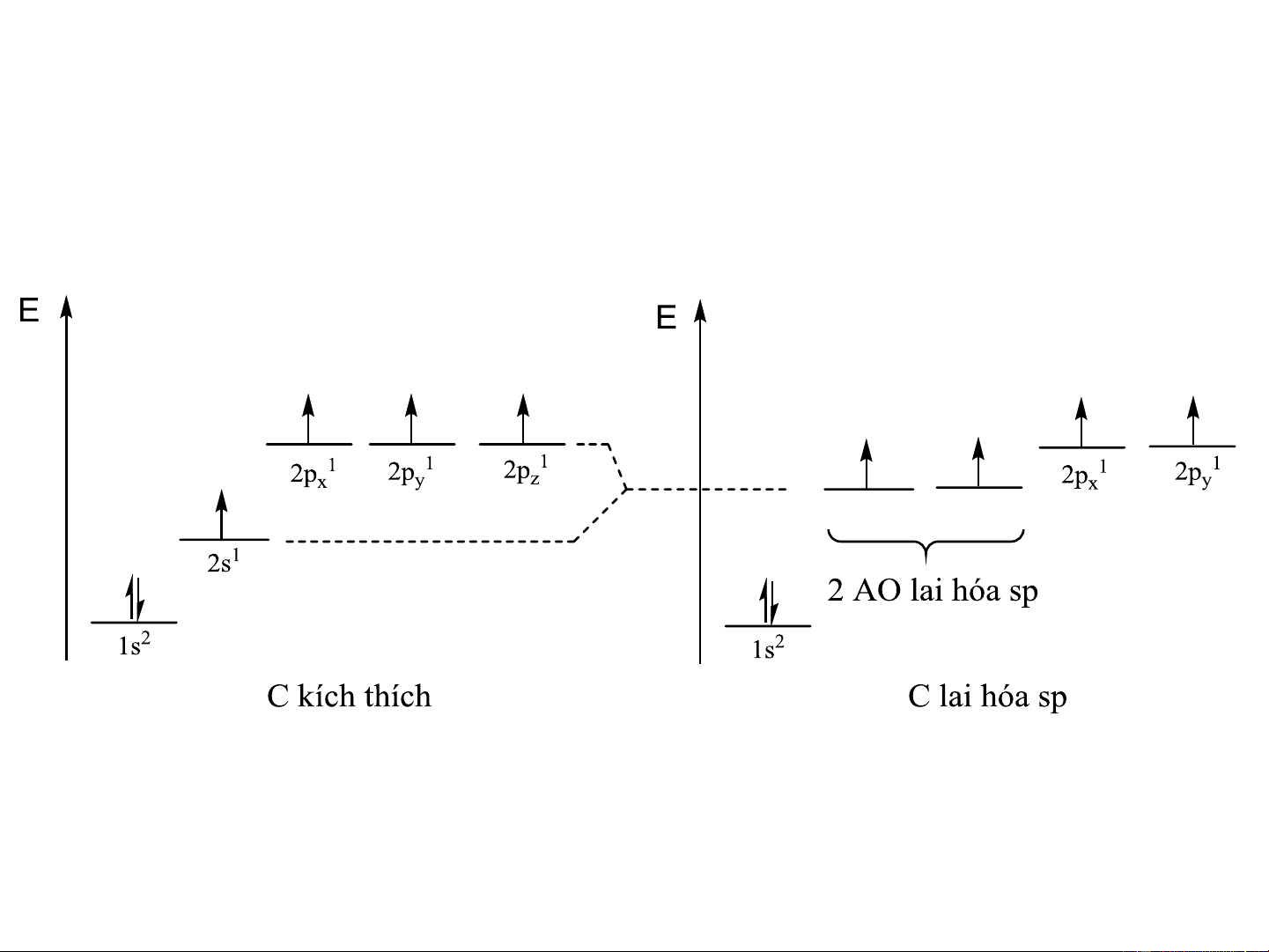
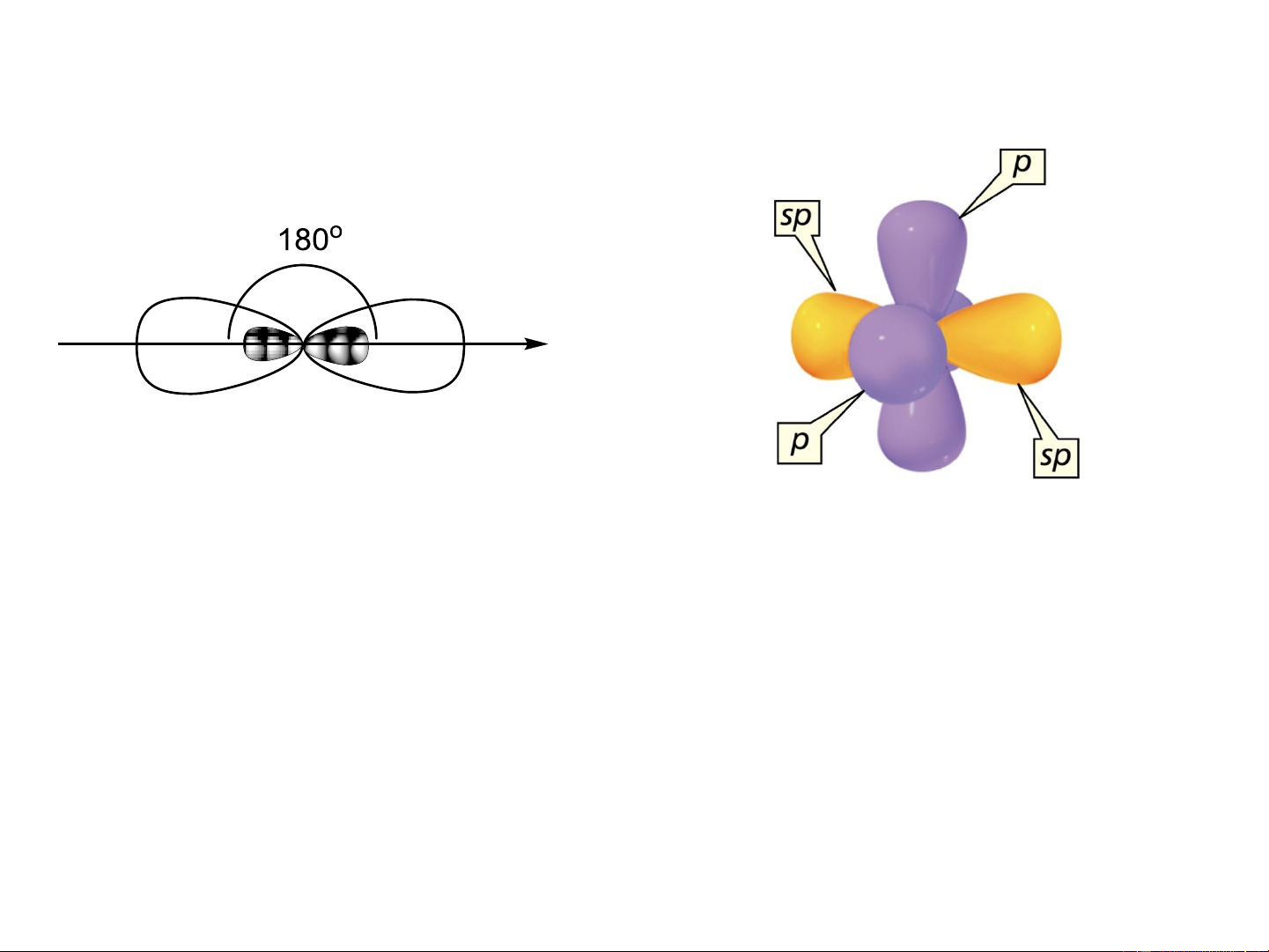
c. Lai hóa sp (lai hóa đường thẳng - digonal)
1AOs + 1AO p tạo 2AO lai hóa sp nằm trên một đường thẳng, z
góc tạo thành là 180o
Hàm sóng thật của các AO lai hoá sp: = a + b i i s i pz
Độ lớn cực đại: = = 1,93 1 2 Carbon lai hóa sp 2 AO lai hóa sp Carbon lai hóa sp
- Hàm lượng AOs đóng góp 50%
- Đặc trưng cho các hợp chất hữu cơ không no chứa liên kết CC hoặc =C=
- Các hợp chất vô cơ: ZnX , CdX , HgX 2 2 2
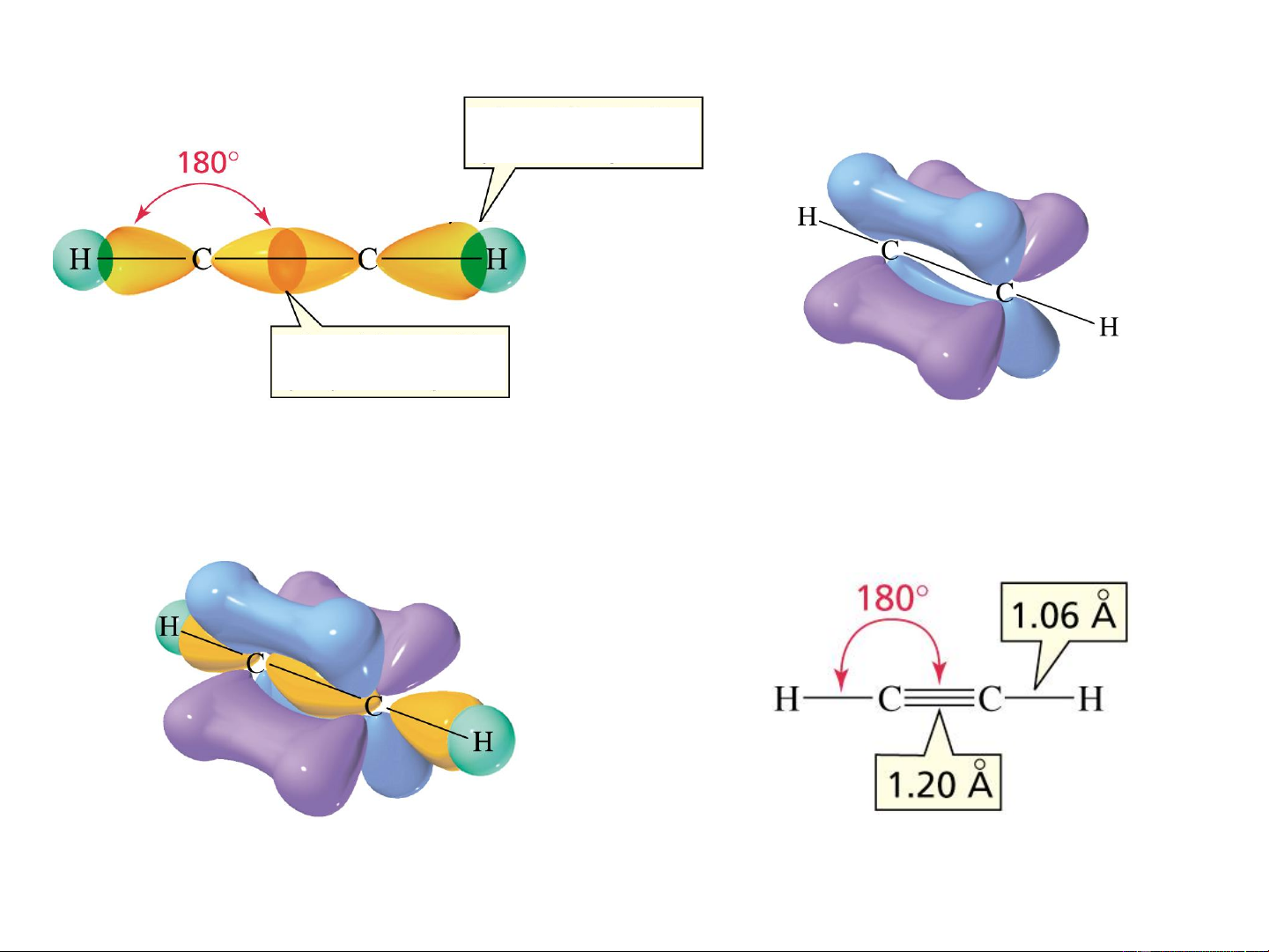
Ví dụ 4: Lai hóa sp trong phân tử C H 2 2
Liên kết hình thành do sự xen phủ của sp – s
Liên kết hình thành do
sự xen phủ của sp – sp
Hình thành lk
Hình thành lk
Xen phủ hình thành liên kết trong C H 2 2
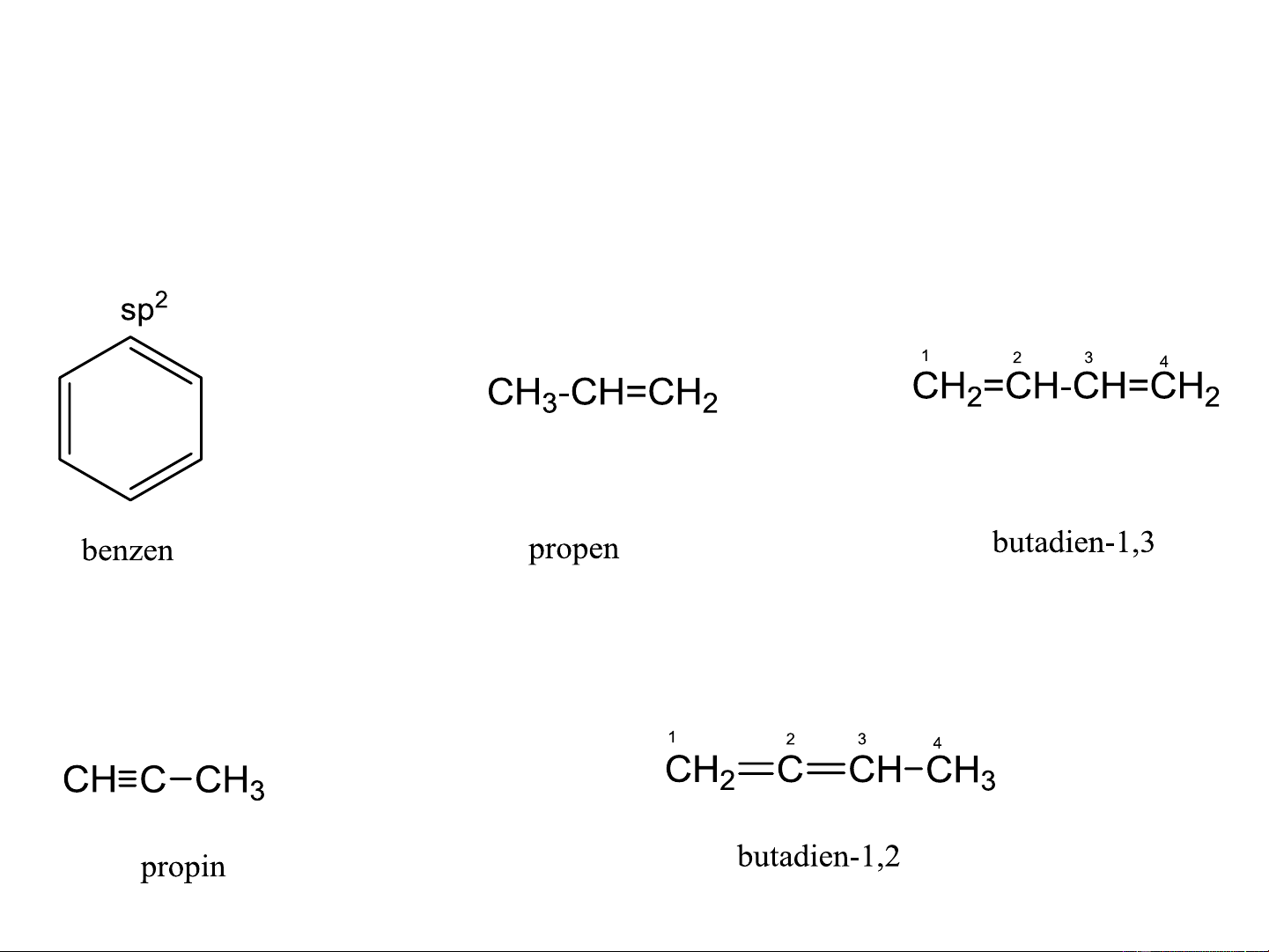
Bài tập áp dụng: Cho biết trạng thái lai hóa của mỗi nguyên tử carbon
và sự xen phủ hình thành liên kết trong các phân tử sau: Nhận xét chung
● Độ lớn cực đại của hàm sóng:
s < p < sp < sp2 < sp3 1 1,93 1,991 2
Hàm lượng AO p trong AO lai hóa càng lớn khả năng xen phủ càng hiệu quả Độ dài lk C -H =1,1 Ao > C
-H = 1,09 Ao > C -H = 1,06 Ao sp3 sp2 sp
Khả năng xen phủ của AO lai hóa hiệu quả hơn so với AO thuần khiết
● Độ âm điện Csp3 < Csp2 < Csp 2,1 2,8 3,5
Các liên kết CH phân cực, H dễ bị thay thế bởi các kim loại, có bản chất axit.
Một số lưu ý về trạng thái lai hóa của C và các nguyên tử khác Lai hóa sp3 Lai hóa sp2 Carbanion Bài tập áp dụng
Cho biết các trạng thái lai hóa của các nguyên tử trong các phân tử sau: CH -CH=O 3 H C=NH 2 CH =C=O 2 CH =CH-CN 2
2.3. Các loại liên kết , trong các hợp chất Hữu cơ
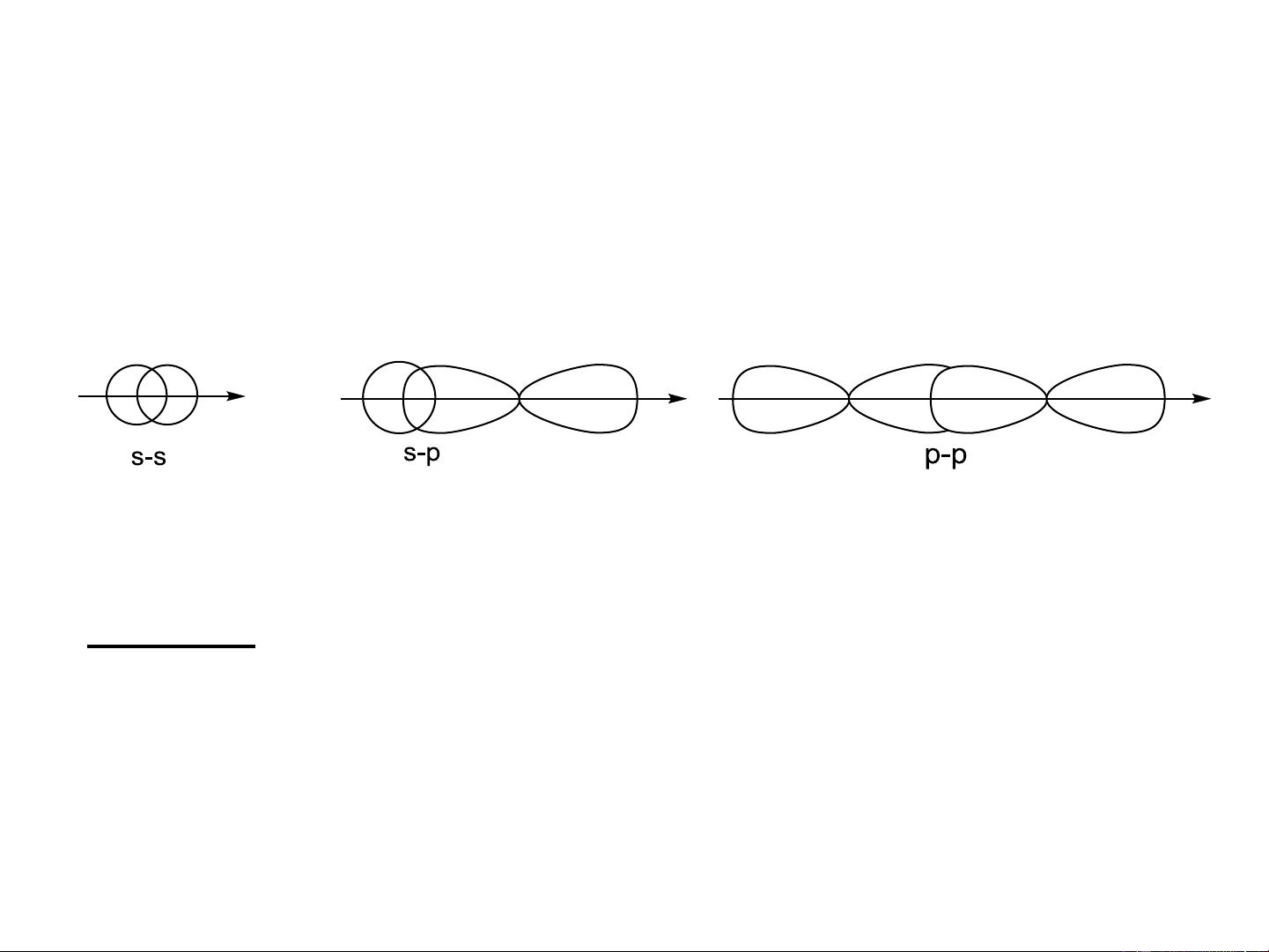
1. Liên kết : Hình thành do sự xen phủ giữa các AO dọc theo trục liên kết.
• Xen phủ giữa các AO lai hóa với nhau và với các AO thuần khiết khác. • Đặc điểm:
- LK bền vững, hình thành đầu tiên, đặc trưng cho các h/c có lk đơn.
- Đối xứng trục, không cản trở sự quay của phân tử, xuất hiện đồng phân cấu dạng




